КЛІНІЧНИЙ ВИПАДОК РОЗВИТКУ ГАНГРЕНОЗНОЇ ПІОДЕРМІЇ У ПАЦІЄНТКИ ІЗ ХВОРОБОЮ ШЕГРЕНА
Триполка С.А. 1, Головач И.Ю.2
- 1Коммунальное учреждение здравоохранения «Областная клиническая больница — центр экстренной медицинской помощи и медицины катастроф», Харьков
- 2Научно-практический центр профилактической и клинической медицины ГУД, Киев
Резюме. Представлено опис клінічного випадку розвитку рідкісного прояву аутоімунних захворювань — гангренозної піодермії у пацієнтки із хворобою Шегрена. Спочатку хворій було встановлено помилковий діагноз, що спричинило призначення антибіотиків і судинної терапії синтетичними аналогами простагландинів без клінічного ефекту. Встановлення діагнозу ревматологом та застосування пульс-терапії метилпреднізолоном і метотрексату сприяло значущій позитивній динаміці та загоєнню ділянок ураження. У статті представлено діагностичні критерії гангренозної піодермії, докладно описано картину класичного варіанта захворювання. Проведено також критичний аналіз курації пацієнтки, причини несвоєчасного встановлення діагнозу. Клінічна оцінка хворого з підозрою на гангренозну піодермію повинна включати ретельний збір анамнезу та фізикальне обстеження. Підозрілими щодо діагнозу гангренозної піодермії вважаються швидке поширення ураження, початкове ураження у вигляді папули, пустули або везикули; біль, пропорційний площі ураження; історія попередньої травми та історія аутоімунних захворювань, пов’язаних із гангренозною піодермією.
Гангренозная пиодермия (ГП — pyoderma gangrenosum) — редкий нейтрофильный дерматоз, который проявляется в виде воспалительного и язвенного поражения кожи [10]. Это удивительное и малопонятное заболевание, которое может быть идиопатическим, но все же чаще его развитие связывают с лежащими в основе лимфопролиферативными или аутоиммунными расстройствам [1, 14]. В отличие от названия, ГП не является ни инфекционным, ни гангренозным состоянием. Современный термин «гангренозная пиодермия — pyoderma gangrenosum» ввели американские дерматологи A. Brunsting, W. Goeckerman и P. O’Leary (1930), ошибочно расценившие язвенный процесс на коже как дистантный фокус стрептококковой или стафилококковой инфекции в кишечнике при язвенном колите или в легких при эмпиеме у 5 пациентов [9]. Под ГП понимают появление болезненной гнойной пустулы или фурункулоподобных высыпаний на коже, которые трансформируются в гнойную некротическую язву с красно-синюшным ободком, увеличивающуюся в размерах путем эксцентрического роста, имеющую различные формы и размеры [7].
Этиология и патогенез ГП до сих пор остаются не установленными [5]. В 25–50% случаев заболевание оказывается идиопатическим, в остальных ассоциируется с различными по природе нозологиями, особенно часто с воспалительными заболеваниями кишечника (неспецифический язвенный колит, болезнь Крона) [14], патологией крови (моноклональная гаммапатия, множественная миелома, лейкоз), аутоиммунными заболеваниями (системная красная волчанка, синдром Шегрена, ревматоидный артрит) и рядом других [2, 5]. ГП является крайне редким заболеванием, с предполагаемой частотой от 3 до 10 случаев на 1 млн человек в год [9]. Заболевать могут лица любого возраста, включая детей [12], но чаще всего ГП развивается у взрослых людей в возрасте 40–60 лет; среди заболевших преобладают женщины [10]. Считается, что pyoderma gangrenosum является распространенным внекишечным проявлением воспалительных заболеваний кишечника, чаще ассоциированным с язвенным колитом (5–12%), чем с болезнью Крона (1–2%) [14]. До 75% пациентов имеют предшествующее заболевание, совпадение во времени дебюта основного заболевания или последующее ассоциированное заболевание [10].
В патогенезе играет роль аберрантная иммунная реакция, вовлекающая T-лимфоциты и цитокины. Выявлены дефекты миграции, хемотаксиса и фагоцитоза нейтрофилов, а также случаи развития ГП на фоне иммунодефицитных состояний [15]. Развитию ГП может способствовать и генетическая предрасположенность; сообщалось о семейных случаях данного заболевания [8]. Также об этом свидетельствуют недавно описанные синдромы PAPA (акроним: Pyogenic sterile Arthritis, Pyoderma gangrenosum, Acne), PASH (акне, ГП и гнойный гидраденит) и PASS (акне, ГП, спондилоартрит), в симптомокомплекс которых входит ГП [7].
Морфологической основой заболевания является аллергический ангиит, сопровождающийся тромбозом, повреждением сосудистой стенки и очаговыми изменениями в периваскулярных нейтрофильных инфильтратах [3].
Классическая язвенная форма начинается с пузырька или пустулы. Вскрытие полостных элементов и некроз подкожных узлов ведут к образованию язвенных дефектов с неровными, слегка нависающими, подрытыми, отечными краями ярко-красного или синюшно-красного цвета. Дно язв неровное с гнойно-кровянистым отделяемым. В стенках периферического валика часто определяются карманы, при надавливании на которые выделяется гнойное или сукровичное содержимое. Содержимое пустул и отделяемое язв на первоначальных этапах стерильное, в последующем возможно присоединение вторичной инфекции. Язвы болезненные, медленно (в течение месяцев) и неравномерно серпигинируют, иногда с захватом крупных по площади участков. Одновременно на каком-либо участке, чаще по периферии, происходит сочетанная эпителизация с образованием тонких атрофических, неравномерно пигментированных рубцов (cribriform scarring). Обычная локализация — конечности (около 70%), реже — туловище, голова, шея. Процесс также может быть диссеминированным [3, 13].
На высоте развития очаг поражения представляет собой обширную язвенную поверхность с неровными подрытыми краями ливидно-розового цвета с нависающими обрывками эпидермиса; края приподняты в виде валика шириной 10–15 мм, окруженного зоной гиперемии [4]. Дно язвы неровное, выполнено сочными и легко кровоточащими грануляциями, иногда покрыто струпом. Отделяемое язвы обильное, гнойно-кровянистое, с примесью распадающихся тканей, с неприятным, гнилостным запахом.
Клинические проявления ГП неоднородны и могут быть разделены на четыре основных подтипа: наиболее распространенный язвенный (классический), буллезный (атипичный), пустулезный и вегетативный варианты [3, 6].
Диагноз ГП базируется на клинических и гистологических результатах, а также на исключении других воспалительных или язвенных кожных заболеваний. Патогномоничных клинических или гистологических проявлений нет. Обычно гистологически выявляется интенсивный нейтрофильный инфильтрат в дерме и подкожных тканях, иногда с эпителиоидными гранулемами. Могут быть фибриноидный некроз, кровоизлияния, но отсутствуют иные доказательства васкулита или инфекции [1]. Кроме того, к биопсии прибегают лишь в сомнительных случаях, чтобы исключить васкулит или инфекцию. Биопсии кожи избегают также в связи с возможным распространением язвенного процесса из-за феномена патергии, свойственного ГП. Однако биопсия показана пациентам без предшествующей истории ГП и у лиц с установленным диагнозом ГП, у которых имеются поражения с атипичными особенностями или при отсутствии ожидаемого ответа на терапию.
У пациентов, которые имеют заболевания, ассоциированные с ПГ, развитие язвенно-некротического поражения кожи должно вызвать подозрение на этот диагноз. И наоборот, как только ГП диагностирована, пациентов необходимо оценивать на наличие связанного с ним основного заболевания [3, 15].
По данным литературы нет общепринятых и установленных критериев диагностики ПГ. Диагностические критерии для язвенной (классической) ГП, используемые некоторыми авторами, приведены ниже [11].
Основные критерии (должны быть представлены оба)
- Быстрое прогрессирование болезненной некролитической кожной язвы, с нависающими краями фиолетового цвета, с нечеткими границами (от 1 до 2 см/сут или 50% увеличения размера в течение 1 мес).
- Отсутствие специфических причин изъязвления кожи (бактериальной инфекции, сифилиса, туберкулеза, грибковой инфекции и пр.).
Малые критерии (должно быть два)
- Наличие феномена патергии в анамнезе и/или история, свидетельствующая о клиническом выявлении крибриформных рубцов (cribriform scarring) — неправильной формы с неровным рельефом и неравномерной пигментацией.
- Системное заболевание, связанное с ГП (воспалительное заболевание кишечника, артрит, системное заболевание соединительной ткани, гаммапатия IgA или злокачественность).
- Гистопатологические данные (стерильная дермальная нейтрофилия ± смешанное воспаление ± лимфоцитарный васкулит).
- Реакция на лечение (быстрый ответ на системное применение глюкокортикоидов).
Клиническая оценка больного с подозрением на ГП должна включать тщательный сбор анамнеза и физикальное обследование. Подозрительными в отношении диагноза ГП считаются быстрое развитие поражения; начальное поражение в виде папулы, пустулы или везикулы; боль, пропорциональная площади поражения; история предшествующей травмы; история аутоиммунных заболеваний, связанных с ГП [6, 10].
Лабораторные изменения являются неспецифичными, однако они необходимы и полезны для проведения дифференциального диагноза и установления основного заболевания, с которым ассоциирована ГП.
Основная цель терапии — уменьшить выраженность воспалительного процесса, что приводит к изъязвлению. Выбор лечения зависит от различных факторов, включая количество и размер повреждений, их местоположение, наличие основного заболевания, предпочтение пациента и сопутствующие заболевания [10].
Лечение также зависит от агрессивности течения ГП. ГП можно условно разделить на агрессивный тип с быстрым распространением и вовлечением новых площадей поверхности кожи в язвенно-некротический процесс, а также хроническое течение, что требует только локального применения препаратов. Системная терапия включает применение высокодозовой глюкокортикоидной терапии в качестве препаратов первой линии; циклоспорин и ингибиторы фактора некроза опухоли (ФНО)-α оказались полезными в качестве второй линии терапии [10]. Основные подходы к лечению ГП представлены в табл. 1.
| Терапевтические подходы | Менеджмент |
|---|---|
| Общие мероприятия | Контроль основного (базового) заболевания Избегать травматизации кожи Адекватное обезболивание Уход за раневыми поверхностями, хирургический дебридмент при необходимости Профилактика вторичной инфекции Оптимизация питания Отказ от курения Контроль гликемии |
| Ограниченные проявления ГП | Локальная терапия Мощные топические кортикостероиды Местное применение такролимуса, пимекролимуса Топически натрия кромогликат Топически дапсон5-аминосалициловая кислота |
| Агрессивное течение ГП (системная терапия) | Глюкокортикоиды (0,1–1,0 мг/кг) Циклоспорин (2,5–5,0 мг/кг/сут) Такролимус (0,1–0,2 мг/кг/сут) Талидомид 50–150 мг на ночь) Колхицин (0,6–1,2 мг/сут) Дапсон (100 мг/сут) Сульфасалазин (0,5–1,0 г 3 раза в сутки) Азатиоприн (50–100 мг 2 раза в сутки) Метотрексат (2,5–25 мг/нед) Микофенолата мофетил (1,0–1,5 г 2 раза в сутки) Внутривенный иммуноглобулин (2,0–3,0 г/кг массы тела) Миноциклин (100 мг/сут) |
| Агрессивное течение (таргетная терапия) |
Ингибиторы ФНО-α: инфликсимаб, адалимумаб, этанерцепт Ингибиторы интерлейкина-1: анакинра, канакинумаб, гевокизумаб Ингибитор интерлейкина-12 и -23: устекинумаб |
Приводим описание случая диагностики и удачного лечения ГП у пациентки с болезнью Шегрена.
Пациентка П., 60 лет, обратилась с жалобами на появление болезненных язвенных высыпаний на нижних конечностях, сухость во рту, слабость, утомляемость, сухость глаз, боль в крупных суставах, мышцах. Из анамнеза известно, что с 24.07.2017 г. по 09.08.2017 г. находилась на стационарном лечении в ревматологическом отделении Коммунального учреждения здравоохранения «Областная клиническая больница — центр экстренной медицинской помощи и медицины катастроф» (КУОЗ «Областная клиническая больница ЦЭМП и МК»), Харьков, с диагнозом: болезнь Шегрена, хроническое течение, активная фаза, активность II степени, с поражением слюнных желез (ксеростомия), глаз (ксерофтальмия), суставов (полиартралгия, функциональная недостаточность суставов (ФНС) 0), мышц (полимиалгия), нервной системы (периферическая полинейропатия), лимфаденопатия с вовлечением паховых, подчелюстных лимфоузлов.
Из анамнеза известно, что считает себя больной около полугода, когда без видимой причины появились вышеуказанные жалобы, за медицинской помощью не обращалась; интенсивность жалоб нарастала, в связи с чем в июне 2017 г. обратилась к ревматологу по месту жительства, была заподозрена болезнь Шегрена, в связи с чем направлена к ревматологу КУОЗ «ОКБ ЦЭМП и МК» и госпитализирована.
При анализе медицинской документации отмечены значительные изменения в лабораторных показателях: повышение скорости оседания эритроцитов (СОЭ) и С-реактивного белка (СРБ), анемический синдром (табл. 2).
| Дата | Эритроциты, · 10/л | Hb, г/л | Лейкоциты, · 10/л | Тромбоциты, · 10/л | Палочкоядерные, % | Сегментоядерные, % | Эозинофилы, % | Базофилы, % | Лимфоциты, % | Моноциты, % | СОЭ, мм/ч |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 14.07.2017 | 2,8 | 89 | 2,9 | 420 | 3 | 52 | 1 | 0 | 36 | 8 | 67 |
| 25.07.2017 | 3,3 | 98 | 3,1 | 420 | 1 | 44 | 1 | 0 | 50 | 4 | 67 |
| 08.08.2017 | 3,3 | 101 | 5,1 | 410 | 5 | 54 | 1 | 0 | 32 | 8 | 62 |
Лабораторные обследования: СРБ от 14.07.2017 г. — 60 мг/л, от 08.08.2017 г. — 42 мг/л; ревматоидный фактор — 120 МЕ/л.
Иммунологические исследования: проведение скрининга на аутоиммунные заболевания позволило выявить следующие иммунологические феномены: наличие позитивных антител к SS-A (52/60) — 615, 55 Ед./мл, к SS-B — 216,59 Ед./мл.
Прокальцитонин — 0,041, КФК — 28,3 МЕ/л, глюкоза в крови — 4,9 ммоль/л, креатинин — 73,1 мкмоль/л, мочевина — 6,2 мкмоль/л, нормолипидемия, железо в сыворотке крови — 9,4 мкмоль/л, АсАТ –18,1 ед./л, АлАТ –30,9 ед./л. Функция щитовидной железы не изменена. Клинический анализ мочи без изменений. Обследования на боррелиоз, гепатит В и С — отрицательны. Рентгенография органов грудной клетки от 14.07.2017 г. — без патологии. Ирригоскопия, ректороманоскопия — без патологии. ФГДС — атрофический гастрит, выявлено Helicobacter pylori. КТ головного мозга — без очаговых изменений. УЗДГ сосудов головы и шеи и нижних конечностей — без гемодинамических окклюзий.
Во время нахождения в стационаре пациентка получила внутривенные инфузии дексаметазона. Была выписана с положительной динамикой в виде уменьшения сухости, мышечной слабости; боль в суставах не беспокоила. Было рекомендовано применение метилпреднизолона 8 мг/сут, спиронолактона 25 мг утром до еды; препараты железа; глазные капли, содержащие карбомер, по 1 капле 2 раза в сутки длительно; контроль у ревматолога через 1,5 мес.
Однако в конце сентября у пациентки внезапно с быстрым прогрессированием появились язвенно-некротические поражения кожи нижних конечностей, по поводу которых она была госпитализирована в хирургическое отделение Центральной районной больницы, где находилась около 1 мес. Принимала антибактериальную и сосудистую терапию (40 мг алпростадила внутривенно капельно в течение 10 дней), продолжала применение метилпреднизолона в дозе 8 мг. Однако состояние пациентки прогрессивно ухудшалось, отмечали неуклонное распространение язвенно-некротического процесса, выраженный болевой синдром. Пациентка была направлена на повторную консультацию к ревматологу КУОЗ «ОКБ ЦЭМП и МК».
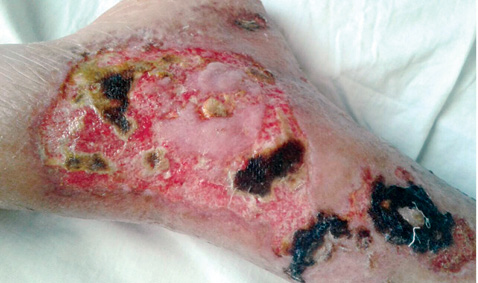
При обращении в КУОЗ «ОКБ ЦЭМП и МК» 06.11.2017 г. были выявлены визуальные изменения кожи нижних конечностей, представленные на рис. 1. У пациентки отмечали обширные язвенно-некротические поражения кожи нижней трети обоих голеней с переходом на стопу. Края язв неровные, рваные, с красно-синюшным ободком, некоторые края подрыты, отмечали неприятный запах из ран. Дно ран полностью покрыто некротическими массами. Пациентка отмечала выраженный болевой синдром.
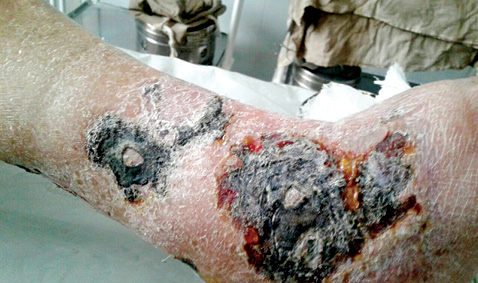
Учитывая наличие аутоиммунного заболевания — болезни Шегрена, развитие язвенно-некротического поражения кожи, что соответствовало большим критериям ГП, быстрое прогрессирование язв, несмотря на проводимое лечение, высокую степень активности заболевания на фоне отсутствия повышения температуры тела, у пациентки было заподозрено развитие ГП. В связи с распространенностью и глубиной поражения больная была госпитализирована в хирургическое отделение.
На момент госпитализации состояние больной средней тяжести. Обширные язвенно-некротические высыпания на обеих голенях. Конечности теплые на ощупь. Суставы внешне не изменены, при пальпации безболезненны, движения в полном объеме. Мышечных атрофий не определяется, полимиалгия. Сила мышц в конечностях сохранена. Слизистые оболочки ротовой полости обычной окраски, суховатые. Ксерофтальмия. В легких везикулярное дыхание, хрипы не выслушиваются. Частота дыхания (ЧД) — 17/мин. Границы сердца расширены влево. Сердечные тоны пониженной звучности, систолический шум на верхушке и точке Боткина — Эрба. Частота сердечных сокращений (ЧСС) — 64/мин. Артериальное давление (АД) 130/75 мм рт. ст. Живот мягкий, безболезненный, печень — у края реберной дуги. Селезенка не пальпируется. Стул регулярный. Мочеиспускание свободное.
При лабораторном обследовании установлено стойкое повышение СОЭ до 46 мм/ч при отсутствии каких-либо других отклонений в общем и биохимическом анализах.
Учитывая клинико-лабораторный симптомокомплекс, пациентке был установлен следующий клинический диагноз: болезнь Шегрена, хроническое течение, активная фаза, активность III ст., с поражением слюнных желез (ксеростомия), глаз (ксерофтальмия), суставов (полиартралгия, ФНС 0), мышц (полимиалгия), нервной системы (периферическая полинейропатия), лимфаденопатия с вовлечением паховых, подчелюстных лимфоузлов, с наличием иммунологических феноменов (позитивность по анти-SS-A и анти-SS-B антителам, позитивный ревматоидный фактор), ГП с поражением кожи голеней.
В связи с высокой клинико-лабораторной активностью, установлением диагноза pyoderma gangrenosum пациентке было назначено проведение пульс-терапии метилпреднизолоном по схеме 500–500–250 мг три дня подряд. Доза перорального метилпреднизолона была повышена до 16 мг/сут. Дополнительно назначен метотрексат — по 20 мг подкожно 1 раз в неделю, фолиевая кислота — 15 мг/нед. В связи с применением глюкокортикоидов в высоких дозах для профилактики индуцированного ими остеопороза назначен комбинированный препарат кальция и витамина D.
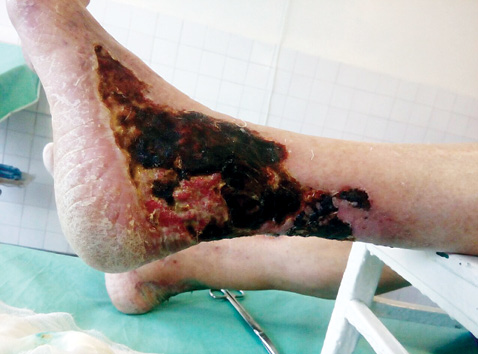
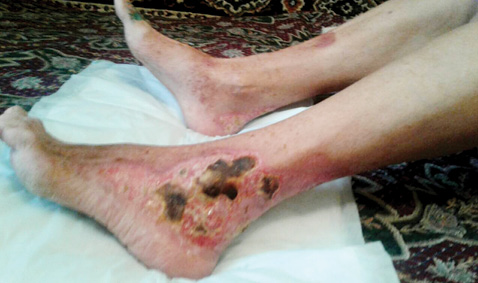
После проведения пульс-терапии метилпреднизолоном отмечена отчетливая положительная динамика со стороны кожи (рис. 2), что подтвердило наше мнение о наличии у пациентки редкой патологии pyoderma gangrenosum. Дальнейшее распространение язвенного-некротического процесса приостановилось, значительно уменьшилась отечность краев ран, некоторые участки очистились от некротических масс, появились свежие грануляции, а также уменьшилась выраженность болевого синдрома.
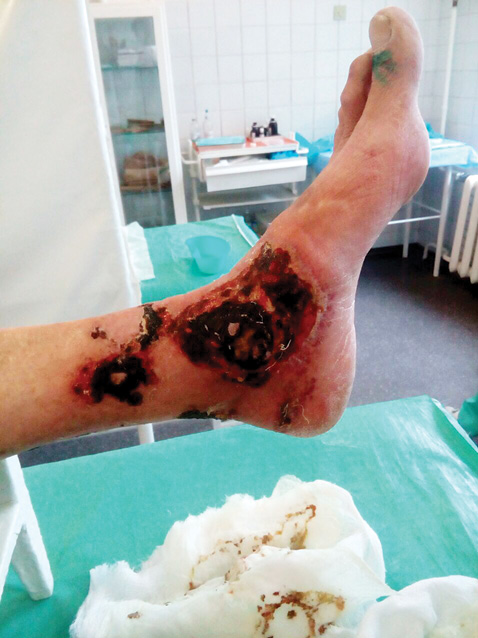
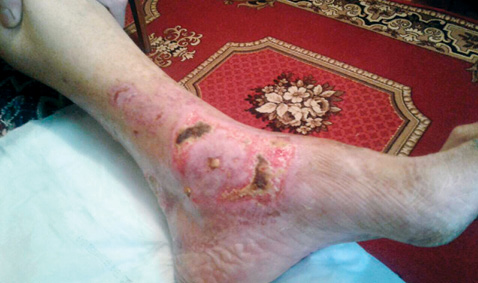
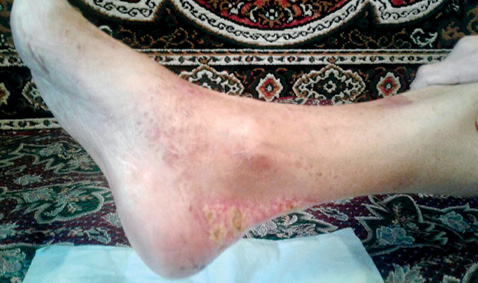
В настоящее время на фоне повышения дозы метилпреднизолона до 24 мг/сут и добавления к терапии метотрексата (20 мг/нед) наблюдается дальнейшая выраженная положительная динамика в виде заживления и эпителизации язвенно-некротических дефектов, значительного уменьшения выраженности боли в этой области. Положительные изменения можно проследить на фотографиях пациентки, сделанных лечащим врачом через 1 и 3 нед после проведения пульс-терапии метилпреднизолоном (рис. 3, 4).
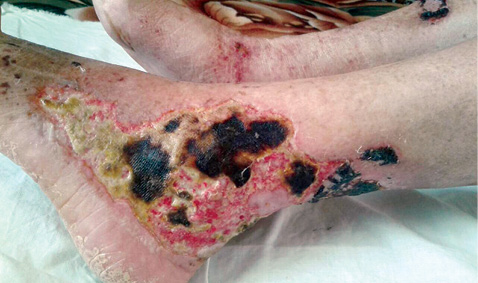
Анализируя данный клинический случай, необходимо акцентировать внимание на следующих моментах. Во-первых, впервые в своей клинической практике мы столкнулись с очень редкой патологией в рамках аутоиммунного заболевания — ГП (предполагаемая частота от 3 до 10 случаев на 1 млн человек в год). Тем ценнее наш опыт, приобретенный в период диагностики и продолжающейся курации пациентки.
Во-вторых, на наш взгляд, пациентке после установления диагноза болезни Шегрена высокой степени активности была назначена низкая доза глюкокортикоидов, которая не соответствовала степени активности заболевания, а также не назначена болезнь-модифицирующая терапия, что, возможно, могло повлиять на развитие данного осложнения, поскольку активность заболевания не контролировалась назначенным лечением.
При развитии ГП кожные изменения у больной ошибочно были трактованы как сосудистые и инфекционные, вследствие чего была назначена антибактериальная и сосудистая терапия, которая была неэффективной и только отдалила время правильного установления диагноза.
Таким образом, ГП (pyoderma gangrenosum), являясь очень редкой и в то же время тяжелой для курации патологией, представляет наибольший интерес как для ревматологов, так и для врачей смежных специальностей (хирургов, сосудистых хирургов, дерматологов). Это связано, с одной стороны, с редкостью данной патологии, когда пациенты обращаются к хирургам, дерматологам, получают неэффективную или малоэффективную, как в данном случае, антибактериальную и сосудистую терапию. С другой стороны, отсутствие четких методов верификации диагноза и трудность принятия решения о системной глюкокортикоидной и цитостатической терапии при наличии обширных язвенно-некротических воспалительных изменений кожи также откладывает своевременное начало адекватного лечения. Тяжелое поражение кожи и болевой синдром, а также склонность к рецидивирующему течению, значительно ухудшают качество жизни пациентов. Обсуждение подобных редких клинических случаев необходимо для повышения информированности врачей о такой патологии и совместном коллегиальном ведении подобных больных ревматологами, дерматологами и хирургами.
СПИСОК ИСПОЛЬЗОВАННОЙ Литературы
- 1. Барышников Е.Н., Нейман К.П. (2008) Гангренозная пиодермия при болезни Крона. Эксперим. и клин. гастроэнтерол., 5: 92–94.
- 2. Елькин В.Д., Митрюковский Л.С., Плотникова Е.В. (2014) Современные представления о гангренозной пиодермии. Терапевт. арх., 12: 121–126.
- 3. Елькин В.Д., Митрюковский Л.С., Седова Т.Г. (2004) Избранная дерматология. Редкие дерматозы и дерматологические синдромы. Звезда, Пермь, 256 с.
- 4. Масюкова С.А., Фролова Л.И., Ильина И.В. и др. (2010) Случай развития гангренозной пиодермии у больного распространенной склеродермией, трудно поддающейся лечению. Соврем. пробл. дерматовенерологии, иммунологии и врачебной косметологии, 5: 67–70.
- 5. Ahronowitz I., Harp J., Shinkai K. (2012) Etiology and management of pyoderma gangrenosum: a comprehensive review. Am. J. Clin. Dermatol., 13: 191–194.
- 6. Barbosa N.S., Tolkachjov S.N., El-Azhary R.A. et al. (2016) Clinical features, causes, treatments, and outcomes of peristomal pyoderma gangrenosum (PPG) in 44 patients: The Mayo Clinic experience, 1996 through 2013. J. Am. Acad. Dermatol., 75: 931.
- 7. Bhat R.M. (2012) Pyoderma gangrenosum: An update. Indian Dermatol. Online J., 3(1): 7–13.
- 8. Khandpur S., Mehta S., Reddy B.S. (2001) Pyoderma gangrenosum in two siblings: a familial predisposition. Pediatr. Dermatol., 18: 308–311.
- 9. Ruocco E., Sangiuliano S., Gravina A.G. et al. (2009) Pyoderma gangrenosum: an updated review. J. Eur. Acad. Dermatol. Venereol., 23(9): 1008–1017.
- 10. Shavit E., Alavi A., Sibbaid R.G. (2017) Pioderma Gangrenosum: A Critical Appraisal. Advances in Skin & Wound Care., 30(12): 534–542.
- 11. Su W.P., Davis M.D., Weenig R.H. et al. (2004) Pyoderma gangrenosum: clinicopathologic correlation and proposed diagnostic criteria. Int. J. Dermatol., 43: 790–795.
- 12. Torrelo A., Colmenero I., Serrano C. et al. (2006) Pyoderma gangrenosum in an infant. Pediatr Dermatol., 23(4): 338–344.
- 13. Vidal D., Puig L., Gilaberte M. et al. (2004) Review of 26 cases of classical pyoderma gangrenosum: clinical and therapeutic features. J. Dermatol. Treat., 15: 146–152.
- 14. Weizman A.V., Huang B., Targan S. et al. (2015) Pyoderma gangrenosum among patients with inflammatory bowel disease: a descriptive cohort study. J. Cutan. Med. Surg., 19(2):125–131.
- 15. Wollina U. (2015) Pyoderma gangrenosum — a systemic disease? Clin. Dermatol., 33(5): 527–530.
Адрес для переписки:
Триполка Светлана Анатольевна
61058, Харьков, просп. Правды, 13
Коммунальное учреждение здравоохранения
«Областная клиническая больница —
центр экстренной медицинской помощи
и медицины катастроф»
E-mail: svtripolka@gmail.com

Leave a comment