Ефективність та безпека глюкозаміну сульфату при лікуванні остеоартриту: дані досліджень, проведених у рутинній клінічній практиці, та оглядів
Брюйер О.1, Альтман Р.Д. 2, Реджинстер Ж.-И.3
- 1Департамент общественного здравоохранения, эпидемиологии и экономики здравоохранения, Университет Льежа, CHU Sart Tilman, 4000, Льеж, Бельгия
- 2Отдел ревматологии и иммунологии, Медицинская школа Дэвида Геффена, Калифорнийский университет, Лос-Анджелес, Калифорния, США
- 3Департамент общественного здравоохранения, эпидемиологии и экономики здравоохранения, Университет Льежа, Льеж, Бельгия
Резюме. Європейське товариство з вивчення клінічних і економічних аспектів остеопорозу та остеоартриту (European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis — ESCEO) рекомендує постійне застосування симптоматичних повільнодіючих препаратів для лікування пацієнтів із остеоартритом (symptomatic slow-acting drugs in osteoarthritis — SYSADOA), включаючи глюкозаміну сульфат (GS) і хондроїтин сульфат (CS) як першу лінію терапії при остеоартриті (OA) колінного суглоба. Опубліковані численні дослідження із застосування SYSADOA при ОА; проте ефективність цього класу лікарських засобів, як і раніше, під запитанням. Здебільшого це пов’язано з нормативним статусом, маркуванням і доступністю цих препаратів, які суттєво різняться по всьому світу. Вивчення доказової бази для рецептурного патентованого кристалічного глюкозаміну сульфату (patented crystalline glucosamine sulfate — pCGS) в дозі 1500 мг 1 раз на добу демонструє перевагу над іншими препаратами GS і глюкозаміну гідрохлориду (glucosamine hydrochloride — GH) та режимами дозування. Таким чином, робоча група ESCEO вважає необхідним диференціювати рецептурні форми pCGS із загальної когорти препаратів глюкозаміну. Результати довгострокових клінічних досліджень і випробувань у рутинній клінічній практиці свідчать про те, що застосування pCGS може затримувати розвиток структурних змін у суглобі, що зумовлює потенційну вигоду не лише щодо контролю симптомів при застосуванні на ранніх етапах лікування при ОА колінного суглоба. Фармакоекономічні дослідження в рутинній клінічній практиці демонструють, що на тлі застосування pCGS відзначається зменшення на тривалий термін необхідності в додатковій анальгезивній терапії та застосуванні нестероїдних протизапальних препаратів зі значним зниженням більше ніж на 50% витрат, пов’язаних із ліками, медичними консультаціями і обстеженнями впродовж понад 12 міс. Крім того, застосування pCGS протягом щонайменше 12 міс зумовлює зниження ймовірності повної заміни суглобів протягом не менше 5 років після припинення лікування. Таким чином, pCGS (1500 мг) — логічний вибір для максимізації клінічної користі для пацієнтів з ОА, з підтвердженою середньостроковою ефективністю контролю больового синдрому і довгостроковим впливом на прогресування захворювання.
Введение
Согласно алгоритму лечения при остеоартрите (ОА) коленного сустава Европейского общества по изучению клинических и экономических аспектов остеопороза и остеоартрита (European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis — ESCEO), рекомендуется постоянное применение симптоматических медленнодействующих препаратов для лечения пациентов с ОА (symptomatic slow-acting drugs in osteoarthritis — SYSADOA), в частности рецептурных глюкозамина сульфата (GS) и хондроитин сульфата (CS), в качестве медикаментозной терапии первой линии, предназначенной для контроля симптомов в средне- и долгосрочной перспективе [1].
Несмотря на то что было опубликовано много результатов исследований, посвященных применению SYSADOA при ОА, эффективность этого класса препаратов по-прежнему вызывает множество дискуссий, что связано со значительными различиями в нормативном статусе, маркировке и доступности этих лекарственных средств в отдельных странах и регионах мира [2]. Глюкозамин, в частности, доступен в качестве рецептурного патентованного кристаллического глюкозамина сульфата (patented crystalline glucosamine sulfate — pCGS) («Rottapharm») [3], генерических и безрецептурных (over-the-counter — OTC) препаратов GS, а также диетических добавок, в основном содержащих соль глюкозамина гидрохлорида (glucosamine hydrochloride — GH). Диетические добавки глюкозамина существенно отличаются от рецептурного pCGS по их молекулярной структуре и режиму дозирования; только рецептурный pCGS обладает высокой биодоступностью, применяется 1 раз в сутки в дозе 1500 мг и характеризуется подтвержденным фармакологическим эффектом [4]. Рабочая группа ESCEO признает различия в эффективности, показанные при применении различных форм глюкозамина в ходе клинических исследований, и рекомендует дифференцировать рецептурный pCGS от других форм глюкозамина [1, 5].
Другие международные руководства по лечению ОА, основанные на данных доказательной медицины, имеют различные рекомендации в отношении применения SYSADOA [6–9]. Рекомендации Европейской антиревматической лиги (European League Against Rheumatism — EULAR) рекомендуют как GS, так и CS в качестве средства для симптоматического лечения при ОА в Европе на основе исследований высокого уровня доказательности (1A) [6]. Напротив, в 2012 г. Американский колледж ревматологии (American College of Rheumatology — ACR) не рекомендовал GS или CS для применения при ОА коленного сустава [7], а обновленное в 2014 г. руководство Международного сообщества остеоартрита (Osteoarthritis Research Society International — OARSI) дает SYSADOA «неопределенный» статус в отношении контроля боли [9]. Причиной этих неблагоприятных и уклончивых рекомендаций может быть отсутствие доступности рецептурной формы данных лекарств в США, отсутствие статистически достоверного влияния на выраженность болевого синдрома в случае, если во внимание при проведении метаанализа принимаются данные об исследованиях всех форм глюкозамина, а также отрицательные результаты, полученные в ходе исследования под эгидой Национального института здоровья (National Institutes of Health — NIH), в котором изучали диетические добавки, доступные в США, включая GH [Glucosamine/Chondroitin Arthritis Intervention Trial (GAIT)] [2,10]. В целом среди рекомендаций, представленных в различных руководствах, присутствует консенсус относительно того, что GH не несет какой-либо пользы как средство для симптоматического лечения при ОА коленного сустава. В руководствах и метаанализах, в которых отдельно оценивают различные формы глюкозамина, анализ результатов исследований с применением любого средства, не являющегося препаратом pCGS, демонстрирует отсутствие эффективности в отношении устранения боли или восстановления функциональных нарушений по шкале Western Ontario and McMaster Universities Osteoarthritis Index (WOMAC), тогда как pCGS постоянно подтверждает эффективность, превосходящую таковую плацебо или других препаратов сравнения, например таких как парацетамол, при боли и функциональных нарушениях, вызванных симптоматикой ОА [11].
Механизм действия глюкозамина
Глюкозамин является природным строительным блоком гликозаминогликанов межклеточного матрикса хряща и синовиальной жидкости, который при экзогенном введении оказывает фармакологическое действие на хрящ и хондроциты при ОА [12–14]. Симптоматические эффекты, также как болезнь-модифицирующий, связанные с применением GS, могут быть обусловлены ингибированием процесса синтеза некоторых медиаторов воспаления, а также молекул, влияющих на деградацию хряща, что приводит к замедлению разрушения хряща и, таким образом, прогрессирования заболевания [15]. В исследованиях in vitro показано, что GS снижает уровень синтеза простагландина E2 (PGE2) и тормозит активацию сигнального пути, опосредованного ядерным фактором каппа В (NF-κB), ингибируя таким образом внутриклеточный цитокиновый сигнальный каскад в хондроцитах и синовиальных клетках [13, 14, 16]. При ОА глюкозамин влияет на провоспалительные и дегенеративные эффекты в отношении сустава, опосредованные интерлейкином (IL)-1 [13]. IL-1β является мощным провоспалительным цитокином, продуцируемым в больших количествах в тканях сустава при OA, где он вызывает экспрессию воспалительных факторов, таких как циклооксигеназа (ЦОГ)-2, индуцибельная форма NO-синтазы (iNOS), IL-6 и фактор некроза опухоли (TNF)-α. IL-1β стимулирует клетки продуцировать большее количество IL-1β, а также факторов деградации межклеточного матрикса, таких как металлопротеиназы (MMP), протеазы семейства дизинтегрин и металлопротеиназы с тромбоспондиновым мотивом типа 1 (disintegrin and metalloproteinase with a thrombospondin type 1 motif, member TSs — ADAM-TSs). Большинство генов, кодирующих указанные белки, находятся под транскрипционным контролем NF-κB. GS в клинически значимых концентрациях снижает экспрессию генов ЦОГ-2, iNOS, синтазы-1 микросомального простагландина Е (microsomal prostaglandin E synthase-1 — mPGEs1) и синтез PGE2 под действием IL-1, что указывает на то, что глюкозамин может контролировать каскад, запускаемый воспалительными стимулами [17].
Исследования, проведенные с использованием клеток хондроцитов человека, демонстрируют, что pCGS ингибирует IL-1-стимулированную экспрессию медиаторов деградации сустава в концентрациях, близких к 10 мкМ, аналогичных тем, которые выявлены в плазме крови или синовиальной жидкости пациентов с ОА коленного сустава после приема pCGS в назначаемой (1500 мг) дозе [15]. При применении pCGS отмечали наличие дозозависимого эффекта в отношении IL-1β-индуцированной генной экспрессии факторов деградации межклеточного матрикса — MMP-3 (стромелизин-1) и ADAM-TS5 (аггреканаза 2) [15]. Как показано на моделях in vitro, длительное пероральное применение GS может замедлить процессы разрушения хряща и повысить экспрессию мРНК MMP-3 [18]. Кроме того, GS является более сильным ингибитором генной экспрессии, чем GH, при введении в дозе 5 мкМ в модели эксплантата ОА человека [19].
Изучение доказательной базы эффективности глюкозамина
Для изучения эффективности глюкозамина проведены многочисленные исследования различного уровня доказательности с целью определить эффективность воздействия глюкозамина на выраженность симптомов ОА. В Кокрановском обзоре 25 рандомизированных контролируемых исследований (randomized controlled trials — RCT, РКИ) всех форм глюкозамина, в которых приняли участие 4963 пациента с ОА, ограниченном исследованиями с адекватным сокрытием информации (11 РКИ), не удалось показать преимуществ применения глюкозамина в отношении купирования боли [стандартное среднее отклонение — standardized mean difference [SMD]=−0,16; 95% доверительный интервал [ДИ] −0,36…0,04] [11]. Однако, когда РКИ, в ходе которых применяли pCGS, проанализировали отдельно, было установлено, что pCGS превосходит плацебо в отношении эффективности купирования боли (SMD =−1,11; 95% ДИ −1,66…–0,57) и улучшения функции (индекс Лекена (Lequesne) SMD=−0,47; 95% ДИ −0,82…−0,12), хотя это и было показано с высоким уровнем неоднородности между исследованиями (I=92%). И наоборот, анализ указанных РКИ, в которых применяли другие препараты за исключением pCGS, не продемонстрировал каких-либо преимуществ по сравнению с плацебо в отношении эффективности купирования боли (SMD = 0,05; 95% ДИ 0,15…0,05) или улучшения функции (SMD =0,01; 95% ДИ 0,13…0,10) [11]. В метаанализе 25 плацебо-контролируемых исследований применение pCGS продемонстрировало преимущества в отношении купирования боли при ОА по сравнению с другими формами GS и GH [20].
Для решения проблемы высокой неоднородности данных, что может позволить получить положительные результаты для рецептурной формы pCGS, целесообразно обратиться к трем базовым исследованиям применения pCGS, которые были оценены как характеризующиеся наивысшим уровнем доказательности, согласно системе оценки качества клинических исследований Ядада (Jadad quality score) [21, 22], и независимо оценены как исследования с «низким риском необъективности» [20]. Все три базовых исследования были долгосрочными, в ходе которых длительность лечения составила от 6 мес до 3 лет у пациентов с умеренным болевым синдромом [20, 23–25]. Для этих исследований общий рассчитанный размер эффекта (effect size) при применении pCGS при боли составлял 0,27 (95% ДИ 0,12…0,43) при отсутствии неоднородности данных [20, 21]. Эффективность применения pCGS в отношении устранения других симптомов подтверждалась статистически достоверным размером эффекта по шкале оценки выраженности боли и нарушения функции WOMAC и в отношении альгофункционального индекса Лекена; при отсутствии неоднородности данных (рис. 1) [21].
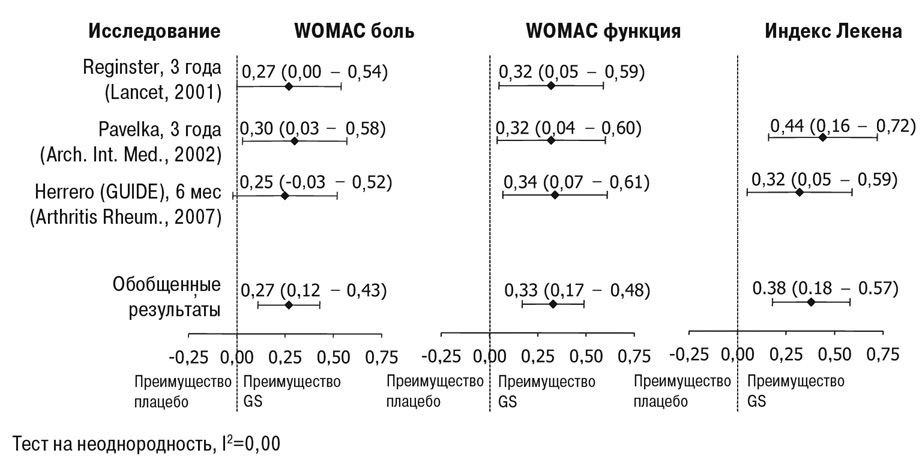
В то время как размер эффекта при применении pCGS для купирования боли рассматривался как умеренный при показателе 0,27, он больше, чем размер эффекта, характерен для парацетамола (0,14; 95% ДИ 0,05…0,22) [26], который рекомендуется в качестве краткосрочной спасательной анальгезии при ОА [1]. В нескольких исследованиях pCGS непосредственно сравнивали с парацетамолом, поскольку последний часто применяют в качестве спасательной анальгезии в клинических исследованиях. В одном РКИ после 6 мес терапии было показано, что размер эффекта по шкале WOMAC при применении pCGS (1500 мг) для купирования боли составил 0,25 (95% ДИ 0,03…0,52) по сравнению с 0,15 (95% ДИ 0,12…0,42) для парацетамола (3 г/сут), демонстрируя тенденцию к большей эффективности pCGS, хотя разница не была статистически достоверной [23]. По сравнению с нестероидными противовоспалительными препаратами (НПВП) размер эффекта pCGS в отношении купирования боли в течение периода лечения в пределах от 6 мес до 3 лет эквивалентен таковому, который достигается при применении системных НПВП, и составил 0,32 для купирования боли (95% ДИ 0,24…0,39) и 0,29 — в отношении улучшения функции (95% ДИ 0,18…0,40) при гораздо более коротких курсах лечения (2–13 нед) [27, 28]. Системные НПВП рекомендуются в качестве второй линии терапии у пациентов с постоянной симптоматикой ОА [1]. Для всех видов лечения соотношение риск/польза должно быть рассмотрено до назначения терапии. Системные НПВП рекомендуются для периодического или циклического краткосрочного применения в минимальных дозах из-за риска развития побочных эффектов со стороны желудочно-кишечного тракта, почек, сердечно-сосудистой системы. Кроме того, имеются также некоторые эпидемиологические данные, свидетельствующие о повышенном риске развития побочных реакций со стороны желудочно-кишечного тракта при применении парацетамола, включая повышение уровня печеночных ферментов [26]. Напротив, GS можно безопасно применять в долгосрочной перспективе, поскольку риск развития побочных реакций при его применении сопоставим с таковым при приеме плацебо [11].
Доказательства наличия болезнь-модифицирующих эффектов глюкозамина
Длительное применение pCGS приводит к задержке развития структурных изменений сустава, что указывает на потенциальную выгоду применения pCGS не только в целях контроля симптоматики при назначении на ранней стадии для лечения ОА. Измерение ширины межсуставного пространства (joint space width — JSW) в начале исследования и после 3 лет лечения в ходе 2 РКИ показало сокращение сужения суставной щели (joint space narrowing — JSN) у пациентов, применявших pCGS, по сравнению с группой плацебо. В одном исследовании через 3 года лечения JSN у пациентов, применявших pCGS, была статистически достоверно лучше на 0,33 мм (95% ДИ 0,12…0,54) по сравнению с плацебо (p=0,003) [24]. Также показано, что в ходе второго исследования лечение pCGS в течение 3 лет полностью предотвращало сужение суставной щели (JSN 0,04 мм, 95% ДИ 0,06…0,14), что статистически достоверно отличалось от умеренного сужения, наблюдаемого при применении плацебо (0,19 мм, 95% ДИ 0,29…0,09; p=0,001) [25] (табл. 1). Отсутствие прогрессии JSN (определяется при пороговом значении 0,5 мм [>0,3–0,7 мм]) показало прогностическое значение >90% относительно отсутствия необходимости проведения хирургической замены сустава [29]. В обоих исследованиях у меньшего количества пациентов, получавших pCGS, отмечали пороговое тяжелое JSN (>0,5 мм) по сравнению с пациентами, принимавшими плацебо: 15% против 30% (р=0,013) [24] и 5% против 14% (р=0,05) [25 ].
| Reginster J.Y. et al. [24] | Плацебо (n=106) | pCGS (n=106) | Разница | Значение, р |
|---|---|---|---|---|
| JSW в начале исследования, мм (среднее±стандартное отклонение) | 3,95±1,24 | 3,82±1,32 | – | – |
| JSN через 3 года, мм (среднее и 95% ДИ) | –0,40 (–0,56…–0,24) | –0,07 (–0,22…0,07) | 0,33 (0,12…0,54) | 0,003 |
| Pavelka K. et al. [25] | Плацебо (n=101) | pCGS (n=101) | Разница | Значение, р |
| JSW в начале исследования, мм (среднее±стандартное отклонение) | 3,63±1,57 | 3,89±1,48 | – | – |
| JSN через 3 года, мм (среднее и 95% ДИ) | –0,19 (–0,29…–0,09) | 0,04 (–0,06…0,14) | 0,23 (0,09…0,37) | 0,001 |
Следует ли сочетать глюкозамин с хондроитин сульфатом?
Долгосрочные исследования рецептурного хондроитин-4 и -6 сульфата (chondroitin 4&6 sulfate — CS) продемонстрировали, что CS может обеспечивать аналогичные преимущества в отношении модификации структуры сустава у пациентов с умеренно выраженным ОА коленного сустава [30–32]. Размер эффекта при применении CS в отношении боли, согласно данным метаанализов, варьирует от 0,13 (95% ДИ 0,00…0,27) до 0,75 (95% ДИ 0,50…0,99) [9]; хотя более современные исследования показывают, что рецептурный CS влияет на структурные изменения сустава и обладает симптоматическим эффектом, что может быть клинически значимым [31, 33].
Глюкозамин и CS часто используют в комбинации в составе диетических добавок; тем не менее нет опубликованных исследований эффективности комбинации этих двух молекул, зарегистрированных в качестве рецептурных лекарственных средств. В проведенном NIH исследовании GAIT установлена положительная тенденция в отношении наличия симптоматического эффекта при применении комбинации CS и GH в подгруппе пациентов с умеренной и сильной болью. Это может рассматриваться как эффект от применения CS плюс плацебо, поскольку применение только GH не оказывало статистически достоверного влияния по сравнению с плацебо [10]. В аналогичном исследовании показано, что сочетание CS и GH, последний из которых является хорошо известным плацебо, характеризовалось сопоставимой эффективностью по сравнению с целекоксибом у пациентов с ОА с умеренной болью после 6 мес лечения [34]. Анализ когорты начального прогрессирования ОА (Osteoarthritis Initiative — OAI), включавшей 600 лиц с ОА коленного сустава, показал, что у пациентов, получавших диетическую добавку, содержащую комбинацию глюкозамина и CS, уменьшилась потеря объема хряща в течение 2 лет независимо от того, принимали ли они дополнительно анальгетики или НПВП [35]. Кроме того, в ходе более нового исследования с участием пациентов с ОА и хронической болью в колене, рандомизированных на группу, получавшую безрецептурные GS (1500 мг) и CS (800 мг) 1 раз в сутки, и группу монотерапии, показано статистически достоверное снижение показателя JSN для группы, получавшей комбинацию, по сравнению с плацебо через 2 года приема (средняя разница = 0,10 мм, 95% ДИ 0,002…0,20 мм; p=0,0046), но не отмечено статистически достоверного структурного эффекта при применении отдельных молекул [36]. Таким образом, имеются ограниченные доказательства того, что комбинация безрецептурных глюкозамина (включая GH) и хондроитина является предпочтительнее любого из двух веществ по отдельности. И наоборот, поскольку оба, рецептурный pCGS и CS, считаются безопасными и эффективными лекарствами, с риском развития побочных эффектов, сопоставимых с плацебо [11,31], может быть разумным проведение плацебо-контролируемых РКИ с целью подтвердить клиническую выгоду от применения комбинации двух этих препаратов рецептурной группы, помимо монотерапии.
Данные исследований, проведенных в рутинной клинической практике, и обзоров
Хотя клинические исследования важны для того, чтобы показать, позволяет ли применение лекарственного средства достичь клинически значимого размера эффекта с хорошей переносимостью, РКИ имеют ряд ограничений, в частности, связанных с вовлечением в исследование только определенной ограниченной выборки пациентов из всей популяции. Эта ограниченность исследуемой популяции может затруднять обобщение результатов. Было бы оптимальным тестировать лекарственные средства в исследованиях в рамках рутинной клинической практики, исследуя группу пациентов общей популяции, сравнивая результаты с эффективностью стандартных методов лечения (а не только в плацебо-контролируемых исследованиях) для достижения клинически значимых конечных точек. В реальном долгосрочном наблюдении пациентов с ОА коленного сустава, участвовавших в двух 3-летних исследованиях эффективности pCGS, лечение с помощью pCGS в течение как минимум 12 мес приводило к значительной отсрочке необходимости проведения полной хирургической замены сустава (total joint replacement — TJR); p=0,026 (рис. 2) [37].
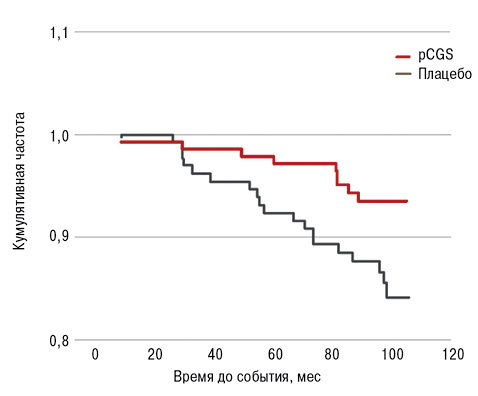
После наблюдения в течение в среднем 5 лет после получения лечения TJR проводили у более чем вдвое большего числа пациентов группы плацебо (14,5%) по сравнению с лицами, ранее получавшими pCGS (6,3%; p=0,024), демонстрируя снижение риска TJR на 57% после применения pCGS (относительный риск (ОР) =0,43; 95% ДИ 0,20…0,92) [37]. pCGS является одним из немногих препаратов, для которых указанный эффект был продемонстрирован в рамках такого длительного периода наблюдения. Например, в одном РКИ пациенты с ОА коленного сустава, получавшие ликофелон в течение 2 лет, имели меньший риск проведения TJR через 4–7 лет наблюдения по сравнению с теми, кто применял напроксен, однако разница была статистически недостоверной [38]. Во всех исследованиях, проводимых в рутинной клинической практике, нет стандартизации лечения пациента после окончания исследования с применением pCGS. Поэтому невозможно выяснить, повлияло ли лечение, полученное впоследствии, на результат этого исследования.
В недавнем исследовании, проводимом в рутинной клинической практике с участием пациентов с ОА, получены данные об уменьшении необходимости применения препаратов для спасательной анальгезии в повседневной жизни при непрерывном приеме pCGS. Исследование Фармакоэпидемиологии гонартроза (Pharmacoepidemiology of gonarthrosis — PEGASus) проводилось французскими органами здравоохранения в сотрудничестве с группой французских ревматологов и эпидемиологов. Основная цель исследования — оценить влияние приема SYSADOA на применение НПВП [39]. Взрослые с ОА коленного и/или бедренного сустава, обращавшиеся за консультацией ревматолога или врача общей практики по поводу обострения симптоматики указанного заболевания, были привлечены в исследование PEGASus, и им назначали лечение SYSADOA согласно выбору врача или пациента. В течение 24 мес допускалось переключение, продолжение или прекращение приема SYSADOA. Применяемые SYSADOA включали pCGS, GH, CS, неочищенные масла авокадо и соевых бобов, а также диацереин. Согласно результатам первичного анализа, только применение pCGS помогало достигнуть статистически достоверного снижения уровня применения НПВП, которое составило 36% (ОР=0,64; 95% ДИ 0,45…0,92), тогда как для всех других видов лечения не выявлено воздействия на уровень применения НПВП (GH: ОР=0,98; 95% ДИ 0,81…1,19; CS: ОР=0,94; 95% ДИ 0,77…1,14; неочищенные масла авокадо и соевых бобов: ОР=0,98; 95% ДИ 0,82…1,17 и диацереин: ОР=1,08; 95% ДИ 0,87…1,33) [39].
Фармакокинетика различных форм глюкозамина
Превосходящая эффективность pCGS может быть объяснена защищенной патентом уникальной стабилизированной кристаллической структурой GS [3], среди других факторов, и однократным режимом дозирования 1 раз в сутки (1500 мг), что позволяет достичь более высокой концентрации глюкозамина в плазме крови по сравнению с другими препаратами [4]. Результаты фармакокинетических исследований свидетельствуют, что однократная суточная доза pCGS 1500 мг позволяет достичь устойчивой средней концентрации в плазме крови 9 ммоль глюкозамина у здоровых добровольцев [40], тогда как введение GH (500 мг 3 раза в сутки) позволяло достичь устойчивого уровня только 1,2 мкМ [ 41]. В перекрестном исследовании показано, что переход с pCGS на GH приводил к снижению на 50% пиковой концентрации в плазме крови и снижению на 75% общей биодоступности [4], что можно объяснить различиями в режиме дозирования и фармацевтической форме. Низкая биодоступность, которая была зафиксирована при применении GH, может помочь объяснить неудовлетворительные результаты, полученные для этой формы: например в исследовании GAIT [10], в котором не показано преимуществ применения GH по сравнению с плацебо. Важно отметить, что у пациентов с ОА максимальная концентрация глюкозамина 7,17 мкМ (в диапазоне 3,35–22,7) в плазме крови и 4,34 мкМ (в диапазоне 3,22–18,1) в синовиальной жидкости была достигнута после применения pCGS (1500 мг) 1 раз в сутки [40, 42].
Отсутствие необходимой стабилизации GS может отрицательно сказываться на доступности активного ингредиента; кроме того, качество безрецептурных форм глюкозамина может быть субоптимальным [43]. Среди 14 диетических добавок и безрецептурных препаратов глюкозамина только один содержит количество активного ингредиента, заявленное на этикетке упаковки, в то время как другие содержат количества в пределах от 59 до 138% заявленной дозы [43]. Таким образом, только рецептурная форма pCGS может обеспечить надежную доставку для достижения достаточных концентраций глюкозамина в плазме крови в диапазоне, который, как показано, является фармакологически эффективным.
Экономическое влияние применения глюкозамина
ОА чаще всего отмечается у людей в возрасте старше 50 лет, и с постепенным старением населения в ряде стран оценка экономической эффективности лечения и воздействия на бюджеты здравоохранения приобретает все большее значение. Экономическая оценка позволяет сравнить различные стратегии лечения с учетом стоимости (затраты на вмешательство и расходы, связанные с заболеванием) и последствия, например количества качественных лет жизни, которые получил пациент в результате лечения (quality-adjusted life years — QALY). Анализ эффективности затрат в ходе 6 мес исследования показал, что прием pCGS является более экономически эффективной терапией по сравнению с парацетамолом и плацебо при ОА коленного сустава по показателю коэффициента эффективности дополнительных затрат (incremental cost-effectiveness ratio — ICER) [23, 44]. Кроме того, системный обзор и экономическая оценка показали, что добавочная стоимость из расчета на QALY при добавлении GS к существующему лечению в течение всей жизни пациента составляет около 21 335 фунтов стерлингов (приблизительно 33 346 дол. США) [45]. Результаты анализа чувствительности свидетельствуют, что экономическая эффективность терапии GS частично зависит от повышения показателя качества жизни, изменения вероятности TJR коленного сустава и ставки дисконтирования.
Наблюдение пациентов с ОА в рамках рутинной клинической практики показало, что непрерывное лечение с применением рецептурного pCGS приводит к уменьшению потребления других сопутствующих лечению ОА лекарств, количества медицинских консультаций и обследований в долгосрочной перспективе [37]. Пациентов с ОА, ранее принимавших участие в РКИ, продолжили наблюдать в клинике (в среднем 5 лет после проведения клинического исследования), в ходе которого была рассчитана общая средняя сумма затрат, связанных с лечением при ОА, в течение года, предшествующего последующему визиту. Она была почти в 2 раза меньше среди пациентов, получавших рецептурный pCGS, по сравнению с теми кто, принимал плацебо (292 евро по сравнению с 605 евро; p=0,024). Общая стоимость препаратов для лечения при ОА, принимаемых пациентами группы плацебо (включая анальгетики и НПВП), была почти в 2 раза выше, чем таковая, принимаемая пациентами группы, получавшей pCGS (204 евро в группе плацебо по сравнению с 108 евро — в группе pCGS) (табл. 2); в то время как количество консультаций у врачей узкой специализации, врачей общей практики (GP) и парамедиков, а также обследований (рентгенограммы, гастроскопии и не связанные с ОА обследования), проведенные в предыдущем году, было постоянно больше для группы, получавшей плацебо, по сравнению с пациентами, принимавшими pCGS [37].
| Средние расходы, евро (дол. США) | Плацебо (n=43) | pCGS (n=58) |
|---|---|---|
| Стоимость анальгетиков | 59 (77) | 19 (25) |
| Стоимость НПВП | 116 (151) | 63 (82) |
| Общая стоимость препаратов для лечения при ОА (включая анальгетики, НПВП и пр.) | 204 (265) | 108 (140) |
| Общая средняя стоимость ресурсов, связанных с лечением ОА | 605 (786) | 292 (380) |
1 евро≈1,3 дол. США (2007).
Общий расчет затрат с учетом стоимости повторных медицинских консультаций (парамедики, специалисты), обследований (рентгенограммы, гастроскопия) и расходы на лекарственные средства (анальгетики, НПВП и пр.).
p=0,024 по сравнению с плацебо.
Выводы
Все больше доказательств того, что разные формы глюкозамина обладают различными терапевтическими эффектами. Поэтому не всем формам глюкозамина следует присваивать одинаковый уровень рекомендаций. Клинические исследования с высоким уровнем доказательности продемонстрировали эффективность рецептурного pCGS как SYSADOA с более высокой эффективностью в отношении купирования боли, чем у парацетамола, и находящемся в том же диапазоне, что и у системных НПВП. Размер эффекта для других препаратов глюкозамина последовательно приближался к нулю. В связи с этим рабочая группа ESCEO выступает за pCGS, советуя рекомендовать его вместо других препаратов глюкозамина в качестве SYSADOA первой линии терапии для средне- и долгосрочного контроля выраженности симптомов. Только pCGS имеет высокую биодоступность при приеме 1 раз в сутки (1500 мг). В дополнение к умеренной эффективности в отношении купирования боли имеются свидетельства того, что постоянное применение может иметь болезнь-модифицирующие эффекты, замедляющие структурные изменения сустава. Последующие исследования когорт пациентов в рутинной клинической практике продемонстрировали, что структурно-модифицирующие эффекты pCGS, по-видимому, превращаются в клинически значимые преимущества для пациентов с ОА коленного сустава, а именно обусловливают отсрочку необходимости полной замены сустава. Кроме того, в фармакоэкономических исследованиях, проведенных в рамках рутинной клинической практики, выявлено снижение потребности в применении сопутствующей анальгезивной терапии и НПВП, а также превосходство pCGS по сравнению с другими препаратами глюкозамина в этом отношении.
Подтверждения
Все авторы соответствуют критериям ICMJE для авторства этой статьи, берут на себя ответственность за целостность работы в целом и окончательно одобрили версию, которая будет опубликована. Редакционную помощь в подготовке этой статьи предоставила Лиза Баттл, доктор философии, Medscript Ltd., которая была профинансирована ESCEO asbl, Бельгия.
Список использованной литературы
- 1. Bruyere O., Cooper C., Pelletier J.P. et al. (2014) An algorithm recommendation for the management of knee osteoarthritis in Europe and internationally: a report from a task force of the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO). Semin. Arthritis Rheum., 44: 253–263.
- 2. Cutolo M., Berenbaum F., Hochberg M. et al. (2014) Commentary on recent therapeutic guidelines for osteoarthritis. Semin. Arthritis Rheum., 44: 611–617.
- 3. De Wan M., Volpi G., inventors; Rottapharm, assignee (1998) Method of preparing mixed glucosamine salts. USA patent 5, 847: 107.
- 4. Altman R.D. (2009) Glucosamine therapy for knee osteoarthritis: pharmacokinetic considerations. Expert. Rev. Clin. Pharmacol., 2: 359–371.
- 5. Bruyere O., Cooper C., Pelletier J.-P. et al. (2016) A consensus statement on the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) algorithm for the management of knee osteoarthritis—from evidence-based medicine to the real-life setting. Semin. Arthritis Rheum., 45: 3–11.
- 6. Jordan K.M., Arden N.K., Doherty M. et al. (2003) EULAR Recommendations 2003: an evidence based approach to the management of knee osteoarthritis: Report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Ann. Rheum. Dis., 62: 1145–1155.
- 7. Hochberg M.C., Altman R.D., April K.T. et al. (2012)American College of Rheumatology 2012 recommendations for the use of nonpharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip, and knee. Arthritis Care Res., 64: 465–474.
- 8. Jevsevar D.S. (2013) Treatment of osteoarthritis of the knee: evidence-based guideline, 2nd edition. J. Am. Acad. Orthop. Surg., 21: 571–576.
- 9. McAlindon T.E., Bannuru R.R., Sullivan M.C. et al. (2014) OARSI guidelines for the non-surgical management of knee osteoarthritis. Osteoarthritis Cartilage, 22: 363–388.
- 10. Clegg D.O., Reda D.J., Harris C.L. et al. (2006) Glucosamine, chondroitin sulfate, and the two in combination for painful knee osteoarthritis. N. Engl. J. Med., 354: 795–808.
- 11. Towheed T.E., Maxwell L., Anastassiades T.P. et al. (2009)Glucosamine therapy for treating osteoarthritis. Cochrane Database Syst. Rev., CD002946.
- 12. Hamerman D. (1989) The biology of osteoarthritis. N. Engl. J. Med., 320: 1322–1330.
- 13. Rovati L.C., Girolami F., Persiani S. (2012) Crystalline glucosamine sulfate in the management of knee osteoarthritis: efficacy, safety, and pharmacokinetic properties. Ther. Adv. Musculoskelet. Dis., 4: 167–180.
- 14. Reginster J.Y., Neuprez A., Lecart M.P. et al. (2012) Role of glucosamine in the treatment for osteoarthritis. Rheumatol. Int., 32: 2959–2967.
- 15. Chiusaroli R., Piepoli T., Zanelli T. et al. (2011) Experimental pharmacology of glucosamine sulfate. Int. J. Rheumatol., 2011: 939265.
- 16. Largo R., Alvarez-Soria M.A., Diez-Ortego I. et al. (2003) Glucosamine inhibits IL-1beta-induced NFkappaB activation in human osteoarthritic chondrocytes. Osteoarthritis Cartilage, 11: 29–28.
- 17. Chan P.S., Caron J.P., Rosa G.J., Orth M.W. (2005) Glucosamine and chondroitin sulfate regulate gene expression and synthesis of nitric oxide and prostaglandin E(2) in articular cartilage explants. Osteoarthritis Cartilage, 13: 387–394.
- 18. Taniguchi S., Ryu J., Seki M. et al. (2012) Long-term oral administration of glucosamine or chondroitin sulfate reduces destruction of cartilage and up-regulation of MMP-3 mRNA in a model of spontaneous osteoarthritis in Hartley guinea pigs. J. Orthop. Res., 30: 673–678.
- 19. Uitterlinden E.J., Jahr H., Koevoet J.L. et al. (2006) Glucosamine decreases expression of anabolic and catabolic genes in human osteoarthritic cartilage explants. Osteoarthritis Cartilage, 14: 250–257.
- 20. Eriksen P., Bartels E.M., Altman R.D. et al. (2014) Risk of bias and brand explain the observed inconsistency in trials on glucosamine for symptomatic relief of osteoarthritis: a meta-analysis of placebo-controlled trials. Arthritis Care Res. (Hoboken), 66: 1844–1855.
- 21. Reginster J.Y. (2007) The efficacy of glucosamine sulfate in osteoarthritis: financial and nonfinancial conflict of interest. Arthritis Rheum., 56: 2105–2110.
- 22. Jadad A.R., Moore R.A., Carroll D. et al. (1996) Assessing the quality of reports of randomized clinical trials: is blinding necessary? Control Clin. Trials, 17: 1–12.
- 23. Herrero-Beaumont G., Ivorra J.A., Del Carmen Trabado M. et al. (2007) Glucosamine sulfate in the treatment of knee osteoarthritis symptoms: a randomized, double-blind, placebo-controlled study using acetaminophen as a side comparator. Arthritis Rheum., 56: 555–567.
- 24. Reginster J.Y., Deroisy R., Rovati L.C. et al. (2001) Long-term effects of glucosamine sulphate on osteoarthritis progression: a randomised, placebo-controlled clinical trial. Lancet, 357: 251–256.
- 25. Pavelka K., Gatterova J., Olejarova M. et al. (2002) Glucosamine sulfate use and delay of progression of knee osteoarthritis: a 3-year, randomized, placebo-controlled, double-blind study. Arch. Intern. Med., 162: 2113–2123.
- 26. Zhang W., Nuki G., Moskowitz R.W. et al. (2010) OARSI recommendations for the management of hip and knee osteoarthritis: part III: Changes in evidence following systematic cumulative update of research published through January 2009. Osteoarthritis Cartilage, 18: 476–499.
- 27. Bjordal J.M., Klovning A., Ljunggren A.E., Slordal L. (2007) Short-term efficacy of pharmacotherapeutic interventions in osteoarthritic knee pain: A meta-analysis of randomised placebo-controlled trials. Eur. J. Pain, 11: 125–138.
- 28. Bjordal J.M., Ljunggren A.E., Klovning A., Slordal L. (2004) Non-steroidal anti-inflammatory drugs, including cyclo-oxygenase-2 inhibitors, in osteoarthritic knee pain: meta-analysis of randomised placebo controlled trials. Br. Med. J., 329: 1317.
- 29. Altman R.D., Abadie E., Avouac B. et al. (2005) Total joint replacement of hip or knee as an outcome measure for structure modifying trials in osteoarthritis. Osteoarthritis Cartilage, 13: 13–19.
- 30. Hochberg M.C., Zhan M., Langenberg P. (2008) The rate of decline of joint space width in patients with osteoarthritis of the knee: a systematic review and metaanalysis of randomized placebo-controlled trials of chondroitin sulfate. Curr. Med. Res. Opin., 24: 3029–3035.
- 31. Kahan A., Uebelhart D., De Vathaire F. et al. (2009) Long-term effects of chondroitins 4 and 6 sulfate on knee osteoarthritis: the study on osteoarthritis progression prevention, a two-year, randomized, double-blind, placebo-controlled trial. Arthritis Rheum., 60: 524–533.
- 32. Wildi L.M., Raynauld J.P., Martel-Pelletier J. et al. (2011) Chondroitin sulphate reduces both cartilage volume loss and bone marrow lesions in knee osteoarthritis patients starting as early as 6 months after initiation of therapy: a randomised, double-blind, placebo-controlled pilot study using MRI. Ann. Rheum. Dis., 70: 982–989.
- 33. Zegels B., Crozes P., Uebelhart D. et al. (2013) Equivalence of a single dose (1200 mg) compared to a three-time a day dose (400 mg) of chondroitin 4&6 sulfate in patients with knee osteoarthritis. Results of a randomized double blind placebo controlled study. Osteoarthritis Cartilage, 21: 22–27.
- 34. Hochberg M.C., Martel-Pelletier J., Monfort J. et al. (2016) Combined chondroitin sulfate and glucosamine for painful knee osteoarthritis: a multicentre, randomised, double-blind, non-inferiority trial versus celecoxib. Ann. Rheum. Dis., 75: 37–44.
- 35. Martel-Pelletier J., Roubille C., Abram F. et al. (2015) First-line analysis of the effects of treatment on progression of structural changes in knee osteoarthritis over 24 months: data from the osteoarthritis initiative progression cohort. Ann. Rheum. Dis., 74: 547–556.
- 36. Fransen M., Agaliotis M., Nairn L. et al. (2015) Glucosamine and chondroitin for knee osteoarthritis: a double-blind randomised placebo-controlled clinical trial evaluating single and combination regimens. Ann. Rheum. Dis., 74: 851–858.
- 37. Bruyere O., Pavelka K., Rovati L.C. et al. (2008) Total joint replacement after glucosamine sulphate treatment in knee osteoarthritis: results of a mean 8-year observation of patients from two previous 3-year, randomised, placebo-controlled trials. Osteoarthritis Cartilage, 16: 254–260.
- 38. Raynauld J.P., Martel-Pelletier J., Haraoui B. et al. (2011) Risk factors predictive of joint replacement in a 2-year multicentre clinical trial in knee osteoarthritis using MRI: results from over 6 years of observation. Ann. Rheum. Dis., 70: 1382–1388.
- 39. Rovati L.C., Girolami F., D’Amato M., Giacovelli G. (2016) Effects of glucosamine sulfate on the use of rescue non-steroidal anti-inflammatory drugs in knee osteoarthritis: results from the Pharmaco-Epidemiology of GonArthroSis (PEGASus) study. Semin. Arthritis Rheum. (Suppl), 45: 34–41.
- 40. Persiani S., Roda E., Rovati L.C. et al. (2005) Glucosamine oral bioavailability and plasma pharmacokinetics after increasing doses of crystalline glucosamine sulfate in man. Osteoarthritis Cartilage, 13: 1041–1049.
- 41. Jackson C.G., Plaas A.H., Sandy J.D. et al. (2010) The human pharmacokinetics of oral ingestion of glucosamine and chondroitin sulfate taken separately or in combination. Osteoarthritis Cartilage, 18: 297–302.
- 42. Persiani S., Rotini R., Trisolino G. et al. (2007) Synovial and plasma glucosamine concentrations in osteoarthritic patients following oral crystalline glucosamine sulphate at therapeutic dose. Osteoarthritis Cartilage, 15: 764–772.
- 43. Russell A.S., Aghazadeh-Habashi A., Jamali F. (2002) Active ingredient consistency of commercially available glucosamine sulfate products. J. Rheumatol., 29: 2407–2409.
- 44. Scholtissen S., Bruyere O., Neuprez A. et al. (2010) Glucosamine sulphate in the treatment of knee osteoarthritis: costeffectiveness comparison with paracetamol. Int. J. Clin. Pract., 64: 756–762.
- 45. Black C., Clar C., Henderson R. et al. (2009) The clinical effectiveness of glucosamine and chondroitin supplements in slowing or arresting progression of osteoarthritis of the knee: a systematic review and economic evaluation. Health Technol. Assess., 13: 1–148.
*© 2016 The Authors. Published by Elsevier HS Journals, Inc. This is an open access article under the CCBY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/). Публикация предоставлена фармацевтической компанией «Меда». Перевод выполнен Лукьянчук Евгенией.

Leave a comment