ПРОБЛЕМА СПІВІСНУВАННЯ СИСТЕМНОГО СКЛЕРОЗУ, СКЛЕРОДЕРМОПОДІБНОГО ПАРАНЕОПЛАСТИЧНОГО СИНДРОМУ І НЕОПЛАСТИЧНОГО ПРОЦЕСУ: ОГЛЯД ЛІТЕРАТУРИ І РОЗБІР КЛІНІЧНИХ ВИПАДКІВ
Головач И.Ю.1, Егудина Е.Д.2, Калашникова О.С.2
- 1Клінічна лікарня «Феофанія» Державного управління справами, Київ
- 2ДЗ «Дніпропетровська медична академія» МОЗ України
Резюме. У представленій статті описано три клінічних випадки діагностики системної склеродермії та злоякісних новоутворень, а також проведено аналіз співіснування системної склеродермії, паранеопластичних реакцій та злоякісних пухлин. Імунні реакції, які беруть участь у патогенезі системної склеродермії, можуть зумовити розвиток онкологічної патології; тому пацієнти з факторами ризику цього захворювання потребують ретельного спостереження за можливим неопластичним процесом. З іншого боку, симптоми системного склерозу можуть бути маскою різних видів злоякісних новоутворень. Диференціація між ідіопатичною формою системної склеродермії, склеродермоподібним паранеопластичним синдромом і розвитком раку на тлі аутоімунної патології викликає безліч труднощів. У першому описаному клінічному випадку був встановлений діагноз «ідіопатична системна склеродермія» у пацієнтки похилого віку. Незважаючи на глибокий діагностичний пошук і нетиповий перебіг хвороби злоякісне новоутворення не було виявлено. У другому випадку склеродермоподібний паранеопластичний синдром дебютував на тлі колоректального раку і випереджав його за клінічними проявами. У третьому клінічному випадку описано розвиток неходжкінської лімфоми на тлі перебігу первинної системної склеродермії. Крім того, у статті представлений аналіз диференційних діагностичних процедур, які були проведені та привели до остаточного діагнозу, згадуються типи злоякісних новоутворень, що асоціюються із системним склерозом, пропонується алгоритм спостереження пацієнтів для раннього виявлення онкологічної патології. Пацієнти із системною склеродермією, особливо старшого віку, при високій активності захворювання, із швидко прогресуючим і атиповим перебігом, при високому титрі антитіл до аутоантитіл, нетиповою капіляроскопічною картиною потребують більш ретельного діагностичного пошуку і контролю з приводу онкологічної патології, особливо якщо пацієнт проявляє ознаки й симптоми обох станів.
Системная склеродермия (прогрессирующий системный склероз) (ССД) — стадийно протекающее полиорганное заболевание с характерными вазоспастическими сосудистыми реакциями по типу синдрома Рейно и облитерирующей васкулопатией с ишемическими нарушениями, при котором развиваются специфические аутоиммунные расстройства, сопровождающиеся активацией фиброзообразования и избыточным отложением коллагена в тканях [5, 41].
Клинические и патологические проявления заболевания являются результатом трех различных процессов: 1) нарушения работы врожденного и приобретенного звеньев иммунной системы, приводящие к аномалиям гуморального (производство аутоантител) и клеточного иммунитетов; 2) фибропролиферативная васкулопатия сосудов малого калибра; 3) дисфункция фибробластов, приводящая к избыточному накоплению коллагена и других матриксных компонентов в коже, кровеносных сосудах и внутренних органах [28, 60].
Вовлечение в патологический процесс внутренних органов является лидирующей причиной смерти этих пациентов. Легочный фиброз (интерстициальное заболевание легких (ИЗЛ)) и легочная артериальная гипертензия приводят к более чем 50% причин смертей при ССД [26]. Скорость прогрессирования висцеритов при разных клинических формах различна и определяет прогноз. Кроме того, прогноз ССД варьирует в зависимости от обширности и локализации поражения кожи. Таким образом, различают три подтипа ССД: лимитированная кожная форма, диффузная кожная ССД и ССД без поражения кожи [41]. Дифференциальный диагноз лимитированной и диффузной формы представлен в табл. 1.
| Органы-мишени | ЛФ-ССД | ДФ-ССД |
|---|---|---|
| Кожа | Утолщение кожи происходит на поздних стадиях болезни, ограничено дистальной частью верхних и нижних конечностей, лица, шеи и верхней части грудной клетки. Частыми проявлениями являются телеангиэктазии и кальциноз | Утолщение кожи происходит на ранних стадиях болезни, распространяется на проксимальную часть конечностей и туловища. Телеангиэктазии и кальциноз являются поздними проявления |
| Желудочно-кишечный тракт | Дисфункцию пищевода выявляют чаще, чем вовлечение толстого и тонкого кишечника | Дисфункцию пищевода выявляют редко; более характерно вовлечение толстого и тонкого кишечника |
| Легкие | Легочный фиброз выявляется реже и менее выражен. Более характерна легочная гипертензия разной степени выраженности | Легочный фиброз более характерен и выражен значительно. Легочная гипертензия менее характерна |
| Почки | Почечный склеродермический криз не характерен | Почечный склеродермический криз отмечается часто |
| Антитела | Характерны антицентромерные антитела (ACA) | Наиболее часто отмечаются антитела к топоизомеразе I ДНК (Anti-Scl-70). Характерны также антитела к РНК полимеразе III (Anti-RNA polymerase) |
Учитывая неоднородность клинических симптомов и признаков, гетерогенность дебютных форм ССД, Американская коллегия ревматологов и Европейская противоревматическая лига (ACR/EULAR) совместно разработали новые классификационные критерии ССД (табл. 2), позволяющие устанавливать достоверный диагноз на любой стадии заболевания, даже при отсутствии уплотнения кожи [29, 57].
Пациенты, набирающие в сумме ≥9 баллов, классифицируются как имеющие достоверную (definite) ССД. Чувствительность новых критериев составила 91% и специфичность — 92%.
| Параметры | Варианты признаков | Баллы |
|---|---|---|
| 1. Уплотнение и утолщение кожи обеих рук выше пястно-фаланговых суставов (ПФС) | 9 | |
| 2. Уплотнение и утолщение кожи пальцев |
|
24 |
| 3. Дигитальная ишемия |
|
23 |
| 4. Телеангиэктазии | 2 | |
| 5. Капилляроскопические изменения | 2 | |
| 6. Легочная артериальная гипертензия и/или ИЗЛ | 2 | |
| 7. Феномен Рейно | 3 | |
| 8. Специфичные аутоантитела (анти-Scl-70, антицентромерные, к RNA-полимеразе III) | 3 |
Однако характерные клинические признаки ССД могут маскировать онкологические заболевания, а паранеопластический процесс, в свою очередь, маскируется симптомами ССД.
Сосуществование ревматических и неопластических процессов широко дискутируется. Общеизвестно, что хроническое течение ревматических заболеваний (синдром Шегрена, системный склероз, ревматоидный артрит, системная красная волчанка, дерматомиозит) путем иммунологической стимуляции может способствовать канцерогенезу. Генетические факторы окружающей среды (вирусы, химические вещества, радиация) и изменения иммунологического контроля могут быть причиной как ревматических, так и паранеопластических нарушений [2, 14].
Паранеопластический синдром — это симптомы или совокупность симптомов, которые являются вторичными по отношению к первичному онкологическому процессу. Эти симптомы могут быть вызваны веществами, секретируемыми опухолью (гормонами и другими биологически активными веществами) или обусловлены реакцией иммунной системы на опухолевые клетки (аутоиммунные реакции, образование иммунных комплексов, супрессия иммунной системы), что вовлекает в патологический процесс различные органы и системы, расположенные дистантно от первичного очага или метастазов [1]. Механизм формирования паранеопластического синдрома связан с опухолевыми антигенами, на появление которых иммунная система человека реагирует образованием аутоантител, в том числе антител к топоизомеразе и антинуклеарных антител. В настоящее время известно более 400 типов таких антигенов [43].
В литературе есть множество сообщений о сосуществовании новообразований и паранеопластических ревматических синдромов, таких как дерматомиозит и полимиозит, ревматическая полимиалгия, эозинофильный фасцит, узелковая эритема, синдром Шегрена с моноклональной гаммапатией, стероидорезистентный лейкоцитокластический васкулит, асимметричный артрит у людей пожилого возраста, артрит с моноклональной гаммапатией, болезнь Стилла у взрослых, антифосфолипидный синдром, смешанная криоглобулинемия, феномен Рейно и ССД [3, 4, 23, 24, 45, 46, 48].
С другой стороны, некоторые хронические ревматические заболевания, такие как ревматоидный артрит, синдром Шегрена, дерматомиозит, височный артериит, системная красная волчанка, ССД, относятся к предраковым состояниям [11, 12]. Предраковое состояние — это состояние или поражение, которое предрасполагает к развитию злокачественной опухоли, повышает риск малигнизации отдельных тканей или органов, и одним из важных механизмов, стимулирующих его развитие, является активация иммунной системы.
Ревматические паранеопластические синдромы могут возникать на фоне онкологического заболевания, могут предшествовать диагнозу на 1–2 года, появляться одновременно с клиническим проявлением онкологического процесса или развиваться через некоторое время после диагностирования опухоли [1, 3]. Часто бывает трудно отличить парнеопластические состояния от первичного идиопатического заболевания. Считается, что наличие паранеопластического синдрома является прогностически неблагоприятным состоянием для течения злокачественного новообразования. Одновременно с выздоровлением симптоматика ревматического заболевания исчезает, а ее повторное появление может указывать на рецидив заболевания.
Патофизиологический механизм склеродермоподобного паранеопластического синдрома (СППС) изучен недостаточно. Согласно одной из теорий, предполагается, что раковые клетки могут индуцировать синтез вещества, инициирующего фиброз кожи и внутренних органов [50]. С другой стороны, многие исследования подтверждают, что у пациентов с ССД, особенно в возрасте старше 50 лет, отмечают статистически более высокий риск развития рака [37, 52]. Возможно, что у предрасположенных пациентов могут развиваться две отдельные болезни с аналогичным патогенным механизмом.
Многочисленные иммунологические реакции при ССД могут способствовать развитию малигнизации различных локализаций [35]. Так, высокие концентрации профибротических цитокинов, участвующих в патогенезе ССД, такие как трансформирующий фактор роста (TGF)-β, можно выявить при некоторых раковых заболеваниях (например рак молочной железы, яичника, почек) [32]. Как ССД, так и склеродермоподобные синдромы могут быть инициированы различными факторами, включая триптофан, кремниевую пыль, ароматические углеводороды, алифатические растворители, хлорированные углеводороды, винилхлорид, трихлорэтилен, эпоксидные смолы, карбидопу, пентазоцин, кокаин, фенфлурамин, D-пеницилламин и многие другие [55]. Некоторые из веществ, такие как органические растворители, могут одновременно являться фактором риска и неопластического заболевания, и ССД, например силиконовые грудные имплантаты [17]. Так, в популяции женщин с силиконовыми грудными имплантатами обнаружено повышение относительного риска развития ССД [10].
Существует ряд исследований, в которых изучали ассоциацию злокачественных новообразований и ССД. В датском исследовании из национального реестра пациентов с ССД в 2000–2010 гг. A.B. Olesen и соавторы (2010) [39] выявили 222 случая рака у пациентов с подтвержденным диагнозом ССД в анамнезе в течение 1–2 последних лет. В этом исследовании установлено повышение стандартизованного коэффициента заболеваемости раком (СКЗР) до 1,5. Мужчины имели более высокий уровень заболеваемости раком, чем женщины: СКЗР у мужчин составил 2,2 (1,7–2,8), а у женщин — 1,3 (1,1–1,6).
Еще одно когортное исследование было проведено в Юго-Западной Англии. К. Siau и соавторы (2011) [54] изучали наличие злокачественных новообразований у пациентов с ССД, базируясь на региональной базе данных здравоохранения. Исследователи выявили 15 злокачественных новообразований у 68 пациентов с ССД. Хотя общее число случаев ССД было низким, авторы рассчитали относительный риск рака — 3,15 (СКЗР — 1,77–5,20) и установили, что наиболее частая выявленная злокачественная патология была связана с поражением органов кроветворения.
Недавние исследования также продемонстрировали, что пациенты с ССД и аутоантителами к РНК-полимеразе III имеют более высокий риск развития рака в течение нескольких лет после дебюта основного заболевания. Идентифицированы изменения в гене, кодирующем РНК-полимеразу III (POLR3A), и пациенты с соматическими мутациями в POLR3A имеют специфические мутации иммунного ответа Т-клеток с образованием аутоантител, перекрестно реагирующих с РНК-полимеразой III [42, 53].
Отметим несколько популяционных когортных метаанализов, цель которых — оценка риска развития паранеопластического процесса при системном склерозе. Так, в исследовании A. Onishi и соавторов (2013) акцентируется повышенный риск развития злокачественных новообразований у пациентов с ССД, и демонстрируется, что риск развития рака наиболее высокий в первый год после установления диагноза ССД [40].
Кроме того, ряд авторов [8, 33, 63] объединили 6 оригинальных исследований из Швеции, Шотландии, Австралии, США, Дании и Тайваня, в общей сложности 6641 пациент с CCД. Пациенты с системным склерозом имели повышенный риск развития всех видов рака (СКЗР — 1,4,), у мужчин риск был выше (СКЗР — 1,85), чем у женщин (СКЗР — 1,33). Пациенты с ССД имели высокий риск развития рака легкого (СКЗР — 3,18), мочевого пузыря (только женщины, СКЗР — 2,80), органов кроветворения (СКЗР — 2,57,), печени (СКЗР — 3,6) и кожи (немеланомный рак кожи) (только мужчины, СКЗР — 2,34). Не отмечено повышенного риска опухолей, специфичных для определенного пола пациентов, таких как рак предстательной железы, шейки матки или матки, молочной железы. Авторы также провели вторичный анализ данных из реферальных центров и выявили повышенный риск развития рака пищевода (СКЗР — 9,59). Другие исследования также продемонстрировали повышенный риск развития рака ротоглотки, причем в одном исследовании в США выявили 25-кратное повышение риска заболеваемости раком языка [52].
Кроме того, пациенты с ССД имеют повышенный риск развития рака вследствие высокой активности болезни и применяемых методов лечения [6, 51]. Повреждение вследствие хронического воспаления и фиброза может привести к злокачественной трансформации клеток в некоторых органах [56]. Например, ИЗЛ может обусловливать развитие рака легкого [30], пациенты с тяжелой рефрактерной гастроэзофагеальной рефлюксной болезнью и пищеводом Барретта могут иметь более высокий риск развития рака пищевода [59]. Перекрестный синдром ССД с первичным билиарным циррозом, отмечаемый более часто у пациентов с лимитированной формой и антицентромерными антителами, является фактором риска развития злокачественных новообразований печени [13]. Иммуносупрессивная терапия, применяемая для лечения при CCД, также может обусловливать развитие малигнизации. Это такие препараты, как мофетила микофенолат и циклофосфамид, часто применяемые для лечения при активной диффузной ССД, ИЗЛ или миозите при системном склерозе. Хорошо известно, что повышение кумулятивной дозы циклофосфамида повышает риск возникновения рака мочевого пузыря и гематологических злокачественных новообразований [21, 38]. Описаны данные о развитии злокачественных новообразований, ассоциированных с применением мофетила микофенолата: повышенный риск развития лимфомы и рака кожи [9, 36].
Учитывая экспериментальные данные, свидетельствующие о том, что В-клетки могут активно участвовать в фиброзном процессе, обосновано применение ритуксимаба при ССД [18]. Об этом же свидетельствует наличие в биоптатах легких у пациентов с ССД-ассоциированным ИЗЛ преимущественно В-клеточной инфильтрации [34]. Отсутствие данных о таких побочных эффектах ритуксимаба, как развитие злокачественных новообразований, также обнадеживает.
Онкологические риски также особо повышаются у пациентов с дебютом ССД в пожилом возрасте [31, 51].
Известно, что системный склероз сам по себе, а также его лечение могут способствовать последующему развитию малигнизации. Однако следует отметить, что у части пациентов с первичным паранеопластическим процессом развивается склеродермоподобный синдром после диагностики онкологического процесса, что, в свою очередь, свидетельствует о роли специфической терапии раковых заболеваний в развитии ССД. В соответствии с этой гипотезой приводятся сообщения о том, что блеомицин, карбоплатин, гемцитабин и паклитаксел могут инициировать тяжелый феномен Рейно, критическую дигитальную ишемию и/или фиброз кожи [7, 15, 19, 22]. Иммунотерапия, направленная на уничтожение опухоли за счет использования иммунного ответа хозяина, может также спровоцировать развитие аутоиммунной патологии [27], в свою очередь, лучевая терапия может стимулировать развитие локализованной склеродермии или усугубить ранее существовавшее заболевание [47].
Эпидемиологические данные демонстрируют, что у тех пациентов, у которых ССД манифестирует в пожилом возрасте, может иметь место первичное паранеопластическое заболевание с небольшим временным интервалом [62].
Одним из наиболее частых паранеопластических синдромов является феномен Рейно. Он может быть первым и долгое время единственным симптомом ССД, длительно предшествуя появлению развернутой симптоматики болезни. Наличие феномена Рейно у пациентов в возрасте старше 50 лет, особенно с асимметричным или нетипичным поражением пальцев, которое быстро прогрессирует вплоть до дигитального некроза, может быть проявлением паранеопластического синдрома в рамках недиагностированного новообразования [20]. Возникновение феномена Рейно ассоциируется с новообразованиями легких, яичников, почек, лимфомой, плазмоцитомой или лейкемией [11]. Развитие паранеопластического феномена Рейно описано у пациентов с саркомой Капоши, леченных винбластином и блеомицином [25]. Этиология феномена Рейно при неопластических заболеваниях неизвестна, его развитие может быть вызвано парапротеинами, криоглобулинами и некоторыми цитокинами. Необходимо отметить, что паранеопластический феномен Рейно обычно резистентен к вазодилататорам и симпатэктомии и может приводить к дигитальному некрозу фаланг пальцев даже у 80% пациентов [20].
Целью данного клинического отчета является анализ трех клинических случаев, демонстрирующих различные взаимодействия и взаимосвязи ССД и СППС. Обсуждаются особенности течения СППС и развитие онкологического процесса на фоне ССД. Первый клинический случай — диагностика ССД без сопутствующего паранеопластического процесса у пациентки старческого возраста; второй клинический случай — СППС вследствие рака толстой кишки у пациента 60 лет; и третий пациент с анамнезом ССД в течение двух лет с манифестированием злокачественного новообразования (В-клеточная неходжкинская лимфома) на фоне течения аутоиммунного заболевания.
Клинический случай 1
Пациентка Н., возраст 78 лет, госпитализирована в ревматологическое отделение 11-й Городской клинической больницы Днепровского городского совета (11 ГКБ ДГС) в июле 2016 г. с диагнозом синдрома Рейно. При поступлении предъявляла жалобы на похолодение и посинение кончиков пальцев кистей и стоп, усиливающиеся на холоде, на прогрессирующее утолщения кожи пальцев, трудности при глотании, особенно твердой пищи, плохую переносимость физической нагрузки, одышку смешанного характера (при ходьбе по ровной местности до 20 м) и потерю массы тела (около 20 кг в за последние 2 года). Вышеперечисленные симптомы беспокоят пациентку в течение последних трех лет; первыми признаками были онемение и похолодение, а затем и посинение, особенно на холоде, кончиков пальцев кистей и стоп, в течение последующих 3 мес начало появляться уплотнение кожи пальцев, через год присоединилось затруднение при глотании твердой пищи. К семейному врачу впервые обратилась полгода назад из-за появления одышки при незначительной физической нагрузке и уменьшения массы тела. Направлена в ревматологический стационар для проведения дифференциальной диагностики и исключения, прежде всего, онкологического заболевания и паранеопластического процесса. Выполнены мультиспиральная компьютерная томография (МСКТ) брюшной полости, магнитно-резонансная томография (МРТ) головы, МСКТ органов грудной клетки и фиброгастродуоденоскопия (ФГДС) — по результатам исследований паранеопластический процесс был исключен. На МСКТ брюшной полости и МРТ головы патологии не выявлено; на МСКТ органов грудной клетки установлен интерстициальный фиброз легких, при ФГДС — рефлюкс-эзофагит, тип А, эритематозная гастропатия.
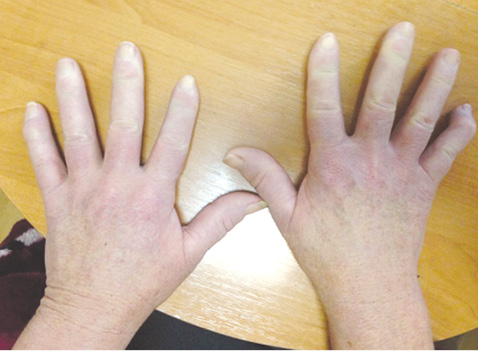
При объективном исследовании выявлен плотный отек и индурация кожи дистальных отделов верхних и нижних конечностей (рис. 1), кисти плохо сжимаются в кулак, отмечены участки уплотнения кожи на передней брюшной стенке и ягодицах, передней поверхности голеней и наружной поверхности плечей (кожный счет составил 42 балла), атрофия губ, телеангиэктазии на лице и небольшие язвочки на кончиках пальцев, при аускультации легких — крепитация ниже углов лопаток симметрично с двух сторон. Тест с 6-минутной ходьбой — 190 м, с SaO2 — 95–91% и повышением ЧСС с 85 до 120 уд./мин. Одышка по шкале Борг оценена в 4 балла.
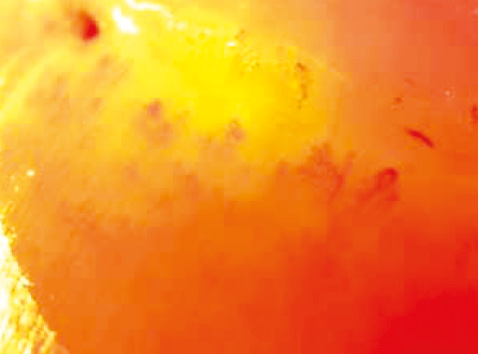
В общем анализе крови: анемия (Hb 112 г/л), повышение скорости оседания эритроцитов (СОЭ) до 35 мм/ч, в остальном — без патологических изменений; в биохимическом анализе крови: С-реактивный белок (СРБ) 27 г/л; скорость клубочковой фильтрации (СКФ) 45 мл/мин/1,73 м, NT proBNP — 845 пг/мл (норма <130 пг/мл). Иммунологические показатели: титр антиядерных антител — 1:640, пятнистый рисунок, выявлены антитела SS-A-Ro52, RNP/Sm и Scl70 (иммуноблоттинг). При эхокардиографическом исследовании (эхоКГ) выявлено расширение полости правого желудочка (КДД 50 мм), правого предсердия (площадь правого предсердия — 30 см), выраженную трикуспидальную недостаточность (>2,4 мм/с), среднее систолическое давление в легочной артерии — 80 мм рт. ст., фракция выброса левого желудочка — 75%, дилатация верхней полой вены — до 9 мм, индекс массы левого желудочка — 64 г/см. При капилляроскопии ногтевого ложе выявлено неравномерное расположение капилляров, дезорганизация капиллярной архитектоники, расширение капилляров, уменьшение их количества, аваскулярные зоны, элементы неоангиогенеза — мегакапилляры (рис. 2).
После оценки вероятности легочной гипертензии с использованием алгоритма DETECT [16] (1 шаг — 329 баллов, 2 шаг — 62 балла) пациентке проведена катетеризация правых отделов сердца и верифицирована прекапиллярная легочная гипертензия: среднее давление в легочной артерии — 48 мм рт. ст., давление заклинивания легочной артерии — 9 мм рт. ст.
Согласно критериям ACR и EULAR 2013 г. был установлен диагноз диффузной склеродермии (14 баллов). Индекс активности — 8 баллов.
Клинический диагноз: ССД, диффузная форма, хроническое течение, фаза обострения, активность II, стадия III, с поражением кожи (склеродерма кожи туловища, бедер, плечей), суставов (склеродактилия), сосудов (синдром Рейно, телеангиэктазии, легочная артериальная гипертензия WHO ФК ІІ), пищевода (рефлюкс-эзофагит, тип А, эритематозная гастропатия), почек (ХБП III степени, нефрит, мочевой синдром, симптоматическая артериальная гипертензия), легких (ИЗЛ, ЛН I–II), сердца (диффузный кардиосклероз, ХСН IIА со сниженной систолической функцией правого желудочка и сохраненной систолической функцией левого желудочка).
Пациентке был назначен метилпреднизолон 12 мг, силденафил в дозе 60 мг/сут, валсартан — 160 мг/сут, торасемид — 10 мг/сут, спиронолактон — 50 мг/сут, илопрост (ингаляционно).
После консультации с нефрологом принято решение начать терапию циклофосфамидом в модифицированных дозах из-за прогрессирующей почечной недостаточности; циклофосфамид назначен внутривенно в дозе 300 мг/м поверхности тела в месяц. В период с июля по сентябрь 2016 г. вводили в общей сложности 1000 мг. Лечение было прекращено из-за плохой переносимости препарата пациенткой, проявляющейся в виде рецидивирующих инфекций нижних дыхательных путей, потери аппетита и повышенной слабости. Был назначен микофенолата мофетил в дозе 1000 мг/сут на протяжении 6 мес.
Через год после установления диагноза ССД и назначения лечения пациентка умерла от нарастающей легочно-сердечной и почечной недостаточности. Несмотря на диагностическую нацеленность относительно злокачественных новообразований, диагноз «рак» так и не был установлен.
ССД у людей пожилого возраста возникает достаточно часто, однако своевременная диагностика данного состояния является достаточно редким явлением, что обусловлено сложностями диагностики. Обсуждаются следующие причины:
- людей пожилого возраста реже направляют на консультацию узкого специалиста;
- клиническая картина заболевания может быть гетерогенной и нетипичной в данной возрастной группе, например, относительно «мягкие» поражения кожи, а также сходство ССД и общих симптомов хронических заболеваний, свойственных группе пациентов пожилого возраста;
- необходимость проведения дорогостоящего комплексного исследования с использованием высокоточной аппаратуры для исключения паранеопластического характера выявленных симптомов.
Известно, что ССД может оказаться побочным эффектом противоопухолевых иммунных реакций у некоторых пациентов, что проявляется в виде СППС, который мы хотели бы представить во втором клиническом случае.
Клинический случай 2
59-летний пациент Р. был госпитализирован в ревматологическое отделение 11 ГКБ ДГС в августе 2016 г. с диагнозом: ССД? Предъявлял жалобы на уплотнение кожи кистей, предплечий, лица, боль в пояснично-крестцовом отделе позвоночника; вышеперечисленные жалобы возникли 3 мес назад, обращался к семейному врачу, была рекомендована консультация ревматолога для уточнения диагноза. В анамнезе жизни: гипертоническая болезнь последний год с максимальными цифрами артериального давления до 150/100, препараты не принимает, является злостным курильщиком с 19 лет, индекс пачка-лет — 15. При объективном исследовании определяется плотный отек и индурация кожи в области кистей, предплечий, щек, кисетный рот (кожный счет — 18) и увеличенные передне-, заднешейные и паховые лимфатические узлы.
Лабораторные тесты указали на несколько повышенные маркеры воспаления (СОЭ — 23 мм/ч, СРБ — 8,2 мг/л); при проведении иммунологических тестов определяли значительно повышенный титр антинуклеарных антител (титр 1:2560), однако специфические для ССД маркеры были отрицательными.
При капилляроскопии ногтевого ложе выявлены неспецифические капиллярные аномалии, что не соответствовало критериям склеродермического рисунка (рис. 3).
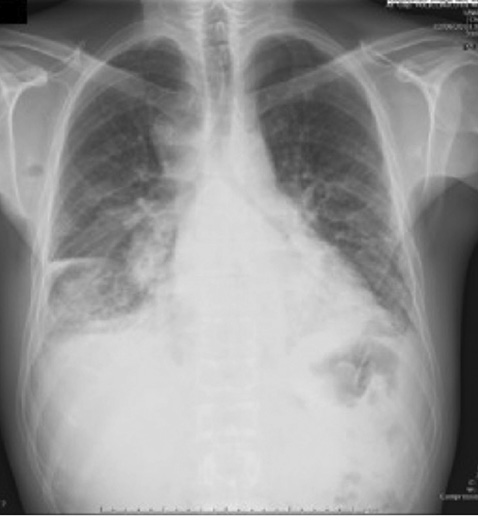
На рентгенограмме органов грудной клетки выявлено расширение корней легких (рис. 4). При проведении МСКТ органов грудной полости выявлены увеличенные лимфатические узлы средостения. Проведена медиастиноскопия с биопсией лимфатического узла и дальнейшим гистологическим исследованием. Выявлены атипичные клетки, предположен диагноз «аденокарцинома легкого». Однако первичный очаг так и не был выявлен. В последующем при проведении МСКТ органов брюшной полости с внутривенным усилением установлена опухоль в восходящем отделе толстого кишечника. Проведение колонофиброскопии подтвердило наличие опухолевого процесса в кишечнике. На основании гистопатологического исследования диагностирована колоректальная аденокарцинома. Пациенту была рекомендована консультация онколога, от которой пациент воздержался на некоторое время по семейным обстоятельствам. В октябре 2016 г. у пациента возникло острое повреждение почек, связанное с обструкцией мочеиспускательного канала. Пациент госпитализирован в урологическое отделение, проведена нефростомия справа, состояние его здоровья улучшилось. Однако на вторые сутки пребывания в отделении появились симптомы тяжелого перитонита и септического шока, приведшие к смерти пациента.
Диагностика системного склероза у пациентов в возрасте старше 50 лет является неблагоприятным предиктором онкопатологии: отмечается более высокая смертность и более высокий риск развития злокачественных новообразований, чем у пациентов более молодого возраста. В случае возникновения ССД у пациентов пожилого возраста следует рассмотреть две возможности: паранеопластический синдром или идиопатическая ССД (при которой рак, скорее всего, будет диагностирован в последующие годы).
Определенные признаки в клинической картине и данные обследования могут нацелить на наличие СППС на ранней стадии диагностического поиска. К ним относятся:
- короткий временной интервал между диагнозом обоих заболеваний;
- пожилой возраст пациента;
- отягощенный наследственный анамнез в отношении онкологической патологии;
- наличие в анамнезе паранеопластических заболеваний;
- асимметричный фиброз кожи;
- отсутствие или асимметричный феномен Рейно;
- нехарактерные для ССД изменения капилляров при капилляроскопии ногтевого ложе;
- отсутствие специфических антител, характерных для ССД;
- наличие общих симптомов, таких как лихорадка и потеря массы тела;
- отсутствие ответа на стандартное лечение (довольно сложно оценить в случае ССД, поскольку до настоящего времени не выявлено эффективного лекарственного средства для прекращения прогрессирования заболевания);
- исчезновение симптомов ССД после противоракового лечения и их появление при раке, вызвавшем реакцию.
Второй случай характеризуется отсутствием феномена Рейно (чрезвычайно распространенного симптома при ССД), отсутствием капиллярных аномалий при капилляроскопии и отсутствием антител, специфичных для ССД, что помогло предположить СППС и продолжить диагностический поиск. В итоге подтверждено первичное предположение: у пациента диагностирована аденокарцинома толстого кишечника с развитием доминантной паранеопластической симптоматики в виде склеродермоподобного синдрома.
Клинический случай 3
55-летний мужчина М. обратился в Донецкое областное клиническое территориальное медицинское объединения в июне 2011 г. с жалобами на утолщение и уплотнение кожи на подбородке, щеках, кистей, грудной клетки, общую слабость. Данные симптомы появились около 1 мес назад. При активном опросе выявлены признаки феномена Рейно и синдрома «сухого глаза». Не курит. При лабораторном исследовании определено ускорение СОЭ до 32 мм/ч, диспротеинемию за счет гамма-глобулинов; выявлены антинуклеарные антитела в титре 1:640, при этом антитопоизомеразные I и антицентромерные аутоантитела не выявлены. В то же время обнаружены анти-Ro/SSA и анти-SSB антитела (синдром Шегрена был заподозрен при первичном осмотре пациента). При рентгеноскопическом исследовании пищевода с контрастированием барием — гипотония пищевода. На рентгенографии легких патологических изменений не выявлено, однако при проведении спирографии форсированная жизненная емкость легких уменьшена до 69%, с индексом Тиффно 98%. При проведении эхоКГ каких-либо аномалий со стороны сердечно-сосудистой системы не было выявлено, вероятность легочной гипертензии была низкой. При проведении МСКТ органнов грудной клетки патологии не выявлено.
Пациенту был установлен диагноз: ССД, диффузная форма, ранняя стадия, активность 2, с поражением кожи (склеродерма лица, кистей, грудной клетки), сосудов (синдром Рейно), легких (пневмосклероз?, ЛН 2 ст., рестриктивный тип), синдром Шегрена.
Назначено лечение: метилпреднизолон 8 мг, метотрексат 10 мг/нед перорально, а затем — 12,5 мг/нед, кардиомагнил 75 мг. Через 3 мес лечения самочувствие улучшилось, индурация кожи приостановлена, отмечали небольшое обратное развитие. Нормализовались также лабораторные показатели, было рекомендовано снижение дозы метилпреднизолона по 2 мг 1 раз в 10 дней до полной отмены.
Через 1 год при повторной госпитализации пациент отметил усиление одышки, появление сухого кашля, увеличение очагов уплотнения кожи и появление новых, повышенную усталость, субфебрилитет и потерю массы тела (5 кг за последние 3 мес). При объективном исследовании выявлено системное увеличение лимфатических узлов — передне- и заднешейных, аксиллярных, надключичных, паховых. По общему анализу крови выявлена анемия (Hb 103 г/л), в остальном — без изменений.
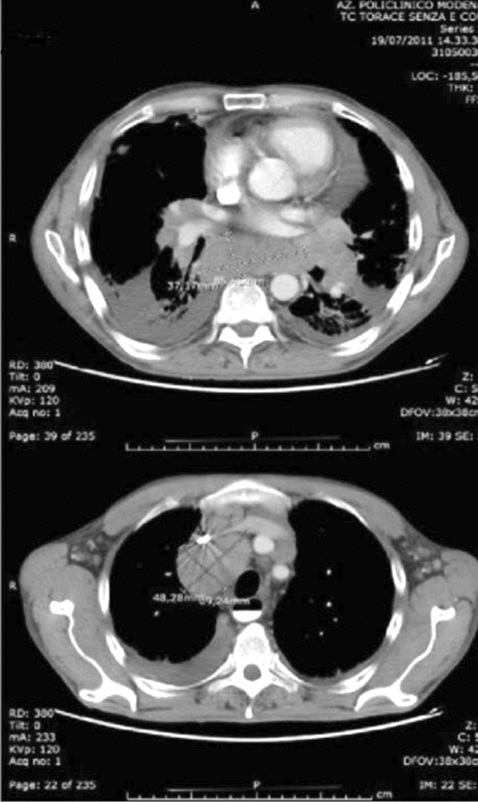
На МСКТ органов грудной клетки выявлено расширение медиастинума за счет лимфаденопатии (рис. 5), проведена биопсия надключичных лимфатических узлов. После гистологического исследования установлен предварительный диагноз: первичная диффузная В-клеточная неходжкинская лимфома. Пациент был переведен в гематологическое отделение. Назначено лечение, однако через несколько месяцев, без какого-либо клинического улучшения, пациент умер от сепсиса.
У пациентов с ССД в нескольких исследованиях продемонстрирована активация периферических В-лимфоцитов с нарушенной долей апоптотических клеток по сравнению со здоровыми [49]. При ССД выживаемость и активация В-клеток повышаются, возрастает также и доля менее зрелых В-лимфоцитов, что, по-видимому, приводит к высокому риску развития лимфоидного канцерогенеза [61]. Более того, Y. Wang и соавторы (2013) [58] установили, что уровни ацетилирования и метилирования гистонов (ответственных за усиление транскрипции гена) в В-клетках у пациентов с ССД коррелируют с активностью заболевания. Следует отметить, что у пациентов с ССД выявляют повышенные концентрации в сыворотке крови цитокинов, регулирующих активность, выживаемость и пролиферацию B-клеток [49]. В этом аспекте можно предположить, что склеродермические пациенты с плохо контролируемым заболеванием (более вероятное на ранней стадии ССД, как и в нашем третьем случае) более склонны к развитию гематологических злокачественных новообразований.
С учетом вышеизложенного, а также ассоциации склеродермии с повышенным риском развития рака у пациентов с ССД необходимо проводить целенаправленный скрининг злокачественных новообразований.
Предлагаем алгоритм диагностического поиска и оценки паранеопластического процесса, который необходимо выполнять у всех пациентов в дебюте ССД в зависимости от их возраста и пола (табл. 3). Этот алгоритм включает комплексное физикальное обследование, в том числе пальпацию передних и задних шейных, надключичных, подмышечных и паховых лимфатических узлов; сканирование кожи на нетипичные поражения, особенно с асимметрией, нечеткими границами, цветовым разнообразием или большим диаметром (>6 мм); тщательный осмотр полости рта; пальпацию щитовидной железы. Для пациентов пожилого возраста, с манифестной ССД, мы предлагаем повторить колоноскопию или мазок Папаниколау. Женщинам должен быть назначен маммографический скрининг на рак молочной железы вне зависимости от возраста. Дальнейший целенаправленный поиск может потребоваться в зависимости от наличия конкретных факторов риска. Следует отметить наличие у этих пациентов «красных флажков» — ситуаций, требующих особого внимания и дополнительных исследований: аутоантитела к РНК-полимеразе III, более старший возраст начала склеродермии (>50 лет), атипичное течение, отсутствие эффекта от лечения, потеря массы тела, отягощенный наследственный анамнез по онкологическим заболеваниям. Таким пациентам должна быть назначена обширная визуализация, такая как компьютерная томография грудной клетки, брюшной полости и таза или всего тела, а также лабораторные исследования (электрофорез сыворотки крови/мочи, опухолевые маркеры).
| Группы риска пациентов с ССД | Рекомендации |
|---|---|
| Возраст: любой | Тщательное объективное исследование: включая пальпацию лимфоузлов, щитовидной железы; осмотр ротовой полости и доступных слизистых оболочек |
| Возраст: впервые выставленный диагноз в возрасте >50 лет | Ограничение курения, инсоляции, КФС или ЭФГДС + сигмоидоскопия |
| Мужчины: любого возраста | Ректороманоскопия, онкомаркеры рака предстательной железы (PSA) |
| Мужчины: <40 лет | УЗИ яичек |
| Женщины: любого возраста | УЗИ органов малого таза, осмотр гинеколога, ПАП-тест |
| Женщины: >40 лет | Ежегодная маммография |
| Факторы риска | |
| Курение: 30+ пачко-лет или бросил <15 лет назад + возраст 55–80 лет | МСКТ органов грудной клетки |
| Пищевод Барретта | ЭФГДС 1–3 раза в год |
| Эзофагит | ЭФГДС 1–3 раза в год |
| Лечение циклофосфаном | Контроль анализа мочи 4 раза в год, цитология мочи, при необходимости — цистоскопия |
| Лечение микофенолатом мофетилом | Ежегодное исследование кожи дерматоскопом |
| Особые клинические ситуации | УЗИ брюшной полости и органов малого таза, УЗИ щитовидной железы, МСКТ с внутривенным усилением органов грудной клетки, брюшной полости, органов малого таза, КФС, ЭФГДС, ПЭТ КТ, онкомаркеры (СА-125, СА-19–9, РЭА) |
| Анти-RNA полимераза III позитивный тест | |
| Начало дебюта ССД >65 лет | |
| Агрессивное, атипичное, резистентное к лечению течение ССД | |
| Потеря массы тела или выраженные симптомы, не коррелирующие с течением болезни | |
| Онкологический анамнез в семье или у пациента |
КФС — колонофиброскопия; ЭФГДС — эзофагофиброгастродуоденоскопия; УЗИ — ультразвуковое исследование; ПЭТ КТ — позитронно-эмиссионная компьютерная томография.
Появление симптомов ССД у пациентов пожилого возраста является возможным СППС, однако не исключено дебютирование первичной ССД в таком возрасте. Кроме того, у пациентов с ССД существует повышенный риск злокачественных новообразований, некоторые авторы описывают ССД как фактор онкологического риска, своеобразное предопухолевое состояние. Так, обширный фиброз, эффект аутоантител и применение иммунодепрессантов (особенно циклофосфамида) связаны с более высокой частотой развития онкопатологии у пациентов с ССД. В частности, считается, что органы, страдающие от чрезмерного фиброза, такие как легкие, кожа и даже грудь, подвергаются более высокому риску малигнизации. Одно из раковых заболеваний, которое ассоциируется с ССД, — это лимфопролиферативные опухоли (описаны в нашем третьем клиническом случае), являющиеся, вероятно, вторичными по отношению к хронической стимуляции В-клеток, происходящие на фоне течения основного заболевания — ССД.
Следовательно, пациенты с ССД, особенно старшего возраста [37], при высокой активности заболевания, быстропрогрессирующем и атипичном течении, высоком титре антител к аутоантителам должны быть подвержены более тщательному диагностическому поиску и контролю по поводу онкологической патологии, особенно если пациент проявляет признаки и симптомы обоих состояний.
Список использованной литературы
- 1. Проценко Г.А. (2016) Паранеопластические синдромы в ревматологической практике. Укр. ревматол. журн., 63(1): 33–37.
- 2. Сидорова Л.Л., Спасская А.А., Мясников Г.В. и др. (2010) Паранеопластический синдром. Ревматологические маски онкологических заболеваний. Therapia, 2(44): 24–28.
- 3. Чіпко Т.М., Головач І.Ю., Вельма І.В. та ін. (2013) Склеродермоподібний паранеопластичний синдром у пацієнта з раком шлунка: опис клінічного випадку. Укр. ревматол. журн., 52(2): 94–98.
- 4. Banaś M., Kotulska A., Kucharz E.J. et al. (2005) Zmiany w narządzie ruchu jako pierwszy objaw ostrej białaczki limfoblastycznej: opis przypadku. Pol. Arch. Med. Wewn., 114: 681–683.
- 5. Barnes J., Mayes M.D. (2012) Epidemiology of systemic sclerosis: incidence, prevalence, survival, risk factors, malignancy, and environmental triggers. Curr. Opin Rheumatol., 24(2): 165–170.
- 6. Bernal-Bello D., Garcíade T., Guillén-del Castillo A. et al. (2017) Novel risk factors related to cancer in scleroderma Autoimmunity Rev., 16(5): 461–468.
- 7. Bessis D., Legouffe E., Guilhou J.J. (2004) Gemcitabine-associated scleroderma-like changes of the lower extremities. J. Am. Acad. Dermatol., 51(2): S73–S76.
- 8. Bonifazi M., Tramacere I., Pomponio G. et al. (2013) Systemic sclerosis (scleroderma) and cancer risk: systematic review and meta-analysis of observational studies. Rheumatology, 52(1): 143–146.
- 9. Brewer J.D., Colegio O.R., Phillips P.K. et al. (2009) Incidence of and risk factors for skin cancer after heart transplant. Arch. Dermatol., 145(12):1391–1396.
- 10. Brinton L.A., Buckley L.M., Dvorkina O. et al. (2004) Risk of connective tissue disorders among breast implant patients. Am. J. Epidemiol., 160: 619–627.
- 11. Brooks P.M. (1992) Rheumatic manifestations of neoplasia. Curr. Opin. Rheum., 4: 90–93.
- 12. Caldwell D.S., McCallum R.M. (1986) Rheumatologic manifestations of cancer. Med. Clin. North. Am., 70: 385–417.
- 13. Cavazza A., Caballeria L., Floreani A. et al. (2009) Incidence, risk factors, and survival of hepatocellular carcinoma in primary biliary cirrhosis: comparative analysis from two centers. Hepatology, 50(4): 1162–1168.
- 14. Ciołkiewicz M., Domysławska I., Ciołkiewicz A. et al. (2008) Coexistence of systemic sclerosis, scleroderma-like syndromes and neoplastic diseases. Pol. Arch. Med. Wewn., 118(3): 119–126.
- 15. Clowse M.E., Wigley F.M. (2003) Digital necrosis related to carboplatin and gemcitabine therapy in systemic sclerosis. J. Rheumatol., 30(6): 1341–1343.
- 16. Coghlan J.C., Denton C.P., Grünig E. et al. (2014) Evidence-based detection of pulmonary arterial hypertension in systemic sclerosis: the DETECT study. Ann. Rheum. Dis., 73(7): 1340–1349.
- 17. D’Cruz D. (2000) Autoimmune diseases associated with drugs, chemicals and enviromental factors. Toxicol Lett., 112–113: 421–432.
- 18. Daoussis D., Liossis S.N., Yiannopoulos G., Andonopoulos A.P. (2011) B-cell depletion therapy in systemic sclerosis: experimental rationale and update on clinical evidence. Int. J. Rheumatol. (doi:10.1155/2011/214013).
- 19. De Angelis R., Bugatti L., Cerioni A. et al. (2003) Diffuse scleroderma occurring after the use of paclitaxel for ovarian cancer. Clin. Rheumatol., 22(1): 49–52.
- 20. DeCross A.J., Sahasrabudhe D.M. (1992) Paraneoplastic Raynand’s phenomenon. Am. J. Med., 92: 570–572.
- 21. Faurschou M., Sorensen I.J., Mellemkjaer L. et al. (2008) Malignancies in Wegener’s granulomatosis: incidence and relation to cyclophosphamide therapy in a cohort of 293 patients. J. Rheumatol., 35(1): 100–105.
- 22. Finch W.R., Rodnan G.P., Buckingham R.B. et al. (1980) Bleomycin-induced scleroderma. J. Rheumatol., 7(5): 651–659.
- 23. Haga H.J., Eide G.E., Brun J. et al. (1993) Cancer in association with polymyalgia rheumatica and temporal arteritis. J. Rheumatol., 20: 1335–1339.
- 24. Hébant B., Miret N., Berthelot L. (2016) Generalized pruritus preceding paraneoplastic neuropathy. J. Clin. Neurosci., 26: 156–157.
- 25. Hladunewich M., Sawka C., Fam A.G. et al. (1997) Raynaud’s phenomenon and digital gangrene as a consequence of treatment for Kaposi’s sarcoma. J. Rheumatol., 24: 2371–2375.
- 26. Hochberg M.C., Silman A.J., Smolen J.S. et al. (2010). Rheumatology. 5 ed. Mosby, Philadelphia, 2228 p.
- 27. Ioannou Y., Isenberg D.A. (2000) Current evidence for the induction of autoimmune rheumatic manifestations by cytokine therapy. Arthritis Rheum., 43(7): 1431–1442.
- 28. Jimenez S.A. (2016) Endothelial to mesenchymal transition (EndoMT) in the pathogenesis of Systemic Sclerosis-associated pulmonary fibrosis and pulmonary arterial hypertension. Myth or reality? Matrix biology: J. Int. Society for Matrix Biology,1: 51–55.
- 29. Johnson S.R. (2015) New ACR EULAR guidelines for systemic sclerosis classification. Curr. Rheumatol. Rep.,17(5): 32.
- 30. Kang K.Y., Yim H.W., Kim I.J. et al. (2009) Incidence of cancer among patients with systemic sclerosis in Korea: results from a single centre. Scan. J. Rheum., 38(4): 299–303.
- 31. Khoury L.E., Mosak J. (2016) Systemic Sclerosis and Malignancy: A Review of Current Data. J. Clin. Med. Res., 8(9): 625–632.
- 32. Kong F.M., Anscher M.S., Murase T. et al. (1995) Elevated plasma transforming growth fac- tor-beta 1 levels in breast cancer patients decrease after surgical removal of the tumor. Ann. Surg., 222: 155–162.
- 33. Kuo C.F., Luo S.F., Yu K.H. et al. (2012) Cancer risk among patients with systemic sclerosis: a nationwide population study in Taiwan. Scan. J. Rheum., 41(1): 44–49.
- 34. Lafyatis R., O’Hara C., Feghali-Bostwick C.A., Matteson E. (2007) B cell infiltration in systemic sclerosis-associated interstitial lung disease. Arthritis Rheum., 56(9): 3167–3168.
- 35. Lee P., Alderdice C., Wilkinson S. et al. (1983) Malignancy in progressive systemic sclerosis — association with breast carcinoma. J. Rheumatol., 10: 665–666.
- 36. Marcen R., Galeano C., Fernandez-Rodriguez A. et al. (2010) Effects of the new immunosuppressive agents on the occurrence of malignancies after renal transplantation. Transplant. Proceedings, 42(8): 3055–3057.
- 37. Marek M., Rudny R. (2016) Scleroderma of geriatric age and scleroderma-like paraneoplastic syndrome — description of two cases. Reumatologia 2: 91–94.
- 38. Monach P.A., Arnold L.M., Merkel P.A. (2010) Incidence and prevention of bladder toxicity from cyclophosphamide in the treatment of rheumatic diseases: a data-driven review. Arthritis Rheum., 62(1): 9–21.
- 39. Olesen A.B., Svaerke C., Farkas D.K., Sørensen H.T. (2010) Systemic sclerosis and the risk of cancer: a nationwide population-based cohort study. Br. J. Dermatol., 163: 800–806.
- 40. Onishi A., Sugiyama D., Kumagai S., Morinobu A. (2013) Cancer incidence in systemic sclerosis: meta-analysis of population-based cohort studies. Arthritis Rheum., 65(7): 1913–1921.
- 41. Pattanaik D., Brown M., Postlethwaite A.E. (2011) Vascular involvement in systemic sclerosis (scleroderma). J. Inflamm. Res.,4: 105–125.
- 42. Pia M., Fonseca C., Hellmich M. et. al. (2014) Association of anti-RNA polymerase III autoantibodies and cancer in scleroderma Arthritis Res. Ther., 16(1): R53.
- 43. Picano E., Semelka R., Ravenel J., Matucci-Cerinic M. (2014) Rheumatological diseases and cancer: the hidden variable of radiation exposure. Ann. Rheum. Dis., 73(12): 2065–2068.
- 44. Pileckyte M., Baliūnaite R., Tamulaitiene V. (2008) Paraneoplastic rheumatic syndromes. Medicina, 39(5): 443–447.
- 45. Rosenthal A., McLaughlin J.K., Gridley G., Nyren O. (1995) Incidence of cancer among patients with systemic sclerosis. Cancer., 76: 910–914.
- 46. Rosenthal A.K., McLanghlin J.K., Linet M.S. et al. (1993) Scleroderma and malignancy: an epidemiologic study. Ann. Rheum. Dis., 52: 531–533.
- 47. Sachsman S.M., Haydel D.M., Kim C.N. (2016) First reported case of postirradiation pseudosclerodermatous panniculitis after stereotactic body radiation therapy for the treatment of non-small cell lung cancer. Am. J. Dermatopathol., 38(2): 144–147.
- 48. Sanchez-Guerrero J., Gutien’ez-Urena S., Daller A. et al. (1990) Vasculitis as a paraneoplastic syndrome: report of 11 cases and review of the literature. J. Rheumatol., 17: 1458–1462.
- 49. Sanges S., Guerrier T., Launay D., et al. (2017) Role of B cells in the pathogenesis of sclerosis. Rev. Med. Intern., 38(2): 113–124.
- 50. Shah A., Rosen A. (2011) Cancer and systemic sclerosis: novel insights into pathogenesis and clinical implications. Curr. Opin. Rheumatol., 23: 530–535.
- 51. Shah A., Rosen L.R. (2015b) Cancer and Scleroderma: A Paraneoplastic Disease with Implications for Malignancy Screening. Curr. Opin. Rheumatol., 27(6): 563–570.
- 52. Shah A.A., Hummers L.K., Casciola-Rosen L. et al. (2015a) Examination of autoantibody status and clinical features associated with cancer risk and cancer-associated scleroderma. Arthritis Rheum., 67(4): 1053–1061.
- 53. Shah A.A., Rosen A., Hummers L. et al. (2010) Close temporal relationship between onset of cancer and scleroderma in patients with RNA polymerase I/III antibodies. Arthritis Rheum., 62(9): 2787–2795.
- 54. Siau K., Laversuch C.J., Creamer P., O’Rourke K.P. (2011) Malignancy in scleroderma and patients from south west England: a population-based cohort study. Rheumatol. Int., 31: 641–645.
- 55. Silver I., Heyes M.P., Maize J.C., et al. (1990) Scleroderma, fascitis and eosinophila associat- ed with the ingestion of tryptophan. N. Engl. J. Med., 322: 874–881.
- 56. Szekanecz É., Szamosi S., Horváth Á. et al. (2012) Malignancies associated with systemic sclerosis. Autoimmun. Rev.,11(12): 852–855.
- 57. Van den Hoogen F., Khanna D., Fransen J. et al. (2013) 2013 classification criteria for systemic sclerosis: an American College of Rheumatology/European League Against Rheumatism Collaborative Initiative. Ann. Rheum. Dis., 72(11): 1747–1755.
- 58. Wang Y., Yang Y., Luo Y. et al. (2013) Aberrant histone modification in peripheral blood B cells from patients with systemic sclerosis. Clin. Immunol., 149(1): 46–54.
- 59. Wipff J., Allanore Y., Soussi F. et al. (2005) Prevalence of Barrett’s esophagus in systemic sclerosis. Arthritis Rheum., 52(9): 2882–2888.
- 60. Wollheim F.A. (2005) Classification of systemic sclerosis. Visions and reality. Rheumatology, 44(10): 1212–1216.
- 61. Yoshizaki A. (2016) B lymphocytes in systemic sclerosis: Abnormalities and therapeutic targets. J. Dermatology, 43(1): 39–45.
- 62. Zeineddine N., Khoury L.E., Mosak J. (2016) Systemic Sclerosis and Malignancy: A Review of Current Data. J. Clin. Med. Res., 8(9): 625–632.
- 63. Zhang J.Q., Wan Y.N., Peng W.J. et al. (2013) The risk of cancer development in systemic sclerosis: a meta-analysis. Cancer Epidem., 37(5): 523–527.
Адрес для переписки:
Головач Ирина Юрьевна
03420, Киев, ул. Академика Заболотного, 21
Клиническая больница «Феофания» ГУД,
Центр ревматологии
E-mail: golovachirina@gmail.com

Leave a comment