Клінічний випадок лікування синдрому Когана з використанням інфліксимабу у період вагітності хворої
Яременко О.Б.1, Федьков Д.Л. 1, Шинькарук Ю.Л.1, Гнилорибов А.М.2, Сітухо М.І.3
- 1Національний медичний університет ім. О.О. Богомольця, Київ
- 2Клініка сучасної ревматології, Київ
- 3ДУ «Інститут отоларингології ім. О.С. Коломійченка НАМН України», Київ
Резюме. У статті наведено огляд даних літератури про клінічні, лабораторні прояви та сучасні підходи до лікування пацієнтів із синдромом Когана. Описано клінічний випадок лікування синдрому Когана у вагітної з ураженням внутрішнього вуха та очей із застосуванням імунобіологічної терапії.
УДК [612.017.3:616-008.6]:616.13/.14 :618.2]-085
Вступ
Синдром Когана — рідкісне аутоімунне захворювання групи системних васкулітів, що характеризується запальним ураженням очей (інтерстиціальний кератит, увеїт, епісклерит) та органа слуху (нейросенсорна туговухість, вестибулярні порушення). Вперше це захворювання описав у 1945 р. американський офтальмолог David Cogan як поєднання неспецифічного (несифілітичного) інтерстиціального кератиту та аудіовестибулярних симптомів, що нагадують хворобу Меньєра (Cogan D., 1945). Згідно з останньою (Chapel Hill Consensus Conference, 2012) міжнародною класифікацією системних васкулітів, синдром Когана належить до групи «Васкуліти, що уражують судини різних розмірів» (Jennette J.C. et al., 2013). У Міжнародній класифікації хвороб 10-го перегляду це захворювання під такою назвою не фігурує, найближчий за значенням для нього код — Н16.3 — «інтерстиціальний (стромальний) і глибокий кератит», оскільки саме цей клінічний прояв (інтерстиціальний кератит) є головною маніфестацією захворювання. Синдром Когана належить до орфанних захворювань, його (Cogan syndrome) код в оrphanet — 1467. У 2017 р. це захворювання під назвою «Інтерстиціальний (стромальний) і глибокий кератит (синдром Когана)» внесено до Переліку рідкісних (орфанних) захворювань і в Україні (наказ МОЗ України від 29.06.2017 р. № 731).
Синдром Когана розвивається насамперед в осіб молодого віку, без будь-яких гендерних особливостей. Середній вік початку захворювання — 29 років, рідко описується у дітей та осіб похилого віку. Популяційних досліджень щодо захворюваності та поширеності цього захворювання немає, діагноз встановлюється рідко, навіть у спеціалізованих медичних центрах (McCallum R.M., St. Clair E.W., 2012). Однією з найвідоміших особистостей, яка хворіла на синдром Когана, був видатний композитор Людвіг ван Бетховен (Larkin E., 1971).
Етіологія та патогенез невідомі. Спочатку існувала інфекційна гіпотеза виникнення синдрому Когана. Дослідники Національного інституту здоров’я виявили, що хворі з цією патологією мають вищі титри антитіл до Chlamydia trachomatis (Haynes B.F. та співавт., 1980). У 1997 р. L. Ljungstrom та співавтори описали випадок синдрому Когана у хворого зі збільшеними у 4 рази титрами антитіл IgG до Chlamydia pneumoniae у сироватці крові. Результати інших досліджень переконливо свідчать про аутоімунний механізм розвитку цього захворювання (Haynes B.F. et al., 1980; Vollertsen R.S. et al., 1986). Так, виявлено лімфоплазмоцитарну інфільтрацію в равлику та рогівці, антитіла до антигенів внутрішнього вуха і рогівки, а також продемонстровано ефективність глюкокортикоїдів і цитостатиків при синдромі Когана (Grecoa A. et al., 2013). Можливість розвитку аортиту чи васкуліту артерій середнього калібру патоморфологічно наближає цей синдром до артеріїту Такаясу та вузликового поліартеріїту. Виявлено антитіла до «пептиду Когана» в сироватці крові пацієнтів із синдромом Когана. Після пасивного транспортування антитіл до «пептиду Когана» у мишей антитіла локалізуються в равлику, тоді як інші антитіла не зв’язуються з кохлеарними клітинами (Lunardi C. et al., 2002).
У табл. 1 представлено головні клінічні прояви синдрому Когана (McCallum R.M. et al., 2002). У всіх пацієнтів відзначають запальні захворювання очей та вестибуло-слухову дисфункцію, дуже часто — втрату слуху та вертиго (запаморочення). Частими проявами при ураженнях очей є інтерстиціальний кератит, а при ураженні вуха — дзвін у вухах, нудота, блювання, дещо рідше — атаксія. У третини хворих виникає кон’юнктивіт, іридоцикліт, епісклерит, склерит, а також ністагм. У 15% хворих відзначають осцилопсію (ілюзію обертання навколишнього середовища або нерухомого об’єкта) та системний васкуліт, у 10% — аортит із/без недостатності клапанів аорти. Такі ураження очей, як папіліт, задній увеїт, ретинальний васкуліт, вітрит і екзофтальм, виявляють досить рідко.
| Прояви | Частка випадків, % | Прояви | Частка випадків, % |
|---|---|---|---|
| Ураження очей | Ураження вуха | ||
| Запальні хвороби очей | 100 | Вестибуло-слухова дисфункція | 100 |
| Інтерстиційний кератит | 70 | Втрата слуху | 95 |
| Кон’юнктивіт | 35 | Вертиго | 90 |
| Іридоцикліт | 30 | Дзвін у вухах | 75 |
| Епісклерит/склерит | 30 | Нудота та блювання | 65 |
| Папіліт | 5 | Атаксія | 45 |
| Задній увеїт | 5 | Ністагм | 30 |
| Ретинальний васкуліт |
5 | Осцилопсія | 15 |
| Вітрит | 5 | Системний васкуліт | 15 |
| Екзофтальм | <5 | Аортит з/без недостатності клапанів аорти | 10 |
У хворих із синдромом Когана нерідко спостерігаються неспецифічні системні прояви (табл. 2), такі як підвищення температури тіла, втома, втрата маси тіла, артрит, артралгія, міалгія. Описано випадки болю в животі, шлунково-кишкових кровотеч, лімфаденопатії, гепато- та спленомегалії. Можуть виникати розлади центральної та периферичної нервової системи, шкірні вузлики, плеврит, висип, ще рідше — поліхондрит (McCallum R.M. et al., 2002).
| Прояви | Частка випадків, % |
|---|---|
| Лихоманка | 25 |
| Втома | 20 |
| Артралгія/міалгія | 15 |
| Артрит | 15 |
| Втрата маси тіла | 15 |
| Біль у животі | 10 |
| Шлунково-кишкова кровотеча | 10 |
| Лімфаденопатія | 10 |
| Гепатомегалія | 10 |
| Спленомегалія | 10 |
| Розлади центральної нервової системи | 5 |
| Шкірні вузлики | 5 |
| Плеврит | 5 |
| Висип | 5 |
| Розлади периферичної нервової системи | 5 |
| Поліхондрит | <5 |
Лабораторні відхилення, які відзначають при синдромі Когана, наведено в табл. 3 (McCallum R.M. et al., 2002). Найчастішими проявами є лейкоцитоз та підвищення швидкості осідання еритроцитів (ШОЕ), у 50% випадків виявляється нейтрофілія, у чверті хворих можливі відносна лімфопенія та зміни у спинномозковій рідині, включаючи плеоцитоз, підвищення рівня білка та γ-глобулінів. Також можливі зниження активності комплементу С3, С4 та загального гемолітичного комплементу (СН50), кріоглобулінемія, лейкоцитоз >24 000 кл/мл.
| Прояви | Частка випадків, % |
|---|---|
| Лейкоцитоз | 75 |
| Нейтрофілія | 50 |
| Відносна лімфопенія | 25 |
| Лейкоцитоз >24 000 кл/мл | 10 |
| ШОЕ >20 мм/год | 75 |
| Зміни у спинномозковій рідині | 25 |
| Кріоглобуліни | 17–23 |
| Зниження комплементу С3 | 21 |
| Зниження комплементу С4 | 17 |
| Зниження загального гемолітичного комплементу | 17 |
Крім оцінки клінічних проявів і малоспецифічних, незакономірних лабораторних відхилень, деякі автори для покращення діагностики синдрому Когана пропонують визначати анти-Hsp70 (білок теплового шоку масою 70 кДа) антитіла, титри яких підвищені у 92,9% хворих із типовим перебігом синдрому Когана та лише у 5,2% осіб групи контролю (5,2%). Позитивність за анти-Hsp70 визначено у 52,7% хворих з аутоімунною сенсоневральною туговухістю та у 16,6% хворих з атиповими формами синдрому Когана. Тому анти-Hsp70-антитіла можуть розглядатись як серологічний маркер синдрому Когана з типовим перебігом (Bonaguri C. et al., 2014).
Рандомізованих клінічних досліджень оцінки ефективності різних лікарських засобів при синдромі Когана немає. Лікування ґрунтується на серіях клінічних випадків або будується шляхом трансферу лікувальної тактики інших аутоімунних хвороб зі схожими механізмами розвитку. Стратегія терапії залежить від тяжкості захворювання: локальні глюкокортикоїди застосовують при ураженні очей легкого ступеня тяжкості, системні імуносупресанти використовують при порушеннях слуху, тяжких захворюваннях очей або за наявності системних проявів. У разі неефективного лікування з незворотною і тяжкою втратою слуху наступним кроком є кохлеарні імплантати (Tayer-Shifman O.E. et al., 2014). У 2009 р. J.G. Orsoni та співавтори проаналізували власний 8-річний досвід застосування покрокової (до отримання повного контролю над запаленням) комбінованої імуносупресивної терапії у 76 пацієнтів із запальними захворюваннями очей, включаючи синдром Когана, в яких не було адекватної відповіді на монотерапію глюкокортикоїдами в максимальних дозах. Продемонстровано високу ефективність комбінованої імуносупресивної терапії (глюкокортикоїди + циклоспорин А; глюкокортикоїди + циклоспорин А + антиметаболіти (першочергово — метотрексат, потім — азатіоприн); глюкокортикоїди + циклоспорин А + антиметаболіти + циклофосфамід; глюкокортикоїди + циклоспорин А + антиметаболіти + циклофосфамід + імуноглобуліни): повний контроль запалення досягався у 86% пацієнтів. Певні надії пов’язують із застосуванням мезенхімальних стовбурових клітин. Результати проведених доклінічних досліджень in vitro та in vivo дають підстави розглядати можливість використання мезенхімальних стовбурових клітин при окремих імунологічно опосередкованих станах, включаючи реакцію «трансплантат проти хазяїна», хворобу Крона, розсіяний склероз, рефрактерний системний червоний вовчак та системний склероз. Їх вплив зумовлений не лише мультипотенціюючою дією, але й протизапальними, трофічними та регенеративними ефектами (Figueroa F.E. та співавт., 2012). В роботі E. Ben-Ami та співавторів (2011) описано, що мезенхімальні стовбурові клітини мають потужні імунорегуляторні властивості та можуть модулювати природжений та набутий імунітет. Так, системне введення мезенхімальних стовбурових клітин в експериментальних моделях аутоімунних захворювань (розсіяний склероз, міастенія, діабет, ревматоїдний артрит і системний червоний вовчак) продемонструвало корисні клінічні ефекти та відновлення імунологічних функцій. Проте необхідні подальші дослідження для з’ясування їх специфічного механізму дії, довгострокової безпеки, ефективності та доцільності клінічного застосування при лікуванні синдрому Когана.
Описано серії випадків застосування імунобіологічних препаратів при цьому васкуліті. Зокрема, продемонстровано ефективність застосування інфліксимабу в 9 з 10 випадків резистентного синдрому Когана (Tayer-Shifman O.E. et al., 2014). В актуальних клінічних рекомендаціях з лікування синдрому Когана (Tayer-Shifman O.E. et al., 2014) наведено показання до застосування інфліксимабу (табл. 4). Зокрема, автори вважають, що розглядати застосування інфліксимабу як терапію першої лінії слід у хворих із тяжкими ураженнями очей, із загрозою втрати зору, швидкою втратою слуху, при одночасному залученні обох очей, за наявності васкуліту великих судин, залучення серця, нирок та нервової системи, при загальному стані, що унеможливлює застосування глюкокортикоїдів у високих дозах.
Ефективність етанерцепту досліджували у проспективному дослідженні за участю 23 хворих із двобічними імуноопосередкованими кохлеовестибулярними розладами або симптомами хвороби Меньєра, у трьох із них був синдром Когана (Matteson E.L. et al., 2005). У двох із трьох хворих із синдромом Когана виявлено поліпшення аудіограми, але етанерцепт не запобігав втраті слуху. Також описано один випадок ефективного застосування ритуксимабу для лікування пацієнтів із синдромом Когана (Orsoni J.G. et al., 2010).
| A. Застосовувати інфліксимаб слід: |
| • за відсутності відповіді на глюкокортикоїди при 2–3-тижневому застосуванні |
| • у разі неможливості знизити дозу глюкокортикоїдів нижче 10 мг/добу, за наявності протипоказань до застосування (діабет, некерована артеріальна гіпертензія) і тяжких побічних ефектів |
| B. Розглядати застосування інфліксимабу як терапію першої лінії слід у хворих з: |
| • тяжкими ураженнями очей, із загрозою втрати зору (рубцювання та підвищення внутрішньоочного тиску) |
| • швидкою втратою слуху (на рівні 50 Гц) |
| • при одночасному залученні обох очей |
| • за наявності васкуліту великих судин, залучення серця, нирок та нервової системи |
| • загальним станом, що унеможливлює застосування глюкокортикоїдів у високих дозах (тяжка серцева недостатність, неконтрольований діабет чи артеріальна гіпертензія) |
Наводимо клінічний випадок розвитку синдрому Когана у жінки молодого віку та його успішного лікування із застосуванням інфліксимабу. Хвора Д., 25 років, звернулася до ревматологів у січні 2016 р. зі скаргами на зниження слуху на обидва вуха (більше зліва), шум у вухах, запаморочення, порушення координації, нудоту, блювання, почервоніння та біль у лівому оці. З анамнезу відомо, що в лютому 2015 р. пацієнтка вперше відзначила епізод загальної слабкості, головного болю, підвищення температури тіла, шум у лівому вусі тривалістю 1 тиж. За медичною допомогою не зверталася, самостійно розпочала прийом парацетамолу та римантадину. У квітні 2015 р. швидко розвинулися запаморочення, загальна слабкість, нудота, блювання, порушення координації рухів, шум у вусі зліва. Загальний аналіз крові, включаючи ШОЕ, та рівень С-реактивного білка були в межах норми. При проведенні комп’ютерної томографії головного мозку, реоенцефалографії, ультразвукового дослідження судин голови та шиї патології не виявили. Аудіометрія: зниження слуху на високих частотах у лівому вусі. Хвора була консультована отоларингологом, який встановив діагноз «Гострий лівобічний лабіринтит вірусної етіології» та призначив дексаметазон 16 мг внутрішньовенно, фуросемід та ондансетрон перорально. За даними повторної аудіограми зниження слуху повністю регресувало, проте шум у вусі залишався. У вересні 2015 р. шум у лівому вусі посилився, отоларинголог запідозрив хворобу Меньєра, але, зважаючи на відсутність змін за даними аудіограми, було рекомендовано спостереження в динаміці. Через 4 міс хвора відзначила різке почервоніння лівого ока, відчуття стороннього тіла в ньому, сльозотечу. Самостійно використовувала краплі з антибіотиком та глюкокортикоїдом. Клінічні прояви запалення лівого ока зникли, але шум у лівому вусі посилився. Через 2 тиж у хворої виник другий епізод запалення того ж ока, застосовувала диклофенак локально. Наступного дня відбувся рецидив гострого лівобічного лабіринтиту. За даними аудіометрії виявлено зниження слуху на високих та низьких частотах у лівому вусі.
Отоларинголог призначив дексаметазон 16 мг внутрішньомʼязово. Через 2 тиж, коли дозу дексаметазону було знижено до 4 мг, у хворої розвинувся третій епізод запалення лівого ока. Офтальмолог встановив діагноз «Лівобічний виразковий інтерстиціальний кератит, можливо, герпесвірусної етіології» та призначив локально ганцикловір та інтерферон. Через кілька днів стан хворої погіршився, з’явився виражений шум в обох вухах із втратою слуху, блюванням та явищами вертиго. У січні 2016 р. хвору було госпіталізовано в Інститут отоларингології ім. О.С. Коломійченка НАМН України. Послідовність розвитку симптоматики до госпіталізації у спеціалізовану установу наведено на рис. 1.
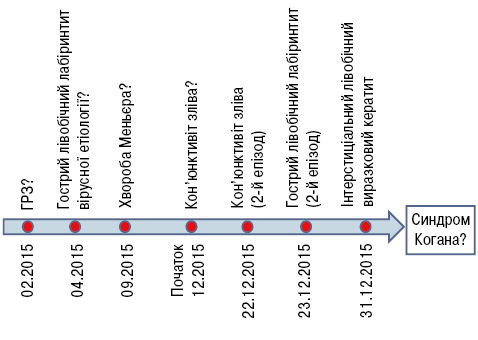
Під час госпіталізації отримано такі результати обстеження. Клінічний аналіз крові: гемоглобін — 126 г/л, еритроцити — 4,61 • 10, гематокрит — 39,1%, лейкоцити — 17,06 • 10, нейтрофіли — 80,8%, лімфоцити — 14,2%, моноцити — 4,4%, еозинофіли — 0,4%, базофіли — 0,2%, тромбоцити — 307 ⋅ 10, ШОЕ — 22 мм/год. Як видно з наведених даних, реєстрували лейкоцитоз із нейтрофільозом та підвищення ШОЕ. В біохімічному аналізі крові та загальному аналізі сечі — без відхилень. Антистрептолізин-О — 110 Од., С-реактивний білок — 1,18 мг/л, ревматоїдний фактор <10 МО/мл. Не виявлено підвищення рівня антитіл до вірусу гепатиту С (HCV), Treponema pallidum, Chlamidia trahomatis, Borrelia burgdorferi, вірусу простого герпесу (HSV) ½ типів, вірусу Varicella zoster (3-й тип герпесу, VZV); з використанням методу полімеразної ланцюгової реакції не виявлено у крові ДНК вірусів простого герпесу 1-го типу (ВПГ 1), простого герпесу 2-го типу (ВПГ 2), Varicella zoster, герпесу 6-го типу. За результатами імунологічних досліджень не виявлено підвищення рівня антитіл до мієлопероксидази, протеїнази-3, базальної мембрани гломерулярного апарату, антинуклеарних антитіл, антитіл до одно- та дволанцюгової ДНК, антифосфоліпідних, антикардіоліпінових, антифосфатидилсеринових та антифосфатидилетаноламінових антитіл.
Магнітно-резонансна томографія: вогнищевих та обʼємних змін у мосто-мозочкових кутах, структурах задньої черепної ями та структурах внутрішнього вуха не визначається. За даними вестибулометрії — двобічна арефлексія лабіринтів, стадія декомпенсації. Спіральна комп’ютерна томографія органів грудної клітки із внутрішньовенним контрастуванням: не виявлено патологічних змін з боку легень та органів середостіння.
Враховуючи гострий розвиток у хворої молодого віку асиметричного зниження слуху на обидва вуха з Меньєроподібним синдромом, однобічного інтерстиціального кератиту, наявність лейкоцитозу та підвищення ШОЕ, виключення вірусної, сифілітичної та іншої специфічної інфекції, системних захворювань сполучної тканини, антифосфоліпідного синдрому, АНЦА-асоційованого васкуліту, онкопатології, наявність тимчасового ефекту від коротких курсів лікування дексаметазоном, було висловлено підозру на синдром Когана і направлено хвору до ревматологів, якими підтверджено діагноз: синдром Когана, гострий перебіг, з ураженням внутрішнього вуха (зниження слуху, Меньєроподібний синдром) та очей (лівобічний виразковий інтерстиціальний кератит). Було призначено лікування: метилпреднізолон 125 мг внутрішньовенно крапельно 3 дні поспіль, потім метилпреднізолон 64 мг/добу перорально, який пізніше було замінено на преднізолон (60 мг/добу), з поступовим зниженням дози після покращення результатів аудіометрії до підтримувальної (мінімально — 5 мг/добу). Враховуючи тимчасовий ефект від попередніх коротких курсів глюкокортикоїдів, швидке прогресування захворювання з ураженням органа зору та із загрозою втрати слуху на обидва вуха, одночасно було призначено метотрексат у початковій дозі 10 мг/тиж та інфліксимаб (внутрішньовенна інфузія в дозі 5 мг/кг маси тіла, потім — на 2-й та 6-й тиждень після першої інфузії, далі — кожні 8 тиж). Тести на вірусні гепатити В і С та на вагітність були негативними. Протягом лікування хвора відзначала постійну нудоту та зменшення маси тіла на 2 кг. Після третьої інфузії інфліксимабу появилися незначні кров’янисті виділення зі статевих шляхів. Ультразвукове дослідження органів малого таза встановило факт вагітності терміном 10 тиж. Терміново було проведено корекцію терапії. Відповідно до рекомендацій EULAR для прийняття рішень щодо застосування протиревматичних препаратів перед вагітністю, у період вагітності та годування грудьми (Götestam S.C. et al., 2016), було відмінено метотрексат; прийом глюкокортикоїдів (преднізолон 45 мг/добу з поступовим зниженням дози до 5 мг від ІІІ триместру вагітності) та інфліксимабу продовжено. Схему лікування, яке проводили до та у період вагітності, відображено на рис. 2 та 3.
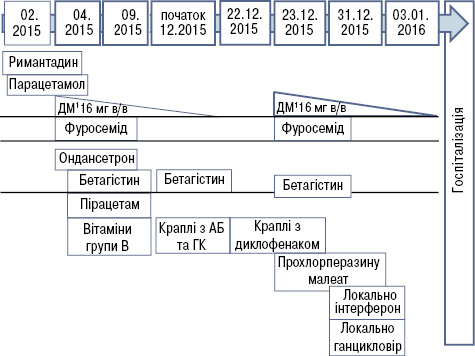
ДМ — дексаметазон зі зниженням дози: 12; 8; 6; 4 мг до повної відміни; АБ — антибіотики; ГК — глюкокортикоїди; в/в — внутрішньовенно.
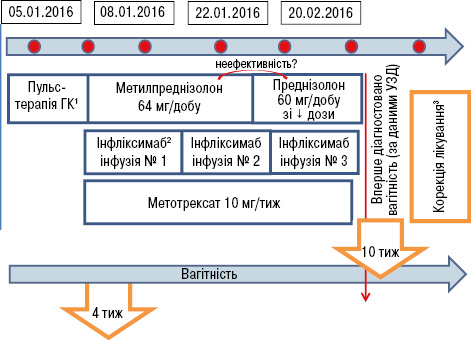
Пульс-терапія ГК: 125 мг солу-медрол 3 дні; 4-й день: метилпреднізолон 32 мг з поступовим зниженням дози (після покращення аудіометрії) до підтримувальної — 4–8 мг. Інфліксимаб: 5 мг/кг, потім — на 2-й, 6-й тиждень, а далі — кожні 8 тиж. Згідно з EULAR 2016. УЗД — ультразвукове дослідження
Ультразвуковий скринінг плода у всіх трьох триместрах був без патологічних змін. Хвора народила здорову доношену дитину (маса тіла — 3060 г, зріст — 52 см), годувала її грудним молоком. Повторних загострень захворювання не було, поступово покращилася координація, повністю зник шум у правому вусі та знизився рівень шуму в лівому, а також покращився слух на праве вухо. Зараз хвора отримує монотерапію інфліксимабом у підтримувальному режимі, скарг не має, активно працює, відхилення у стані здоров’я та розвитку дитини відсутні.
Наведений клінічний випадок демонструє складнощі в діагностиці синдрому Когана (діагноз встановлено через 11 міс від початку розвитку симптомів), що, зокрема, спричинено незначними і пізніми лабораторними відхиленнями (лейкоцитоз і помірне підвищення ШОЕ лише на 10-му місяці хвороби), відсутністю системних проявів і специфічних діагностичних лабораторно-інструментальних маркерів захворювання. Водночас завдяки активному лікуванню пацієнтки із застосуванням інфліксимабу вдалося запобігти розвитку незворотних порушень функції органів. Підкреслимо важливість і конструктивність у цьому разі міждисциплінарної взаємодії фахівців. Особливість цього випадку полягає у продовженні лікування глюкокортикоїдами та інфліксимабом у період вагітності та грудного вигодовування, що забезпечило досягнення стійкого клінічного результату та виявилося безпечним для матері, плода та новонародженої дитини.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- 1. Наказ МОЗ України «Про внесення змін до Переліку рідкісних (орфанних) захворювань, що призводять до скорочення тривалості життя хворих або їх інвалідизації та для яких існують визнані методи лікування» від 29.06.2017 р. № 731.
- 2. Ben-Ami E., Berrih-Aknin S., Miller A. (2011) Mesenchymal stem сells as an immunomodulatory therapeutic strategy for autoimmune diseases. Autoimmun. Rev., 10(7): 410–415.
- 3. Bonaguri C., Orsoni J., Russo A. et al. (2014) Cogan’s syndrome: anti-Hsp70 antibodies are a serological marker in the typical form. Isr. Med. Assoc. J., 16(5): 285–288.
- 4. Cogan D. (1945) Syndrome of non-syphilitic interstitial keratitis and vestibuloauditory symptoms. Arch. Ophthalmol., 33: 144–149.
- 5. Figueroa F.E., Carrion F., Villanueva S. et al. (2012) Mesenchymal stem сell treatment for autoimmune diseases: a critical review. Biol. Res., 45(3): 269–277.
- 6. Götestam Skorpen C., Hoeltzenbein M., Tincani A. et al. (2016) The EULAR points to consider for use of antirheumatic drugs before pregnancy, and during pregnancy and lactation. Ann. Rheum. Dis., 75(5): 795–810.
- 7. Grecoa A., Galloa A., Fusconi M. et al. (2013) Cogan’s syndrome: an autoimmune inner ear disease. Autoimmun. Rev., 12: 396–400.
- 8. Haynes B.F., Kaiser-Kupfer M.I., Mason P., Fauci A.S. (1980) Cogan syndrome: studies in thirteen patients, long-term follow-up, and a review of the literature. Medicine (Baltimore), 59: 426–441.
- 9. Jennette J.C., Falk R.J., Bacon P.A. et al. (2013) 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum., 65(1): 1–11.
- 10. Larkin E. (1971) Beethoven’s illness. Proc. R. Soc. Med., 64: 493–496.
- 11. Ljungstrom L., Franzen C., Schlaug M. et al. (1997) Reinfection with Chlamydia pneumoniae may induce isolated and systemic vasculitis in small and large vessels. Scand. J. Infect. Dis., 104: 37–40.
- 12. Lunardi C., Bason C., Leandri M. et al. (2002) Autoantibodies to inner ear and endothelial antigens in Cogan’s syndrome. Lancet, 360: 915–921.
- 13. Matteson E.L., Choi H.K., Poe D.S. et al. (2005) Etanercept therapy for immune-mediated cochleovestibular disorders: a multi-center open-label, pilot study. Arthritis Rheum., 53(3): 337–342.
- 14. McCallum R.M., St. Clair E.W., Haynes B.F. (2002) Cogan’s syndrome. In: Hoffman G.S., Weyand C.M. (Eds.) Inflammatory Diseases of Blood Vessels. Marcel Dekker, New York, p. 491–509.
- 15. McCallum R.M., St. Clair E.W. (2012) Cogan’s syndrome. In: Hoffman G.S., Weyand C.M., Langford C.A., Goronzy J.J. (Eds.) Inflammatory Diseases of Blood Vessels. 2 ed. Blackwell Publishing Ltd., p. 299–311.
- 16. Orsoni J.G., Laganà B., Rubino P. et al. (2010) Rituximab ameliorated severe hearing loss in Cogan’s syndrome: a case report. Orphanet J. Rare Dis., 5: 18.
- 17. Orsoni J.G., Zavota L., Mora P. et al. (2009) Discontinuous drug combination therapy in autoimmune ocular disorders. Acta Ophthalmol., 87(3): 340–345.
- 18. Tayer-Shifman O.E., Ilan O., Tovi H. et al. (2014) Cogan’s syndrome — clinical guidelines and novel therapeutic approaches. Clin. Rev. Allergy Immunol., 47(1): 65–72.
- 19. Vollertsen R.S., McDonald T.J., Younge B.R. et al. (1986) Cogan’s syndrome: 18 cases and a review of the literature. Mayo Clin. Proc., 61: 344–361.
КЛИНИЧЕСКИЙ СЛУЧАЙ ЛЕЧЕНИЯ СИНДРОМА КОГАНА С ИСПОЛЬЗОВАНИЕМ ИНФЛИКСИМАБА В ПЕРИОД БЕРЕМЕННОСТИ БОЛЬНОЙ
Резюме. В статье представлен обзор данных литературы о клинических, лабораторных проявлениях и современных подходах к лечению пациентов с синдромом Когана. Описан клинический случай лечения синдрома Когана у беременной с поражением внутреннего уха и глаз с применением иммунобиологической терапии.
синдром Когана, интерстициальный кератит, лабиринтит, аудиограмма, инфликсимаб, беременность.
Адреса для листування:
Яременко Олег Борисович
01601, Київ, бульв. Тараса Шевченка, 13
Національний медичний університет ім. О.О. Богомольця,
кафедра внутрішньої медицини № 3

Leave a comment