Запальні і дегенеративні захворювання скронево-нижньощелепного суглоба: сучасний стан проблеми (огляд літератури)
Резюме. У статті наведено сучасні погляди на частоту виникнення, практичне значення і лікування запальних і дегенеративних захворювань скронево-нижньощелепного суглоба (СНЩС) у практиці ревматолога і стоматолога. На прикладі проведених досліджень показано, що ці хвороби можуть мати перебіг як складової артритичного синдрому при псоріатичному, ревматоїдному, інфекційних артритах, анкілозивному спондилоартриті та остеоартриті. Аналіз опрацьованих джерел дозволив дійти висновку, що кожний випадок артриту СНЩС потребує обов’язкової оцінки артритичного статусу, оклюзії та проведення об’єктивного обстеження з метою виявлення структурних змін. У статті зроблений акцент на важливості патогенетичної терапії в кожному окремому випадку, продемонстровано алгоритми сучасного ведення пацієнтів із захворюваннями СНЩС.
УДК 616.724–002.77–073.7
За даними статистики, розлади скронево-нижньощелепних суглобів (СНЩС) на різних стадіях виявляють у 25–65% населення земної кулі. Невипадково саме ця патологія потрапила в поле зору вчених, адже захворювання СНЩС посідають особливе місце в клінічній практиці у зв’язку зі складністю клінічної картини, яка нерідко нагадує перебіг хвороб, що перебувають у межах компетенції лікарів різних спеціальностей: стоматологів, отоларингологів, невропатологів, психіатрів, ревматологів та ін. Внаслідок цього практикуючі лікарі різних профілів стикаються з труднощами в діагностиці і лікуванні. На сьогодні існує необхідність настороженості як стоматологів, так і ревматологів щодо недооцінювання і правильної діагностики артритів СНЩС у ранній стадії, в тому числі й при ревматичних захворюваннях. Останні дослідження в цій галузі констатують високу поширеність дегенеративних і запальних дисфункцій СНЩС у пацієнтів із системним ревматичним захворюванням та меншу поширеність, але все ж таки з її високим показником у хворих без системного залучення (Pantoja L.L.Q. et al., 2018). Ревматичні захворювання СНЩС стають дедалі частішими, і, на жаль, їх часто плутають з «класичними» мануальними дисфункціями (дислокація диска, міофасціальні больові синдроми) (Ferri J. et al., 2018).
Нині вважають, що лікування будуть підбирати індивідуально для кожного конкретного пацієнта, ґрунтуючись на його генетичних даних. У США вже почала діяти федеральна наукова програма, в рамках якої передбачається отримати генетичний матеріал і дослідити геном мільйона громадян одночасно зі збором електронних даних щодо стану їх здоров’я, способу життя, психологічних характеристик. Наразі проводяться різноманітні дослідження з вивчення індивідуальних особливостей болю з метою надання персоніфікованої терапії. Наприклад, у дослідженні OPPERA (Orofacial Pain: Prospective Evaluation and Risk Assessment) брали участь пацієнти з дисфункцією СНЩС, у частини з яких наявні супутні захворювання, що супроводжуються появою болю (Wilentz J.B. et al., 2017).
На часі реалізація пацієнторієнтованої допомоги і освітніх процесів, хоча в дії лікувальні процедури та діагностика захворювань СНЩС розроблені як усереднені з позицій так званого шаблонного пацієнта. Перехід до прецизійної (від англ. precise — точна) медицини потребує наявності особистих даних щодо стану здоров’я пацієнта, супутніх захворювань, особливостей геному. Таким чином, глибоке розуміння патологічних процесів вимагає залучення спеціалізованої багатопрофільної команди, до складу якої входили б ортопеди, ревматологи, фізіотерапевти, психіатри.
СНЩС — типовий та унікальний, оскільки на перший погляд — це простий суглоб, який утворюється двома кістковими поверхнями (головкою нижньої щелепи, скроневою кісткою), має фіброзну капсулу та суглобовий диск. Останній, як і диски в багатьох інших суглобах, є двошаровою структурою, що складається зі щільної волокнистої сполучної тканини. Диск СНЩС, як і інші його «колеги», згладжує нерівності кісткових поверхонь, які зчленовуються, робить їх конгруентними, амортизує поштовхи і струси під час руху. Значну роль у нормальному функціонуванні будь-якого суглоба відіграє синовіальна рідина. Саме вона забезпечує вільне ковзання суглобових поверхонь, сприяє живленню безсудинних шарів суглобового диска та суглобових поверхонь, а також виведенню чужорідних клітин і речовин, які проникають із крові при ушкодженнях суглобової капсули.
Будова суглобових поверхонь СНЩС також досить типова: вони вкриті сполучнотканинним хрящем, а синовіальна мембрана, яка вистилає порожнину суглоба, контактує із внутрішньосуглобовою рідиною. Живлення хряща СНЩС теж здійснюється згідно з класичними канонами: з капілярів синовіальної оболонки та субхондральної кістки шляхом дифузії до нього з двох боків надходять поживні речовини. При кожному руховому акті нижньої щелепи хрящова тканина, немов губка, стискається, а при розслабленні — розправляється. Завдяки цим особливостям синовіальна рідина постійно циркулює із суглобової сумки всередину хряща і назад. Хрящ у СНЩС має типові властивості, притаманні хрящовій тканині організму людини: він позбавлений кровоносних судин і нервових закінчень, а для його адекватного функціонування необхідні такі речовини, як глікозаміноглікани та хондроїтинсульфат.
Попри зазначені типові характеристики, притаманні майже всім суглобам, СНЩС має деякі особливості, що виокремлюють його серед усіх інших кісткових зчленувань. СНЩС є одним з найбільш активно працюючих шарнірних суглобів, який забезпечує плавні рухи щелепи вгору-вниз і з боку в бік та надає людині можливість виконувати унікальні функції: розмовляти, співати, їсти, позіхати та ін. Саме цей суглоб працює набагато більше, адже рухи у СНЩС можуть здійснюватися під час функціонального спокою інших суглобів. Таким чином, на СНЩС припадає велике фізичне навантаження, під час якого можуть страждати як його суглобові поверхні, диск, так і хрящова тканина.
Як і інші суглоби, СНЩС може страждати під впливом різноманітних факторів. На сьогодні для опису широкого спектра симптомів, які з’являються при порушенні нормальної функції СНЩС, використовують термін «дисфункція», або «порушення». Хоча цю дефініцію застосовують для позначення процесу захворювання, формально в стоматології цей стан не вважається хворобою, а розглядається як діапазон проявів від змінення власне структури суглоба до ураження періартикулярних тканин. Дисфункція СНЩС може виникати з різних причин. СНЩС уражається при дегенеративних захворюваннях суглобів (остеоартриті), системних запальних артритах (He D. et al., 2018). Перебіг ревматоїдного або псоріатичного артриту також може супроводжуватися ураженням СНЩС: у 67–71% пацієнтів із ревматоїдним артритом діагностують патологію не лише великих суглобів, а й СНЩС (Pinto J.R.R. et al., 2018; Savtekin G., Sehirli A.O., 2018; Skármeta N.P. et al., 2018). Також відомі інші захворювання СНЩС: кондилізи, або ідіопатична кондилярна резорбція, остеохондрит та остеонекроз, новоутворення і синовіальний хондроматоз.
Клінічно ураження СНЩС незалежно від етіологічних факторів майже завжди маніфестує болем різного ступеня інтенсивності. У разі гострого процесу біль має колючий, ріжучий характер, він перешкоджає відкриванню рота, розмові, унеможливлює прийом їжі. Біль переслідує хворих під час жування, розмови та в спокої. Дуже часто відмічають головний біль і невелике локальне підвищення температури тіла. Необхідно підкреслити, що в деяких випадках ураження СНЩС може маскуватися під інші захворювання, наприклад мігрень, неврит. При поширенні запального процесу відбувається звуження слухових каналів, що клінічно проявляється зниженням гостроти слуху, оталгією. Також гостра дисфункція СНЩС може маніфестувати міалгією жувальних м’язів, болем в шиї, артралгіями (Schiffman E., Ohrbach R., 2016).
За умов тривалого перебігу запального процесу, обмеження кількісного складу ексудату в порожнині СНЩС, можливої появи проліферативних ускладнень внутрішньосуглобові структури починають неадекватно впливати один на одного. Усі ці зміни спричиняють звуження суглобової щілини, зближення сусідніх кістково-суглобових поверхонь, що призводить до появи специфічного хрускотіння, клацання, яке лякає багатьох пацієнтів. Крім того, тривала бездіяльність СНЩС через значні больові відчуття зумовлює відповідну реакцію — скутість рухів лицьових м’язів і суглобових ділянок, а також погіршення слухових якостей. Таке різноманіття клінічної картини спонукає хворих звертатися до лікарів різних спеціальностей, у тому числі до стоматологів й отоларингологів.
Слід розуміти, що дисфункція СНЩС може виникати при різноманітних супутніх захворюваннях суглобів, наприклад при ревматоїдному артриті. У цих хворих труднощі при відкриванні рота зумовлені не тільки болем, а й фіброзними спайками, м’язовою контрактурою, запаленням, дегенерацією СНЩС. При ревматоїдному генезі ураження СНЩС на рентгенограмах виявляють досить типові зміни: кортикальні ерозії, звуження міжсуглобової щілини, анкілоз. Але, за статистичними даними, значуща різниця між утрудненням відкривання рота в пацієнтів із ревматоїдним артритом та в загальній популяції відсутня, тому ця знахідка сама по собі не дає достатніх підстав для остаточного підтвердження ревматоїдного генезу ураження.
Дисфункція СНЩС спостерігається в 90% пацієнтів із псоріатичним артритом, а також у 29% хворих на псоріаз. Доведено, що наявність псоріатичного ураження великих суглобів не асоціюється зі збільшенням ризику дисфункції СНЩС, але при ураженні останнього перебіг захворювання погіршується, клінічні ознаки ураження скронево-нижньощелепної ділянки посилюються. У деяких випадках може розвиватися однобічне ураження. До клінічних особливостей псоріатичного ураження СНЩС можна віднести наявність крепітації чи інших суглобових звуків, біль при відкриванні рота та жуванні, ранкову скутість, атрофію м’язів. За умови прогресування захворювання біль змінюється обмеженням руху через розвиток фіброзу (O’Connor R.C. et al., 2017).
Відносно невелика кількість хворих на анкілозивний спондиліт (приблизно 22%) мають рентгенологічні ознаки ураження СНЩС. При цьому такі пацієнти майже не скаржаться на біль і не мають специфічних симптомів, які виникають при ураженні скронево-нижньощелепної ділянки. Найпоширенішими клінічними ознаками дисфункції СНЩС в осіб з анкілозивним спондилітом є крепітація, атрофія жувальних м’язів, обмеження рухів у суглобах (обмежене відкривання рота).
Відомі випадки виникнення дисфункції СНЩС при системній склеродермії. На початкових етапах розвитку системної склеродермії дуже рідко діагностують ураження СНЩС, проте при прогресуванні захворювання з’являється не тільки дискомфорт у скронево-нижньощелепних ділянках, а й значне обмеження рухів щелепи, що дуже важко піддається лікуванню. З урахуванням цього в будь-якого пацієнта із системною склеродермією рекомендується регулярно аналізувати стан СНЩС при динамічному рентгенографічному дослідженні з метою підбору ефективного лікування та запобігання виникненню ускладнень (Gupta N. et al., 2016; Giudice A.L. et al., 2018).
Інфекція СНЩС є рідкісним станом, що виникає внаслідок введення патогенів у суглоб гематогенним шляхом або внаслідок травми. Раннє розпізнавання типових ознак і симптомів, включаючи лихоманку, тризм, преаурикулярний набряк і чутливість скронево-нижньощелепної ділянки, є необхідним для того, щоб ініціювати подальшу оцінку та запобігти фіброзуванню, анкілозу, аномальній структурі обличчя. У літературі описано декілька випадків септичного артриту СНЩС без очевидного джерела інфекції. Щоб уникнути серйозних проблем, необхідно врахувати ймовірність розвитку септичного артриту СНЩС у пацієнтів з болем у скронево-нижньощелепній ділянці, тризмом і набряком (Frojo G. et al., 2018; Wittig J. et al., 2018).
На сучасному етапі за умов підозри на дисфункцію СНЩС в діагностичному пошуку використовують різноманітні сучасні інструментальні методи. Ультразвукове дослідження високої якості дозволяє виявити зміни внутрішньо- і навколосуглобових м’яких тканин. У ході артросонографії можна виявити ознаки ексудативного або проліферативного синовіту суглобів, синовіальні кісти й ерозивні дефекти кісткової і суглобової поверхонь, визначити дегенеративні зміни суглобів і м’яких тканин (остеофіти, бурсит, навколосуглобова осификація, ушкодження капсульно-зв’язкового апарату).
Традиційне рентгенологічне дослідження суглобів (панорамна й оглядова рентгенографія, ортопантомографія), яке широко застосовується в повсякденній практиці, також має велике значення. Воно дозволяє отримати певні уявлення про стан кісткових структур, що формують СНЩС, рентгенівської суглобової щілини, внутрішньосуглобових поверхонь. Упровадження комп’ютерної томографії (КТ) дозволило отримати зображення СНЩС у різних площинах та візуалізувати кісткові елементи суглоба більш детально, але цей метод дослідження не може визначити стан некісткових структур СНЩС (Murphy M.K. et al., 2013).
Нині повноцінним методом діагностики ушкоджень СНЩС є магнітно-резонансна томографія (МРТ), яка дозволяє констатувати анатомічні зміни м’якотканинних та фіброзних структур. Саме МРТ визнана найбезпечнішим неінвазивним методом діагностики дисфункції СНЩС: цей золотий стандарт має дуже високу чутливість, специфічність, діагностичну точність. Проведення МРТ СНЩС є запорукою комплексної оцінки стану синовіальної оболонки, суглобового диска, внутрішньосуглобових зв’язок, біламінарної зони та виявлення ексудативно-проліферативних, дегенеративно-дистрофічних і деструктивних змін у хрящових та фіброзних структурах суглоба.
Найбільш перспективним в діагностиці функціональних порушень зубощелепового апарату на сьогодні вважається функціональний метод — аксіографія (графічний запис траєкторії руху суглобової головки та диска СНЩС при різноманітних рухах нижньої щелепи), котрий дозволяє провести поглиблений аналіз клінічної ситуації.
Використовуючи спеціальне програмне забезпечення, можна додатково оцінити особливості рухів нижньої щелепи для визначення можливих функціональних порушень. Результати аналізу подають у вигляді проекції траєкторії руху нижньої щелепи на три взаємно перпендикулярні площини. Одночасно особливості руху кондиляра при переміщенні щелепи вздовж горизонтальної осі (право-ліво) подаються у вигляді зміни просторового положення кінематичної осі. Ці дані дозволяють не тільки виявити наявні функціональні порушення (обмеженість, дискоординація рухів чи надлишкова рухомість щелепи), але й визначити, якими причинами вони викликані (артрогенні, міогенні чи оклюзійні дефекти) (Єзерська О.О. та співавт., 2013; Дрогомирецька М.С. та співавт., 2016).
Незважаючи на використання сучасних інструментальних досліджень у діагностиці ураження СНЩС, не існує чітких інструкцій щодо точного встановлення етіології порушення його функції. Часто це призводить до встановлення помилкового діагнозу та, як наслідок, до призначення неадекватного лікування.
Метою лікування дисфункції СНЩС може бути досягнення знеболення, припинення патологічних структурних змін, відновлення/покращення функції суглоба та відтермінування проведення артропластики. Лікування уражень СНЩС при ревматичних захворюваннях не є консенсуальним і часто включає в себе нехірургічну (гігієнічні і дієтичні правила, нестероїдні протизапальні препарати (НПЗП), оклюзійні шини) та/або хірургічну фазу, і лише у випадку, коли пацієнти не реагують на лікування, їх скеровують до ревматолога і проводять патогенетичне лікування.
Нині вважається, що порушення оклюзії є важливим і провідним етіологічним чинником у розвитку суглобових дисфункцій. Відтак, пропонують завжди в першу чергу нормалізувати оклюзію як ключовий момент у комплексному лікуванні дисфункції СНЩС та подальшому адекватному протезуванні.
Проте низка авторів у довготривалих дослідженнях виявили слабкий зв’язок між порушеннями оклюзії як етіологічного чинника та дисфункціями СНЩС, вважаючи, що самі дисфункції як первинний фактор можуть спричиняти різноманітні порушення оклюзійних співвідношень зубів, тому комплексний підхід є запорукою успішного лікування (Kalladka M. et al., 2016).
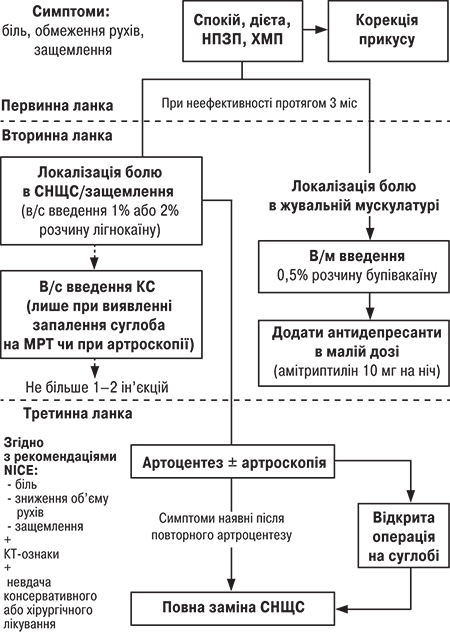
Слід зауважити, що за невизначеної етіології ураження СНЩС терапія переважно має симптоматичний характер, що в більшості випадків може призвести до прогресування захворювання. Зменшити прогресування запального ураження СНЩС при ревматоїдному чи псоріатичному генезі захворювання можна шляхом призначення метотрексату, імунобіологічної терапії; при остеоартриті доцільно використовувати хворобо-модифікуючі препарати (хондропротектори). У 2017 р. R. O’Connor і співавтори запропонували алгоритм лікування пацієнтів із запальними ураженнями СНЩС, що передбачає декілька етапів (рисунок).
Відповідно до цього алгоритму на першому етапі надання допомоги пацієнтам із дисфункцією СНЩС призначають НПЗП, які мають переваги щодо усунення запалення. Однак є потреба у проведенні подальших досліджень щодо вивчення безпеки тривалого використання та переваг у контролі болю, запалення, а також порівняльної оцінки профілю ефективності та можливих негативних побічних дій. Внутрішньосуглобове введення кортикостероїдів є мінімально інвазивною терапією. У пацієнтів з ревматоїдним артритом СНЩС наслідком такої терапії є зменшення болю в 75,6% випадків порівняно з використанням гіалуронової кислоти (19,6%) та плацебо (17,8%). Утім, застосування гіалуронової кислоти можливе тільки при виявленні ознак запалення під час МРТ або артроскопії; крім цього, максимальна кількість зазначених втручань становить лише 1–2 ін’єкції. Необхідно акцентувати, що ні НПЗП, ні кортикостероїди не забезпечують повного відновлення суглоба/суглобових поверхонь (Zou K. et al., 2016).
Автори наведеного алгоритму підкреслюють, що перша лінія терапії остеоартриту СНЩС має бути неінвазивною та передбачати застосування патогенетичної хондропротекторної терапії (глюкозамін та хондроїтин), а ін’єкції гіалуронової кислоти слід зарезервувати для пацієнтів, які не користуються консервативними методами, а процедуру артропластики (заміна диска та суглобів) призначати лише тоді, коли консервативні заходи є неефективними.
Переконливо доведено, що неінвазивне консервативне лікування є досить ефективним і має бути наріжним каменем ведення пацієнтів з остеоартритом СНЩС. Цей підхід передбачає призначення хондропротекторів — глюкозаміну та хондроїтину. Встановлено хондропротекторну дію комбінованого прийому хондроїтинсульфату та глюкозаміну, що асоціюється зі зниженням рівнів запальних медіаторів (інтерлейкіну-1 та фактора некрозу пухлини) у сироватці крові, а також зі зниженням концентрації біомаркерів запалення хряща (матриксної металопротеїнази-3, С-телопептидного типу колагену ІІ типу і RANKL-κB/остеопротегерину). Показано, що терапія хондроїтинсульфатом і глюкозаміном сприяє покращенню мікроархітектоніки кістки. Хондроїтинсульфат та глюкозамін можуть бути корисними при необхідності контролю катаболічних ефектів запального стресу. Комбінований прийом хондроїтинсульфату та глюкозаміну забезпечує симптом-модифікуючий та структурно-модифікуючий ефекти; поєднане призначення цих компонентів характеризується високим рівнем безпеки (McAlindon T.E. et al., 2000).
В одному дослідженні (Haghighat A. et al., 2013) встановлено, що у пацієнтів з дегенеративними порушеннями СНЩС за рівнем ефективності та безпеки глюкозамін перевершує такий НПЗП, як ібупрофен. Глюкозамін як хондропротектор гальмує катаболічні механізми дегенеративних процесів у суглобах. Крім того, вважається, що глюкозаміну сульфат може пригнічувати прозапальні цитокіни. Дослідження A. Haghighat та співавторів показало, що порівняно із загальновизнаним НПЗП ібупрофеном глюкозаміну сульфат може бути використаний як більш ефективний та безпечний терапевтичний засіб для лікування пацієнтів із дегенеративними порушеннями СНЩС (Tsujimoto K. et al., 2018).
Метааналіз отриманих даних дозволив зробити висновок, що глюкозамін і хондроїтинсульфат можуть зменшити сумарне проміжне звуження суглобової щілини після 2–3 років безперервного застосування.
Сучасні настанови щодо лікування остеоартриту містять рекомендації щодо застосування повільнодіючих симптом-модифікуючих засобів (SYSADOA) з метою запобігання розвитку та прогресуванню дегенеративних змін у хрящі (Zhu X. et al., 2018). Підкреслюється також доцільність призначення тривалих курсів лікування хондропротекторами. Вчені припускають, що саме хондроїтинсульфат і глюкозамін можуть сприяти відновленню структури хряща, зменшенню болю та покращенню функції при дисфункції СНЩС, спричиненій остеоартритом (Fernández‐Cuadros M.E., 2018; Puigdellivol J. et al., 2018; Sanches M. et al., 2018).
Список використаної літератури
- Дрогомирецька М.С., Гергель І.М., Єзерська О.О. (2013) Використання апарату T-SCAN III у ортодонтії. Вісник стоматології, (1): 180–181.
- Єзерська О.О., Дрогомирецька М.С., Гергель І.М. (2013) Сучасний метод діагностики функціонального стану СНЩС. Вісник стоматології, (1): 183–184.
- Fernández‐Cuadros M.E. (2018) Does glucosamine/chondroitin sulfate have a long‐term effect on the progression of structural changes in knee osteoarthritis? Comment on the article by Raynauld et al. Arthritis Care Res. (Hoboken), 70(1): 167–167.
- Ferri J., Potier J., Maes J.M. et al. (2018) Temporomandibular joint arthritis: Clinical, orthodontic, orthopaedic and surgical approaches. Int. Orthodontics, 16(3): 545–561.
- Frojo G., Tadisina K.K., Shetty V., Lin A.Y. (2018) Temporomandibular joint septic arthritis. Plast. Reconstr. Surg. Glob. Open, 6(1): e1648.
- Haghighat A. et al. (2013) Evaluation of Glucosamine sulfate and Ibuprofen effects in patients with temporomandibular joint osteoarthritis symptom. J. Res. Pharm. Pract., 2(1): 34.
- He D., An Y., Li Y. et al. (2018) RNA sequencing reveals target genes of temporomandibular joint osteoarthritis in rats after the treatment of low-intensity pulsed ultrasound. Gene, 672: 126–136.
- Giudice A.L., Brewer I., Leonardi R. et al. (2018) Pain threshold and temporomandibular function in systemic sclerosis: comparison with psoriatic arthritis. Clin. Rheumatol., 37(7): 1861–1867.
- Gupta N., Gupta N., Tomar L.R., Nair N. (2016) Temporomandibular joint ankylosis in ankylosing spondylitis: A case report and review of literature. J. Family Med. Prim. Care, 5(3): 716.
- Kalladka M., Quek S., Heir G. et al. (2014) Temporomandibular joint osteoarthritis: diagnosis and long-term conservative management: a topic review. J. Indian Prosthodont. Soc., 14(1): 6–15.
- McAlindon T.E., LaValley M.P., Gulin J.P., Felson D.T. (2000) Glucosamine and chondroitin for treatment of osteoarthritis: a systematic quality assessment and meta-analysis. Jama, 283(11): 1469–1475.
- Murphy M.K., MacBarb R.F., Wong M.E., Athanasiou K.A. (2013) Temporomandibular joint disorders: A review of etiology, clinical management, and tissue engineering strategies. Int. J. Oral Maxillofac. Implants, 28(6): e393.
- O’Connor R.C., Fawthrop F., Salha R., Sidebottom A.J. (2017) Management of the temporomandibular joint in inflammatory arthritis: Involvement of surgical procedures. Eur. J. Rheumatol., 4(2): 151.
- Pantoja L.L.Q., de Toledo I.P., Pupo Y.M. et al. (2018) Prevalence of degenerative joint disease of the temporomandibular joint: a systematic review. Clin. Oral Investig., 1–14. doi: 10.1007/s00784-018-2664-y.
- Pinto J.R.R., Pedron I.G., Utumi E.R. et al. (2018) Temporomandibular joint disorders as the only manifestation of juvenile idiopathic arthritis: a case report. Einstein (São Paulo), 16(3): eRC4003.
- Puigdellivol J., Comellas Berenger C., Pérez Fernández M.Á. et al. (2018) Effectiveness of a dietary supplement containing hydrolyzed collagen, chondroitin sulfate, and glucosamine in pain reduction and functional capacity in osteoarthritis patients. J. Diet. Suppl., 1–11.
- Sanches M., Assis L., Criniti C. et al. (2018) Chondroitin sulfate and glucosamine sulfate associated to photobiomodulation prevents degenerative morphological changes in an experimental model of osteoarthritis in rats. Lasers Med. Sci., 33(3): 549–557.
- Savtekin G., Sehirli A.O. (2018). Rheumatoid arthritis in temporo-mandibular joint: A review. Nigerian J. Clin. Practice, 21(10): 1243.
- Schiffman E., Ohrbach R. (2016) Executive summary of the diagnostic criteria for temporomandibular disorders for clinical and research applications. J. Am. Dent. Assoc., 147(6): 438–445.
- Skármeta N.P., Araneda L., Araya C. (2018) Destructive psoriatic arthritis of the temporomandibular joint: a clinical case, an overview of the pathophysiology and its differential diagnoses. Cranio, 1–7.
- Tsujimoto K., Hata A., Fujita M. et al. (2018) Presepsin and procalcitonin as biomarkers of systemic bacterial infection in patients with rheumatoid arthritis. Int. J. Rheum. Dis., 21(7): 1406–1413.
- Wilentz J.B., Cowley A.W. Jr. (2017) How can precision medicine be applied to temporomandibular disorders and its comorbidities? Mol. Pain., 13.
- Wittig J., Borumandi F., Gaggl A., Hachleitner J. (2018) Septic arthritis of the temporomandibular joint leading to an epidural abscess. BMJ Case Rep., 2018: pii: bcr-2017-223563.
- Zhu X., Sang L., Wu D. (2018) Effectiveness and safety of glucosamine and chondroitin for the treatment of osteoarthritis: a meta-analysis of randomized controlled trials. J. Orthop. Surg. Res., 13(1): 170.
- Zou K., Wong J., Abdullah N. et al. (2016) Examination of overall treatment effect and the proportion attributable to contextual effect in osteoarthritis: meta-analysis of randomised controlled trials. Ann. Rheum. Dis., 75(11): 1964–1970.
Воспалительные и дегенеративные заболевания височно-нижнечелюстного сустава: современное состояние проблемы (обзор литературы)
Резюме. В статье приведены современные взгляды на частоту возникновения, практическое значение и лечение воспалительных и дегенеративных заболеваний височно-нижнечелюстного сустава (ВНЧС) в практике ревматолога и стоматолога. На примере проведенных исследований показано, что данные болезни могут протекать как составляющая артритического синдрома при псориатическом, ревматоидном, инфекционных артритах, анкилозирующем спондилоартрите и остеоартрите. Анализ обработанных источников позволил сделать вывод, что каждый случай артрита ВНЧС требует обязательной оценки артритического статуса, окклюзии и проведения объективного обследования с целью выявления структурных изменений. В статье сделан акцент на важности патогенетической терапии в каждом отдельном случае, продемонстрированы алгоритмы современного ведения пациентов с заболеваниями ВНЧС.
височно-нижнечелюстной сустав, дисфункция ВНЧС, артрит ВНЧС, ВНЧС при ревматических болезнях.
Адреса для листування:
Сміян Світлана Іванівна
46001, Тернопiль, майдан Волi, 1
ДВНЗ «Тернопільський державний медичний
університет ім. І.Я. Горбачевського МОЗ України»,
кафедра внутрішньої медицини № 2

Leave a comment