Морфологічні показники патологічних змін кульшового суглоба, їх частота та кореляційні залежності між показниками гістоморфометрії спонгіози голівки стегнової кістки у хворих на ревматоїдний артрит
Григоровський В.В., Бабко А.М., Герасименко А.С.
Резюме. Мета дослідження — використовуючи систему напівкількісних градаційних показників патологічних змін тканин кульшового суглоба (запальних, дистрофічних, репаративних тощо) та гістоморфометрії спонгіози (ГМС), визначити частоту випадків певної градації та кореляційні зв’язки між окремими показниками стану суглобової капсули та голівки стегнової кістки у хворих на ревматоїдний артрит (РА), яким видаляли фрагменти уражених суглобів. Матеріалом дослідження послужили кісткові та м’якотканинні фрагменти кульшових суглобів 20 хворих на РА. У результаті гістологічного дослідження визначено низку непараметричних морфологічних показників. ГМС голівки стегнової кістки включала чотири показники, що відображають різні кількісні властивості спонгіози. Результати. У тканинах кульшового суглоба виявлено низку гістологічних змін, які відображають різні патологічні процеси: хронічне продуктивне запалення з імунним компонентом, гіпертрофічні розростання синовіального шару суглобової капсули, дистрофічно-деструктивні зміни. Ступінь вираженості морфологічних показників варіює від випадку до випадку, та вони можуть по-різному корелювати між собою та з параметрами показників ГМС. Висновки. Між морфологічними показниками стану тканин кульшового суглоба: синовіального шару капсули, суглобового хряща, субхондріальної кісткової пластинки та кісткового мозку, з одного боку, та ГМС-показниками стану спонгіози голівки стегнової кістки — з іншого боку, існують кореляційні залежності, на основі яких можна прогнозувати вираженість одних показників стану тканин за іншими, відомими показниками ураження.
УДК 616.72-002.77:616.718.41-018.4
ВСТУП
Ревматоїдний артрит (РА) — системне захворювання, яке характеризується хронічним запаленням, уражає діартрозні суглоби та прилеглі до них м’які тканини, а також різні екстраартикулярні сполучнотканинні утворення (Hale L.P., 2005). В основі морфогенезу — хронічне запалення з імунним компонентом, що супроводжується системними змінами кісткової та інших похідних сполучної тканини (Раденска-Лоповок С.Г., 2013). Найбільш виражені патологічні зміни стосуються різних тканин уражених суглобів: синовіального шару суглобової капсули (СК), суглобового хряща (СХ), кісткового мозку субхондріальної спонгіози суглобових поверхонь кісток (Soren A., 1993; Hale L.P., 2005; Лялина В.В., Шехтер А.Б., 2007).
Широко відомо, що у пацієнтів із РА з перебігом захворювання погіршуються властивості кісткової тканини (Malluche H.H., Faugere M.-C., 1986; Алякна В. и соавт., 1999; Hale L.P., 2005). Це стосується як системної кісткової тканини, так і кісткової тканини суглобових кінців. На клінічному матеріалі стан кісткової тканини у хворих на РА вивчали методами ультразвукової та рентгенденситометрії (Haugeberg G. et al., 2003; Курята А.В. та співавт., 2006). Проте характеристики кісткової тканини, одержані різними апаратними методами, у світлі сучасних даних не відображають всіх особливостей її функціонального стану, тобто, крім загальної щільності (частка кісткової тканини в одиниці об’єму) — ще й ступеня вираженості остеогенезу та остеорезорбції. Хоча ці характеристики розширюють уявлення про доопераційний стан кісткової тканини у хворих на РА, дотепер не відомо, як вони поєднуються з патологічними змінами у СК та губчастій кістковій тканині голівки стегнової кістки (ГСК) і чи можна на цій основі прогнозувати стан спонгіози перед операцією ендопротезування кульшового суглоба.
У попередніх наших роботах встановлено середні параметри губчастої кісткової тканини суглобових кінців та кореляційні зв’язки, наявні між окремими показниками гістоморфометрії спонгіози (ГМС), а також між клінічними та клініко-лабораторними даними, з одного боку, та ГМС-показниками — з іншого, у хворих на РА (Григоровський В.В., Герасименко А.С., 2011; Григоровський В.В. та співавт., 2015). Втім, детального аналізу гістологічних проявів основних патологічних процесів у тканинах кульшового суглоба та визначення параметрів кореляції між цими змінами та ГМС-показниками стану губчастої кісткової тканини ГСК раніше не проводили.
Мета дослідження — на основі напівкількісних градаційних показників, що відображають патологічні зміни тканин кульшового суглоба (запальні, дистрофічні, репаративні тощо), визначити частоту випадків зі змінами певної градації та кореляційні зв’язки між окремими показниками стану СК, ГСК та ГМС-показниками у хворих на РА, яким видалено фрагменти уражених суглобів під час операції тотального ендопротезування.
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
Матеріалом дослідження послужили резектати кісткової та м’яких тканин, одержані під час ендопротезування кульшового суглоба у 20 хворих на РА різного віку. Для гістологічного дослідження вилучені фрагменти зазвичай використовували цільно, далі не подрібнюючи, з них вирізали фрагменти з максимальним збереженням топографії. Проводили фіксацію 10% формаліном, декальцинацію шматочків 5% азотною кислотою, заливання у целоїдин, виготовлення зрізів товщиною 10 мкм, фарбування гематоксиліном та еозином. Гістологічні та гістоморфометричні дослідження проводили на мікроскопах «Olympus СХ-41» і «МБС-2».
Внаслідок гістологічного дослідження складено низку непараметричних морфологічних показників, які загалом характеризують обсяг та ступінь вираженості патологічних змін у ГСК та СК. Градації ступенів вираженості, їхній зміст, розподіл випадків за градаціями непараметричних показників наведено у табл. 1 та в тексті. Градаційні оцінки вираженості для кожного об’єкта дослідження виносили, застосовуючи сліпий метод, тобто не знаючи клінічних даних та параметрів ГМС.
Таблиця 1
Частота випадків з окремими градаціями морфологічних показників стану тканин кульшового суглоба та середньозважені параметри показників ГМС ГСК хворих на РА
| Показник | Загальна характеристика показника, одиниці виміру та опис градацій вираженості | Групові вимірні та частотні параметри у хворих на РА з ураженням кульшового суглоба |
|---|---|---|
| Морфологічні показники патологічних змін СК | ||
| Ворсинчасті розростання синовіального шару СК | Непараметричний показник
Низький ступінь: не виражені або слабо виражені |
10/13*
76,92% |
| Високий ступінь: добре виражені, з ознаками гіпертрофії | 3/13
23,08% |
|
| Активність запалення у синовіальному шарі СК | Непараметричний показник
Низький ступінь: відсутня, низька чи середня активність |
8/13
61,54% |
| Високий ступінь: висока активність | 5/13
38,46% |
|
| Морфологічні показники патологічних змін суглобової поверхні ГСК | ||
| Вираженість ДДЗ у тканинах суглобової поверхні ГСК | Непараметричний показник
Низький ступінь: патологічні зміни відповідають І або ІІ стадії ураження голівки при остеоартрозі |
3/16
18,75% |
| Високий ступінь: патологічні зміни відповідають ІІІ стадії ураження голівки при остеоартрозі | 13/16
81,25% |
|
| Активність запалення у субхондріальній спонгіозі ГСК | Непараметричний показник
Низький ступінь: низька активність |
9/16
56,25% |
| Високий ступінь: середня чи висока активність | 7/16
43,75% |
|
| Гістоморфометричні показники спонгіози ГСК | ||
| Кістковий об’єм BV/TV% | Параметричний показник, вимірюється у процентах | 20**
18,83±0,45 |
| Відносна остеоїдна поверхня OS/BS% | Параметричний показник, вимірюється у процентах | 20
9,97±0,39 |
| Остеокластичний індекс: кількість клітин на одиницю площі зрізу NOc/TAr 1/мм | Параметричний показник, вимірюється кількістю клітин (остеокластів) на одиницю площі зрізу спонгіози | 20
1,04±0,04 |
| Остеокластичний індекс: кількість клітин на одиницю сумарної довжини перетину поверхні кісткових трабекул зрізу NOc/TS 1/мм | Параметричний показник, вимірюється кількістю клітин (остеокластів) на одиницю сумарної довжини перетину поверхні кісткових трабекул | 20
0,37±0,01 |
*У таких комірках вміщено: кількість випадків, що відповідають цій градації/загальна кількість випадків, які враховано, частота наявності (%); **у таких комірках вміщено: кількість випадків, середньозважена величина ± стандартна помилка.
ГМС виконували у кількох послідовно-прилеглих полях зору мікроскопів відповідного збільшення у ділянках, віддалених від ураженої суглобової поверхні ГСК не менше ніж на 5 мм, тобто розташованих біля площини хірургічної резекції фрагментів. Вимірювали параметри показників зі стандартної системи ASBMR (American Society for Bone and Mineral Research, США) (Malluche H.H., Faugere M.-C., 1986; Parfitt A.M., 1988; Meunier P.J., 2000):
1. Кістковий об’єм BV/TV (bone volume/total volume), у процентах. Гістоморфометрію проводили на мікроскопі «МБС-2» із застосуванням квадратно-сітчастої окулярної вставки зі 196 перетинами, максимально у 10 полях зору. За наявності дрібніших фрагментів кісткового об’єкта кількість полів зору була меншою. Індивідуальний параметр кісткового об’єму (BV/TV) вираховували відносно загальної кількості тестових точок перетину у всіх полях зору (максимально було 1960 точок у 10 полях вимірювання).
2. Остеоїдна поверхня OS/BS (osteoid surface/bone surface), у процентах. Гістоморфометрію проводили на мікроскопі «Olympus СХ-41» із застосуванням окулярної квадратно-сітчастої вставки з 10 паралельними відрізками; максимально у 20 послідовно-прилеглих полях зору. Підраховували загальну кількість точок перетину поверхні кісткових трабекул з усіма відрізками та окремо — кількість перетинів поверхні трабекул, вкритих шаром остеоїду, а потім — вираховували їхню частку.
3. Остеокластичний індекс відносно площі вимірювання спонгіози (кількість багатоядерних остеокластів на одиницю площі, N.Oc/T.Ar (number of osteoclasts/total area), на 1 мм. Визначення проводили на мікроскопі «Olympus СХ-41» із застосуванням окулярної квадратно-сітчастої вставки з полем квадратної форми відомої площі при використанні об’єктива 20× та окуляра 7×; максимум у 20 послідовно-прилеглих полях зору підраховували загальну кількість багатоядерних клітин-остеокластів, які містилися на поверхнях трабекул, а потім визначали частку від ділення сумарної кількості остеокластів на загальну площу досліджених полів зору, в одиницях на мм.
4. Остеокластичний індекс відносно поверхні перетину трабекул — відносна кількість остеокластів на одиницю довжини перетину поверхні кісткових перекладок, N.Oc/BS (number of osteoclasts/bone surface), на 1 мм. Визначення проводили на мікроскопі «Olympus СХ-41» із застосуванням окулярної квадратно-сітчастої вставки з полем квадратної форми відомої площі при використанні об’єктива 20× та окуляра 7× максимум у 20 послідовно-прилеглих полях зору. Підраховували загальну кількість багатоядерних клітин-остеокластів, які містилися на поверхні трабекул, а потім визначали частку від ділення сумарної кількості остеокластів на сумарну довжину перетину поверхонь кісткових трабекул спонгіози у всіх полях зору, виражену в мм. Сумарну довжину перетину поверхонь кісткових трабекул вираховували, перемножаючи кількість точок перетину поверхні трабекул на довжину, якій відповідає один перетин. Останню виміряно об’єкт-мікрометром, вона становила 0,08 мм.
Для непараметричних морфологічних показників визначали частоту випадків різного ступеня вираженості, для параметричних показників ГМС — середньозважені величини та помилку середньої.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
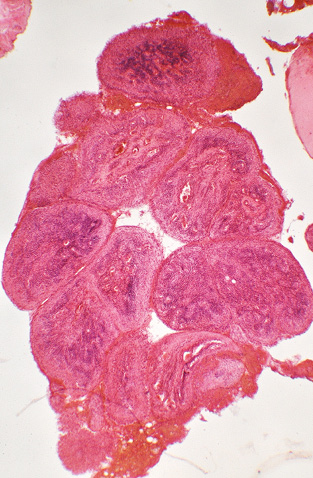
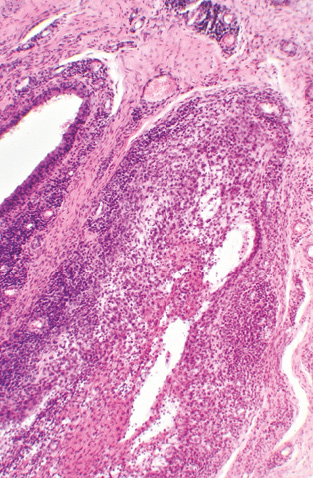
Патогістологічні зміни тканин кульшового суглоба. Частина випадків ревматоїдного синовіту кульшового суглоба характеризувалася наявністю розростань синовіального шару у вигляді гіпертрофованих ворсинок (рис. 1), часто — з потовщенням покривного шару синовіоцитів. Виявляли ознаки хронічного неспецифічного продуктивно-інфільтративного та ексудативного запалення, які найбільшої вираженості досягали у синовіальному шарі (рис. 2). Ці зміни відповідали різному ступеню активності запального процесу. За низького ступеня загальна структура синовіального шару була добре збережена, покрив синовіоцитів скрізь наявний, у власній пластинці синовіального шару траплялися дрібні ділянки серозного запалення та дуже дрібні, до 15–20 клітин, інтерстиційні лімфоцитарно-макрофагально-плазмоцитарні інфільтрати. За середнього ступеня активності подекуди виявляли ділянки відсутності покриву синовіоцитів, на поверхні — невеликі нашарування фібрину, у власній пластинці спостерігали гіперемію, щільні, але розрізнені лімфоцитарно-макрофагально-плазмоцитарні інфільтрати (рис. 2). За високого ступеня активності синовіту синовіальний покрив займав значну протяжність або повністю відсутній, при цьому на поверхні оголеної власної синовіальної пластинки містилися об’ємні нашарування мас фібрину, у самій власній пластинці — виражена гіперемія, поширена та щільна зливна лімфоцитарно-макрофагально-плазмоцитарна інфільтрація, з домішкою нейтрофілоцитів та невеликих багатоядерних гігантських клітин (рис. 3); подекуди скупчення мононуклеарів формували у власній синовіальній пластинці лімфоцитарні агрегати. В окремих випадках проявом високої активності запального процесу виступали ділянки фібриноїдного некрозу сполучної тканини ворсинок, глибоких шарів власної синовіальної пластинки тощо.
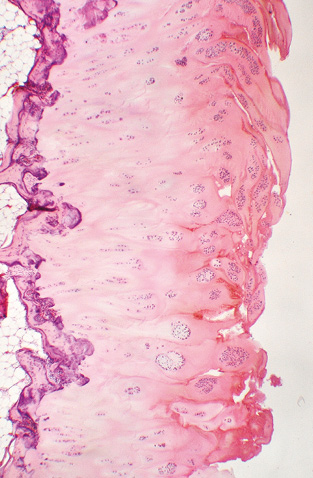
Для оцінки ступеня ураження структур суглобової поверхні ГСК враховували характерні гістологічні зміни окремо для СХ та субхондріальної спонгіози. На поверхні СХ траплялися нашарування невеликої кількості пухкого чи ущільненого фібринозного ексудату та напластування волокнистої сполучної тканини у вигляді пануса, який мав різну будову та вираженість запальної інфільтрації. СХ у жодному випадку не відповідав нормі: був більшою чи меншою мірою потоншений, різко деформований, з численними вертикальними та горизонтальними щілинами, неоднорідної будови, з розволокненням, утворенням псевдоворсинок та ділянок з великими ізогенними групами хондроцитів тощо. У разі якщо СХ був майже повністю збережений, на поверхні траплялися тонкі нашарування фіброзного пануса, дистрофічні зміни та деструкція СХ були мінімальні — такі патологічні особливості відповідали низькому ступеню дистрофічно-деструктивних змін (ДДЗ). За ДДЗ, що були добре виражені, з помітним потоншенням СХ та дефектом його в межах поверхневої та проміжної зон, ступінь вираженості пошкодження СХ визначався як середній (рис. 4). При значному потоншенні СХ у межах глибокої зони хряща чи повній відсутності СХ з оголенням поверхні склерозованої кісткової тканини, наявністю хрящових вузликів або кістозних утворень на рівні субхондріальної кісткової пластинки — таку гістологічну картину розцінювали як високий ступінь ДДЗ (рис. 5).
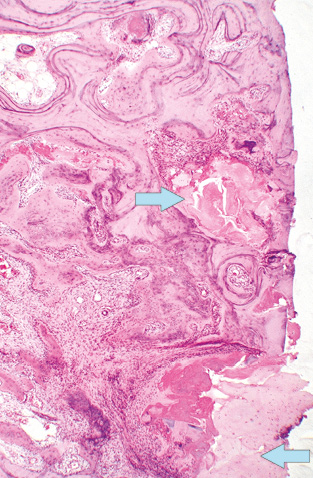
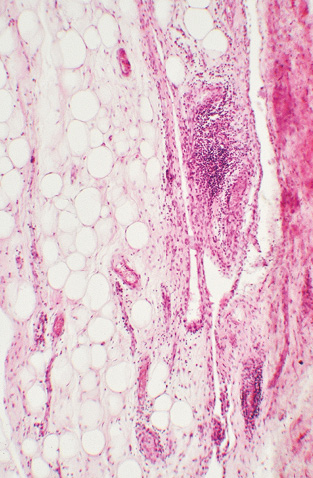
Хронічний запальний процес за РА спостерігали не тільки у синовіальному шарі СК, але і у кістковомозкових порожнинах безпосередньо під субхондріальною кістковою пластинкою. При цьому гістологічні ознаки активності хронічного продуктивного запалення в окремих хворих варіювали. За низького ступеня активності запального процесу в прилеглих кістковомозкових порожнинах виявлялися розрізнені нещільні скупчення мононуклеарів, макрофагів та плазмоцитів навколо дрібних судин (рис. 6). За наявності значного запального набряку тканини кісткового мозку зі щільними мононуклеарно-макрофагально-плазмоцитарними інфільтратами, з домішкою нейтрофілоцитів, які мали зливний характер та/чи поєднувалися з відкладеннями фібрину та фібриноїдними некрозами сполучної тканини та дрібних судин — така гістологічна картина, за нашою оцінкою, відповідала високому ступеню активності ревматоїдного запалення (рис. 7).
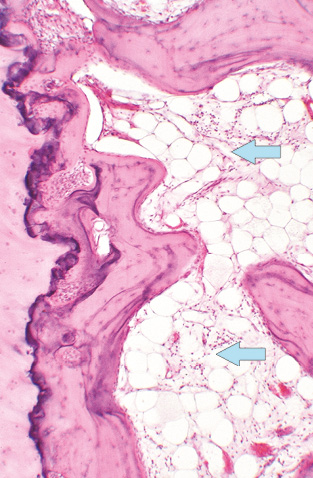
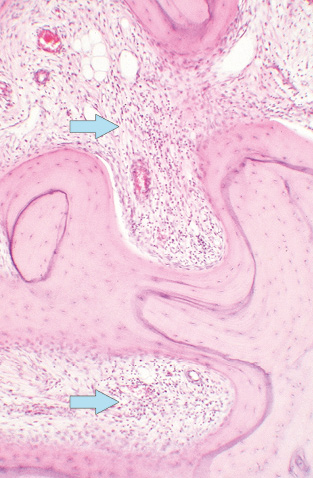
У багатьох випадках патологічні зміни втілювалися у потоншенні субхондріальної кісткової пластинки та перекладок безпосередньо прилеглих до неї ділянок спонгіози ГСК. При цьому були наявні прояви різної активності перебудови кісткової тканини, зокрема фаз остеорезорбції та остеогенезу (рис. 8).
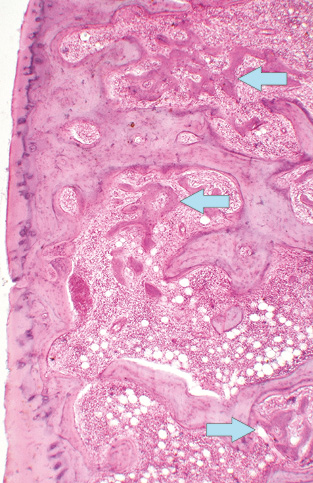
Частота наявності певних патологічних змін у тканинах кульшового суглоба та середні величини ГМС-показників голівки. Для фрагментів резектованих тканин кульшових суглобів хворих на РА було визначено низку напівкількісних морфологічних показників, які характеризують стан патологічних процесів у тканинах. Основними об’єктами напівкількісного морфометричного дослідження були СК, СХ ГСК та субхондріальна кісткова пластинка суглобової поверхні. Дані частотного аналізу випадків з певними градаціями патологічних змін СК та ГСК та середні параметри показників ГМС див. табл. 1.
За вираженістю показника «ворсинчасті розростання синовіального шару» більшість випадків відповідали низькому ступеню. Дещо частіше (до 40%) траплялися випадки, де ступінь «активності запалення у синовіальному шарі» виявився високим. За «вираженістю ДДЗ тканин суглобової поверхні» переважна більшість випадків відповідала високому ступеню, а за показником «активність запалення у субхондріальній спонгіозі» переважали випадки з ознаками низької активності.
Зіставлення частот наявності випадків з різною вираженістю ДДЗ суглобової поверхні свідчить, що ці зміни у більшості випадків перевищували ступінь вираженості запалення як у СК, так і у субхондріальній спонгіозі ГСК. Можна припустити, що в процесі прогресування ДДЗ відіграють роль не лише порушення трофіки, пов’язані безпосередньо з активністю запалення, але і деякі інші фактори, зокрема фактор порушення біомеханіки кульшового суглоба та перевантаження суглобової поверхні.
Кореляційні залежності між окремими морфологічними показниками стану тканин кульшового суглоба. Більшість пар непараметричних показників стану тканин кульшового суглоба були пов’язані між собою слабкими або дуже слабкими зв’язками (табл. 2). Лише дві пари показників мали тісний зв’язок у діапазоні абсолютних значень коефіцієнта асоціації >0,3:
- «ворсинчасті розростання синовіального шару СК» — «активність запалення у синовіальному шарі СК» — залежність позитивна, слабкої тісноти, невірогідна за наявної кількості спостережень. Це означає, що майже у 40% всіх випадків високий ступінь вираженості ворсинчастих розростань синовіального шару СК поєднується з високою активністю запалення у синовіальному шарі, і навпаки;
- «вираженість ДДЗ у тканинах суглобової поверхні ГСК» — «активність запалення у субхондріальній спонгіозі ГСК» — залежність позитивна, слабкої тісноти, вірогідна з імовірністю помилки р<0,1 за наявної кількості спостережень. Це означає, що у понад 40% всіх випадків високий ступінь вираженості ДДЗ у тканинах суглобової поверхні голівки поєднується з високою активністю запалення у субхондріальній спонгіозі голівки, і навпаки.
Таблиця 2
Кореляційні зв’язки між окремими морфологічними показниками стану тканин кульшового суглоба хворих на РА
| Перший морфологічний показник | Другий морфологічний показник | Кількість пар параметрів, n | Коефіцієнт асоціації Пірсона | ||
|---|---|---|---|---|---|
| rа | tr | р | |||
| Ворсинчасті розростання синовіального шару СК | Активність запалення у синовіальному шарі СК | 13 | +0,386 | 1,508 | НВ |
| Ворсинчасті розростання синовіального шару СК | ДДЗ у тканинах суглобової поверхні ГСК | 9 | +0,286 | 0,894 | НВ |
| Ворсинчасті розростання синовіального шару СК | Активність запалення у субхондріальній спонгіозі ГСК | 9 | –0,060 | 0,180 | НВ |
| Активність запалення у синовіальному шарі СК | ДДЗ у тканинах суглобової поверхні ГСК | 9 | –0,060 | 0,180 | НВ |
| Активність запалення у синовіальному шарі СК | Активність запалення у субхондріальній спонгіозі ГСК | 9 | –0,100 | 0,302 | НВ |
| ДДЗ у тканинах суглобової поверхні ГСК | Активність запалення у субхондріальній спонгіозі ГСК | 16 | +0,424 | 1,871 | <0,1 |
rа — значення коефіцієнта асоціації; tr — фактичне значення критерію Стьюдента при оцінці значення rа; р — ймовірність помилки при оцінці значення показника кореляції; НВ — значення коефіцієнта асоціації невірогідне.
Кореляційні залежності між морфологічними показниками стану тканин кульшового суглоба та показниками ГМС ГСК. Результати кореляційного аналізу залежностей між ГМС-показниками ГСК та морфологічними показниками основних патологічних процесів у тканинах кульшового суглоба зазначено у табл. 3.
Таблиця 3
Кореляційні зв’язки між окремими показниками ГМС ГСК та морфологічними показниками
стану тканин кульшового суглоба хворих на РА
| ГМС-показник | Морфологічний показник | Кількість пар пара-метрів, n | Коефіцієнт асоціації Пірсона | ||
|---|---|---|---|---|---|
| rа | tr | р | |||
| Кістковий об’єм BV/TV% | Вираженість ДДЗ у тканинах суглобової поверхні ГСК | 16 | +0,545 | 2,598 | <0,05 |
| Відносна остеоїдна поверхня OS/BS% | Ворсинчасті розростання синовіального шару СК | 13 | +0,433 | 1,732 | НВ |
| Відносна остеоїдна поверхня OS/BS% | Вираженість ДДЗ у тканинах суглобової поверхні ГСК | 16 | +0,424 | 1,871 | <0,1 |
| Остеокластичний індекс: кількість клітин на одиницю площі зрізу NOc/TAr1/мм | Ворсинчасті розростання синовіального шару СК | 13 | –0,318 | 1,207 | НВ |
| Остеокластичний індекс: кількість клітин на одиницю площі зрізу NOc/TAr1/мм | Активність запалення у синовіальному шарі СК | 13 | +0,300 | 1,134 | НВ |
| Остеокластичний індекс: кількість клітин на одиницю сумарної довжини перетину поверхні кісткових трабекул зрізу NOc/TS1/мм | Ворсинчасті розростання синовіального шару СК | 13 | –0,426 | 1,698 | НВ |
До таблиці уведено лише пари показників з параметром коефіцієнта асоціації |>=0,3| незалежно від знака та ступеня вірогідності. rа — значення коефіцієнта асоціації; tr — фактичне значення критерію Стьюдента при оцінці значення rа; р — імовірність помилки при оцінці значення показника кореляції; НВ — значення коефіцієнта асоціації невірогідне.
Лише одна пара показників виявила коефіцієнт асоціації в діапазоні значень середньої сили, всі інші — у діапазоні значень слабких або дуже слабких, та не вірогідних. Враховуючи найбільші абсолютні значення коефіцієнта асоціації (>0,3), можна виділити такі пари показників, що корелюють:
- «кістковий об’єм» — «вираженість ДДЗ у тканинах суглобової поверхні голівки» — залежність позитивна, середньої тісноти, вірогідна (p<0,05). Це означає, що у більше ніж половині всіх випадків високий ступінь вираженості ДДЗ суглобової поверхні голівки вірогідно поєднується з високими значеннями «кісткового об’єму спонгіози», і навпаки. Така залежність уявляється природною, бо погіршення біомеханічних властивостей СХ та субхондріальної кісткової пластинки ГСК викликає компенсаторне збільшення кісткової маси трабекул спонгіози у глибоких відділах голівки;
- «відносна остеоїдна поверхня» — «вираженість ДДЗ у тканинах суглобової поверхні голівки» — залежність позитивна, слабкої тісноти, вірогідна (p<0,1). Це означає, що у >40% випадків високий ступінь ДДЗ суглобової поверхні поєднується з високими значеннями «відносної остеоїдної поверхні спонгіози», яка відображає активність кісткоутворення, і навпаки. Виявлена залежність свідчить про активізацію остеогенезу у трабекулах глибоких відділів спонгіози голівки — як компонент компенсаторної реакції на погіршення біомеханічних властивостей тканин суглобової поверхні ГСК;
- «відносна остеоїдна поверхня» — «ворсинчасті розростання синовіального шару СК» — залежність позитивна, слабкої тісноти, невірогідна за наявної кількості спостережень. Це означає, що у >40% випадків високий ступінь вираженості ворсинчастих розростань у синовіальному шарі СК поєднується з високими значеннями «відносної остеоїдної поверхні спонгіози», яка відображає активність кісткоутворення, і навпаки; тобто залежність відображає сполученість продуктивних репаративних процесів як у СК, так і у спонгіозі глибоких відділів ГСК;
- «остеокластичний індекс: кількість клітин на одиницю площі» — «активність запалення у синовіальному шарі СК» — залежність позитивна, слабкої тісноти, невірогідна за наявної кількості спостережень. Це означає, що у 30% усіх випадків високий ступінь активності запалення у синовіальному шарі СК поєднується з високими значеннями остеокластичного індексу, визначеному як кількість остеокластів на одиницю площі вимірювання у спонгіозі, і навпаки; така залежність свідчить, що активність остеорезорбції у спонгіозі ГСК поєднується з активністю запалення у СК — навіть тісніше, ніж з активністю запалення у кістковому мозку субхондріальної пластинки ГСК. Цей важливий факт раніше уявлявся неочевидним;
- «остеокластичний індекс: кількість клітин на одиницю площі» — «ворсинчасті розростання синовіального шару СК» — залежність негативна, слабкої тісноти, невірогідна за наявної кількості спостережень. Це означає, що у >30% всіх випадків високий ступінь вираженості ворсинчастих розростань синовіального шару СК поєднується з низькими значеннями остеокластичного індексу, визначеному як кількість остеокластів на одиницю площі вимірювання у спонгіозі глибоких відділів ГСК, і навпаки;
- «остеокластичний індекс: кількість клітин на одиницю сумарної довжини перетину поверхні трабекул спонгіози» — «ворсинчасті розростання синовіального шару СК» — залежність негативна, слабкої тісноти, невірогідна за наявної кількості спостережень. Це означає, що у >40% усіх випадків високий ступінь вираженості ворсинчастих розростань синовіального шару СК сполучається з низькими значеннями остеокластичного індексу, визначеному як кількість остеокластів на одиницю сумарної довжини перетину поверхні трабекул спонгіози, і навпаки. Вперше встановлені негативні залежності між ГМС-показниками, що відображають активність остеорезорбції у спонгіозі глибоких відділів ГСК, та показником, що відображає вираженість проліферативних процесів у СК кульшового суглоба, можна пояснити як прояви різноспрямованих процесів: з одного боку — остеорезорбції у спонгіозі ГСК, з іншого — проліферативних процесів у СК.
Обговорення результатів
Вже понад півстоліття відомі характерні патологічні зміни в уражених тканинах суглобів хворих на РА. Поступово дослідники дійшли необхідності згрупувати окремі прояви патології тканин суглоба для одержання об’єктивної різнобічної характеристики ураження. Низку досліджень було присвячено відпрацюванню квантифікації показників вираженості гістологічних змін у тканинах уражених суглобів за РА порівняно з іншими нозологіями.
Найдокладніші аналітичні дослідження синовіальних структур включають від 6 до 10 критеріїв-показників, за якими проводиться оцінка ступеня ураження. Враховують такі: 1) зміни шару синовіоцитів; 2) проліферацію; 3) імуноморфологічні ознаки; 4) запально-ексудативні ознаки; 5) судинні зміни; 6) дезорганізація сполучної тканини; 7) зміни клітинних ядер; 8) реакція тканинних базофілів; 9) склероз, гіаліноз; 10) депозити (Fonseca J.E. et al., 2000; Krenn V. et al., 2006; Лялина В.В., Шехтер А.Б., 2007).
Застосування напівкількісних критеріїв, що дозволяють отримати сумарний «рахунок балів синовіту» забезпечило проведення деяких диференційних досліджень, у яких було визначено кількісні відмінності ступеня активності синовіту різних нозологій. Так, «рахунки балів синовіту» суттєво розрізнялися між групами захворювань, особливо між дегенеративними та ревматичними захворюваннями суглобів. Синовіт високого ступеня був сильно асоційований із ревматичними захворюваннями; при цьому медіана «рахунку балів» корелювала з клінічними діагнозами: у контролі — 1,0, посттравматичний артрит — 2,0, псоріатичний артрит — 3,5, реактивний артрит — 5,0, РА — 5,0 (Krenn V. et al., 2006). Деякі автори вважають, що інтенсивність гістологічних ознак запалення та особливо значна частка судин з периваскулярними лімфоцитарними інфільтратами можуть мати прогностичне значення при РА. Вірогідні відмінності середніх величин «рахунку балів» виявлено між синовітами при РА та остеоартрозі, а також між іншими запальними захворюваннями та остеоартрозом (p<0,01). Середня величина «загального рахунку» для РА була більша, ніж за інших запальних захворювань, але невірогідно, а також більша за таку при РА з ерозіями суглобової поверхні порівняно з РА без ерозій (Koizumi F., Matsuno H. et al., 1999; Fonseca J.E. et al., 2000).
Окремі патогістологічні дослідження присвячено визначенню інформативності біоптатів СК, одержаних різними способами: сліпою троакарною біопсією, артроскопічною біопсією та відкритою інцизійною біопсією під час ендопротезування суглоба. Так, встановлено, що результати кількісного аналізу запальних змін тканин суглоба: товщини покривного шару синовіоцитів, Т-клітинної інфільтрації та васкуляризації власної синовіальної пластинки — є досить точними, якщо оцінюються в обмеженій кількості полів зору мікроскопа (Bresnihan B. et al., 1998). У дослідженні, проведеному на матеріалі артроскопічних біопсій від хворих на РА з ураженням колінного суглоба, виявлено, що між показниками тяжкості ураження за даними гістологічного дослідження та ступенем локального пошкодження суглоба за клінічними, радіологічними і артроскопічними проявами кореляції не виявлено (Henderson D.R.F. et al., 1975).
Застосування напівкількісних бальних оцінок активності запалення дало змогу з’ясувати відмінності у зразках СК, відібраних при артроскопії порівняно зі зразками, одержаними при сліпій голковій біопсії. Встановлено, що більшість мікроскопічних вимірів стану запалення у зразках СК, одержаних сліпим методом, були зіставними з тими, які взято при артроскопії. Однак вимірювання у зразках, одержаних сліпим методом у супрапателярній ділянці, може недооцінювати ступінь інтенсивності макрофагальної інфільтрації тканин, прилеглих до СХ (Youssef P.P. et al., 1998).
У роботі T.J.M. Smeets та співавторів (2001) показано, що лімфоцити, макрофаги та фібробластоподібні синовіоцити — основні клітинні типи в ділянці хрящ-панусного з’єднання. Експресія матриксних металопротеїназ (ММР) макрофагами, особливо ММР-3, була високою, а патологічні зміни, які відзначають у ділянках хрящ-панусного з’єднання у кінцевій стадії РА, добре відображали перехід у процес, при якому макрофаги, фібробластоподібні синовіоцити та клітини іншого типу відіграють основну роль у патогенезі ураження суглобової поверхні кістки.
В іншому патоморфологічному дослідженні встановлено, що TRAP-позитивні (тартрат-резистентна кисла фосфатаза) та катепсин-позитивні остеокласти виявляються одночасно на синовіальній та кістковомозковій поверхнях суглобового кінця кістки. Зразки кісткового мозку, де визначали вищий ступінь запалення, характеризувалися вірогідно збільшеною кількістю остеокластів, прикріплених до кісткових поверхонь субхондріальної кісткової тканини (Bugatti S. et al., 2005).
Результати досліджень тканин, видалених із ділянок кістка-панус у хворих на РА, та у тварин з експериментальним артритом, свідчать, що остеокласти, які беруть участь у фізіологічній остеорезорбції, відповідальні за деструкцію кісткової тканини суглобової поверхні. Виявлено, що, хоча попередники остеокластів наявні всередині мікросередовища кістки на місцях патологічної остеорезорбції, клітини, які повністю експресують морфологічні та функціональні властивості зрілих остеокластів, обмежені безпосередньо кістковою пластинкою та прилеглим звапненим хрящем. Ці дані доводять, що, на доповнення до дії специфічних цитокінів, результатом взаємодії попередників остеокластів з цими мінералізованими матрицями (хрящ, кістка) є активація специфічних сигнальних шляхів, які є суттєвими для кінцевої диференціації та активації остеокластів (McHugh K.P. et al., 2010).
Що стосується патогенезу запального процесу у тканинах СК та суглобової поверхні за РА, то вже давно відомо про роль окремих клітинних ліній та цитокінів у формуванні клітинних інфільтратів і агрегатів, що передують реакціям пошкодження. Серед клітинних ліній найбільшого значення надають макрофагам, які концентруються у синовіальному покриві та прилеглих ділянках власної синовіальної пластинки СК, а також, якщо йдеться про ділянку хрящ-панусного з’єднання у тканині суглобової поверхні, є багато даних про роль фібробластоподібних синовіоцитів як складової частини проліферуючої тканини пануса у процесах пошкодження хрящового матриксу (Smeets T.J.M. et al., 2001; Hale L.P., 2005; Bartok B., Firestein G.S., 2010; Раденска-Лоповок С.Г., 2013).
В останні роки в міру ідентифікації нових патогенетичних факторів розширюється група про- і антизапальних цитокінів, що відіграють роль у патогенезі хронічних імуномедійованих ревматичних захворювань, включно РА. Це насамперед представники сімейства IL-1 (IL-33, -36, -37, -38), IL-12 (IL-23, -27, -35, -39), а також IL-32 та IL-34. У хворих на РА підвищений рівень IL-33 у сироватці крові порівняно зі здоровими особами та з іншими захворюваннями неревматоїдної етіології. Деякі представники цього сімейства цитокінів (IL-37, IL-38) зумовлюють протизапальну, інші (IL-36, -6, -8, -17, -22), навпаки, прозапальну дію, хоча за ефектом такого впливу поступаються дії цитокіну IL-1. До важливих прозапальних цитокінів належать також IL-12 та -23, водночас IL-27 виявляє протизапальну дію. Такий фактор, як IL-32, бере участь у низці біологічних функцій: диференціюванні та загибелі клітин, зокрема апоптозі, стимуляції про- та протизапальних цитокінів (Alunno A. et al., 2017).
З багатьох досліджень, виконаних за допомогою різних методик, відомо, що за РА відбуваються системні зміни кісткової тканини. Так, методами УЗ- та рентгенівської абсорбціометрії встановлено, що властивості кістки були погіршені у хворих на РА — порівняно з контролем (Haugeberg G. et al., 2003). В іншій роботі виявлено, що розвиток системного остеопорозу у пацієнтів з РА виникає у 71% хворих; відзначають наростання остеопорозу в осіб віком 41–76 років, особливо у жінок, які перебувають у прямій залежності від давності захворювання (Курята А.В. и соавт., 2006).
Найціннішими вважаємо роботи, в яких проаналізовано відмінності та залежності величин, асоційованих із мінеральною щільністю кісткової тканини (МЩКТ), яку вимірювали методом подвійної рентгенівської абсорбціометрії у пацієнтів з РА. Асоціації між демографічними та клінічними вимірюваннями, з одного боку, та МЩКТ — з іншого боку, вивчали методом регресійного аналізу. Виявлено, що старший вік та менша маса тіла корелювали з МЩКТ стегнової кістки та хребців; застосування кортикостероїдів не було незалежно асоційованим з МЩКТ; виявлено також асоціацію між високим ступенем вираженості рентгенологічних ознак РА-пошкодження та низьким значенням МЩКТ стегнової кістки, що дозволяє зробити припущення про асоціацію між тяжкістю РА і ризиком генералізованої втрати кісткової маси, що також відбувається у пацієнтів, які не застосовували кортикостероїдів (Lodder M. et al., 2004).
Окремі дослідження властивостей системної кісткової тканини хворих на РА проводили на матеріалі іліобіоптатів із визначенням показників ГМС. При цьому за РА, порівняно з контролем, зменшено загальний об’єм трабекул,збільшено об’єм остеоїду та знижено ступінь мінералізації, до того ж помітно підвищена активність остеорезорбції. І хоча показано, що зростала активність кісткоутворення, основну роль автори вбачають у підвищенні активності остеорезорбції за рахунок посилення функціональної активності остеокластів (Алякна В. та співавт., 1999).
Втім, робіт щодо вивчення властивостей параартикулярної спонгіози у ділянках, які знаходяться поза межами найвищої активності ревматоїдного запалення (у нашому дослідженні — у глибоких ділянках спонгіози ГСК), дуже мало. Так, застосовуючи метод цифрової рентгенорадіограмметрії, виявлено, що періартикулярний остеопороз при РА має різні причини: генералізовану втрату кісткової тканини, яка може бути наслідком втрати мобільності, власне запальний процес і/або лікування стероїдами, та периваскулярну демінералізацію. Остання, можливо, пов’язана з локальним вивільненням запальних агентів (Böttcher J., Pfeil A., 2008).
Внаслідок проведеного дослідження, де у хворих на РА вивчали кореляції рентгенологічних показників ураження суглобових поверхонь та клініко-лабораторних показників: рівня гемоглобіну, швидкості осідання еритроцитів, С-реактивного протеїну, орозомукоїда, імуноглобулінів (Ig)G, M, A, ревматоїдного фактора, встановлено, що частина показників, зокрема С-реактивного протеїну та гемоглобіну, виявляли значну асоціацію з вираженістю рентгенопоказників ерозування лише на пізніх стадіях РА. Інші показники: IgG, IgM та IgA — не виявляли ніякої вірогідної кореляції з рентгенологічними показниками (Larsen A., 1988).
У проведених нами попередніх дослідженнях внаслідок вивчення морфології тканин кульшових суглобів у хворих на РА з віддаленими проявами деструкції тканин кульшових суглобів виявлено патологічні зміни, які відповідають ДДЗ певної стадії. Виявляли дистрофію матриксу, хондронекрози, деформації, механічне руйнування та зменшення товщини СХ, остеохондрорезорбцію у глибокій ділянці СХ та субхондральній кістці, ознаки репарації у вигляді проліферації хондроцитів. Спонгіоза ГСК виглядала порозною, містила частіше дрібні, проте іноді великі інтерстиційні остеонекрози та сліди численних циклів перебудови, у кістковомозкових порожнинах спостерігали фіброзування та утворення ендостальних губчастих кісткових регенератів (Григоровський В.В., Герасименко А.С., 2011; Григоровський В.В. та співавт., 2015).
Результати кореляційного аналізу зв’язків між окремими клінічними та лабораторними показниками, з одного боку, та ГМС-показниками суглобових кінців стегнової кістки (голівки та дистального епіфіза), з іншого, свідчать про відносно малу кількість пар показників із вірогідними значеннями коефіцієнта кореляції. Слід підкреслити, що вірогідні значення коефіцієнта кореляції для різних суглобових кінців стегна (голівка, дистальний епіфіз) спостерігаються у різних парах показників «клініка — ГМС»: для ГСК залежність між ступенем функціональної недостатності суглоба та «остеокластичним індексом» негативна, середньої сили, водночас ступінь функціональної недостатності суглобів виявляє негативну залежність середньої сили з «остеокластичним індексом» (Григоровський В.В. та співавт., 2015).
Виявлені у представленій нами роботі кореляційні залежності між показниками патологічних змін у тканинах кульшового суглоба і ГМС-показниками спонгіози ГСК розширюють наші знання про поєднаність, зв’язок певних проявів патології, що дає можливість використати знання цих залежностей для прогнозування поведінки одних, невідомих, показників за відомими значеннями інших. Подібні залежності раніше були не очевидні, а тепер можуть бути покладені в основу розробки, наприклад, алгоритмів прогнозування стану тканин ГСК за результатами біопсійного дослідження тканин СК.
ВИСНОВКИ
1. У тканинах кульшового суглоба хворих на РА, яким виконано тотальне ендопротезування, внаслідок патоморфологічного дослідження виявлено низку патологічних змін, які відображають різні патологічні процеси: хронічне продуктивне запалення з імунним компонентом, гіпертрофічні розростання синовіального шару СК, ДДЗ СХ та субхондріальної кісткової пластинки, хронічне продуктивне запалення у кістковомозкових порожнинах спонгіози голівки. Ступінь вираженості окремих морфологічних показників, які відображають стан патологічних змін та активність патологічних процесів, у рамках одного клінічного спостереження варіює.
2. Гістоморфометричні показники характеризують стан спонгіози глибоких відділів ГСК і відображають різні властивості губчастої кісткової тканини: загальний об’єм трабекул кісткової тканини, частку немінералізованого остеоїду на поверхні кісткових перекладок, активність процесу остеокластичної резорбції, перебіг якої відбувається на поверхнях трабекул.
3. Між морфологічними показниками патологічних змін тканин кульшового суглоба: СК, СХ, субхондріальної кісткової пластинки та кісткового мозку, з одного боку, та ГМС-показниками стану спонгіози ГСК існують кореляційні залежності, які раніше були невідомими та/чи неочевидними, та на основі яких можна прогнозувати вираженість одних показників стану тканин за іншими, невідомими показниками ураження.
Список використаної літератури
- Алякна В., Мацкявичус З., Черемных Е. (1999) Структурные изменения костей (по данным гистоморфометрического анализа) у больных ревматоидным артритом и остеоартрозом. Проблеми остеології, 2 (1): 28–31.
- Григоровський В.В., Герасименко А.С. (2011) Гістопатологія тканин кульшового та колінного суглобів, гістоморфометричні показники і деякі кореляційні залежності спонгіози голівки та дистального епіфіза стегнової кістки хворих на ревматоїдний артрит. Укр. ревматол. журн., 4(67): 19–25.
- Григоровський В.В., Герасименко А.С., Панченко Л.М., Лютко О.Б. (2015) Кореляції гістоморфометричних показників спонгіози суглобових кінців стегнової кістки і результатів клінічних та лабораторних досліджень у хворих на ревматоїдний артрит. Ортопед. травматол., (3): 36–45.
- Курята А.В., Караванская И.А., Фролова Е.А., Павлова И.В. (2006) Частота развития системного остеопороза при ревматоидном артрите. Пробл. остеології, 9(2–3): 31–32.
- Лялина В.В., Шехтер А.Б. (2007) Артроскопия и морфология синовитов. Наука, Москва, с. 24–28.
- Раденска-Лоповок С.Г. (2013) Клеточные и цитокиновые маркеры в синовиальной оболочке при ревматоидном артрите. Арх. патологии, 5: 58–62.
- Alunno A., Carubbi F., Giacomelli R., Gerli R. (2017) Cytokines in the pathogenesis of rheumatoid arthritis: new players and therapeutic targets. BMC Rheumatology, 1(3): 1–13.
- Bartok B., Firestein G.S. (2010) Fibroblast-like synoviocytes: key effector cells in rheumatoid arthritis. Immunol. Rev., 233(1): 233–255.
- Böttcher J., Pfeil A. (2008) Diagnosis of periarticular osteoporosis in rheumatoid arthritis using digital X-ray radiogrammetry. Arthritis Res. Ther., 10(1): 103.
- Bresnihan B., Cunnane G., Youssef P. et al. (1998) Microscopic measurement of synovial membrane inflammation in rheumatoid arthritis: proposals for the evaluation of tissue samples by quantitative analysis. Brit. J. Rheumatol., 37(6): 636–642.
- Bugatti S., Caporali R., Manzo A. et al. (2005) Involvement of subchondral bone marrow in rheumatoid arthritis: lymphoid neogenesis and in situ relationship to subchondral bone marrow osteoclast recruitment. Arthritis Rheum., 52(11): 3448–3459.
- Fonseca J.E., Canhao H., Resende C. et al. (2000) Histology of synovial tissue: value of semiquantitative analysis for the prediction of joint erosions in rheumatoid arthritis. Clin. Exper. Rheumatol., 18(5): 559–564.
- Hale L.P. (2005) Pathology of Rheumatoid Arthritis and Associated Disorders. In: W.J. Koopman, L.W. Moreland (Eds.) Arthritis and Allied Conditions. A textbook of Rheumatology. 15-th Ed., Vol. 1, Lippincott Williams and Wilkins, Philadelphia, p. 1117–1140.
- Haugeberg G., Ørstavik R.E., Uhlig T. et al. (2003) Comparison of ultrasound and X-ray absorptiometry bone measurements in a case control study of female rheumatoid arthritis patients and randomly selected subjects in the population. Osteoporos. Int., 14(4): 312–319.
- Henderson D.R.F., Jayson M.I.V., Tribe C.R. (1975) Lack of correlation of synovial histology with joint damage in rheumatoid arthritis. Ann. Rheum. Dis., 34(1): 7–11.
- Koizumi F., Matsuno H., Wakaki K. et al. (1999) Synovitis in RA: scoring of characteristic histopathological features. Pathol. Int., 49(4): 298–304.
- Krenn V., Morawietz L., Burmester G-R. et al. (2006) Synovitis score: discrimination between chronic low-grade and high-grade synovitis. Histopathology, 49: 358–364.
- Larsen A. (1988) The relation of radiographic changes to serum acute-phase proteins and rheumatoid factor in 200 patiens with rheumatoid arthritis. Scand. J. Rheumatol., 17(2): 123–129.
- Lodder M., de Jong Z., Kostense P. et al. (2004) Bone mineral density in patients with rheumatoid arthritis: relation between disease severity and low bone mineral density. Ann. Rheum. Dis., 63(12): 1576–1580.
- Malluche H.H., Faugere M.-C. (1986) Atlas of Mineralized Bone Histology. Karger, Basel, 136 p.
- McHugh K.P., Shen Z., Crotti T.N. et al. (2010) The role of cell-substrate interaction in regulating osteoclast activation: potential implications in targeting bone loss in rheumatoid arthritis. Ann. Rheum. Dis., 69(Suppl. 1): i83–85.
- Meunier P.J. (2000) Гистоморфометрия кости. В кн.: Б.Л. Риггз, Л.Дж. Мелтон III (ред.) Остеопороз. Этиология, диагностика, лечение (Пер. с англ.). БИНОМ, Невский диалект, Санкт-Петербург, с. 321–344.
- Parfitt A.M. (1988) Bone histomorphometry: proposed system for standardization of nomenclature, symbols and units. Calcif. Tiss. Int., 42(5): 284–286.
- Smeets T.J.M., Kraan M.C., Galjaard S. et al. (2001) Analysis of the cell infiltrate and expression of matrix metalloproteinases and granzyme B in paired synovial biopsy specimens from the cartilage-pannus junction in patients with rheumatoid arthritis. Ann. Rheum. Dis., 60: 561–565.
- Soren A. (1993) Arthritis and Related Affections. Clinic, Pathology, and Treatment. Springer-Verlag, Berlin, p. 162–190.
- Youssef P.P., Kraan M., Breedveld F. et al. (1998) Quantitative micriscopic analysis of inflammation in rheumatoid arthritis synovial membrane samples selected at arthroscopy compared with samples obtained blindly by needle biopsy. Arthritis Rheum., 41(4): 663–669.
МОРФОЛОГИЧЕСКИЕ ПОКАЗАТЕЛИ ПАТОЛОГИЧЕСКИХ ИЗМЕНЕНИЙ ТАЗОБЕДРЕННОГО СУСТАВА, ИХ ЧАСТОТА И КОРРЕЛЯЦИОННЫЕ ЗАВИСИМОСТИ между ПОКАЗАТЕЛЯМИ ГИСТОМОРФОМЕТРИИ СПОНГИОЗЫ ГОЛОВКИ БЕДРЕННОЙ КОСТИ У БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ
Резюме. Цель исследования — используя систему полуколичественных градационных показателей патологических изменений тканей тазобедренного сустава (воспалительных, дистрофических, репаративных и т.п.) и гистоморфометрии спонгиозы (ГМС), определить частоту случаев определенной градации и корреляционные связи между отдельными показателями состояния суставной капсулы и головки бедренной кости у больных ревматоидным артритом (РА), которым удаляли фрагменты пораженных суставов. Материалом исследования послужили костные и мягкотканные фрагменты тазобедренных суставов 20 больных РА. В результате гистологического исследования определен ряд непараметрических морфологических показателей. ГМС головки бедренной кости включала четыре показателя, отражающих различные количественные свойства спонгиозы. Результаты. В тканях тазобедренного сустава выявлен ряд гистологических изменений, отражающих различные патологические процессы: хроническое продуктивное воспаление с иммунным компонентом, гипертрофические разрастания синовиального слоя суставной капсулы, дистрофически-деструктивные изменения. Степень выраженности морфологических показателей варьирует от случая к случаю и они могут по-разному коррелировать между собой и с параметрами показателей ГМС. Выводы. Между морфологическими показателями состояния тканей тазобедренного сустава: синовиального слоя капсулы, суставного хряща, субхондриальной костной пластинки и костного мозга, с одной стороны, и ГМС-показателями состояния спонгиозы головки бедренной кости — с другой стороны, существует корреляционная зависимость, на основе которой можно прогнозировать выраженность одних показателей состояния тканей по иным, известным показателям поражения.
ревматоидный артрит, тазобедренный сустав, патоморфология, гистоморфометрия спонгиозы головки бедренной кости, корреляционные зависимости.
Адреса для листування:
Григоровський Валерій Володимирович
01601, Київ, вул. Бульварно-Кудрявська, 27
ДУ «Інститут травматології та ортопедії НАМН України»,
відділ патоморфології
E-mail: val_grigorov@bigmir.net

Leave a comment