АТЕРОТРОМБОЗ ТА ОСНОВНІ ЗАКОНОМІРНОСТІ ЕВОЛЮЦІЇ ГРАНУЛЕМАТОЗНОГО ЗАПАЛЕННЯ
Резюме. У роботі наведено характеристику атеротромбозу як наслідку фази некрозу, що розвивається в процесі еволюції гранулематозного запалення в інтимі артерій.
Инфаркт миокарда (ИМ) и ишемический инсульт, часто регистрируемые заболевания в нашей стране, преимущественно являются следствием атеротромбоза. Поэтому актуально и важно рассмотреть этот процесс с точки зрения воспалительной природы локальных изменений при атеросклерозе (Ат).
Природа Ат
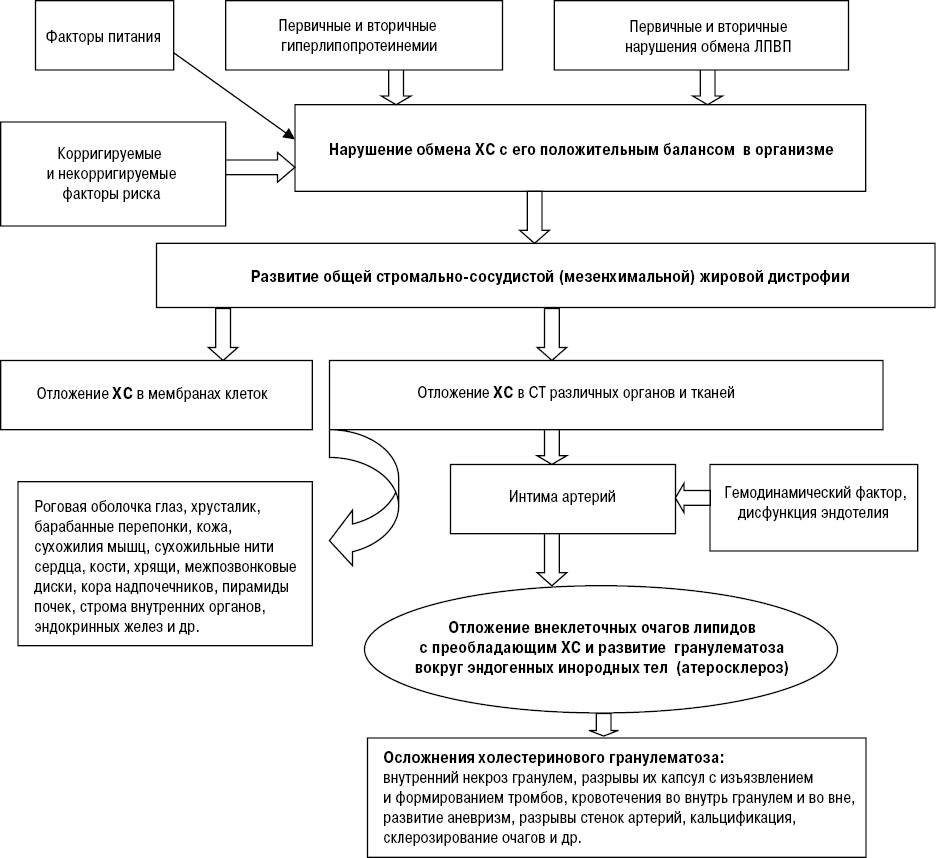
В этом заболевании сочетаются нарушения жирового обмена и «повреждения» эндотелия в гемодинамически уязвимых местах артерий. Известно, что Ат — следствие нарушения обмена холестерина (ХС) и его эфиров в организме [1], выражающееся в развитии стромально-сосудистой жировой дистрофии (или липидно-белковой, или холестериноза) [7, 14]. Характеристики данной дистрофии: мезенхимальная (изменения преобладают в мезенхиме — строме), по распространенности — генерализованная (общая), по происхождению — наследственная или приобретенная. Она проявляется депонированием внеклеточного ХС в соединительной ткани (СТ) организма, включая СТ внутренней оболочки артерий крупного и среднего калибра, эластического и мышечно-эластического типов. Эта дистрофия, как проявление нарушения обмена ХС, полиэтиологична; Ат же представляет собой ее частное проявление (рис. 1). Второе условие развития Ат — «повреждение» эндотелия, наблюдается в гемодинамически уязвимых участках артерий, имеет генетические корни и обусловливает однотипную локализацию поражений у всех людей. Тот факт, что депонирующийся внеклеточно в интиме артерий ХС, будучи для нее чужеродным (инородным) телом, индуцирует пролиферативное (или продуктивное) гранулематозное воспаление, позволяет развивающийся Ат считать и осложнением дистрофии. По характеру воспаления в интиме артерий Ат входит в число гранулематозных болезней — гранулематозов, индуцированных инородными телами. Из сказанного выше вытекает, что Ат принадлежит к болезням обмена веществ, хотя он включен в число заболеваний артерий. Это также болезнь неспецифического иммунитета, следствие незавершенности фагоцитоза внеклеточного ХС макрофагами (МФ). Приведенная выше информация показывает содержание реальной унитарной теории Ат: это частное проявление (осложнение) стромально-сосудистой (мезенхимальной) жировой дистрофии, сопровождающейся отложением в гемодинамически уязвимых участках артерий среднего и крупного калибра, эластического и мышечно-эластического типов депозитов липидов с преобладающим в них ХС и индукцией гранулематоза вокруг этих инородных тел (см. рис. 1).
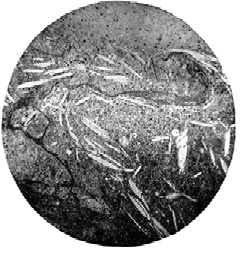
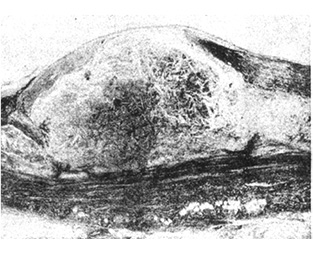
Образование воспалительных гранулем как вокруг введенного в ткани животных ХС в эксперименте, так и в стенках артерий человека объясняется тем, что его молекула отличается уникальным сочетанием ряда структурных особенностей, самой важной из которых является жесткий циклический углеводородный скелет, не разрушаемый лизосомальными ферментами МФ. Эта особенность, известная биохимикам, сочетается с нерастворимостью и химико-физическим метаморфозом ХС в сосудистой стенке: его эфиры, представляющие собой жидкие кристаллы, в интиме расщепляются на жирные кислоты и свободный ХС, который вне клеток принимает форму пластинчатых или игольчатых кристаллов (рис. 2 и 3) [1, 4, 8]. Количество твердых кристаллов ХС в интиме артерий прогрессирующе нарастает по мере развития Ат [1, 4]. В процессе индуцированного частицами ХС воспаления возникают гранулемы — узелки, бугорки, в центре которых преимущественно содержатся аморфные массы и кристаллы внеклеточного ХС. Такой процесс представляет собой гранулематоз вокруг эндогенных инородных тел [10, 13]. Образующиеся плотные гранулемы желтовато-белого цвета имеют различные размер и форму, относительно ровные края, содержат желтоватое ядро — нередко кашицеобразную массу, дегенерирующие клетки, эфиры ХС, его кристаллы, фосфолипиды, триглицериды и др. Гранулемы часто сливаются, придают бугристый вид внутренней поверхности крупных артерий и особенно аорты (рис. 4); в дальнейшем они претерпевают такую же эволюцию, как и гранулемы других этиологий, включая внутренний некроз, склерозирование, кальцификацию. Вокруг ядра гранулемы под капсулой («покрышкой») и по бокам от нее содержится смесь МФ, гладкомышечных клеток (ГМК), Т-лимфоцитов, нейтрофилов, пенистых и тучных клеток. Капсула включает в себя внеклеточный матрикс СТ, коллагеновые и эластические волокна, протеогликаны, ГМК, МФ, лейкоциты [9, 12]. Состав и количество компонентных элементов зависят от давности образования («возраста») гранулем. В основе различий гранулем лежит количество окруженных грануляционной тканью липидов и клеток. Чем старше гранулема, тем больше в ней фиброзной ткани, количество липидов постепенно уменьшается, преобладает фиброзная ткань. В давно образовавшихся гранулемах присутствуют соли кальция.

Основные закономерности эволюции гранулематозного воспаления, некроз гранулем, атеротромбоз
Сегодня проблему атеротромбоза следует рассматривать с учетом того факта, что атероматозные бляшки — это воспалительные гранулемы вокруг инородных тел — депозитов липидов. В 1974 г. в докладе комиссии экспертов Всемирной организации здравоохранения при характеристике гранулематозного воспаления была отмечена возможность формирования в гранулемах некрозов и абсцессов. В рабочей классификации гранулем, разработанной академиком А.И. Струковым и О.Я. Кауфман [13], в разделе «Гистология» представлен некроз в центре гранулем. В соответствии с этой классификацией для каждой этиологической формы гранулемы требуется при описании указывать ее стадию — «гранулема молодая; гранулема зрелая; гранулема, находящаяся в стадии некроза», а также давать характеристику васкуляризации и состоянию кровеносных и лимфатических сосудов в гранулеме и вокруг нее. Академик И.В. Давыдовский [5] отмечает, что гранулемы различных этиологий претерпевают 4 характерные фазы: 1) первичную альтерацию ткани; 2) развитие клеточной гранулемы; 3) деструкцию клеток гранулемы (некроз); 4) остаточный склероз, или инкапсуляцию очага. Такие же фазы проходят и холестериновые гранулемы. Первичная альтерация ткани интимы при Ат вызвана чужеродными для нее телами — частицами внеклеточного ХС. Вторая фаза развития гранулем стереотипна в морфологическом и гистогенетическом отношении для всех гранулем, так как в их состав входят одни и те же клетки и различно только их соотношение. Клеточная гранулема при Ат включает моноциты/МФ, пенистые клетки, Т-лимфоциты, ГМК, фибробласты (ФБ), нейтрофилы, тучные и другие клетки. Цитологическое строение гранулем зависит от того, являются ли гранулемы иммунными или неиммунными [5, 13]. Холестериновые гранулемы как гранулемы, индуцированные эндогенными инородными телами, — это неиммунные, типичные макрофагальные гранулемы или простые гранулемы либо фагоцитомы. Обычно третья фаза гранулематозного процесса выражается в некрозе центра гранулемы или в прогрессирующем постепенном превращении ее в склерозированный очаг (то и другое мы наблюдаем в холестериновых гранулемах). Деструкция клеток, распад содержимого гранулем, дезорганизация межуточной ткани (коллагена, эластина) в Ат-гранулемах приводят нередко к повреждению капсулы и покрывающего ее эндотелия, развитию тромбоза. Остаточный склероз (четвертая фаза) при Ат представляет собой замещение липидных очагов СТ. Таким образом, клиническое значение холестеринового гранулематоза определяется как некрозом с деструкцией гранулем и развивающимся атеротромбозом, так и склерозом, вызывающим сужение просвета артерий, ишемию тканей. Весь цикл развития холестериновых гранулем охватывает многие годы. При этом гранулемы в различных и даже в одних и тех же артериях нередко находятся на разных стадиях развития.
Академики В.В. Серов и М.А. Пауков [11] также отмечают, что гранулематозное воспаление, как и всякое другое, протекает в виде цепной реакции. При этом возможны такие исходы, как: 1) рассасывание клеточного инфильтрата; 2) сухой (казеозный) или влажный некроз с образованием дефекта тканей; 3) нагноение гранулемы с формированием абсцесса; 4) фиброзное превращение гранулемы с образованием фиброзного узелка или рубца; 5) рост гранулемы с формированием псевдоопухоли. Как видим, некротизация содержимого воспалительных гранулем является одной из закономерных фаз их эволюции. Биологическая цель некроза содержимого гранулем состоит в разрушении содержащихся в них инородных тел. Но в холестериновых гранулемах эта цель недостижима из-за стойкости молекулы ХС по отношению к гидролитическим ферментам МФ. В связи с этим свойством отграничиваемого субстрата (ХС) воспаление в гранулемах длительно персистирует, в него может включаться отграничивающая капсула («покрышка»), так как под ней постоянно содержатся в том или ином количестве скопления МФ/пенистых клеток, ГМК, Т-лимфоцитов, нейтрофильных гранулоцитов, тучных и других клеток. Напомним также тот факт, что развивающийся некротический процесс, как правило, сопровождается возникновением перифокального (демаркационного) воспаления по периферии очага некроза. В данном случае его периферия граничит с капсулой, следствием чего является вовлечение ее в воспаление, повреждение ее и покрывающего эндотелия. Некрозы развиваются в процессе эволюции как инфекционных гранулем (туберкулез, псевдотуберкулез, нетуберкулезный микобактериоз, сифилис, венерическая лимфогранулема, лепра, туляремия, склерома, иерсиниоз и др.), так и неинфекционных, включая гранулемы инородных тел (Ат, подагра, силикоз, антракосиликоз и др.), а также гранулем неустановленной этиологии (саркоидоз, болезнь Крона, лимфогранулематоз и др.) и гранулем при некротизирующих васкулитах (болезнь Вегенера, Черджа — Стросс, панникулит Вебера — Крисчена, гранулематозный ангиит головного мозга и др.). Гранулематозное воспаление при микозах (актиномикоз, гистоплазмоз, бластомикоз, аспергиллез, мукороз) сопровождается некрозом и нагноением ядра гранулем [13].
На тот факт, что гранулемы, содержащие нерастворимые или медленно разрушающиеся раздражители, подвергаются деструкции и некрозу, указывает D.O. Adams [15]. Он отмечает, что развитие таких гранулем сопровождается рядом дополнительных признаков: 1) инфильтрацией другими клетками — плазматическими, лимфоцитами, нейтрофильными и эозинофильными гранулоцитами; 2) развитием деструктивных изменений и некроза; 3) наличием ФБ и развитием склероза. Как видим, развитие некроза тканей является важным компонентом гранулематозного воспаления. В неиммунных гранулемах, образующихся вокруг инородных тел, преобладают механизмы ауторегуляции за счет биологически активных веществ, прежде всего простагландинов, синтезируемых МФ, других производных арахидоновой кислоты [16]. Важную роль в них играют производные калликреин-кининовой системы, а также системы свертывания крови и фибринолиза. Большое значение в механизмах гранулематозного воспаления (как иммунного, так и неиммунного) имеют лизосомные нейтральные и кислые протеазы МФ; в очаге воспаления многие клетки продуцируют большое количество различных гидролитических ферментов. Кроме того, обычно вокруг воспаленного участка ткани развивается тромбоз сосудов (микрососудов), наступающий после эмиграции лейкоцитов в очаг повреждения. Считается, что он ограничивает воспалительную область, способствует развитию гипоксии тканей и их некрозу. В разгар воспалительной реакции, когда все поле воспаления инфильтрировано лейкоцитами и концентрация гидролитических ферментов очень высока, МФ концентрируются на его периферии, формируя так называемый второй ограничивающий (отграничивающий воспаление) барьер [11]. Все перечисленное касается и холестериновых гранулем.
Академик М.А. Пальцев [8] некрозы относит к исходам гранулем, включающим: 1) рассасывание клеточного инфильтрата; 2) фиброзное превращение гранулемы; 3) некроз гранулемы; 4) ее нагноение. Он отмечает активное участие в развитии некроза протеолитических ферментов МФ.
В целом течение воспалительного холестеринового гранулематоза носит вялый персистирующий характер. Продуктивное воспаление имеет признаки ограничивающей реакции: оно сопровождается разрастанием СТ вплоть до полного изолирования депозитов. Появившаяся рубцовая ткань приводит к остаточным патологическим состояниям — сужениям просвета сосудов, а возникающий некроз гранулем с повреждением капсул становится причиной развития ИМ, инсультов, эмболий различных сосудов. В процессе его развития происходит разрушение как клеток интимы, так и компонентов межклеточного матрикса. В центре гранулем совершается распад, фрагментация, лизис волокон, в некротических массах содержатся жирные кислоты и мыла. Некроз в холестериновых гранулемах, как один из этапов гранулематозного процесса, проявляется альтерацией содержимого гранулем в зоне воспаления за счет секреции активированными МФ протеаз, металлопротеиназ (коллагеназы, эластазы), липаз, активных форм кислорода (АФК), фактора некроза опухоли (ФНО)-α, интерлейкина (ИЛ)-1. Распад, фрагментация ретикулярных, коллагеновых и эластических волокон происходит с участием коллагеназы и эластазы, гликопротеинов — протеаз, липидов — липаз. Обычно зона некроза в холестериновых гранулемах окружена МФ/пенистыми клетками, Т-лимфоцитами, лейкоцитами, ГМК, ФБ. В ходе некроза в гранулемах повреждаются микрососуды, возникают кровоизлияния. Развитию упомянутого выше перифокального острого воспаления способствует выделение некротизированной тканью провоспалительных субстанций. Погибающие клетки генерируют такие медиаторы воспаления, как лейкотриены. Эта воспалительная реакция вокруг очага некроза вызывает дополнительные повреждения, захватывающие клетки и ткани капсулы/«покрышки». Некроз преимущественно распространяется из центра гранулем в зону периферического воспаления, что приводит к повреждению капсулы и к выходу ее содержимого в просвет сосуда. Не исключается, однако, возможность поверхностного расположения очага воспаления с формированием проникающего дефекта. Обращенные к просвету фиброзные слои бляшек/гранулем подвергаются набуханию и разрыхлению в связи с накоплением в них МФ/пенистых клеток, и здесь возможно появление трещин и разрывов [3]. Повреждения в зоне перифокального воспаления обусловлены действием клеток содержащегося в этом месте воспалительного инфильтрата с преобладающими МФ/пенистыми клетками.
Как видим, такой этап эволюционного превращения воспалительных гранулем, как некроз липидного ядра, таит в себе большую опасность: неконтролируемость этого процесса, интенсификация воспаления приводят к развитию некротически-воспалительных дефектов капсулы, разрыву ее и покрывающего эндотелия с развитием атеротромбоза. Разрыв стенок гранулем сопровождаются интрамуральными кровоизлияниями и кровотечениями наружу, возникновением гематом. Повреждение, разрушение гранулемами средней стенки, ее атрофия приводят к разрыву или развитию аневризм сосудов. Такие процессы являются частым осложнением на поздних стадиях эволюции гранулем. При этом реакция на воспаление и некроз приобретает выраженный системный характер: клетки печени синтезируют в значительном количестве белок острой фазы воспаления — С-реактивный белок (СРБ), который аккумулируется в некротических массах, может инициировать развитие демаркационного воспаления.
Некроз ядра гранулемы с возникающим атеротромбозом можно назвать «острым воспалением в ходе хронического». Хотя, как мы уже отмечали, в целом воспалительный процесс в артериях при Ат имеет первично-хронический вялотекущий персистирующий характер (это «медленно текущий фиброз»). Поддержание воспаления обусловливает неоангиогенез — формирование в гранулемах микрососудов, через которые продолжается поступление в них липопротеинов и клеток крови. Незавершенный фагоцитоз ХС препятствует полному репаративному завершению воспаления в гранулемах. Накоплению и длительному активному функционированию МФ в гранулемах способствуют пептиды, выделяемые Т-лимфоцитами (migration inhibitory factor — MIF). Эти клетки также вырабатывают фактор, активирующий миграцию МФ (macrophage-activating factor — MAF). Важную роль в активации МФ играют такие лимфокины, как гамма-интерферон (ИФН-γ), ИЛ-4. В свою очередь МФ выделяют ФНО-α, ИЛ-1, ИЛ-6, активирующие лимфоциты. Известно, что хроническое воспаление может сопровождаться любыми патологическими реакциями и их комбинациями: иммунокомплексными, цитотоксическими, анафилактическими, особенно развитием гиперергических реакций замедленного типа. При наличии таких реакций воспаление считается иммунным. В холестериновых гранулемах, как проявлении неиммунного гранулематоза вокруг инородных тел, такие процессы отсутствуют. Обычно иммунные гранулемы — это эпителиоидные гранулемы, а в гранулемах, вызванных персистированием неантигенного инородного материала (например ХС, урата натрия и др.), эпителиоидные клетки не выявляются.
Как видим, так называемые бляшки, атеромы, сущность которых — воспалительные гранулемы, формируясь вокруг липидных депозитов, проходят характерные этапы развития, присущие гранулематозному воспалению в целом. Вокруг депозитов ХС развиваются инфильтраты из МФ, ГМК, ФБ, лимфоцитов и других клеток и грануляционная ткань. Образующиеся гранулемы претерпевают развитие во времени, и наибольшую опасность для жизни человека представляет такой этап их эволюции, как некроз содержимого, который приводит к развитию тромбозов и тромбоэмболий. Частота клинически манифестного Ат повышается с каждым новым десятилетием жизни человека. Некротизации Ат-гранулем способствует активация МФ под действием катехоламинов (стресс, курение, прием алкоголя, нервно-психическое и физическое перенапряжение, гипертонический криз и др.), повышенная продукция ими ФНО-α, ИЛ-1, АФК, а также усиленная гибель пенистых клеток. Некротические массы приобретают жидкую консистенцию за счет появления жирных кислот, мыл. Кроме того, большую массу ядра Ат-гранулем составляют эфиры ХС, представляющие собой жидкие кристаллы, и они могут напоминать липогранулемы (олеогранулемы). В целом исходами холестериновых гранулем, как и других гранулем вокруг инородных тел, являются некроз, склероз, кальциноз, частичное рассасывание, а также целый ряд дополнительных проявлений, обусловленных сосудистой локализацией патологического процесса.
Как мы отметили выше, повреждение холестериновых гранулем в коронарных артериях авторы связывают с тяжелым физическим напряжением, курением, психоэмоциональным стрессом, травмой, повышением артериального давления, тахикардией, то есть состояниями, сопровождающимися активацией симпатоадреналовой системы и интенсификацией метаболизма МФ. Циркадным повышением уровня катехоламинов объясняют частое развитие ИМ в ранние утренние часы. Разрывы гранулем в коронарных артериях авторы связывают также с давлением крови в сосуде, воздействием со стороны работающего миокарда. Однако некроз воспалительных холестериновых гранулем — это системное явление, для большинства из них не ощутимо воздействие со стороны работающего миокарда. Несомненно, основным фактором повреждения Ат-гранулем является их внутренний некротическо-воспалительный процесс как один из этапов эволюции этих патологических образований. Риск разрыва капсулы/«покрышки» гранулем возрастает при увеличении количества под капсулой (в области так называемого плеча) МФ/пенистых клеток, Т-лимфоцитов, лейкоцитов и других клеток. Выделяемые МФ цитокины — ФНО-α, ИЛ-1 — снижают способность ГМК образовывать коллаген, подавляют их пролиферацию, стимулируют протеолитическую активность МФ; продуцируемые металлопротеиназы (коллагеназа, эластаза, желатиназа, стромелизин и др.) разрушают коллаген и эластин капсулы, повреждают внеклеточный матрикс. К разрыву капсулы приводят и внутренние кровоизлияния. В области поврежденной Ат-гранулемы возникает спазм артерии, что ограничивает кровоток, обусловливает динамический стеноз и окклюзию. Этому также способствует наступающее снижение продукции NO и простациклина и повышение — эндотелина и ангиотензина II. Потенциально уязвимые для развития некроза Ат-гранулемы обычно имеют крупное липидное ядро, тонкую фиброзную капсулу и высокую концентрацию воспалительных клеток на границе жирового ядра и покрывающей его капсулы. Чем больше размер липидного ядра, тем больше очаг возникающего некроза и тем интенсивнее развивающееся воспаление, о чем свидетельствует значительное повышение в таких случаях концентрации в крови СРБ. Стабильные гранулемы имеют малое липидное ядро и относительно толстую капсулу.
Тип некроза в холестериновых гранулемах
Некроз — всегда результат повреждения клеток, исход некробиоза. Обязательными компонентами некроза являются посмертный аутолиз клеток и массивное высвобождение медиаторов, запускающих перифокальную реакцию ткани на некроз, выражающуюся в форме воспаления [6]. Что касается Ат, то некроз изначально охватывает ядро холестериновой гранулемы. И.В. Давыдовский называл «атероматозом» лишь те стадии процесса, когда уже имеется молекулярный распад структурных элементов стенки наподобие скоплений жирового детрита в атероме кожи. Возникающее размягчение депозитов липидов сопровождается нередко прорывом содержимого в просвет сосуда, появлением полостей, со дна и стенок которых можно выскоблить остатки кашицеобразного детрита. Таким образом, традиционное понятие «атероматоз» отражает развитие некроза, дезинтеграции липидов. В таких случаях ядро гранулемы содержит желто-бурые кашицеобразные продукты распада липидов, маслянистый липидно-белковый детрит, напоминающий содержимое ретенционных кист сальной железы — атеромы [1, 4, 5, 8]. Распад жировых отложений, волокон, погибших клеток, кровоизлияния в толщу гранулем, повреждение капсулы, возникновение в ней дефектов, изъязвление происходят в результате гибели большого количества МФ/пенистых клеток и выхода гидролитических ферментов и АФК. Атероматоз как одна из фаз развития холестериновых гранулем проявляется распадом как содержимого ядра, так и структурных элементов стенки, исчезновением гиперпластически-эластического слоя интимы. В поверхностных слоях гранулем образуются структурные дефекты, именуемые атероматозными язвами, с тромботическими наложениями (рис. 5). Атероматоз и деструкция холестериновых гранулем преобладают в старческом возрасте, сопровождаются атрофией стенок артерий, аневризматическими расширениями, надрывами и разрывами стенок. Эктазии артерий и аорты развиваются тогда, когда гранулемы захватывают среднюю оболочку. Они служат местом разрыва сосудов и острых кровотечений, развития ложных и расслаивающихся аневризм. Заживление атероматозных язв происходит путем организации тромбов, перекрывающих их просвет [4]. Организация внутристеночных кровоизлияний и разрывов тканей ведет к еще большей деформации стенок и просвета артерий.
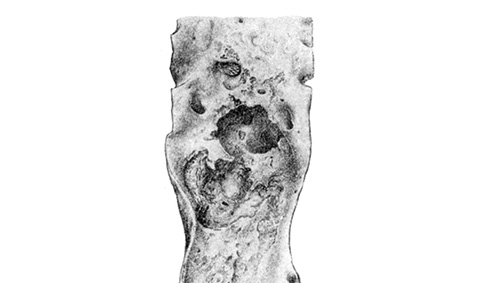
Касаясь морфологической характеристики некроза в холестериновых гранулемах, именуемого «атероматозом», можно отметить, что характер наблюдающегося в них процесса в какой-то мере напоминает колликвационный некроз, при котором происходят процессы ферментативного расщепления тканей [2]. Примером классического колликвационного некроза являются инфаркты мозга, клетки которого содержат много липидов и склонны к аутолизу, размягчению ткани с исходом в виде кисты. Депозиты липидов в ядре Ат-гранулем также подвергаются моляции, размягчению (колликвации). Для колликвационного некроза характерно размягчение погибшей ткани до тех пор, пока она не приобретает кашицеобразную консистенцию, что мы и наблюдаем в холестериновых гранулемах. Такое расплавление тканей происходит под действием гидролитических ферментов, высвобождающихся из погибших клеток или из лизосом клеток воспалительного инфильтрата. Важную роль в развитии некробиотических изменений, некроза играет ФНО-α, образуемый в больших количествах клетками гранулемы, в первую очередь МФ.
Таким образом, возникающие в холестериновых гранулемах углубления, пустоты («изъязвления»), — это результат воспаления и их внутреннего некроза с вовлечением капсулы, выходом в просвет сосуда содержимого через образующиеся дефекты в капсуле. Подобным образованием полостей (каверн) в легких, например, сопровождаются силикозные, туберкулезные гранулемы, гранулемы при болезни Вегенера (гранулематозном полиангиите), гранулематозном воспалении при болезни Черджа — Стросс и др.
Выводы
1. В очагах хронического воспаления всегда присутствуют неполная регенерация, фиброплазия и некрозы. Продуктивное гранулематозное воспаление в артериях развивается как реакция на депонирование в их интиме неразрушимого МФ внеклеточного ХС с его особым физико-химическим метаморфозом: кристаллизацией во внеклеточной среде.
2. Развитие некроза в холестериновых гранулемах представляет собой один из признаков, характеризующих хроническое воспаление, вызванное нерастворимыми или медленно разрушающимися раздражителями. Биологическая целесообразность возникающего некроза состоит в ликвидации имеющихся в гранулемах инородных тел. В данном случае попытка разрушить патологический агент (ХС) посредством некроза не достигает цели из-за прочности его циклического молекулярного скелета. Наоборот, некроз ядра с возникновением дефектов тканей капсулы в силу локализации гранулемы в сосудистой стенке приводит к атеротромбозу.
3. Факт, что некрозы развиваются в воспалительных гранулемах различной этиологии, как иммунных, так и неиммунных, свидетельствует о стереотипности этого процесса. Некроз в холестериновых гранулемах с последующим образованием тромбов в артериях — это закономерный процесс, проявление одной из стадий развития гранулематозного воспаления. Развитие вторичной альтерации содержимого гранулем в зоне воспаления происходит как за счет секреции активированными МФ целого ряда гидролитических ферментов, АФК, ФНО-α, ИЛ-1, так и их выхода из распадающихся МФ/пенистых клеток. Капсулы гранулем повреждаются в ходе воспалительного процесса, включая развитие перифокального воспаления вокруг очага некроза. Возникающее «острое воспаление в ходе хронического» сопровождается существенным повышением концентрации СРБ в крови и в самой гранулеме.
4. Уменьшить поступление в Ат-гранулемы триггера воспаления (ХС) и снизить интенсивность воспаления непосредственно в них, действуя на клетки воспаления, можно сегодня с помощью статинов. Этот класс препаратов демонстрирует доказанную высокую эффективность средств, предупреждающих развитие таких последствий атеротромбоза, как ОКС, ИМ, ишемический инсульт. Для дальнейшего повышения эффективности лечения Ат нужны новые подходы с учетом воспалительной природы такой болезни, как гранулематоз вокруг эндогенных инородных тел. Всегда будут необходимы устранение факторов риска, угнетение синтеза ХС и ограничение его поступления в организм.
Список использованной литературы
- 1. Аничков Н.Н. (1947) Сосуды. В кн.: Частная патологическая анатомия. Вып. 2. Сердце и сосуды. Медгиз, Москва — Ленинград, 350 с.
- 2. Богодаров В.М., Богомолець К.О., Рудницька О.Г., Вербицький В.В. (2007) Основи патоморфології. У 2 ч. Частина 1. Загальна патоморфологія. ТОВ «Атлант ЮЕмСІ», 198 с.
- 3. Волкова К.Т. (1963) Атеросклероз. В кн.: Патологическая анатомия человека. Под. ред. А.Н. Чистовича. Государственное издательство медицинской литературы, Ленинград, с. 230–245.
- 4. Давыдовский И.В. (1958) Патологическая анатомия и патогенез болезней человека. Т. 2. Медгиз, Москва, 689 с.
- 5. Давыдовский И.В. (1969) Общая патология человека. Медицина, Москва, 611 с.
- 6. Зайчик А.Ш., Чурилов Л.П. (2005) Общая патофизиология (с основами иммунопатологии). ЭЛБИ-СПб, 656 с.
- 7. Лопухин Ю.М., Арчаков А.И., Владимиров Ю.А., Коган Э.М. (1983) Холестериноз (Холестерин биомембран. Теоретические и клинические аспекты). Медицина, Москва, 352 с.
- 8. Пальцев М.А. (ред.) (2007) Патология. Курс лекций. Т. 1. Общий курс. Медицина, Москва, 280 с.
- 9. Пальцев М.А., Аничков Н.М. (2000) Патологическая анатомия. Учебник: В 2 т. Т. 1. Медицина, Москва, 528 с.
- 10. Серов В.В. (1998) Воспаление. В кн.: Патологическая анатомия. Под ред. В.В. Серова, М.А. Пальцева. Медицина, Москва, с. 146.
- 11. Серов В.В., Пауков В.С. (ред.) (1995) Воспаление. Руководство для врачей. Медицина, Москва, 640 с.
- 12. Серов В.В., Пальцев М.А. (ред.) (1998) Патологическая анатомия. Курс лекций. Учебное пособие. Медицина, Москва, 640 с.
- 13. Струков А.И., Кауфман О.Я. (1989) Гранулематозное воспаление и гранулематозные болезни. Медицина, Москва, 182 с.
- 14. Струков А.І., Сєров В.В. (1999) Патологічна анатомія. Підручник. Пер. з рос. мови. Факт, Харків, с. 55–109.
- 15. Adams D.O. (1983) The Biology of the granuloma. Pathology of granuloma. Ed. H. Joachim. New York: 1–20.
- 16. Epstein W.L. (1980) Foreing body granulomas. Basic and clinical aspects granulomatous diseases. Ed. D.L. Boros, T. Yochida. New York, р. 133–148.
Адрес для переписки:
Казимирко Виталий Казимирович
04112, Киев, ул. Дорогожицкая, 9
Национальная медицинская
академия последипломного образования
имени П.Л. Шупика

Leave a comment