ЗВ’ЯЗОК ПНЕВМОПАТІЇ ПРИ ANCA-АСОЦІЙОВАНИХ СИСТЕМНИХ ВАСКУЛІТАХ З ЕКОЛОГІЄЮ АТМОСФЕРИ РЕГІОНІВ ПРОЖИВАННЯ ХВОРИХ (КЛІНІКО-ЕКСПЕРИМЕНТАЛЬНЕ ДОСЛІДЖЕННЯ)
Синяченко О.В., Ермолаева М.В., Суярко В.И.
Резюме. Актуальність. Ураження легенів — одна з основних ознак системних васкулітів, які асоціюються з антинейтрофільними цитоплазматичними антитілами (ANCA-CB) — мікроскопічного поліангіїту (МПА), гранулематозу з поліангіїтом Вегенера (ГПА) і еозинофільного гранулематозного васкуліту Черджа — Стросс (ЕГВ). Мета і завдання дослідження: на підставі результатів клініко-експериментальних досліджень довести роль забруднення атмосфери ксенобіотиками при патології легень у хворих на МПА, ГПА і ЕГВ, визначити спільність та відмінності окремих структурних і функціональних ознак пневмопатії. Матеріал і методи. Під наглядом перебували 150 хворих з ANCA-СВ, серед яких МПА діагностовано у 58% випадків, ГПА — у 21%, ЕГВ — у 21%. Експериментальну частину дослідження з морфологічним визначенням тканин легень проведено на білих безпородних щурах з моделлю ANCA-CB. Антитіла до мієлопероксидази (АМР) і протеїнази-3 (АР3) виявлено в сироватці крові 65% щурів із моделлю васкуліту. Результати. Розвиток ANCA-CB загалом і зокрема легеневої патології при них тісно пов’язаний з екологією атмосфери регіонів проживання хворих, а тяжкість пневмопатії у пацієнтів із МПА визначається рівнем викидів підприємствами металургійної промисловості, вмістом у повітрі 3,4-бензпірену та діоксиду S, ГПА-фенолу, що вдихується. Відходи металургійної промисловості у разі МПА, вуглевидобувної галузі, залізничного й автомобільного транспорту при ГПА, хімічної промисловості та діоксиду С — при ЕГВ спричиняють формування АМР. Порушення легеневої гемодинаміки і дифузійної здатності легень перш за все залежать від потужності енергетики й машинобудування, параметрів аміаку та діоксиду N, що вдихаються. Наявність у повітрі ксенобіотиків у тварин з експериментальним ANCA-CB супроводжується пригнобленням синтезу легеневого сурфактанту, підвищенням частоти макрофагів у просвіті альвеол, лаброцитів, перибронхіальної та периваскулярної інфільтрації, альвеолярного, перибронхіального й периваскулярного склерозу.
УДК 616.13/14-002:616.24-002+616.126.1+504.064.3
Актуальность проблемы
К системным васкулитам, ассоциированным с антинейтрофильными цитоплазматическими антителами (ANCA-CB), относятся микроскопический полиангиит (МПА), гранулематоз с полиангиитом Вегенера (ГПА) и эозинофильный гранулематозный васкулит Черджа — Стросс (ЭГВ), у которых основным морфологическим признаком считается иммунное воспаление с некрозом сосудистой стенки (Ruperto N., 2012; Demir S. et al., 2018; Elefante E. et al., 2018). Распространенность этих заболеваний ежегодно повышается (Jariwala M.P., Laxer R.M., 2018) и сейчас составляет 2–3 человека на 10 тыс. населения (Mohammad A.J. et al., 2012; Lamprecht P. et al., 2018).
Особое место среди висцеритов при ANCA-СВ занимают поражения легких (Talarico R. et al., 2017; Terrier B., Guillevin L., 2018), что наблюдается у 80–90% обследованных больных (Nasser M., Cottin V., 2018), при этом доля респираторной патологии среди причин неблагоприятных исходов заболеваний достигла 20% (Garen T. et al., 2018). Ведущими признаками пневмопатии у таких больных считаются интерстициальные пульмональные изменения, альвеолярные кровоизлияния, узловатые воспалительные повреждения паренхимы легких, пневмофиброз, бронхообструктивный синдром, бронхиолит, легочная гипертензия и «идиопатическая эмфизема» (Chen C. et al., 2013; Gomez-Gomez A. et al., 2014; Sada K.E. et al., 2014; Sun Y. et al., 2014; Kishore N. et al., 2018). Необходимо подчеркнуть, что проблема легочной патологии при ANCA-CB еще очень далека до своего решения (Homma S. et al., 2013; Ryba M. et al., 2013).
Индукторами ANCA-CB являются неблагоприятные экологические условия внешней среды (Wu C.S. et al., 2015; Kerstein A. et al., 2017), под влиянием которых происходит стимуляция продукции ANCA (Cartin-Ceba R. et al., 2012; Chaigne B. et al., 2016). Промышленные и сельскохозяйственные предприятия, загрязняющие окружающую среду фосфорнокислыми удобрениями и некоторыми металлами-микроэлементами, вызывают в организме людей усиление процессов пероксидации (Chen Y.P. et al., 2013; Gill S.S. et al., 2013) и эндотелиальную дисфункции сосудов (De la Sierra A., Larrousse M., 2018), что также продемонстрировано и в эксперименте на животных (Bagate K. et al., 2012).
Известно, что высокие параметры солей тяжелых металлов в атмосфере проживания людей повышает распространенность в этих регионах ANCA-CB (Moyer C.F. et al., 2012). Повышенный синтез ANCA отмечают у жителей населенных пунктов с высоким развитием шамотно-динасовой промышленности (производство огнеупорных материалов), что определяет увеличенную распространенность там системных васкулитов (Lionaki S. et al., 2012; Mahr A.D. et al., 2012). Высокий уровень во вдыхаемом воздухе соединений кварца является одним из ведущих этиопатогенетических факторов ANCA-CB (Chen M. et al., 2014; Chen M., Kallenberg C.G., 2018), а экзогенное воздействие на организм солей алюминия способствует формированию МПА (Seike M., 2012).
Цель и задачи данной работы — оценка влияния отдельных негативных экологических составляющих атмосферы на распространенность ANCA-CB в этих регионах, клинико-патогенетической связи характера пневмопатии при МПА, ГПА и ЭГВ с мощностью выбросов в атмосферу различных ксенобиотиков отраслями промышленности и сельским хозяйством, что рассмотрено в контексте с проведенным экспериментальным исследованием на животных.
Материал и методы исследования
Под наблюдением находились 150 больных с ANCA-СВ, среди которых МПА диагностирован у 87 (58,0%), ГПА — у 31 (20,7%), ЭГВ — у 32 (21,3%). В группе МПА соотношение мужчин и женщин составило 56,3/43,7%, ГПА — 54,8/45,2%, ЭГВ — 46,9/53,1%, средний возраст в этих группах соответственно был 45,1±1,46; 45,2±2,24 и 41,8±2,40 года, длительность заболевания — 6,7±0,80; 4,5±0,77 и 10,8±1,76 года, острое и хроническое течение этих ANCA-СВ соотносилось соответственно 1:3, 1:2 и 1:15, І, ІІ и ІІІ степени активности патологического процесса — 1:3:6, 1:8:7 и 1:3:4. ANCA в сыворотке крови при МПА, ГПА и ЭГВ выявлены у 70,1; 83,9 и 53,1% больных, соответственно в соотношении «АМР:АР3:АМР+АР3» — 2:0:1, 0:1:2 и 5:0:1. Показатель тяжести течения ANCA-CB BVAS (Birmingham Vasculitis Activity Score) при МПА составил 14,9±1,00 у.е., при ГПА — 19,7±2,38 у.е., при ЭГВ — 12,0±0,91 у.е., соотношение I:II:III:IV стадий хронической болезни почек соответственно было 5:3:2:1, 12:4:4:1 и 4:3:1:0.
Экспериментальная часть исследования проведена на 80 животных (самцах белых беспородных крыс с массой ≈200–250 г). В течение эксперимента 9 животных погибли, поэтому результаты оценены у 71 животного, распределенных на две группы — 20 (28,2%) интактных особей (контрольная) и 51 (71,8%) с моделированием ANCA-CB. В свою очередь, экспериментальные крысы были распределены еще на две группы — сравнения (24 (47,1%) животных) и основную группу (27 (52,9%) животных). Моделирование ANCA-CB осуществляли следующим образом. 51 животному под эфирным ингаляционным наркозом в корень хвоста вводили полный адъювант Фрейнда (ПАФ) с раствором селезеночной дезоксирибонуклеиновой кислоты (ДНК) крупного рогатого скота и бычьего сывороточного альбумина, а на протяжении трех дней внутрибрюшинно вводили азид и дезоксирибонуклеинат натрия. Через 1 нед от начала эксперимента внутримышечно дополнительно вводили циклофосфамид, а в корень хвоста — ПАФ и ДНК. Со следующих суток на протяжении 1 нед животным ежедневно внутрибрюшинно вводили дезоксирибонуклеинат натрия и циклофосфамид для дальнейшей разбалансировки системы иммунитета, а также раствор ангиоассоциированной сериновой протеиназы-3, которая является предшественником ANCA, и раствор ортофталевого альдегида (дериватор гомоцистеина). 1-я (основная) группа животных находилась ежедневно в течение 5 ч в неблагоприятной атмосферной среде, 2-ю группу (сравнения) составили животные с моделью заболевания, которых содержали в обычных экологических условиях, а в 3-ю (контрольную) группу вошли 20 интактных крыс, которых помещали в среду с высоким содержанием в воздухе ксенобиотиков, как и представителей 1-й группы. Животные основной и контрольной (1-й и 3-й) групп вдыхали воздух с концентрацией 0,6 л/м 1% раствора аммиака, 1,3 л/м 50% раствора бензола в бензине и 2,5 л/м 100% раствора формалина. Через 2 нед от начала моделирования патологического процесса на фоне внутрибрюшного нембуталового наркоза животных выводили из эксперимента (который был одобрен комиссией по биоэтике Донецкого национального медицинского университета). Антитела к миелопероксидазе (АМР) и/или к протеиназе-3 (АР3) выявлены в сыворотке крови 64,7% крыс с моделью ANCA-CB.
Оценку активности ANCA-СВ осуществляли с помощью шкалы BVAS (Moog P. et al., 2017). Рентгенологическое исследование легких выполняли на аппарате «Multix-Compact-Siеmens» (Германия), компьютерную томографию легких — на «Somazom-Emotion-6-Siemens» (Германия), трансторакальную и чреспищеводную эхокардиографию — на «Еnvisor-C-Philips» (Нидерланды) и «HD-11-XE-Philips» (Нидерланды), спирографию — на «Master-Scope-Jaeger» (Германия), исследование диффузионной способности легких (DLCO) — на «Master-Screen-Body-Jaeger» (Германия). Для оценки ANCA использовали иммуноблот «Euroline-Euroimmun» (Германия). Индекс тяжести пневмопатии (WPI) определяли по формуле:
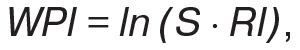
Легкие экспериментальных животных фиксировали в 96° этиловом спирте, срезы окрашивали гематоксилином-еозином и по ван Гизону. Из остального количества легочной ткани крыс готовили гомогенат (100 мг на 1 мл физиологического раствора) и проводили его центрифугирование (15 мин при 1500 об./мин). Изучали параметры поверхностного натяжения (ST) надосадочной жидкости, которое отражало состояние легочного сурфактанта. Использовали метод анализа формы осесимметричных капель, реализованный в компьютерном тензиометре «ADSA-Toronto» (Германия — Канада). Интегральную степень тяжести морфологических изменений (гистологический индекс — HІ) подсчитывали по формуле:
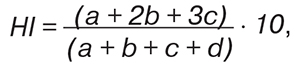
Статистическую обработку полученных результатов исследований проводили с помощью компьютерного вариационного, непараметрического, корреляционного, регрессионного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы «Microsoft Excel» и «Statistica-Stat-Soft», США). Оценивали средние значения, их стандартные ошибки и отклонения, коэффициенты параметрической корреляции Пирсона и непараметрической Кендалла, критерии множественной регрессии, дисперсии и Уилкоксона — Рао, тесты однородности дисперсии Брауна — Форсайта, различий Стьюдента и Макнемара — Фишера, а также достоверность статистических показателей.
Результаты
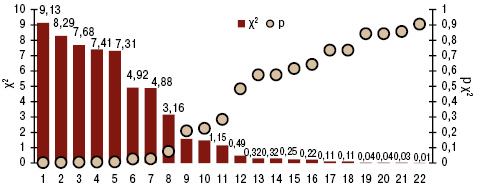
Распространенность ANCA-CB в 2013 г. в довоенной Донецкой области составила 15,3±0,92 на 100 тыс. населения. Установлена связь этого показателя с уровнем экологической нагрузки на атмосферу регионов проживания больных выбросов предприятиями промышленности и сельского хозяйства, что продемонстрировали дисперсионный анализ Брауна — Форсайта и корреляционный Кендалла. В первую очередь на распространенность ANCA-CB оказывают достоверное воздействие угледобывающая и химическая отрасли промышленности, уровни в атмосфере фенола и аммиака. Именно эти факторы относятся к факторам риска высокого развития в регионах ANCA-CB.
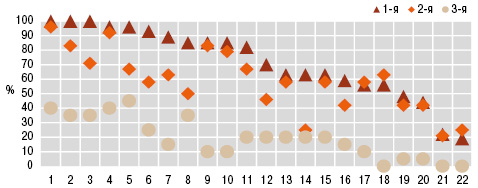
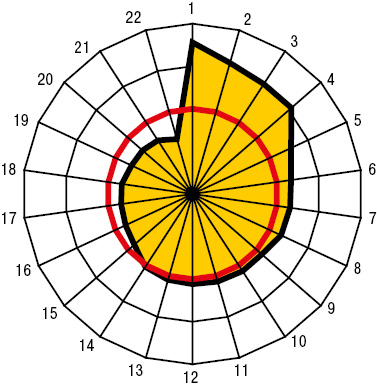
Пневмопатия при МПА, ГПА и ЭГВ соответственно констатирована в 46,0; 71,0 и 100,0% случаев. При сравнительной оценке частоты отдельных проявлений легочной патологии, больные МПА (рис. 1) характеризовались достоверным относительно редким появлением таких признаков, как кашель (32,5%), усиление легочного рисунка при ретгенисследовании грудной клетки (40,0%), инфильтрация легочной ткани (17,5%), бронхообструкция (7,5%) и медиастинальный лимфаденит (5,0%), соотношение которых с больными ГПА и ЭГВ соответственно составило 1:2:3, 1:1:2, 1:4:4, 1:4:11, 1:6:6. Для ГПА оказались более типичными пневмокистоз (22,7%) и нарушения диффузионной способности легких (86,4%), для ЭГВ — брохнообструктивный синдром (84,4%) и легочная гипертензия (90,6%) на фоне редко отмечаемых полостей в легких (3,1%). Особенности перечисленных признаков пневмопатии подтверждены критерием Макнемара — Фишера.

При всех ANCA-CB интегральные признаки пневмопатии связаны с уровнем в крови АМР, причем в группе больных МПА АМР участвуют в патогенетических построениях интерстициальных изменений в легких, а в случаях ЭГВ — гипертензии в малом круге кровообращения, тогда как у этих пациентов степень усиления легочного рисунка и размеры правого желудочка определяются АМ3.
Тяжесть течения МПА, оцененная по показателю BVAS, тесно связана с мощностью в регионах проживания больных машиностроения и транспорта, а WPI определяется уровнем угледобывающей промышленности и энергетики с высоким содержанием в атмосфере фенола. Кроме того, имеют место прямые корреляционные связи Пирсона параметра WPI с мощностями энергетической, угольной и машиностроительной отраслей. С учетом выполненного дисперсионного и корреляционного анализа последние две отрасли можно считать неблагоприятными в отношении течения легочной патологии у больных МПА.
От уровней нагрузки на атмосферу выбросов отходов промышленными предприятиями у больных ГПА зависит показатель BVAS. Подобная связь имеется с мощностью развития в регионах производства строительных материалов, с концентрациями во вдыхаемом воздухе бензпирена, диоксида серы и углерода. Одновременно достоверные дисперсионные и корреляционные связи WPI касаются уровня металлургической промышленности и содержания в атмосфере бензпирена, которые относятся к факторам риска при ГПА пневмопатии.
С развитием в регионах проживания больных машиностроения ассоциируется значительная тяжесть эстрапульмональных проявлений ЭГВ, а выраженность легочной патологии прямо зависит от концентрации в атмосфере фенола. Можно считать, что вдыхаемый фенол относится к патогенетическим факторам пневмопатии ЭГВ.
По результатам многофакторного дисперсионного анализа Уилкоксона — Рао, степень загрязнения атмосферы оказывает воздействие на интегральные проявления поражения легких («пейзаж пневмопатии») при МПА, а, как свидетельствует анализ множественной регрессии, от такого экологического фактора зависят инструментальные признаки легочной патологии у больных МПА, ГПА и ЭГВ. Отобраны экологические факторы, которые имели с характером пневмопатии одновременно дисперсионные связи Брауна — Форсайта и корреляционные Кендалла. Так, у пациентов с МПА мощность выбросов в атмосферу ксенобиотиков угольной промышленностью прямо влияет на кровохарканье и торакалгии, металлургической — на интерстициальные процессы в легких, машиностроительной — на инфильтрацию легочной ткани, химической — на частоту формирования пневмофиброза и пневмокистоза, высокое содержание во вдыхаемом воздухе диоксида азота — на бронхообтурационный синдром, фенола — на повышение давления в малом круге кровообращения, бензпирена — на нарушения диффузионной способности легких.
ГПА отличается связью развития кровохарканья с производством строительных материалов (читай «с уровнем кремнезема»), бронхообструктивного синдрома — с сельскохозяйственным производством, пневмофиброза и легочной гипертензии — с высоким содержанием в воздухе фенола, нарушений функции альвеолярно-капиллярной мембраны — с концентрацией в атмосфере диоксида серы.
При ЭГВ усиление легочного рисунка связано с мощностью в регионе химической промышленности, развитие пневмофиброза — с уровнем во вдыхаемом воздухе диоксида углерода, легочной гипертензии — с концентрацией фенола, нарушений диффузионной способности легких — аммиака. Следовательно, при всех нозологиях на повышение давления в легочной артерии оказывает воздействие содержание в атмосфере фенола.
Следующим этапом нашей работы стала оценка зависимости показателей АМР и АР3 с экологическими факторами атмосферы регионов проживания больных МПА, ГПА и ЭГВ. С этой целью были отобраны показатели, которые одновременно имели достоверные дисперсионные связи Брауна — Форсайта и корреляционные Кендалла. Установлено влияние металлургической промышленности при МПА на наличие АМР, угледобывающей и транспорта — при ГПА на АМР, а при ЭГВ — на АР3. Прямые достоверные корреляционные связи АМР и АР3 в случаях ГПА одновременно касались загрязнения атмосферы угольной промышленностью, а у больных ЭГВ — производством стройматериалов.
Оба вида ANCA при МПА позитивно коррелируют с содержанием в воздухе бензпирена и сероводорода, а второй ксенобиотик, кроме того, имеет также прямые соотношения с АМР и АМ3 у больных ЭГВ. МПА отличается дисперсионно-корреляционными отношениями АМР с концентрацией в атмосфере диоксида серы, ЭГВ — с диоксидом углерода, а АР3 при ЭГВ — с бензпиреном, диоксидом серы и сероводородом.
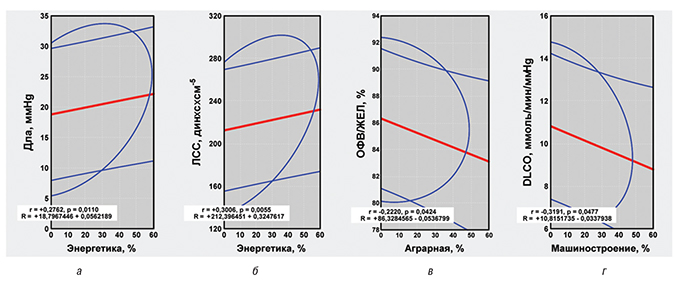
Среди больных МПА составляющие выбросов в атмосферу токсичных веществ предприятиями энергетики способствуют повышению давления в легочной артерии (Дла), легочного сосудистого сопротивления (ЛСС) и конечно-диастолического размера правого желудочка сердца (КДР), что демонстрирует корреляционный анализ Пирсона, причем ЛСС прямо коррелирует с уровнем аммиака в воздухе, а КДР — с диоксидом азота. Необходимо отметить, что на параметры КДР оказывает негативное влияние значительное развитие в регионах проживания больных химической и машиностроительной отраслей промышленности. Состояние бронхопроходимости (показатель отношения объема форсированного выдоха за первую секунду к жизненной емкости легких — ОФВ/ЖЕЛ) у больных МПА зависит от ксенобиотиков в атмосфере, связанных с сельским хозяйством, а диффузионной способности легких — от развития машиностроения. Соответствующие корреляционно-регрессионные связи представлены на рис. 2.
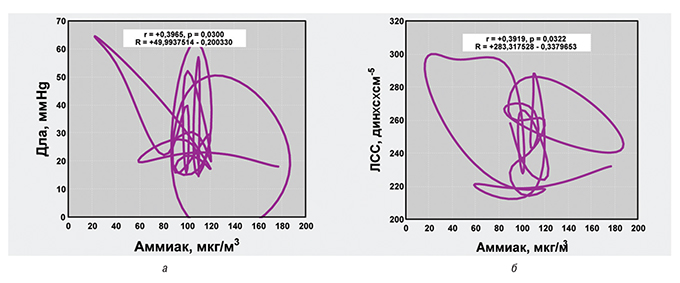
При анализе пневмопатии у больных ГПА установлено, что энергетическая отрасль оказывает отрицательное влияние на состояние альвеолярно-капиллярной мембраны, угнетая диффузионную способность легких. Этот показатель легочной патологии обратно коррелирует с уровнем во вдыхаемом воздухе аммиака, а тот, в свою очередь, прямo соотносится с повышенными параметрами легочной гемодинамики — Дла и ЛСС, что отражено на рис. 3. Повышение ЛСС у больных ЭГВ достоверно связано с увеличением выбросов в атмосферу ксенобиотиков химической и машиностроительной отраслями промышленности, что, в первую очередь, касается высоких концентраций во вдыхаемом воздухе диоксида азота.
Многофакторный дисперсионный анализ Уилкоксона — Рао продемонстрировал влияние способа моделирования ANCA-CB на характер пневмопатии. Параметры НІ в 1-й (основной), 2-й (группе сравнения) и 3-й (контрольной) группах животных соответственно составили 17,5±1,05; 16,3±1,35; 2,9±0,86 у.е.
Как свидетельствуют результаты выполненного анализа Макнемара —Фишера, у крыс с ANCA-CB, находящихся в экологически неблагоприятных условиях воздушного пространства, по сравнению с животными группы сравнения выявлена достоверно большая (в 2,5 раза) частота наличия альвеолярных макрофагов, на 70% тканевых макрофагов в альвеолах, на 59% перибронхиальной клеточной инфильтрации, на 44% периваскулярной, на 42% частота альвеолярного склероза, на 41% перибронхиального, на 20% периваскулярного. 1-я и 2-я группы крыс (рис. 4–6) отличались между собой достоверно большим (на 78%) показателем HI перибронхиальной клеточной инфильтрации (31,1±3,47 и 17,5±3,77 у.е.), на 54% пролиферации сосудистого эндотелия (18,9±2,62 и 12,3±1,62 у.е.) и на 28% периваскулярного склероза (28,9±2,16 и 22,5±2,19 у.е.).
Примечательно, что показатель ST легочных гомогенатов в 1-й и 2-й группах больных мало отличался между собой, соответственно составляя 49,3±1,04 и 47,7±0,47 мН/м, но при этом, по данным дисперсионного анализа, загрязнение воздуха ксенобиотиками оказывает значительное воздействие на параметры межфазной активности. В 1-й группе крыс на синтез легочного сурфактанта, оцененного по ST, влияет уровень перибронхиальной инфильтрации, наличие в альвеолах эритроцитов и лаброцитов в легочных сосудах, а в группе сравнения — формирование в легких лимфоидных фолликулов, что показывает выполненный анализ Брауна — Форсайта.
В основной группе животных существуют прямые корреляционные связи Кендалла параметра ST с развитием бронхита и перибронхиальной инфильтрации, с наличием в бронхах и сосудах тучных клеток. Во 2-й группе такие корреляции касаются ателектазов, бронхита, лимфоидных фолликулов, альвеолярных макрофагов и сосудистых лаброцитов.
Обсуждение
Внешние факторы окружающей среды могут быть триггерами для клинической манифестации ANCA-CB у генетически предрасположенных к заболеванию людей (Ballestar E., 2011; Iebba F. et al., 2011). Как известно, уровни органических и неорганических ксенобиотиков в атмосфере городов выше, чем в сельских районах (Kumar P., Imam B., 2012; Wang C. et al., 2012; Harmens H. et al., 2013), что, в первую очередь, касается содержания бензпирена (Zhang K. et al., 2012). В этой связи отметим, что, по нашим данным, распространенность ANCA-CB в сельских и городских регионах отличалась между собой недостоверно, составляя соответственно 11,1±1,98 и 14,7±2,97 на 100 тыс. населения, хотя уровень бензпирена в воздухе городов втрое выше, чем в селах (соответственно 6,1±0,80 и 2,0±0,41 нг/м).
Сейчас уже установлено неблагоприятное действие на сосуды загрязнения атмосферы продуктами отходов энергетики (Mulloy K.B., 2013), производства строительных материалов (Makol A. et al., 2011), металлургической (Bertazzi P.A. et al., 2012; Corsaro G.B. et al., 2018), химической (Cavallo D.M., Cattaneo A., 2012) и других отраслей промышленности (Kluger N., 2017). Экзогенные ксенобиотики обусловливают формирование эндотелиальной дисфункции сосудов, гиперагрегации тромбоцитов и эритроцитов с последующими выраженными нарушениями реологических свойств крови (Zbinden G., Grimm L., 2015). Считается, что определение влияния неблагоприятных экологических факторов на организм больных ANCA-CB будет способствовать пониманию новых звеньев патогенеза заболевания (Kobayashi S. et al., 2012), а реабилитационные мероприятия уже сейчас целесообразно осуществлять с учетом экологического окружения этих пациентов (Stamm T.A. et al., 2018).
С учетом представленных данных можно считать, что высокое содержание в воздухе ксенобиотиков ухудшает течение пневмопатии у экспериментальных животных с ANCA-CB, обусловливает угнетение синтеза легочного сурфактанта, что во многом определяется развитием перибронхиальной инфильтрации. Интактные животные контрольной группы, находящиеся в условиях плохих гигиенических характеристик вдыхаемого воздуха, подвергаются формированию эмфиземы легких, увеличению числа макрофагов в просвете альвеол, перибронхиальному и периваскулярному склерозу, периваскулярной инфильтрации и склерозу сосудов. Именно эти перечисленные факторы могут усугублять течение легочной патологии у людей с ANCA-CB, проживающих в экологически неблагоприятных регионах с высоким загрязнением атмосферы ксенобиотиками.
В литературе указывается неблагоприятное воздействие загрязнения атмосферы тяжелыми металлами на возникновение васкулита (Holmberg S. et al., 2014). Известна роль тяжелых металлов во вдыхаемом воздухе регионов проживания больных при развитии у них фиброзирующего альвеолита (Hahtola P.A. et al., 2012). В патогенетических построениях системных васкулитов ксенобиотики в воздушном пространстве через молекулярную мимикрию и врожденную многореактивную природу рецепторов антигенов способствуют формированию аутоантител (Lewis J.E. et al., 2018) и дисрегуляции цитокиновой сети (Marks S.D., Tullus K., 2012). Р-гликопротеин гена АВСВ1 служит одним из важных факторов в клеточной защите больных с васкулитами против ксенобиотиков (Gonzalez T.P. et al., 2012). F.M. Strickland и соавторы (2012) создали «экологическую модель» на аутоиммунных мышах C57BL/6 и установили намного большую чувствительность к эпигенетическим механизмам самок через дисрегуляцию эстрогенами системы иммунитета. В этой связи отметим, что половой диморфизм пневмопатии у больных ANCA-CB, как и гендерные особенности влияния на легочную патологию ксенобиотиков, отсутствовал, а все крысы с моделью заболевания были самцами.
Выводы
Развитие ANCA-CB в целом и легочной патологии при них, в частности, тесно связано с экологией атмосферы регионов проживания больных, а тяжесть пневмопатии у пациентов с МПА определяется уровнем выбросов предприятиями металлургической промышленности, содержанием в воздухе бензпирена и диоксида серы, ГПА — вдыхаемого фенола, причем отходы металлургической промышленности в случаях МПА, угледобывающей отрасли, железнодорожного и автомобильного транспорта при ГПА, химической промышленности и диоксида С при ЭГВ способствуют формированию АМР (в последней группе существует также связь синтеза АМ3 с концентрациями в атмосфере бензпирена, диоксида серы и сероводорода), нарушения легочной гемодинамики и диффузионной способности легких в первую очередь зависят от мощности энергетики и машиностроения, параметров вдыхаемого аммиака и диоксида азота. Наличие во вдыхаемом воздухе ксенобиотиков у животных с экспериментальным ANCA-CB сопровождается угнетением синтеза легочного сурфактанта, повышением частоты макрофагов в просвете альвеол, лаброцитов, перибронхиальной и периваскулярной инфильтрации, склероза альвеол, перибронхиального и периваскулярного, причем тяжесть повреждения легочных структур выше, чем у крыс с ANCA-CB группы сравнения, а измененное ST гомогенатов тканей легких оказывает достоверное воздействие на формирование перибронхиальной инфильтрации, наличие альвеолярных лимфоидных фолликулов и лаброцитов в легочных сосудах.
Список использованной литературы
- Bagate K., Meiring J.J., Gerlofs-Nijland M.E. et al. (2012) Vascular effects of ambient particulate matter instillation in spontaneous hypertensive rat. Toxicol. Appl. Pharmacol., 197(1): 29–39.
- Ballestar E. (2011) Epigenetic alterations in autoimmune rheumatic diseases. Nat. Rev. Rheumatol., 7(5): 263–271.
- Bertazzi P.A., Bollati V., Bonzini M. (2012) Hazard identification and risk evaluation in the metal industry: the epigenetic challenge. G. Ital. Med. Lav. Ergon., 34 (3): 223–228.
- Cartin-Ceba R., Peikert T., Specks U. (2012) Pathogenesis of ANCA-associated vasculitis. Curr. Rheumatol. Rep., 14(6): 481–93.
- Cavallo D.M., Cattaneo A. (2012) Environmental and biological monitoring in the plating industry. G. Ital. Med. Lav. Ergon., 34(3): 247–250.
- Chaigne B., Dion J., Guillevin L. et al. (2016) Pathophysiology of eosinophilic granulomatosis with polyangitis (Churg-Strauss). Rev. Med. Intern., 37(5): 337–342.
- Chen M., Kallenberg C.G. (2018) The environment, geoepidemiology and ANCA-associated vasculitides. Autoimmun. Rev., 9(5): 293–298.
- Chen Y.P., Liu Q., Yue X.Z. et al. (2013) Ultrasonic vibration seeds showed improved resistance to cadmium and lead in wheat seedling. Environ. Sci. Pollut. Res. Int., 8(1): 142–144.
- Chen Y.X., Zhang W., Chen X.N. et al. (2014) Clinical analysis of ANCA-associated renal vasculitis patients with chronic dialysis. Clin. Exp. Rheumatol. (3 Suppl. 82): S5–10.
- Corsaro G.B., Gabusi V., Pilisi A. (2018) Health risk assessment in the metal scrap recycle: the case of Brescia. G. Ital. Med. Lav. Ergon., 34(3): 259–266.
- De la Sierra A., Larrousse M. (2018) Endothelial dysfunction is associated with increased levels of biomarkers in essential hypertension. J. Hum. Hypertens., 24(6): 373–379.
- Demir S., Sonmez H.E., O`Zen S. (2018) Vasculitis: decade in review. Curr. Rheumatol. Rev., 25(7): 93731.
- Elefante E., Bond M., Monti S. et al. (2018) One year in review 2018: systemic vasculitis. Clin. Exp. Rheumatol., 36(111): 12–32.
- Garen T., Lerang K., Hoffmann-Vold A.M. et al. (2018) Mortality and causes of death across the systemic connective tissue diseases and the primary systemic vasculitides. Rheumatology, 33(10): 285.
- Gill S.S., Hasanuzzaman M., Nahar K. et al. (2013) Importance of nitric oxide in cadmium stress tolerance in crop plants. Plant. Physiol. Biochem., 63(2): 254–261.
- Gomez-Gomez A., Martínez-Martinez M.U., Cuevas-Orta E. et al. (2014) Pulmonary manifestations of granulomatosis with polyangiitis. Reumatol. Clin., 13(2): 233–237.
- Gonzalez T.P., Mucenic T., Brenol J.C. et al. (2012) ABCB1 C1236T, G2677T/A and C3435T polymorphisms in systemic lupus erythematosus patients. Braz. J. Med. Biol. Res., 41(9): 769–772.
- Hahtola P.A., Jarvenpaa R.E., Lounatmaa K. (2012) Hard metal alveolitis accompanied by rheumatoid arthritis. Respiration., 67(2): 209–212.
- Harmens H., Foan L., Simon V., Mills G. (2013) Terrestrial mosses as biomonitors of atmospheric POPs pollution: a review. Environ Pollut., 173: 245–254.
- Holmberg S., Thelin A., Thelin N. (2014) Is there an increased risk of knee osteoarthritis among farmers? A population-based case-control study. Int. Arch. Occup. Environ Health., 77(5): 345–350.
- Homma S., Suzuki A., Sato K. (2013) Pulmonary involvement in ANCA-associated vasculitis from the view of the pulmonologist. Clin. Exp. Nephrol., 17(5): 667–671.
- Iebba F., Di Sora F., Tarasi A., Leti W. (2011) Rheumatoid arthritis: a typical multifactorial genetic disease: review of the literature. Recenti Prog. Med., 102(4): 175–182.
- Jariwala M.P., Laxer R.M. (2018) Primary vasculitis in childhood: GPA and MPA in childhood. Front. Pediatr., 16(6): 226–229.
- Kerstein A., Schüler S., Cabral-Marques O. et al. (2017) Environmental factor and inflammation-driven alteration of the total peripheral T-cell compartment in granulomatosis with polyangiitis. J. Autoimmun., 78(4): 79–91.
- Kishore N., Gupta N., Dhar A. et al. (2018) Interstitial lung disease with usual interstitial pneumonia pattern preceding the presentation of ANCA-associated vasculitis by 4 years: coincidence or correlation? Breathe, 14(3): 105–110.
- Kluger N. (2017) Tattoo-induced vasculitis: is it really the ink? Am. J. Emerg. Med., 29(3): 347–348.
- Kobayashi S., Momohara S., Kamatani N., Okamoto H. (2012) Molecular aspects of rheumatoid arthritis: role of environmental factors. FEBS J., 275(18): 4456–4462.
- Kumar P., Imam B. (2012) Footprints of air pollution and changing environment on the sustainability of built infrastructure. Sci. Total. Environ., 20(444): 85–101.
- Lamprecht P., Kerstein A., Klapa S. et al. (2018) Pathogenetic and clinical aspects of anti-neutrophil cytoplasmic autoantibody-associated vasculitides. Front. Immunol., 9(9): 680.
- Lewis J.E., Fu S.M., Gaskin F. (2018) Autoimmunity, end organ damage, and the origin of autoantibodies and autoreactive T cells in systemic lupus erythematosus. Discov. Med., 15(81): 85–92.
- Lionaki S., Blyth E.R., Hogan S.L. et al. (2012) Classification of antineutrophil cytoplasmic autoantibody vasculitides: the role of antineutrophil cytoplasmic autoantibody specificity for myeloperoxidase or proteinase 3 in disease recognition and prognosis. Arthritis Rheum., 64(10): 3452–3462.
- Mahr A., Katsahian S., Varet H. et al. (2012) Revisiting the classification of clinical phenotypes of anti-neutrophil cytoplasmic antibody-associated vasculitis: a cluster analysis. Ann. Rheum. Dis., 74(12): 234–239.
- Makol A., Reilly M.J., Rosenman K.D. (2011) Prevalence of connective tissue disease in silicosis (1985–2006) — a report from the state of Michigan surveillance system for silicosis. Am. J. Ind. Med., 54(4): 255–262.
- Marks S.D., Tullus K. (2012) Autoantibodies in systemic lupus erythematosus. Pediatr. Nephrol., 27(10): 1855–1868.
- Mohammad A.J., Jacobsson L.T., Westman K.W., Sturfelt G. (2012) Incidence and survival rates in Wegener’s granulomatosis, microscopic polyangiitis, Churg-Strauss syndrome and polyarteritis nodosa. Rheumatology, 48(12): 1560–1565.
- Moog P., Eren O., Kossegg S. et al. (2017) Pupillary autonomic dysfunction in patients with ANCA-associated vasculitis. Clin. Auton. Res., 27(6): 385–392.
- Moyer C.F., Kodavanti U.P., Haseman J.K. (2012) Systemic vascular disease in male B6C3F1 mice exposed to particulate matter by inhalation: studies conducted by the National Toxicology Program. Toxicol. Pathol., 30(4): 427–434.
- Mulloy K.B. (2013) Silica exposure and systemic vasculitis. Environ. Health Perspect, 111(16): 1933–1938.
- Nasser M., Cottin V. (2018) Alveolar hemorrhage in vasculitis (primary and secondary). Semin. Respir. Crit. Care. Med., 39(4): 482–493.
- Ruperto N. (2012) Paediatric rheumatology international trials organisation (PRINTO). Classification criteria and diagnostic tests for vasculitides. J. Rheumatol., 3(9): 1503–1505.
- Ryba M., Hruby Z., Witkiewicz W. (2013) ANCA associated vasculitis. Przegl. Lek., 70(3): 149–156.
- Sada K.E., Yamamura M., Harigai M. et al. (2014) Classification and characteristics of Japanese patients with antineutrophil cytoplasmic antibody-associated vasculitis in a nationwide, prospective, inception cohort study. Arthritis Res. Ther., 16(2): 101–109.
- Seike M. (2012) Diagnostic and therapeutic biomarkers for lung cancer patients. Nihon Rinsho, 70(5): 809–815.
- Stamm T.A., Machold K.P., Smolen J., Prodinger B. (2018) Life stories of people with rheumatoid arthritis who retired early: how gender and other contextual factors shaped their everyday activities, including paid work. Musculoskeletal. Care, 8(2): 78–86.
- Strickland F.M., Hewagama A., Lu Q. et al. (2012) Environmental exposure, estrogen and two X chromosomes are required for disease development in an epigenetic model of lupus. J. Autoimmun., 38(2–3): 135–143.
- Sun Y., He L., Lü X. et al. (2014) ANCA associated glomerulonephritis in a patient with mixed connective tissue disease. Zhong Nan Da Xue Xue Bao Yi Xue Ban, 39(2): 209–214.
- Talarico R., Barsotti S., Elefante E. et al. (2017) Systemic vasculitis and the lung. Curr. Opin. Rheumatol., 29(1): 45–50.
- Terrier B., Guillevin L. (2018) Treatment of pulmonary vasculitis. Semin. Respir. Crit. Care Med., 39(4): 504–510.
- Wang C., Li W., Chen J. (2012) Summer atmospheric polybrominated diphenyl ethers in urban and rural areas of northern China. Environ. Pollut., 171: 234–240.
- Wu C.S., Hsieh C.J., Peng Y.S. et al. (2015) Antineutrophil cytoplasmic antibody-associated vasculitis in Taiwan: A hospital-based study with reference to the population-based National Health Insurance database. J. Microbiol. Immunol. Infect., 48(5): 477–482.
- Zbinden G., Grimm L. (2015) Thrombogenic effects of xenobiotics. Arch. Toxicol., 8: 131–141.
- Zhang K., Zhang B.Z., Li S.M. et al. (2012) Calculated respiratory exposure to indoor size-fractioned polycyclic aromatic hydrocarbons in an urban environment. Sci. Total Environ., 431(1): 245–251.
Адрес для переписки:
Синяченко Олег Владимирович
Украина, 84404, Донецкая обл.,
Лиман, ул. Привокзальная, 27
Донецкий национальный
медицинский университет
Е-mail: synyachenko@ukr.net

Leave a comment