РЕТРОСПЕКТИВНЕ СПОСТЕРЕЖЕННЯ ПАЦІЄНТКИ З ДЕРМАТОМІОЗИТОМ ТА АНТИСИНТЕТАЗНИМ СИНДРОМОМ: Поліморфізм клінічних проявів І ПОШУК МЕТОДІВ ЛІКУВАННЯ
- 1Коммунальное некоммерческое предприятие Харьковского областного совета «Областная клиническая больница», Харьков
- 2Клінічна лікарня «Феофанія» Державного управління справами, Київ
Резюме. Представлено опис клінічного випадку трирічного спостереження антисинтетазного синдрому у пацієнтки молодого віку, що клінічно проявився домінуючими у клінічній картині тяжким феноменом Рейно, розвитком оклюзійної васкулопатії, критичної дигітальної ішемії, інтерстиціальною хворобою легень. Захворювання дебютувало шкірним симптомокомплексом (геліотропна еритема, еритематозні висипання на шкірі) та лихоманкою, згодом приєднався суглобовий синдром, біль у м’язах, діагностовано ураження легень (пульмоніт і інфільтрати). При імунологічному тестуванні виявлено антитіла до гістидил-тРНК-синтетази (анти-Jo-1). На підставі цього симптомокомплексу пацієнтці було встановлено діагноз «антисинтетазний синдром». Через 3 міс після появи перших шкірних симптомів розвинулася тяжка васкулопатія з розвитком критичної дигітальної ішемії пальців рук, пізніше ділянки лівої п’яти. Застосування комбінованої пульс-терапії циклофосфаном і метилпреднізолоном, лікування внутрішньовенним імуноглобуліном дозволило знизити активність дерматоміозиту, клінічні та лабораторні появи міозиту, ураження легень, зупинити прогресування васкулопатії та досягти клінічної ремісії. Однак після переривання непланованої вагітності у пацієнтки знову відзначався спалах активності захворювання з акцентом на ураження легень. З огляду на відсутність ефекту від антибактеріальної, комбінованої пульс-терапії, терапії внутрішньовенним імуноглобуліном було прийнято рішення про застосування ритуксимабу, на тлі якого вдалося досягти стабілізації стану пацієнтки.
Антисинтетазный синдром (АСС) является наиболее тяжелым подтипом течения дерматомиозита/полимиозита (ДМ/ПМ), характеризующийся развитием интерстициальной болезни легких (ИБЛ), а именно синдрома фиброзирующего альвеолита, резистентностью к традиционной глюкокортикоидной (ГК)-терапии и наличием специфических аутоантител против аминоацил-тРНК-синтетаз [1]. Это группа цитоплазматических ферментов, участвующих в синтезе белка в фазе трансляции, которые катализируют образование аминоацил-тРНК-комплекса из определенной аминокислоты и соответствующей ей тРНК. Одними из наиболее изученных и распространенных антител (до 75% всех случаев антисинтетазных антител) являются анти-Jo-1, антигеном для которых служит гистидил-тРНК-синтетаза [1, 4]. Их выявление у больных идиопатическими воспалительными миопатиями (ПМ/ДМ) рассматривают как предиктор развития интерстициального поражения легких и неблагоприятного прогноза [2]. На сегодняшний день известны и другие антисинтетазные антитела: анти-PL7, анти-PL12, анти-KS, анти-OJ, анти-EJ, анти-Zo, антитела к тирозил-тРНК-синтетазе и др. [18, 20]. Их выявление сопряжено с развитием определенного симптомокомплекса — АСС — включающего, помимо миозита, острое начало, лихорадку (у 35% больных), симметричный ревматоидоподобный неэрозивный артрит (у 75% пациентов), феномен Рейно (у ⅔ пациентов), поражение кожи ладоней и пальцев кистей по типу «руки механика» и интерстициальное поражение легких [1, 10, 16].
В 2011 г. J. Solomon и соавторами [18] были предложены предварительные критерии АСС, учитывающие наличие специфических антител в сочетании с двумя или одним большим и двумя малыми критериями. АСС отмечается у приблизительно 30% пациентов с воспалительными миопатиями [20]. Диагностика базируется на наличии антител к антиаминоацил-тРНК-синтетазе и двух симптомов из следующих: артрит, идиопатическая воспалительная миопатия (миозит) и ИБЛ. Лихорадка, «руки механика» и явления феномена Рейно также могут присутствовать, однако менее распространены [13]. Таким образом, АСС имеет определенные фенотипические особенности, отличающие его от группы ПМ/ДМ в целом [21]. Если классический дебют ПМ/ДМ характеризуется прогрессирующим нарастанием мышечной слабости или кожным синдромом, то при АСС в дебюте могут наблюдаться лихорадка, артрит/артралгия или нарастающая одышка при слабо выраженных симптомах миозита [1, 21]. Существует значительная клиническая гетерогенность АСС [4]. Так, пациенты с антителами против PL-7 могут демонстрировать мягкий субклинический миозит, который хорошо откликается на терапию. Анти-PL-7, анти-Ku и анти-SSA-52kD всегда сочетаются с тяжелым течением ИБЛ. Одновременное наличие анти-Ku повышает возможность перекрестного синдрома ПМ/склеродермия с феноменом Рейно и типичным склеродермическим поражением кожи [16]. Острая дигитальная ишемия описана у пациентов с положительным анти-Jo-1 [8, 12], при сопутствующем криоглобулинемическом васкулите, а также при анти-PL-7/anti-SSA 52kD ASS спектре антител [7].
Интерес к АСС в рамках ДМ/ПМ обусловлен особенностями его течения, значительной гетерогенностью проявлений в зависимости от спектра выявляемых антител, трудностью диагностики и дальнейшей терапии. Ранее нами проведено собственное наблюдение диагностики АСС с редкими клиническими проявлениями — тяжелым течением феномена Рейно с развитием окклюзионной васкулопатии и острой ишемии пальцев рук в дебюте заболевания [5]. В течение последующих двух лет мы продолжали курацию этой пациентки и наблюдали весь разнообразный спектр клинических проявлений и динамику развития симптомов данного редкого синдрома.
Приводим динамическое клиническое наблюдение пациентки О.
Больная О., 1984 г.р., находится в декретном отпуске по уходу за ребенком в возрасте 4 лет, обратилась на консультативный прием в Коммунальное учреждение охраны здоровья «Областная клиническая больница — Центр экстренной медицинской помощи и медицины катастроф» г. Харькова, поликлиническое отделение, в мае 2017 г. с жалобами на изъязвления и боль в области пальцев кистей, похолодение пальцев кистей, ощущение их онемения, изменения окраски кожи рук, боль в суставах кистей, стоп, коленных, голеностопных, локтевых суставов, утреннюю скованность в течение до 1 ч, повышение температуры тела до 37–37,3 °С, плохой сон, слабость в мышцах конечностей, повышенную утомляемость. На рис. 1 представлены фотографии рук пациентки при первичном обращении на консультативный прием.
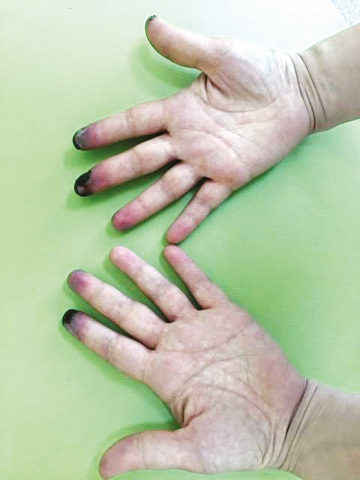
Из анамнеза известно, что пациентка О. считает себя больной с января 2017 г., когда без видимой причины появилась отечность в области левого глаза, по поводу чего обследовалась у аллерголога. Через 1 мес появился симметричный отек правого глаза, покраснение вокруг глаз, эритематозные высыпания на теле, также отмечала появление боли и слабости в мышцах, боли и отечности суставов кистей. С марта 2017 г. зафиксированы эпизоды субфебрилитета, незначительная одышка. При рентгенографии органов грудной клетки выявлены признаки двусторонней пневмонии, инфильтраты в легких. Рентгенологические изменения были расценены как пневмония, в связи с чем прошла курс антибактериальной терапии с удовлетворительным клиническим и радиологическим результатом. Во время стационарного лечения по поводу пневмонии была консультирована ревматологом, заподозрено системное заболевание соединительной ткани. При иммунологическом обследовании выявлены положительные антинуклеарные антитела (АНА), анти-RNP и анти-Jo-1. С 04.04.2017 г. назначен метилпреднизолон в дозе 32 мг/сут, на фоне которого уменьшилась отечность лица и суставов, нормализовалась температура тела, но усилились цианоз и боль в суставах кистей рук, ощущение холода в конечностях.
С 10.04.2017 г. по 12.05.2017 г. находилась на стационарном лечении в ревматологическом отделении, где был установлен диагноз: Смешанное заболевание соединительной ткани, активна фаза, активность II ст., с поражением кожи и сосудов (параорбитальный отек, эритема, синдром Рейно, дигитальная ульцерация), мышц верхних конечностей, суставов (полиартрит, ФН II ст.), легких (пульмонит), почек (ХБП I ст., нефропатия, МКБ).
При анализе медицинской документации отмечены значительные изменения в лабораторных показателях миозитспецифических ферментов: высокие колебания значений креатинфосфокиназы (КФК) — от 1613 ед./л (11.04.2017 г.) до 854 ед./л (04.05.2017 г.) при норме 26–192 ед./л. Спектр иммунологических иccледований, кроме положительных АНА, выявил повышение титров антител IgG к Jo-1 (АNA-Screen) — 3 Al — положительные.
Во время пребывания в стационаре пациентка получила 23 внутривенные инфузии алпростадила (20 мкг/сут) без клинического эффекта; в клинической картине превалировали симптомы феномена Рейно, усилились дигитальные изъязвления вплоть до формирования сухих некрозов пальцев рук. При этом динамика изменений в легких была положительная: при проведении исходного обследования (мультиспиральная компьютерная томография органов грудной клетки от 31.03.2017 г.) выявлены признаки двусторонней очаговой пневмонии, множественные инфильтраты; при повторном исследовании от 19.05.2017 г. определялось обратное развитие очагов в легких.
Кроме алпростадила, пациентка продолжала принимать 32 мг метилпреднизолона, 10 мг/нед метотрексата, фолиевую кислоту 5 мг/нед, сосудистую терапию (нифедипин, дипиридамол, пентоксифиллин, ксантинола никотинат), кислота ацетилсалициловая 75 мг/сут.
При обращении в КУОЗ «ОКБ ЦЭМП и МК» в мае 2017 г. диагноз смешанного заболевания соединительной ткани вызвал сомнения. Наличие гелиотропного отека в начале заболевания, мышечной слабости, эпизодов эритематозных высыпаний на туловище, тахикардии и аускультативных симптомов миокардита, а также анализа лабораторных изменений (повышение КФК в серии анализов, положительные антитела IgG к Jo-1), у больной был заподозрен ДМ и его особый фенотипический вариант — АСС.
Объективно состояние пациентки оценивалось как средней тяжести. Незначительный параорбитальный отек без эритемы, формирование кушингоидного типа лица. Эритематозные высыпания в области «декольте», пятна Готтрона на руках, локусы гиперпигментации на кистях. Сетчатое ливедо в области предплечий и бедер. Конечности холодные на ощупь. Сухие некрозы I–IV дистальных фаланг правой кисти, II и III пальцев левой кисти. Синюшность пальцев рук. Пятнистая синюшность левой пятки. Суставы внешне не изменены, при пальпации безболезненны, движения в полном объеме. Мышечных атрофий нет, генерализованные полимиалгии. Сила мышц в верхних конечностях снижена — 3 балла. Слабость шеи и плечевого пояса. Голову удерживает. Повышенная мышечная утомляемость. Слизистая оболочка ротовой полости без особенностей. Отмечает частые носовые кровотечения, сухость носа, сухие корки в носовых ходах. При осмотре ЛОР-специалиста — данных о перфорации носовой перегородки не получено. В легких везикулярное дыхание, фокусы жесткого дыхания в нижних отделах с обеих сторон, хрипы не выслушиваются. Частота дыхания — 17/мин. Границы сердца расширены влево. Сердечные тоны глухие, систолический шум на верхушке, точке Боткина. Тахикардия 90–100 уд./мин, АД 130/75 мм рт. ст. без существенных отличий на обеих руках. Живот мягкий, безболезненный. Печень у края реберной дуги. Селезенка не пальпируется. Стул регулярный. Мочеиспускание свободное, дизурических явлений нет. Отеков нет.
Учитывая клинико-лабораторный симптомокомплекс, пациентке был установлен следующий диагноз: Первичный дерматомиозит, антисинтетазный синдром, подострое течение, активная фаза, активность III ст., с поражением кожи (параорбитальный отек, гелиотропная эритема, эритематозные высыпания — симптом «декольте», симптом «шали», эритема Готтрона), мышц (миозит), суставов (неэрозивный артрит, полиартралгии, ФН I), феномен Рейно тяжелого течения, окклюзионная васкулопатия (дигитальные язвы, критическая ишемия конечностей, сухие некрозы дистальных фаланг рук), легких (интерстициальное поражение — пульмонит, инфильтраты, ЛН I), сердца (миокардит, СН I), с иммунологическими феноменами (позитивность по АНА, антителам к IgG Jo-1, JgG RNP).
В связи с установленным диагнозом ДМ с АСС пациентка была переведена с метилпреднизолона на преднизолон с назначением адекватной дозы; учитывая поражение легких и опасаясь дополнительно развития метотрексат-индуцированного поражения, отменили метотрексат; учитывая также окклюзионную васкулопатию с развитием критической ишемии конечностей и стадии формирования некрозов пациентка была переведена на курсовую комбинированную пульс-терапию циклофосфаном (1000 мг) и метилпреднизолоном (1000 мг 3 дня подряд). Вместо алпростадила был назначен более рекомендуемый в таких случаях илопрост [3, 9]. Сосудистая терапия была дополнена празозином/доксазозином 2 мг 2 раза в сутки длительно и силденафилом по 25 мг 2 раза в сутки, с увеличением дозы до 25 мг 3 раза в сутки через 2 нед; целевая максимальная доза (при отсутствии эффекта на предыдущих дозах) — 150 мг/сут (50 мг 3 раза в сутки). Статинотерапия включала назначение розувастатина 10 мг 1 раз в сутки; антикоагулянтная терапия — клопидогрел 75 мг/сут. В связи с применением ГК в высоких дозах был назначен комбинированный препарат кальция и витамина D.
К сожалению, повышение пероральной дозы ГК до 60 мг/сут (из расчета 1 мг/кг массы тела), переход на комбинированную пульс-терапию ГК с циклофосфаном, применение тройной вазоактивной терапии не принесли желаемых результатов: у пациентки сформировались сухие некрозы дистальных отделов пальцев рук (рис. 2а, б, в), наблюдались значительные сосудистые нарушения в области пятки (рис. 3), прогрессирующие в динамике.
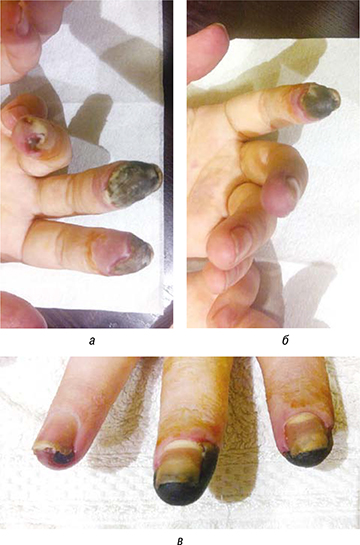
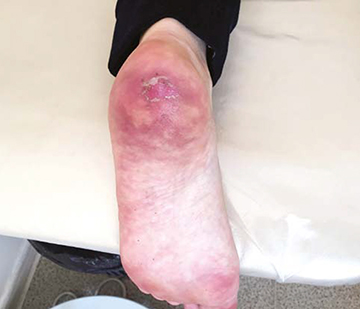
При этом сухие некрозы были четко отграничены от здоровых участков кожи; распространение некрозов, появление новых участков изъязвлений не отмечено. С учетом прогрессирования сосудистых нарушений в области левой пятки принято решение о непрерывном введении вазоактивных препаратов (илопрост) на фоне продолжения курсов комбинированной пульс-терапии и перорального приема ГК. Со стороны легких, суставов, мышц наблюдалась положительная клиническая и лабораторная динамика. Отмечена низкая лабораторная активность миозита: КФК 152 и 30 ед./л.
Учитывая прогрессирующие сосудистые нарушения, дигитальную ишемию, формирование некрозов пальцев, что было расценено как недостаточная эффективность проводимой терапии, принято решение о старте терапии внутривенным иммуноглобулином в суммарной дозе 90 г в течение 3 последовательных дней 1 раз в месяц. На фоне данной терапии отмечалась постепенная положительная динамика в отношении сосудистых нарушений в виде уменьшения выраженности явлений дигитальной ишемии, замещения зоны некрозов участками регенерированной кожи.
В сентябре 2017 г. у пациентки появляется боль в спине, по ходу позвоночника в грудном и поясничном отделах. 08.10.2017 г. проведено компьютерную томографию (КТ) грудного и поясничного отделов позвоночника. Выявлены множественные компрессионные переломы ThIX, ThXII, LI, LII. К сожалению, назначенная терапия сопровождения комбинированными препаратами кальция и витамином D не смогла профилактировать развитие тяжелого ГК-индуцированного остеопороза и его осложнений. На основании этих данных и после получения результатов рентгеновской остеоденситометрии, подтвердившей наличие остеопении (total Z-score=–1,8SD), была проведена коррекция антиостеопоротической терапии, добавлена золедроновая кислота 5 мг внутривенно капельно 1 раз в год.
Через 8 мес терапии внутривенным иммуноглобулином мы достигли стойкой положительной динамики в течении заболевания (рис. 4а, б), что позволило в дальнейшем постепенно минимизировать дозу пероральных ГК до 5 мг преднизолона в сутки. В июле 2018 г. — прекращение сеансов пульс-терапии и снижение дозы внутривенного иммуноглобулина до минимальной поддерживающей 10 г в месяц (с учетом материальных возможностей пациентки). Таким образом, к концу 2018 г. пациентка принимала 5 мг преднизолона ежедневно, илопрост ежемесячно, доксазозин 2 мг 2 раза в сутки, силденафил по 25 мг 2 раза в сутки, розувастатин 10 мг 1 раз в сутки; клопидогрел 75 мг/сут, комбинированный препарат кальция и витамина D, золедроновую кислоту 5 г 1 раз в год. В объективном статусе не отмечалось каких-либо патологических отклонений со стороны суставов, легких, сердечно-сосудистой системы, желудочно-кишечного тракта, наблюдалась отчетливая положительная динамика в виде восстановления участков здоровых тканей в области кистей и пяточной области. Миозитспецифические ферменты стойко удерживались в пределах лабораторной нормы, клиническая и лабораторная активность не отмечалась. Состояние было расценено как ремиссия.
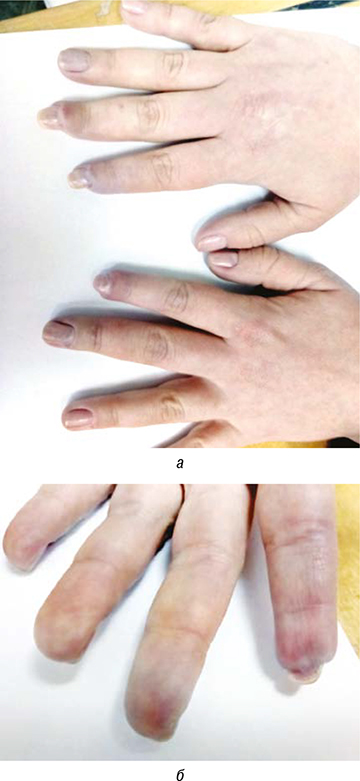
Однако в ноябре 2018 г., при очередной амбулаторной консультации пациентки, она сообщила о своей беременности в сроке 4–5 нед. С больной была проведена беседа о возможных серьезных рисках и осложнениях, возможном отрицательном влиянии гормональных изменений на течение основного заболевания. Консилярно было принято решение о прерывании беременности по медицинским показаниям, учитывая недавний прием цитостатических препаратов (перерыв после завершения терапии циклофосфаном около 3 мес), компрессионные переломы позвонков на фоне остеопороза, значительные сосудистые нарушения, а также факт дебюта заболевания в послеродовой период. В декабре 2018 г. беременность была прервана.
В январе 2019 г. состояние пациентки значительно ухудшилось: появилась нарастающая одышка, сухой кашель, ощущение нехватки воздуха, выраженная слабость, артралгия, повышение КФК до 567 ед./л. При КТ органов грудной клетки 31.01.2019 г. в паренхиме легких с обеих сторон, преимущественно в средней и нижней долях справа, в язычковом сегментах и нижней доле слева, определяются множественные, местами сливающиеся очаги и фокусы инфильтрации легочной ткани от 3 до 45 мм в диаметре без четких контуров. В субплевральных отделах легких единичные очаги поствоспалительного фиброза от 3 до 5 мм в диаметре. Легочной рисунок усилен, обогащен. Субсегментарные бронхи уплотнены. Сохраняется диффузный остеопороз со снижением высоты в передних отделах на ¼ тела ThХ, на ½ тел ThVIII, LIII, до ¾ тел ThХI, ThХII, LI, LII. Костных деструктивных изменений на исследованных уровнях не выявлено. В сравнении с КТ от 05.10.2018 г. отмечается появление инфильтративных изменений в паренхиме легких. Изменения в грудном и поясничных отделах позвоночника без динамики. Заключение: КТ-признаки двусторонней пневмонии, хроническое обструктивное заболевание легких, спондилопатии (дисгормональной) с компрессией тела ThХ первой степени, тел ThVIII, LIII второй степени, тел ThХI, ThХII, LI, LII третьей степени.
Пациентка была госпитализирована в стационар, где после проведения курса антибактериальной терапии синтетическими пенициллинами, респираторными фторхинолонами, цефалоспорином III поколения, а также на фоне продолжающейся терапии внутривенным иммуноглобулином не отмечалось положительной динамики ни в клинических, ни в рентгенологических проявлениях. Наоборот, клинические и рентгенологические симптомы со стороны легких усиливались. Так, на КТ органов грудной клетки от 11.02.2019 г. отмечалось усиление легочного рисунка и инфильтративных изменений в легких. В марте больной возобновляются ежемесячные курсы комбинированной пульс-терапии метилпреднизолоном 500 мг и циклофосфаном 750 мг, повышена доза перорального преднизолона до 40 мг/сут с небольшой положительной динамикой. Однако в мае 2019 г. состояние больной ухудшается, нарастает одышка в покое, при разговоре. Больная повторно консилярно осматривается. На основании данных клиники, анамнеза, инструментальных изменений, отсутствия динамики на фоне антибактериальной, комбинированной пульс-терапии, терапии внутривенным иммуноглобулином принято решение о начале терапии ритуксимабом в дозе 1000 мг внутривенно капельно в течение 1 мес дважды с промежутком в 2 нед. С учетом материальных трудностей пациентки и необходимости самостоятельного приобретения препаратов данная терапия была начата в июне 2019 г. Ритуксимаб доказал свою эффективность при АНЦА-ассоциированных системных васкулитах [19] и волчаночном нефрите [6]. Обоснованием для применения ритуксимаба при ДМ и АСС явились данные литературы, описание клинических случаев, когортные, ретроспективные и рандомизированные исследования [11, 14, 15, 17], а также рефрактерность пациентки к предыдущим вариантам лечения, в том числе к высокодозовой ГК-терапии. В клинических исследованиях были отмечены высокий уровень ответа на ритуксимаб, который составил 75–82%, и увеличение среднего времени без симптомов до 19 мес [17]. Ритуксимаб обычно хорошо переносился всеми пациентами, без серьезных побочных эффектов. Большинство зарегистрированных побочных эффектов были в основном инфекциями, в частности инфекциями дыхательных путей.
До начала терапии 25.06.2019 г. больной была проведена рентгенограмма органов грудной клетки. Отмечается на фоне обогащения легочного рисунка в средних, нижних легочных полях с обеих сторон наличие участков инфильтрации легочной ткани сливного характера.
01.07.2019 г. была проведена первая инфузия 1000 мг ритуксимаба внутривенно капельно, через 1 сут после введения отмечена отчетливая положительная динамика в виде значительного уменьшения одышки, уменьшения мраморности кожи, улучшение общего самочувствия и намечающаяся положительная рентгенологическая динамика (рис. 5а, б).
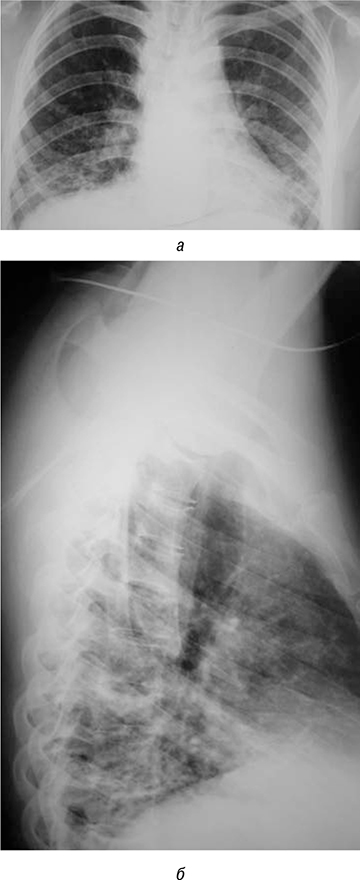
Через 2 нед проведена следующая инфузия ритуксимаба. В лабораторных показателях отмечаются положительные сдвиги: СОЭ — 15 мм/ч, незначительна анемия (гемоглобин 115 г/л), С-реактивный белок — 0,74 мг/л, КФК — 164 ед./л (норма 26–192 ед./л). Клинически: значительное уменьшение одышки, отсутствие одышки в покое и при средней физической нагрузке, уменьшение мышечной и общей слабости, общее улучшение самочувствия.
Анализируя данный клинический случай, необходимо акцентировать внимание на следующих аспектах.
Во-первых, мы впервые в своей клинической практике столкнулись с очень редким проявлением АСС — окклюзионной васкулопатией с развитием критической дигитальной ишемии с быстрым формированием некрозов кончиков пальцев, а также поражением пятки в дебюте заболевания. В доступной медицинской литературе нам удалось найти описание только двух подобных клинических случаев [8, 9]. Они свидетельствуют о крайне редком подобном проявлении АСС. Однако именно наличие анти-Jo1 обусловливает ассоциацию ПМ с васкулитом, что вызывает выраженную сосудистую недостаточность [9].
Во-вторых, отсутствие классической манифестации в виде мышечного синдрома привело к тому, что диагноз ДМ и его особый фенотипический вариант — АСС не были заподозрены на начальном этапе. Явления гелиотропного отека и эритематозных высыпаний на туловище были расценены как проявления аллергии, и больная длительное время лечилась у аллерголога. Дебют заболевания сочетал кожный синдром, поражение легких, незначительно выраженный мышечный и общеинтоксикационный синдромы. Явления васкулопатии присоединились позже, однако впоследствии стали доминировать в клинической картине. Манифестация болезни в виде пневмонии в данной ситуации явилась признаком ИБЛ, что также подтверждается данными литературы о высокой сочетаемости ИБЛ с наличием антисинтетазных антител [4].
В-третьих, на данном примере мы убедились в целесообразности и эффективности применения внутривенного иммуноглобулина при тяжелой окклюзионной васкулопатии. Нам удалось достичь обратного развития сухих некрозов, восстановления жизнеспособных тканей и купирования явлений дигитальной ишемии.
В-четвертых, мы убедились в необходимости раннего агрессивного антиостеопоротического лечения даже у пациентов молодого возраста с изначально нормальными показателями минеральной плотности кости при терапии ГК в высоких дозах. В нашем случае у пациентки молодого возраста применение пульс-терапии и перорального преднизолона в высоких дозах, несмотря на регулярный прием комбинированных препаратов кальция и витамина D, все же привело к развитию компрессионных переломов позвоночника и вызвало необходимость дополнительного применения бисфосфонатов.
В-пятых, физиологические изменения, связанные с женскими половыми гормонами, могут отрицательно влиять на основное системное заболевание соединительной ткани. Вопрос о беременности при данной патологии должен решаться строго индивидуально и только после достижения стойкой клинико-лабораторной и инструментальной ремиссии. Она должна быть планируемой, а подход к ее сохранению взвешенным и оправданным после оценки всех возможных рисков для здоровья. В нашем случае именно гормональные изменения, связанные с беременностью и ее прерыванием, стали пусковым механизмом реактивации агрессивного аутоиммунного процесса с точкой приложения на легкие.
В-шестых, мы получили положительный результат применения ритуксимаба как «терапии отчаяния» в ситуации, когда все возможные методы лечения не показали своей эффективности. Согласно существующим рекомендациям и проведенным исследованиям ритуксимаб следует всегда рассматривать при рефрактерных формах ДП/ПМ.
Таким образом, данный клинический случай представляет интерес своим ретроспективным наблюдением в течение трех лет полиморфизма АСС как наиболее тяжелого подтипа ПМ/ДМ, и представляет наибольший интерес не только для ревматологов, но и для врачей смежных специальностей (пульмонологов, аллергологов, сосудистых хирургов). Это связано как с трудностями ранней диагностики болезни, так и резистентностью (или недостаточной эффективностью) к терапии ГК с иммуносупрессивной терапией, в данном случае с метотрексатом, циклофосфаном, внутривенным иммуноглобулином, позволявшей на каком-то этапе купировать патологический процесс или замедлить его прогрессирование, однако в последующем оказавшейся абсолютно неэффективной при смещении акцентов и точек приложения аутоиммунного процесса. Обсуждение подобных редких клинических случаев необходимо для поиска путей преодоления трудностей курации таких больных, часто резистентных к общепринятой терапии ПМ/ДМ.
Авторы высказывают слова благодарности заведующей отделом комплексного снижения риска хронических неинфекционных заболеваний ГУ «Национальный институт терапии имени Л.Т. Малой Национальной академии медицинских наук Украины» доктору медицинских наук А.С. Исаевой за предоставление данных о пациентке во время проведения терапии ритуксимабом.
Список использованной литературы
- Антелава О.А., Насонов Е.Л. (2013) Фенотипические особенности и клиническая неоднородность антисинтетазного синдрома. Соврем. ревматология, 3: 41–46.
- Антелава О.А., Тарасова Г.М., Мажина Е.Г. и др. (2009) Антисинтетазный синдром — наиболее тяжелый подтип полимиозита/дерматомиозита (описание случаев). Соврем. ревматология, 4: 54–58.
- Головач И.Ю., Чипко Т.М., Корбут Н.Н. (2017) Феномен Рейно и дигитальные язвы при системной склеродермии: вопросы патофизиологии и менеджмента на современном этапе. Укр. ревматол. журн., 70(4): 15–23.
- Сіренко Ю.М., Проценко Г.О., Бойчук Н.С. (2014) Антисинтетазний синдром: особливості діагностики та лікування. Укр. ревматол. журн., 56(2): 85–88.
- Триполка С.А., Головач И.Ю. (2017) Развитие критической дигитальной ишемии у пациентки с дерматомиозитом и антисинтетазным синдромом: клинический случай. Укр. ревматол. журн., 69(3): 45–50.
- Arce-Salinas C.A., Rodrıguez-Garcıa F., Gоmez-Vargas J.I. (2012) Long-term efficacy of anti-CD20 antibodies in refractory lupus nephritis. Rheumatol. Int., 32: 1245–1249.
- Chan J.E., Palakodeti S., Koster M.J. (2017) Acute digital ischemia: A rare presentation of antisynthetase syndrome. Eur. J. Rheumatol., 4(1): 63–65.
- Disdier P., Bolla G., Harle J.R. et al. (1994) Digital necrosis disclosing antisynthetase syndrome. Ann. Dermatol. Venereol., 121: 493–495.
- Hughes M., Ong V.H., Anderson M.E. et al. (2015) Consensus best practice pathway of the UK Scleroderma Study Group: digital vasculopathy in systemic sclerosis. Rheumatology, 54: 2015–2024.
- Katzap E., Barilla-LaBarca M.L., Marder G. (2011) Review antisynthetase syndrome. Curr. Rheumatol. Rep., 13: 175–181.
- Kuye I.O., Smith G.P. (2017) The Use of Rituximab in the Management of Refractory Dermatomyositis. J. Drugs Dermatol., 16(2): 162–166.
- Laugharne M.J., Wood J.J., Mitchell D.C., Glover S.C. (2007) Arterial Occlusion from Anti-Jo1 Antibody-associated Autoimmune Myositis: Arteritis not Compartment Syndrome. EJVES Extra, 13: 23–25.
- Marie I., Josse S., Decaux O. et al. (2013) Clinical manifestations and outcome of anti-PL7 positive patients with antisynthetase syndrome. Eur. J. Intern. Med., 24: 474–479.
- Noss E.H., Hausner-Sypek D.L., Weinblatt M.E. (2006) Rituximab as therapy for refractory polymyositis and dermatomyositis, 33(5): 1021–1026.
- Oddis C.V. Reed A.M., Aggarwal R. et al. (2013). Rituximab in the treatment of refractory adult and juvenile dermatomyositis and adult polymyositis: a randomized, placebo-phase trial. Arthritis Rheum., 65(2): 314–324.
- Rigolet A., Musset L., Dubourg O. et al. (2012) Inflammatory myopathies with anti-Ku antibodies: a prognosis dependent on associated lung disease. Medicine (Baltimore), 91: 95–102.
- Rios Fernandez R., Callejas Rubio J.L., Sanchez Cano D. et al. (2009) Rituximab in the treatment of dermatomyositis and other inflammatory myopathies. A report of 4 cases and review of the literature. Clin. Exp. Rheumatol., 27(6): 1009–1016.
- Solomon J., Swigris J., Brown K. (2011) Myositis-related interstitial lung disease and antysyn-thetase symndrome. J. Bras Rheumatol., 37: 100–109.
- Stone J.H., Merkel P.A., Spiera R. et al. (2010) Rituximab versus cyclophosphamide for ANCA-associated vasculitis. N. Engl. J. Med., 363: 221–232.
- Targoff I.N. (2008) Autoantibodies and their significance in myositis. Curr. Rheumatol. Rep., 10: 333–40.
- Theilacker L.R., Brandão F., Goular F.V. et al. (2015) Antisynthetase Syndrome: two case reports and literature review. Rev. Bras. Reumatol., 55(2): 177–180.
Адрес для переписки:
Триполка Светлана Анатольевна
61058, Харьков, просп. Независимости, 13
Коммунальное некоммерческое предприятие
Харьковского областного совета
«Областная клиническая больница»
E-mail: svtripolka@gmail.com

Leave a comment