ОСТЕОАРТРИТ І КОМОРБІДНІСТЬ: ОСОБЛИВОСТІ ЛІКУВАННЯ ХВОРИХ НА СУЧАСНОМУ ЕТАПІ
Резюме. У статті обговорюються проблеми остеоартриту (ОА), які перешкоджають ефективному лікуванню пацієнтів із цим захворюванням. Це проблеми пізнього звернення до лікаря, несвоєчасного початку лікування, способу життя пацієнта і коморбідності. Відзначені особливості рекомендацій ESCEO 2019, їх відмінність від рекомендацій інших професійних товариств. Докладно розглянута покрокова терапія ОА, рекомендована ESCEO 2019. Обговорюються питання призначення хондропротекторів (SYSADOA) на першому кроці терапії замість нестероїдних протизапальних препаратів (НПЗП). Детально розглянуто місце і роль хондроїтину сульфату в лікуванні пацієнтів із ОА. Обговорюються принципи призначення пацієнтам НПЗП, гіалуронової кислоти, глюкокортикоїдних гормонів, опіоїдних анальгетиків і хірургічних методів лікування.
 DOI: 10.32471/rheumatology.2707-6970.80.15122
DOI: 10.32471/rheumatology.2707-6970.80.15122
Остеоартрит (ОА) — найпоширеніша форма артриту і провідна кістково-суглобова патологія в усьому світі [1–4]. Згідно з даними Американського коледжу ревматології (American College of Rheumatology — ACR) за 2019 р., ця патологія, виявлена у близько 302 млн осіб у світі, є провідною причиною інвалідності у пацієнтів літнього віку [4]. З віком захворюваність на ОА підвищується, втім, як і частота інших хронічних хвороб. Так, згідно з даними Міжнародного товариства з вивчення остеоартриту (Osteoarthritis Research Society International — ОARSI) і Європейського товариства з клінічних та економічних аспектів остеопорозу, остеоартриту та захворювань опорно-рухового апарату (European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases — ESCEO), якщо у одного середнього пацієнта з ОА є 4 супутні захворювання [5], то у пацієнта літнього віку, окрім ОА, є ще 8 інших хронічних захворювань [6]. Найчастіше це такі, як цукровий діабет — у 33%, дисліпідемія — у 63%, захворювання шлунково-кишкового тракту — у 65%, ожиріння — у 57%, захворювання периферичних судин — у 18%, бронхіальна астма — у 16% пацієнтів [5]. Більшість лікарів терапевтичного профілю, ортопеди-травматологи, хірурги практично щодня спілкуються з цими пацієнтами.
Проблеми остеоартриту
На сьогодні при ОА існує ряд об’єктивних і суб’єктивних чинників, які не дозволяють ефективно боротися з цим захворюванням.
Проблема перша, а може, й найважливіша — пізнє звернення. За нашими даними, звертаються за медичною допомогою на I стадії ОА лише 1% пацієнтів, на II стадії — 18% пацієнтів, на III стадії — 81% пацієнтів. Отже, на ранніх стадіях захворювання, коли можливе найефективніше лікування, хворий на ОА за медичною допомогою не звертається. У цей період у нього немає постійного болю в суглобах, виникає він лише при перевантаженні суглобів, може самоусуватися. Частіше пацієнт звертається до лікаря на III стадії ОА, коли біль виникає щодня, а ефективність консервативного лікування нижча. Пріоритет на цій стадії отримують препарати лише анальгезивної дії.
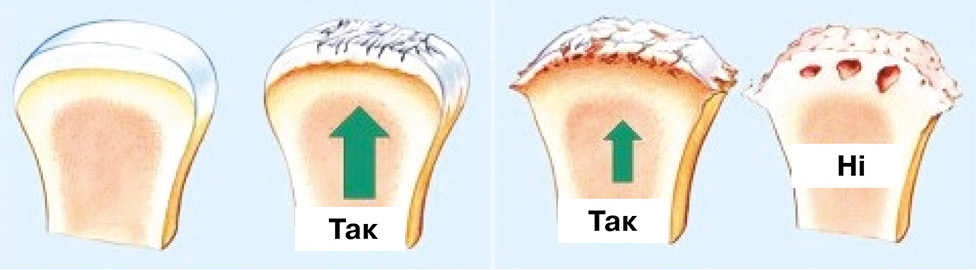
Проблема друга — несвоєчасне лікування — випливає з першої. Якщо пацієнти з ОА на ранніх стадіях хвороби рідко звертаються до лікаря за медичною допомогою, це означає, що більшість із них у цей період не отримують структурно-модифікуючого лікування і, отже, не уповільнюють прогресування хвороби. ОА у цих пацієнтів прогресує природним чином. А саме на ранніх стадіях структурно-модифікуючі препарати найбільше показані для довгострокового застосування, і саме на цих стадіях ОА можна отримати найкращий результат у лікуванні (рис. 1) [7].
Проблема третя — спосіб життя — полягає в тому, що більшість пацієнтів з ОА мають надмірну масу тіла чи метаболічний синдром, але боротися з цим не налаштовані. Існує своєрідне зачароване коло. Пацієнтові з надмірною масою тіла рекомендують зменшити її. Один із шляхів — підвищення фізичного навантаження. Але останнє призводить до посилення болю в суглобах, і пацієнт припиняє фізичні тренування. Маса тіла збільшується. З іншого боку, досягти зменшення маси тіла пацієнтові набагато важче, ніж приймати декілька лікарських препаратів. І хворі зазвичай вибирають саме цей шлях.
Проблема четверта при ОА пов’язана з коморбідністю. Небагато пацієнтів літнього віку з ОА без супутніх захворювань. Коморбідність при ОА — це неначе дві сторони однієї медалі. З одного боку, ОА істотно обмежує здатність людини самостійно управляти іншими станами, такими як цукровий діабет чи артеріальна гіпертензія (біль, знижена фізична активність, нестероїдні протизапальні препарати (НПЗП) тощо). З іншого боку, наявність супутніх захворювань обмежує застосування багатьох методів терапії ОА (фізіотерапевтичні дії, застосування НПЗП та ін.). Лікувати пацієнтів з ОА в умовах коморбідності традиційною послідовністю «діагноз — лікування» неможливо. Прийом одним пацієнтом 1–2 препаратів від кожного захворювання призводить до іншої проблеми — безпеки фармакотерапії з урахуванням поліпрагмазії.
Рекомендації щодо ведення пацієнтів з остеоартритом
У світі існує ряд міжнародних організацій та професійних співтовариств, які постійно займаються вивченням і аналізом проблем ОА, періодично представляють лікарям рекомендації з ведення цих пацієнтів. Серед найбільш впливових організацій і товариств можна назвати Європейську антиревматичну лігу (European League Against Rheumatism — EULAR) (рекомендації щодо ведення пацієнтів з ОА 2003, 2005, 2007, 2018 р.), Міжнародне товариство з вивчення остеоартриту (Osteoarthritis Research Society International — OARSI) (рекомендації 2007, 2008, 2010, 2014 р.), Американський коледж ревматології (American College of Rheumatology — ACR) (рекомендації 2012, 2019 р.), Національний інститут охорони здоров’я Великої Британії (National Institute for Health and Care Excellence — NICE) (рекомендації 2014 р.), Європейське товариство клінічних і економічних аспектів остеопорозу, остеоартриту та захворювань опорно-рухового апарату (European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases — ESCEO) (рекомендації 2014, 2016, 2019 р.). У кожного товариства свій погляд на проблему ОА, але більшість фахівців єдині в тому, що будь-який пацієнт з ОА має отримувати знеболювальну терапію і структурно-модифікуючі засоби. Зауважимо, що на Заході структурно-модифікуючі засоби для лікування пацієнтів із ОА позначають абревіатурою SYSADOA (SYmptomatic Slow Acting Drugs for OsteoArthritis — симптоматичні повільнодіючі лікарські засоби для пацієнтів із ОА). У російськомовних країнах цей довгий термін з абревіатурою SYSADOA замінюється зазвичай одним словом «хондропротектори». Йдеться про одні й ті самі лікарські препарати.
Останніми роками високий авторитет завоювало ESCEO. І не лише тому, що товариство є некомерційним, а серед його експертів — провідні фахівці з різних континентів, але й завдяки оригінальному, принципово іншому підходу до ведення пацієнтів з ОА. Останній оновлений алгоритм рекомендацій щодо ведення пацієнтів з ОА колінних суглобів прийнятий ESCEO у 2019 р. [3]. Раніше були опубліковані рекомендації у 2014 і 2016 р. [8, 9].
При підготовці рекомендацій для кожного втручання експерти ESCEO оцінювали величину ефекту (effect size — ES). За впливом на біль або функцію ES оцінювали від нуля до одиниці (0–1). Крім того, аналізували співвідношення користі–ризику, якість доказів ефективності, цінність і переваги кожного методу для пацієнта, а також вартість лікування. На основі системи GRADE кожне втручання експертами ESCEO:
- сильно рекомендовано;
- слабо рекомендовано;
- сильно не рекомендовано;
- слабо не рекомендовано.
Особливості рекомендацій ESCEO 2019
Уперше представлений покроковий алгоритм ведення пацієнтів з ОА колінних суглобів: крок перший, другий, третій і четвертий. Коли пацієнт уперше звертається до лікаря, то визначення лікувальних втручань має розпочинатися з кроку 1. Цей алгоритм рекомендацій ESCEO для лікування пацієнтів із ОА колінного суглоба отримав позитивну оцінку практичних лікарів. На наш погляд, це пов’язано з граничною ясністю викладення покрокових втручань, чітким представленням дій у разі слабкої ефективності лікування на тому чи іншому кроці, а також із включенням в рекомендації деяких принципово нових підходів до ведення пацієнтів.
Основний принцип алгоритму ESCEO — це комбінація методів лікування, включаючи нефармакологічні і фармакологічні втручання (рис. 2) [3].
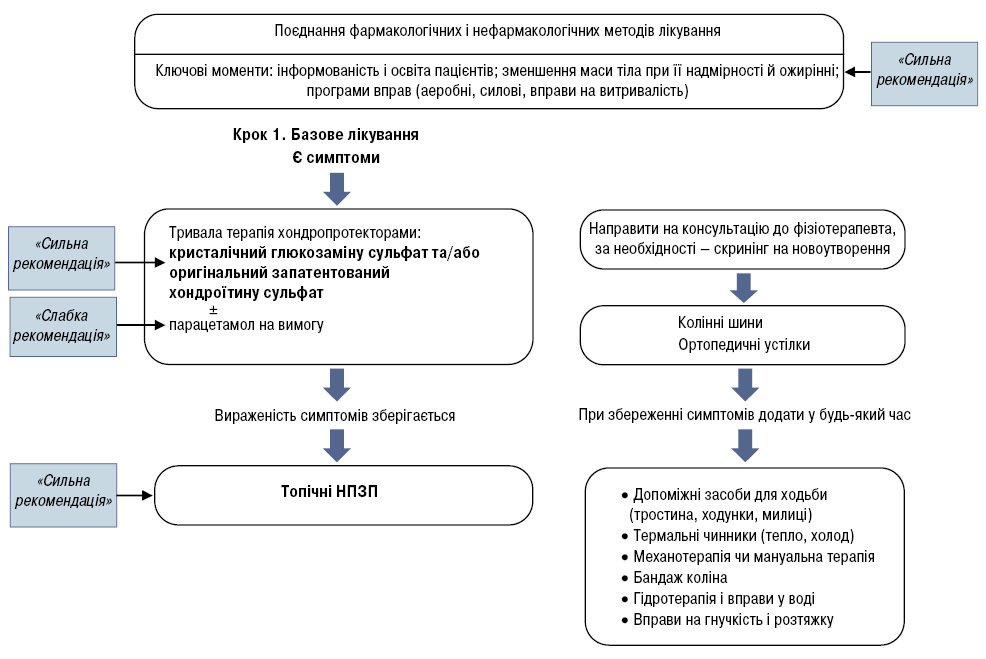
В оновлених рекомендаціях посилена значущість у комплексній терапії немедикаментозних методів лікування. Підкреслюється важливість використання недорогих, порівняно безпечних і багато в чому ефективних нефармакологічних методів впливу. Це важливо і тому, що нині розв’язати проблему ОА лише впливом лікарських засобів нереально.
Серед нефармакологічних методів передусім йдеться про освіту пацієнта, зміну звичного, сталого способу життя, зменшення маси тіла у разі її надмірності чи ожиріння [10], яким робоча група ESCEO дає сильну рекомендацію.
В обговорюваному алгоритмі уперше зменшена значущість парацетамолу в лікуванні пацієнтів із ОА. Його рекомендують застосовувати лише як додатковий засіб при збереженні клінічної симптоматики на тлі прийому хондропротекторів. Раніше лікування ОА рекомендувалося розпочинати саме з парацетамолу. Особливо чітко це було прописано в американських рекомендаціях. На перше місце ставилася невисока вартість препарату. Завжди здавалося дивним, як лікарський засіб, механізм дії якого пов’язаний головним чином з блокадою ЦОГ‑3 — ізофермента, локалізованого в основному в головному мозку, — може викликати протизапальний і анальгезивний ефект у пацієнтів з ОА, коли уражені периферичні суглоби. В останнє десятиліття збільшилася також кількість доказів наявності у парацетамолу небажаної побічної дії з боку шлунково-кишкового тракту, серцево-судинної системи, печінки і нирок [11].
На першому кроці лікування пацієнтів із ОА колінного суглоба робоча група ESCEO рекомендує призначати базисну терапію хондропротекторами (SYSADOA) [3]. Мета структурно-модифікуючої терапії при ОА — відновлення хряща, оскільки хондроцити навіть у серйозно пошкоджених ділянках хряща зберігають здатність до синтезу компонентів матриксу. Проте у класі хондропротекторів є багато різних агентів, включаючи глюкозамін, хондроїтин сульфат (ХС), діацереїн, неомилювані речовини сої та авокадо, що підтверджується різним ступенем клінічної ефективності цих препаратів.
Отже, в рекомендаціях ESCEO хондропротектори рекомендується застосовувати вже на першому кроці фармакологічного лікування. Це принципово новий підхід. Знову ж таки раніше завжди вважалося, що головне і перше завдання при лікуванні хворого на ОА — усунути біль. Лікування розпочинали з призначення анальгезивної терапії, тобто парацетамолу або НПЗП. На ранніх стадіях хвороби пацієнт отримував хороший терапевтичний, в основному знеболювальний ефект. Коли через певний час біль у суглобах рецидивував, пацієнт знав, що йому, зокрема, добре допомагав німесулід або мелоксикам. Він самостійно знаходив препарат у домашній аптечці, приймав його, і за медичною допомогою не звертався. Так тривало упродовж ряду років, поки біль у суглобах не ставав щоденним, а НПЗП були недостатньо ефективні. Але це вже була III стадія ОА. Час для ефективного патогенетичного лікування втрачено.
Серед усіх доступних продуктів, які містять глюкозамін або хондроїтин, ESCEO наполегливо рекомендує застосовувати лише запатентовані оригінальні препарати кристалічного глюкозаміну і хондроїтин сульфату, для яких доказова база однозначна [3].
Хондроїтину сульфат (ХС) — типовий представник групи хондропротекторів (SYSADOA) — застосовується в медичній практиці понад 40 років. OARSI і EULAR давно включили його в рекомендації з ведення пацієнтів з ОА.
ХС — один з основних компонентів сполучної тканини, що міститься у кістках, хрящах, сухожиллі, зв’язках, виконуючи ряд найважливіших обмінних і біомеханічних функцій. Молекула ХС — сульфатований глюкозаміноглікан, що складається з довгих нерозгалужених ланцюгів із залишками N-ацетилгалактозаміну і глюкуронової кислоти, що повторюються. Більшість N-ацетилгалактозамінових залишків сульфатуються в 4-му або в 6-му положеннях (ХС-4, ХС-6). Подібна будова молекули ХС зумовлює її участь у процесах транспорту води, амінокислот і ліпідів у гіаліновий хрящ. Довгі ланцюги ХС, що входять до складу екстрацелюлярного матриксу, визначають найважливіші біомеханічні властивості хрящової тканини: в’язкість синовіальної рідини та еластичність хряща.
У хрящі людини містяться лише хондроїтин-4‑сульфат (ХС-4) і хондроїтин-6-сульфат (ХС-6) у співвідношенні 3:1. ХС-4 переважає, і він же в основному втрачається при ОА. ХС-4 має кращу здатність притягувати воду і має кращі амортизаційні властивості. Для ХС в основному використовують сировину, що отримують із птахів, биків або акул. Окрім різного походження, ХС добувають на різних виробництвах, він може мати різні ступені очищення, відрізнятися за молекулярною масою, довжиною дисахаридів, щільністю заряду, сульфатністю, вмістом різних домішок (білки, віруси, пріони, розчинники). У табл. 1 представлено відмінності у складі різних препаратів із ХС [12]. Від походження та якості лікарського препарату ХС залежать його клінічна ефективність і безпека.
| Показник | Пташиний | Бичачий | Акулячий |
|---|---|---|---|
| Молекулярна маса, кДа | 13 | 21 | 70 |
| ХС-4,% | 72 | 61 | 32 |
| ХС-6,% | 28 | 33 | 50 |
| Несульфатовані ХС, дисульфатовані ХС,% | – | 6 | 18 |
У різному за походженням ХС також істотно розрізняється співвідношення ХС-4/ХС-6. В акулячому ХС це співвідношення <0,7, у бичачому — 1,5–2 і в пташиному — 3–4. Отже, найбільш якісним можна вважати ХС пташиного походження. Препарати мають різний ступінь очищення від домішок. Усі ці відмінності можуть насамкінець зумовлювати і різний біологічний ефект ХС [13–16], що слід враховувати при призначенні оригінальних препаратів або генериків. Серед рекомендованих ESCEO лікарських препаратів ХС пташине походження має препарат Структум («Пьєр Фабр», Франція).
За оцінкою EULAR, ХС є найбезпечнішим лікарським засобом для застосування у пацієнтів із ОА, що має значення токсичності, рівне 6 за 100-бальною шкалою [17, 18]. Найважливіша цінність ХС полягає у відсутності його взаємодії з іншими лікарськими засобами. Його метаболізм відбувається без участі системи цитохрому Р450 в печінці, ХС не є субстратом ізоферментів Р450 (CYP), не інгібує і не індукує ізоферментів цитохрому Р450. Отже, ризик розвитку небажаних явищ при поєднаному застосуванні ХС з іншими препаратами маловірогідний. Він не взаємодіє з НПЗП, анальгетиками, антибіотиками, гіпотензивними препаратами. Це надзвичайно важливо для пацієнтів похилого віку, у яких відзначається висока коморбідність і наявна потреба в одночасному використанні великої кількості лікарських засобів [19].
При застосуванні ХС у клінічній практиці виявлено, що він не відрізняється від целекоксибу щодо ефективності при симптоматичному ОА колінного суглоба [20]. Повідомлялося також, що ХС позитивно впливає на структуру суглоба, що оцінювали за змінами, візуалізованими за допомогою магнітно-резонансної томографії [21]. У спеціально проведеному метааналізі з метою оцінки ефективності ХС у пацієнтів з ОА, а саме — оригінального препарату Структум у дозі 1 г/добу — встановлено, що ХС упродовж 3–6 міс лікування ефективно знижує інтенсивність болю за шкалою ВАШ на 26 мм порівняно з початковим рівнем. Крім того, лікування препаратом Структум покращує функціональні можливості пацієнта при оцінці індексу Лекена (на 0,73 бала вище такого у разі плацебо) [22].
Робоча група ESCEO настійно рекомендує застосування запатентованого оригінального ХС у довгостроковій фоновій терапії на першому кроці лікування пацієнтів із ОА колінного суглоба. Водночас слід відрізняти рецептуру оригінального препарату від такої у низькоякісних лікарських засобів та дієтичних добавок.
Крім того, ХС — єдиний хондропротектор, який рекомендується пацієнтам з ОА суглобів кистей, згідно з оновленими рекомендаціями EULAR 2018 р. Він може призначатися для зменшення вираженості болю і поліпшення функції у пацієнтів з ОА кистей [23].
Більше того, ХС уперше з’явився в останніх рекомендаціях ACR 2019 із ведення пацієнтів з ОА [4], і це можна вважати великим проривом. Інші хондропротектори не згадуються або строго не рекомендовані. ХС умовно рекомендований ACR до застосування для лікування пацієнтів із ОА кистей (рис. 3).
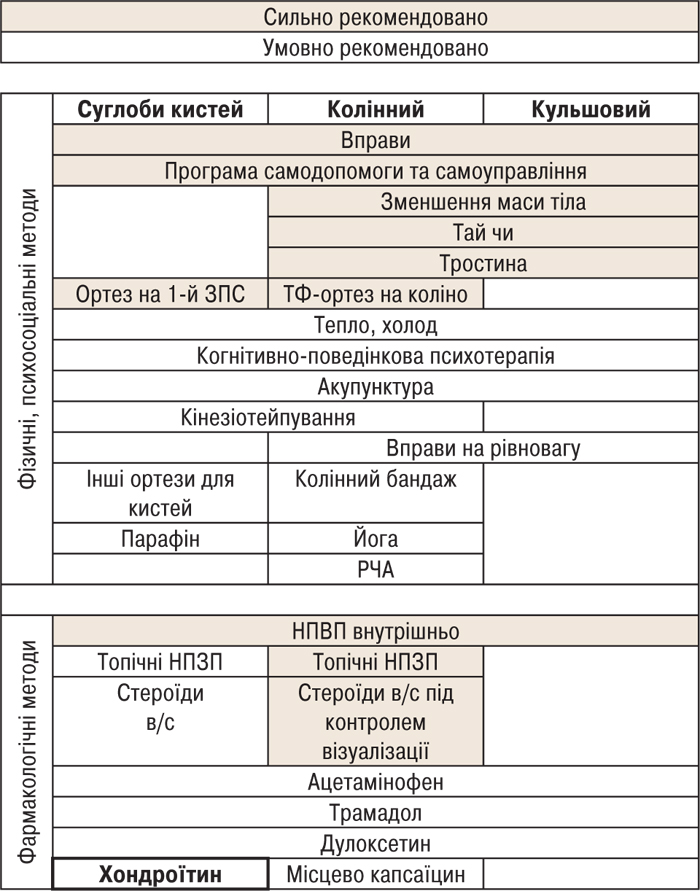
РЧА — радіочастотна абляція; в/с — внутрішньосуглобово.
Таким чином, на сьогодні ХС — єдиний хондропротектор, рекомендований одночасно для лікування у разі ОА колінних, кульшових суглобів і суглобів кистей, відповідно до таких рекомендацій з лікування ОА: EULAR (2003, 2005, 2018 р.), ESCEO (2019), ACR (2019) [3, 4, 17, 23, 24]. Причому в більшості рекомендацій ХС має високий рівень доказів та сильну рекомендацію (табл. 2).
| Хондропротектори | Гонартроз
EULAR 2003 [17] |
Коксартроз
EULAR 2005 [24] |
Суглоби кистей рук
EULAR 2018 [23] |
Гонартроз
ESCEO 2019 [3] |
Суглоби кистей рук
ACR 2019 [4] |
|---|---|---|---|---|---|
| Хондроїтину сульфат | А | A | A | Сильна | Умовно рекомендовано |
| Глюкозамін | A | Не застосовують у зв’язку з відсутністю даних при коксартрозі | Сильна* | Строго не рекомендовано | |
| Комбінація глюкозаміну та хондроїтину сульфат | Слабка
Не слід застосовувати |
Строго не рекомендовано | |||
| Неомильні з’єднання авокадо та сої | В | Не рекомендовано | Слабка | ||
| Діацереїн | В | Непереконливо | Слабка |
В офіційних документах фігурує застосування лише перорального ХС. У рекомендаціях використання ХС внутрішньом’язово чи внутрішньосуглобово не згадується, оскільки немає переконливих досліджень, що підтверджують терапевтичну ефективність парентеральних форм.
Окрім ХС, на першому кроці фармацевтичного лікування пацієнтів із ОА колінного суглоба ESCEO рекомендує застосовувати також кристалічний глюкозаміну сульфат, розмір ефекту (effect size — ES) якого у разі болю становить 0,27, що практично у 2 рази вище, ніж дія парацетамолу (ES=0,14) [25]. Глюкозаміну сульфат кристалічний має не лише анальгезивний ефект, але й впливає на функцію суглобів, а при тривалому застосуванні зумовлює структурно-модифікуючу дію [26–28]. Лише кристалізований глюкозаміну сульфат, на відміну від інших глюкозамінів, гальмує звуження суглобової щілини (ефект через 3 роки прийому 0,32) [8].
Інші форми глюкозаміну (глюкозаміну сульфат звичайний, глюкозаміну гідрохлорид) у клінічних дослідженнях не показали терапевтичної ефективності [25, 29]. Це пов’язано, очевидно, з особливостями фармакокінетики різних форм глюкозаміну.
Робоча група ESCEO настійно рекомендує застосовувати кристалічний глюкозаміну сульфат на першому кроці довгострокової фонової терапії для лікування пацієнтів із ОА колінного суглоба і не рекомендує використовувати інші форми глюкозаміну.
Враховуючи доведену клінічну ефективність і хорошу переносимість лікарських засобів ХС і глюкозаміну сульфату, їх можна розглядати як найбільш прийнятні препарати для лікування у разі клінічних проявів ОА у пацієнтів із коморбідною патологією. Проте, застосовуючи порівняно безпечні та якісні хондропротектори, слід пам’ятати про застороги при їх призначенні, що особливо актуально у коморбідних пацієнтів (табл. 3).
| Лікарський засіб |
Застереження
|
|---|---|
| Хондроїтину сульфат (Структум)* | Немає |
| Глюкозамін** |
|
| Комбінація глюкозаміну та ХС** |
|
*Згідно з інструкцією для медичного застосування в Республіці Білорусь та в Україні.
**Наведено у скороченому вигляді, згідно з Drugs.com
Застережень не містить лише інструкція для медичного застосування ХС (Структуму). Згідно з офіційною позицією ЕULAR, ХС показаний усім пацієнтам з ОА будь-якої локалізації та супутніми станами (метаболічним синдромом, цукровим діабетом, дисліпідемією, серцево-судинними, онкологічними захворюваннями) [30].
Комбінація глюкозаміну та хондроїтину. Глюкозамін і ХС часто випускають у комбінації як у вигляді дієтичних добавок, так і як лікарські препарати. Клінічні дослідження дають суперечливі результати відносно того, чи має комбінація цих складових додаткові переваги. На думку багатьох дослідників, глюкозамін і ХС у поєднанні не зменшують вираженості симптомів і не впливають на прогрес захворювання у пацієнтів з ОА [31, 32]. Як відомо, при застосуванні комбінації препаратів ХС впливає на всмоктування глюкозаміну, знижуючи його біодоступність на 50–75% [33, 34].
Робоча група ESCEO слабо не рекомендує комбінації глюкозаміну і ХС на першому кроці фонової терапії, оскільки немає препарату, який би одночасно містив обидві запатентовані оригінальні діючі речовини, і немає переконливих доказів клінічної ефективності цієї комбінації.
Інші хондропротектори. Зокрема це неомилювані соєві боби й авокадо. Ця комбінація є складною сумішшю багатьох натуральних рослинних екстрактів, отриманих із авокадо та соєвих олій. У раніше проведених клінічних дослідженнях показане деяке зменшення вираженості болю, скутості й фізичної функції при використанні неомилюваних з’єднань соєвих бобів і авокадо, що призводило до зниження потреби у застосуванні анальгезивних препаратів [35].
Діацереїн — похідне антрахінону з протизапальною активністю. У метааналізах діацереїн при тривалому застосуванні зумовлює незначний позитивний вплив на біль, що еквівалентно зменшенню вираженості болю на 9% та ES 0,24, що вище, ніж у парацетамолу [36]. Безпека діацереїну поставлена під сумнів після повідомлень про тяжку діарею та окремі випадки потенційно серйозної гепатотоксичності. Основні побічні дії виникають з боку шлунково-кишкового тракту (діарея, біль у животі, м’яке випорожнення, коліт), а також може змінюватися колір сечі [37]. Частота виникнення діареї після щоденного лікування діацереїном 100 мг, згідно з повідомленнями, варіює від 2,3 до 45,9%. Цей широкий діапазон результатів може бути частково пояснений мінливістю продуктів, що містять діацереїн, на ринку [38]. Проте Європейським агентством з лікарських засобів (EMA) зроблено висновок про те, що баланс діацереїну відносно користі й ризику залишається позитивним для ОА кульшового і колінного суглобів у пацієнтів віком до 65 років [39].
Робоча група ESCEO дає слабку рекомендацію використовувати неомилювані з’єднання авокадо, сої та діацереїн як альтернативної терапії на першому кроці лікування.
Якщо у пацієнта зберігається симптоматика після встановлення відповідної фонової фармакологічної терапії хондропротекторами, а рятівна анальгезія з парацетамолом недостатньо зменшує вираженість симптомів, до схеми лікування на першому кроці можуть бути додані топічні НПЗП.
Якщо лікування на першому кроці недостатньо ефективне, у пацієнта зберігається больовий синдром, призначають НПЗП всередину. Це вже другий крок терапії (рис. 4). Пероральні НПЗП ефективні для лікування у разі болю при ОА, зумовлюючи слабкий або помірний вплив. При цьому розмір ефекту становить 0,35–0,58 [40]. Різниці в ефективності селективних інгібіторів ЦОГ-2, частково селективних або неселективних НПЗП при ОА не виявлено [41, 42].
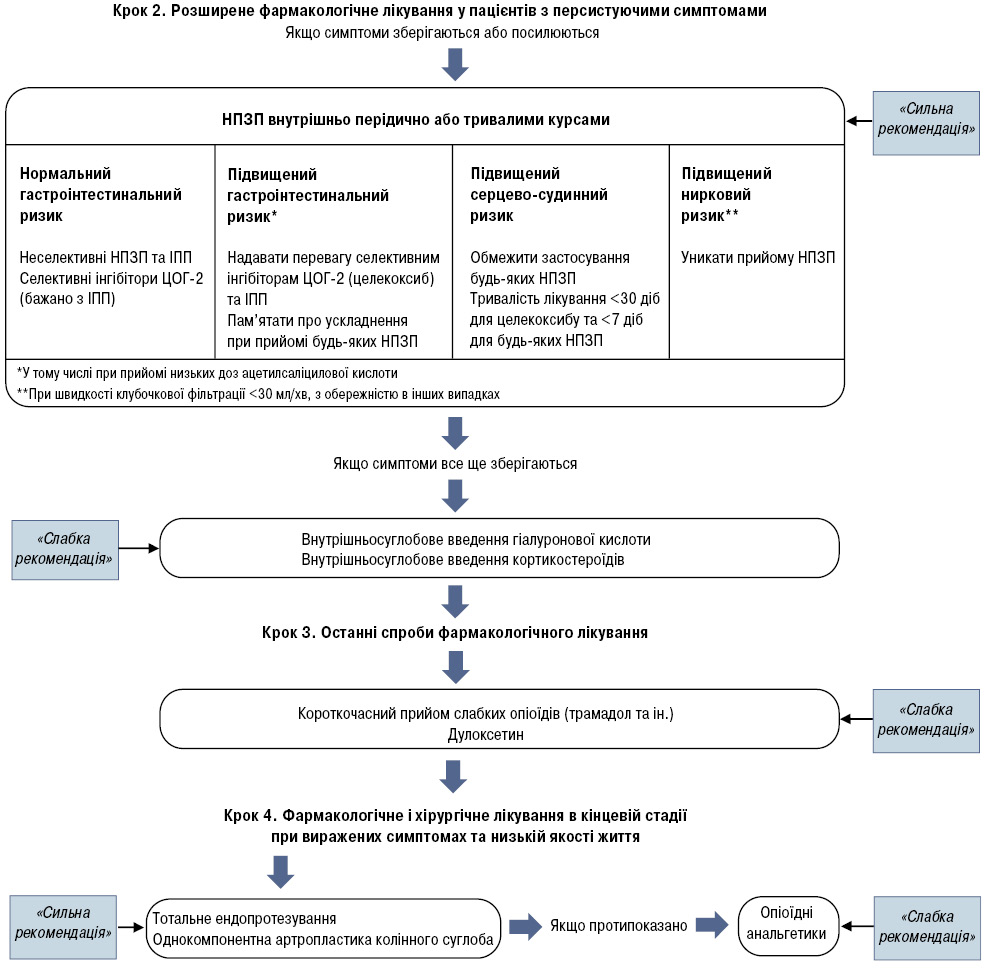 <
<Проведені метааналізи щодо оцінки безпеки НПЗП свідчать, що усі НПЗП, у тому числі й інгібітори ЦОГ-2, мають потенційну токсичність для шлунково-кишкового тракту і серцево-судинної системи. НПЗП можуть загострювати перебіг серцево-судинних захворювань, викликати дестабілізацію артеріальної гіпертензії, прогресування хронічної серцевої недостатності, знижувати ефективність препаратів, що застосовують у лікуванні пацієнтів із серцево-судинними захворюваннями (блокатори бета-адренорецепторів, діуретики, інгібітори АПФ) [43–45].
З підвищеним кардіоваскулярним ризиком особливо асоційоване тривале застосування НПЗП. У пацієнтів з артеріальною гіпертензією рекомендується вимірювати артеріальний тиск до початку прийому НПЗП і контролювати його після початку терапії. У разі наявної в анамнезі артеріальної гіпертензії рекомендується контроль артеріального тиску навіть при короткочасному прийомі НПЗП. У пацієнтів із резистентною до лікування гіпертензією слід взагалі уникати застосування НПЗП, якщо це можливо [45].
Усі НПЗП також пов’язані з підвищеним ризиком гострого ураження нирок, яке може бути особливо вираженим у перші 30 днів після початку терапії [46]. Вірогідність ураження нирок у пацієнтів з ОА нижча при збереженій функції, але небезпека ушкодження помітно підвищується при супутній артеріальній гіпертензії, серцевій недостатності або цукровому діабеті.
При ОА рекомендується застосовувати НПЗП у найефективнішій дозі впродовж короткого періоду, необхідного для контролю болю, а не тривалий час. Загалом при ОА переважає прийом НПЗП на вимогу [47]. Тому анахронізмом виглядають ситуації, коли НПЗП містяться в комбінованих хондропротекторах, що унеможливлює відміну НПЗП без відміни хондропротектора.
Робоча група ESCEO настійно рекомендує застосовувати пероральні НПЗП (селективні або неселективні) у терапії кроку 2. Застосування пероральних НПЗП має ґрунтуватися на профілі ризику пацієнта і клінічному досвіді лікаря.
Оскільки больовий синдром займає одне з провідних місць серед скарг пацієнтів літнього віку, то вони самостійно або за призначенням лікаря для усунення болю найчастіше приймають НПЗП. Вибір ефективного і безпечного препарату для цієї мети є актуальним завданням для фахівців різних спеціальностей. У коморбідних пацієнтів для кожного лікарського засобу особливо ретельно слід враховувати протипоказання до призначення, застереження, особливості застосування і взаємодію.
Як приклад можна розглянути застосування одного з НПЗП — ібупрофену у коморбідного пацієнта з ОА, тим більше що саме ібупрофен входить до складу деяких комбінованих препаратів для лікування у разі ОА. В інструкції для застосування ібупрофену зазначений ряд застережень, взаємодії препарату, що важливо враховувати при лікуванні (табл. 4).
| Лікарський засіб | Застереження | Взаємодія |
|---|---|---|
| Ібупрофен* | Протипоказаний при бронхіальній астмі, уртикарії, системному червоному вовчаку, запальних захворюваннях кишечнику.
Ризик інфаркту міокарда чи інсульту. Ризик побічних ефектів з боку шлунково-кишкового тракту: кровотечі, виразки, перфорації, виразки шлунка або кишечнику, які можуть бути летальними. Погіршує перебіг артеріальної гіпертензії. Обережно застосовувати у разі тяжкої серцевої недостатності. При захворюваннях печінки — контроль функції печінки. Контроль згортання крові |
НПЗП Метотрексат Ацетилсаліцилова кислота (NB!) Антигіпертензивні Антидіуретичні Антикоагулянти Кортикостероїди Вітаміни С, В12, D3 |
*Наведено у скороченому вигляді, згідно з Drugs.com
Побічної дії, враховуючи застереження, можна частково уникнути. Але найважливіше в цьому разі навіть не попередження, а можливість взаємодії ібупрофену з ацетилсаліциловою кислотою. Ібупрофен може конкурувати з ацетилсаліциловою кислотою за зв’язування з активним центром ЦОГ-1 і відміняти її антиагрегантний ефект. Якщо пацієнт з приводу супутньої ішемічної хвороби серця або після стентування коронарних артерій приймає ацетилсаліцилову кислоту, то призначення йому ібупрофену протипоказано, оскільки це помітно підвищує кардіоваскулярний ризик. Хворим на ОА з високим кардіоваскулярним ризиком НПЗП слід призначати з великою обережністю, дотримуючись прийнятих рекомендацій.
Внутрішньосуглобові втручання: гіалуронова кислота і кортикостероїди. У разі протипоказань до призначення НПЗП або якщо у пацієнта зберігається симптоматика, незважаючи на застосування НПЗП, можна розглянути внутрішньосуглобове введення гіалуронової кислоти. Вона може бути хорошою альтернативою НПЗП при ОА колінних суглобів зі сприятливішим профілем безпеки, особливо для пацієнтів літнього віку або хворих з високим ризиком розвитку ускладнень, викликаних НПЗП. Гіалуронова кислота при ОА зумовлює позитивний вплив на біль, функцію і загальну оцінку стану пацієнта [48, 49].
Терапевтичний ефект ін’єкцій гіалуронової кислоти може зберігатися до 6 міс. Зазвичай на курс лікування рекомендується ввести в цільовий суглоб три ін’єкції препарату. Додаткової користі від 5-ін’єкційного курсу гіалуронової кислоти порівняно з трьома ін’єкціями не отримано [50]. Побічні реакції при технічно правильному введенні гіалуронової кислоти і дотриманні показань до застосування виникають украй рідко.
Застосування низькомолекулярних препаратів гіалуронової кислоти більшою мірою показане з метою вискоіндукції (ранні стадії ОА), а високомолекулярна гіалуронова кислота прийнятніша з метою вискосуплементації (пізні стадії ОА).
Використовуючи диференційований підхід, гіалуронову кислоту можна застосовувати при будь-якій стадії ОА.
Робоча група ESCEO дає слабку рекомендацію відносно застосування гіалуронової кислоти у пацієнтів з наявними протипоказаннями до застосування НПЗП, або якщо у пацієнта все ще відзначають симптоми ОА, незважаючи на застосування НПЗП.
Кортикостероїдні гормони, введені в суглоб, швидко й ефективно пригнічують біль і запалення при синовіті (набряк і припухання суглоба). Проблема полягає в тому, що безпосередньо ОА кортикостероїди не лікують і лікувати не можуть, вони не в змозі запобігти й розвитку артрозних змін. Кортикостероїди не покращують стан суглобового хряща, не зміцнюють кісткову тканину і не відновлюють нормальний кровообіг. Проте кортикостероїди ефективніші, ніж плацебо і препарати гіалуронової кислоти в короткостроковій перспективі (2–4 тиж), їх ефективність може бути вищою у пацієнтів із сильнішим болем [51, 52].
Для внутрішньосуглобових ін’єкцій використовують зазвичай пролонговані форми бетаметазону, метилпреднізолону або тріамцинолону. Якщо перше внутрішньосуглобове введення кортикостероїдів у пацієнта з ОА не дало позитивного результату, маловірогідно, що його дасть друге або третє введення. Застосовувати внутрішньосуглобові ін’єкції кортикостероїдів як самостійний метод лікування ОА безперспективно. Їх слід призначати лише у складі комплексної терапії.
Робоча група ESCEO дає слабкі рекомендації щодо застосування кортикостероїдів внутрішньосуглобово.
Крок 3. Останні спроби фармакологічного лікування
При збереженні клінічної симптоматики у пацієнта з ОА переходять до третього кроку в лікуванні. У схему лікування можуть бути включені або слабкі опіоїди (трамадол, кодеїн), або дулоксетин. При ОА колінних суглобів є докази знеболювального ефекту трамадолу [53]. Однак є і повідомлення, що серед пацієнтів з ОА віком 50 років і старше початкове застосування трамадолу асоціювалося зі значно вищою смертністю впродовж першого року спостереження порівняно зі звичайними НПЗП, що призначалися, але не порівняно із кодеїном [54]. Менше побічних дій відзначають при застосуванні трамадолу з уповільненим вивільненням (SR).
Антидепресант дулоксетин застосовують у разі нейропатичного болю, хронічних больових синдромів, і деякі докази ефекту отримані при ОА, особливо у пацієнтів з болем внаслідок центральної сенсибілізації [55].
Дулоксетин належить до антидепресантів групи інгібіторів зворотного захоплення серотоніну і норадреналіну. Від інших його відрізняє наявність антидепресивного і одночасно анальгезивного ефектів. Дулоксетин пригнічує зворотне захоплення серотоніну і норадреналіну, внаслідок чого підвищується серотонінергічна і норадренергічна нейротрансмісія в центральній нервовій системі. Центральний механізм пригнічення больового синдрому проявляється підвищенням порогу больової чутливості при нейропатичному болю.
Проаналізувавши результати проведених досліджень, ESCEO дає слабку рекомендацію щодо застосування слабких опіоїдів, а також дулоксетину як альтернативи слабким опіоїдам на кроці 3 алгоритму лікування в останній фармакологічній спробі перед операцією.
Крок 4. Фармакологічне і хірургічне лікування в кінцевій стадії ОА при виражених симптомах і низькій якості життя
Коли можливості фармакологічного лікування вичерпані, переходять до четвертого кроку лікування. Хірургічні методи, які можуть бути використані, включають тотальне ендопротезування або однокомпонентну артропластику колінного суглоба. В останні десятиліття відзначають збільшення кількості виконаних операцій із заміни суглобів. Тотальне ендопротезування суглоба має кращу довгострокову ефективність. Ендопротезування дає кращі результати, коли пацієнти ретельно відібрані, операція виконана професійно, проведена відповідна реабілітація.
Для пацієнтів із вираженою симптоматикою, яким хірургічне втручання призначене і вони перебувають у листі очікування, або які не бажають проводити хірургічне втручання, або наявні протипоказання до операції, останнім фармакологічним засобом можуть бути класичні пероральні опіоїди або трансдермальні опіоїдні системи.
ESCEO настійно рекомендує (сильна рекомендація) проводити ендопротезування колінних суглобів у пацієнтів з ОА на кінцевій стадії захворювання. Інших ефективних методів лікування пацієнтів із ОА на цій стадії хвороби просто не існує.
Застосування ж класичних пероральних або трансдермальних опіоїдів у пацієнтів з ОА на кінцевій стадії ОА колінного суглоба розцінено як слабку рекомендацію.
Висновки
Таким чином, лікування пацієнтів із ОА нині не є таким безуспішним, як це було 30–40 років тому. В арсеналі лікаря є комплекс нефармакологічних, фармакологічних і, нарешті, хірургічних методів впливу. Найважливіше із завдань — максимально рання діагностика захворювання, своєчасне призначення адекватної та раціональної терапії з урахуванням наявності супутніх захворювань і позиції самого пацієнта. Принципово новий підхід у сучасних рекомендаціях щодо ведення пацієнтів з ОА — початок фармакологічного лікування з призначення хондропротекторів (SYSADOA). Численні дослідження підтверджують, що ХС покращує клінічний перебіг хвороби: сприяє зменшенню вираженості хронічного больового синдрому, при тривалому застосуванні зумовлює структурно-модифікуючу дію; безпечний для пацієнтів із будь-якою супутньою патологією, єдиний із хондропротекторів, рекомендований при будь-якій локалізації ОА (колінного, кульшового і ОА суглобів кистей).
Список використаної літератури
- 1. Allen K.D., Golightly Y.M. (2015) Epidemiology of osteoarthritis: state of the evidence. Curr. Opin. Rheumatol., 27(3): 276–283.
- 2. Vina E.R., Kwoh C.K. (2018) Epidemiology of Osteoarthritis: Literature Update. Curr. Opin. Rheumatol., 30(2): 160–167.
- 3. Bruyere O., Honvoa G., Veronesec N. et al. (2019) An updated algorithm recommendation for the management of knee osteoarthritis from the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Semin. Arthrit. Rheumatism, 49: 337–350.
- 4. Sharon L., Kolasinski S.L., Neogi T. et al. (2020) 2019 American College of Rheumatology/Arthritis Foundation Guideline for the Management of Osteoarthritis of the Hand, Hip, and Knee. Arthrit. Care Res., 72(2): 149–162.
- 5. OARSI (2016) Osteoarthritis: A Serious Disease, Submitted to the U.S. Food and Drug Administration. Dec. 1.
- 6. Atlas of Osteoarthritis, ESCEO (2018).
- 7. Сорока Н.Ф. (2008) Биохимические и патофизиологические основы эффективности хондроитинсульфата при остеоартрозе. Здравоохранение, 9: 65–67.
- 8. Bruyere O., Cooper C., Pelletier J.-P. et al. (2014) An algorithm recommendation for the management of knee osteoarthritis in Europe and internationally: a report from a task force of the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO). Semin. Arthritis Rheum., 44(3): 253–263.
- 9. Bruyere O., Cooper C., Pelletier J.-P. et al. (2016) A consensus statement on the European Society for Clinical and Economic Aspects of Osteo-porosis and Osteoarthritis (ESCEO) algorithm for the management of knee oste-oarthritis From evidence-based medicine to the real-life setting. Semin. Arthritis Rheum., 45(Suppl. 4S): S3–S11.
- 10. Messier S.P., Resnik A.E., Beavers D.P. et al. (2018) Intentional weight loss in overweight and obese patients with knee osteoarthritis: is more better? Arthritis Care Res. (Hoboken), 70(11): 1569–1575.
- 11. Conaghan P.G., Arden N., Avouac B. et al. (2019) Safety of paracetamol in osteoarthritis: what does the literature say? Drugs Aging, 36 (Suppl. 1): 7–14.
- 12. Martel-Pelletier J., Farran A., Montell E. et al. (2015) Discrepancies in com-position and biological effects of different formulations of chondroitin sulfate. Molecules, 20(3): 4277–4289.
- 13. Imada K., Oka H., Kawasaki D. et al. (2010) Anti-arthritic action mechanisms of natural chondroitin sulfate in human articular chondrocytes and synovial fibroblasts. Biol. Pharm. Bull., 33(3): 410–414.
- 14. Volpi N. (2009) Quality of different chondroitin sulfate preparations in relation to their therapeutic activity. J. Pharm. Pharmacol., 61(10): 1271–1280.
- 15. Rainsford K.D. (2009) Importance of pharmaceutical composition and evidence from clinical trials and pharmacological studies in determining effectiveness of chondroitin sulphate and other glycosaminoglycans: a critique. J. Pharm. Pharmacol., 61(10): 1263–1270.
- 16. Lauder R.M. (2009) Chondroitin sulfate: a complex molecule with potential impacts on a wide range of biological systems. Complement. Ther. Med., 17(1): 56–62.
- 17. Jordan K.M., Arden N.K., Doherty M. et al. (2003) EULAR Recommendations 2003: An Evidence Based Approach to the Management of Knee Osteoarthritis: Report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Ann. Rheum. Dis. Dec., 62(12): 1145–1155.
- 18. Volpi N. (2019) Chondroitin Sulfate Safety and Quality. Molecules, 24(8): 1447.
- 19. Аникин С.Г., Алексеева Л.И. (2012) Хондроитин сульфат: механизмы действия, эффективность и безопасность при терапии остеоартрита. Соврем. ревматол., 2: 78–82.
- 20. Reginster J.Y., Dudler J., Blicharski T., Pavelka K. (2017) Pharmaceutical-grade Chondroitin sulfate is as effective as celecoxib and superior to placebo in symptomatic knee osteoarthritis: the ChONdroitin versus CElecoxib versus Placebo Trial (CON-CEPT). Ann. Rheum. Dis., 76(9): 1537–1543.
- 21. Pelletier J.P., Raynauld J.P., Beaulieu A.D. et al. (2016) Chondroitin sulfate efficacy versus celecoxib on knee osteoarthritis structural changes using magnetic resonance imaging: a 2-year multicentre exploratory study. Arthritis Res. Ther., 18(1): 256.
- 22. Schneider H., Maheu E., Cucherat M. (2012) Symptom-Modifying Effect of Chondroitin Sulfate in Knee Osteoarthritis: A Meta-Analysis of Randomized Placebo-Controlled Trials Performed with Structum. Open Rheumatol. J., 6: 183–189.
- 23. Kloppenburg M., Féline PB Kroon F.P.B. et al. (2018) 2018 update of the EULAR recommendations for the management of hand osteoarthritis. Ann. Rheum. Dis., 0: 1–9.
- 24. Zhang W. (2005) EULAR evidence based recommendations for the management of hip osteoarthritis: report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann. Rheum. Dis., 64: 669–681.
- 25. Eriksen P., Bartels E.M., Altman R.D. et al. (2014) Risk of bias and brand explain the observed inconsistency in trials on glucosamine for symptom-atic relief of osteoarthritis: a meta-analysis of placebo-controlled trials. Arthritis Care Res. (Hoboken), 66(12): 1844–1855.
- 26. Pavelka K., Gatterova J., Olejarova M. et al. (2002) Glucosamine sulfate use and delay of progression of knee osteoarthritis: a 3-year, randomized, pla-cebo-controlled, double-blind study. Arch. Intern. Med., 162(18): 2113–2123.
- 27. Bruyere O., Pavelka K., Rovati L.C. et al. (2008) Total joint replacement after glucosamine sulphate treatment in knee osteoarthritis: results of a mean 8-year observation of patients from two previous 3-year, rand-omised, placebo-controlled trials. Osteoarthritis Cartilage, 16(2): 254–260.
- 28. Gregori D., Giacovelli G., Minto C. et al. (2018) Associa-tion of pharmacological treatments with long-term pain control in patients with knee osteoarthritis: a systematic review and meta-analysis. JAMA, 320 (24): 2564–2579.
- 29. Runhaar J., Rozendaal R.M., Middelkoop M.V. et al. (2017) Subgroup analyses of the effectiveness of oral glucosamine for knee and hip osteoarthritis: a systematic review and individual patient data meta-analysis from the OA trial bank. Ann. Rheum. Dis., 76(11): 1862–1869.
- 30. Sakellariou G., Conaghan P.G., Zhang W. et al. (2017) EULAR recommendations for the use of imaging in the clinical management of peripheral joint osteoarthritis. Ann. Rheum. Dis., 76(9): 1484–1494.
- 31. Yang S., Eaton C.B., McAlindon T.E., Lapane R.L. (2015) Effects of glucosamine and chondroitin on treating knee osteoarthritis: an analysis with marginal structural models. Arthrit. Rheumatol., 67(3): 714–723.
- 32. Roman-Blas J.A., Castaneda S., Sanchez-Pernaute O. et al. (2017) Combined treatment with chondroitin sulfate and glucosamine sulfate shows no superiority over placebo for reduction of joint pain and func-tional impairment in patients with knee osteoarthritis: a six-month multicenter, randomized, double-blind, placebo-controlled clinical trial. Arthritis Rheumatol., 69(1): 77–85.
- 33. Altman R.D. (2009) Glucosamine therapy for knee osteoarthritis: pharmacokinetic con-siderations. Expert Rev. Clin. Pharmacol., 2(4): 359–371.
- 34. Jackson C.G., Plaas A.H., Sandy J.D. et al. (2010) The human pharmacokinetics of oral ingestion of glucosamine and chondroitin sulfate taken separately or in combination. Osteoarthrit. Cartilage, 18(Iss. 3): 297–302.
- 35. Appelboom T., Schuermans J., Verbruggen G. et al. (2001) Symptoms modifying effect of avocado/soybean unsaponifiables (ASU) in knee osteoarthri-tis. A double blind, prospective, placebo-controlled study. Scand. J. Rheumatol., 30(4): 242–247.
- 36. Bartels E.M., Bliddal H., Schondorff P.K. et al. (2010) Symp-tomatic efficacy and safety of diacerein in the treatment of osteoarthritis: a meta-analysis of randomized placebo-controlled trials. Osteoarthrit. Cartilage, 18(3): 289–296.
- 37. Honvo G., Reginster J-Y., Rabenda V. et al. (2019) Safety of symptomatic slow-acting drugs for osteoarthritis: outcomes of a systematic review and meta-analysis. Drugs Aging., 36(Suppl. 1): 65–99.
- 38. Pelletier J.P., Martel-Pelletier J. (2018) Diacerein-containing products: same risk of diarrhoea? Aging Clin. Exp. Res., 30(4): 411–412.
- 39. EMA (2018) European Medicines Agency. Assessment report for diacerein containing medicinal products. EMA/527347/2014. Available from: http://www.ema. europa.eu/docs/en_GB/ document_library/ Referrals_document/Diacerein/ European_Commission_final_decision / WC500173145.pdf [Accessed Apr. 27].
- 40. da Costa B.R., Reichenbach S., Keller N. et al. (2017) Effective-ness of non-steroidal anti-inflammatory drugs for the treatment of pain in knee and hip osteoarthritis: a network meta-analysis. Lancet, 390(10090): e21–33.
- 41. Pelletier J-P., Martel-Pelletier J., Rannou F., Cooper C. (2016) Efficacy and safety of oral NSAIDs and analgesics in the management of osteoarthritis: evidence from real-life setting trials and surveys. Semin. Arthritis Rheum.; 45(Suppl. 4): S22–27.
- 42. Jung S.Y., Jang E.J., Nam S.W. et al. (2018) Comparative effective-ness of oral pharmacologic interventions for knee osteoarthritis: a network meta-analysis. Mod. Rheumatol., 28(6): 1021–1028.
- 43. Cooper C., Chapurlat R., Al-Daghri N. et al. (2019) Safety of oral non-selective non-steroidal anti-inflammatory drugs in oste-oarthritis: what does the literature say? Drugs Aging, 36(Suppl. 1): 15–24.
- 44. Alekseeva L.I., Nasonov E.L. (2013) Osteoarthritis and comorbidities. Medicographia, 35: 152–157.
- 45. Szeto C-C., Sugano K., Wang J-G. et al. (2020) Non-steroidal Anti-Inflammatory Drug (NSAID) Therapy in Patients With Hypertension, Cardiovascular, Renal or Gastrointestinal Comorbidities: Joint APAGE/APLAR/APSDE/APSH/APSN/PoA Recommendations Gut., 69(4): 617–629.
- 46. Ungprasert P., Cheungpasitporn W., Crowson C.S., Matteson E.L. (2015) Individual non-steroidal anti-inflammatory drugs and risk of acute kidney injury: a systematic review and meta-analysis of observational studies. Eur. J. Intern. Med., 26(4): 285–291.
- 47. Ho K.Y., Gwee K.A., Cheng Y.K. et al. (2018) Nonsteroidal Anti-Inflammatory Drugs in Chronic Pain: Implications of New Data for Clinical Practice. J. Pain Res., 11: 1937–1948.
- 48. Cooper C., Rannou F., Richette P., Bruyere O. et al. (2017) Use of intraarticular hyaluronic acid in the management of knee osteoarthritis in clini-cal practice. Arthritis Care Res. (Hoboken), 69(9): 1287–1296.
- 49. Pelletier J-P., Raynauld J.P., Abram F. et al. (2018) Exploring determinants predicting response to intra-articular hyaluronic acid treatment in symptomatic knee osteoarthritis: 9-year follow-up data from the Osteoarthritis Initiative. Arthritis Res. Ther., 20(1): 40.
- 50. Stitik T.P., Issac S.M., Modi S. et al. (2017) Effectiveness of 3 weekly injections compared with 5 weekly injections of intra-articular sodium hyaluronate on pain relief of products: a systematic review and meta-analysis. Arch. Phys. Med. Rehabil., 98(5): 1042–1050.
- 51. van Middelkoop M., Arden N.K., Atchia I. et al. (2016) The OA trial bank: meta-analysis of individual patient data from knee and hip osteo-arthritis trials show that patients with severe pain exhibit greater benefit from intra-articular glucocorticoids. Osteoarthritis Cartilage, 24(7): 1143–1152.
- 52. Juni P., Hari R., Rutjes A.W. et al. (2015) Intraarticular corticosteroid for knee osteoarthritis. Cochrane Database Syst. Rev., 10: CD005328.
- 53. Pelletier J.P., Martel-Pelletier J., Rannou F., Cooper C. (2016) Efficacy and safety of oral NSAIDs and analgesics in the management of osteoarthritis: evidence from real-life setting trials and surveys. Semin. Arthritis Rheum., 45(4 Suppl.): S22–27.
- 54. Zeng C., Dubreuil M., LaRochelle M.R. et al. (2019) Association of Tramadol With All-Cause Mortality Among Patients With. JAMA, 321(10): 969–982.
- 55. Wang Z.Y., Shi S.Y., Li S.J. et al. (2015) Efficacy and safety of duloxe-tine on osteoarthritis knee pain: a meta-analysis of randomized controlled trials. Pain Med., 16(7): 1373–1385.
- 56. Nuesch E., Rutjes A.W., Husni E. et al. (2009) Oral or transdermal opioids for osteoarthritis of the knee or hip. Cochrane Database Syst. Rev., 4: CD003115.
Остеоартрит и коморбидность: особенности лечения больных на современном этапе
Белорусский государственный медицинский университет, Минск, Республика Беларусь
Резюме. В статье обсуждаются проблемы остеоартрита (ОА), препятствующие эффективному лечению пациентов с этим заболеванием. Это проблема позднего обращения к врачу, несвоевременного начала лечения, проблема образа жизни пациента и коморбидности. Отмечены особенности рекомендаций ESCEO 2019, их отличие от рекомендаций других профессиональных сообществ. Подробно рассмотрена пошаговая терапия при ОА, рекомендованная ESCEO 2019. Обсуждаются вопросы назначения хондропротекторов (SYSADOA) на первом шаге терапии вместо нестероидных противовоспалительных препаратов (НПВП). Подробно рассмотрены место и роль хондроитина сульфата в лечении пациентов с ОА. Обсуждаются принципы назначения пациентам НПВП, гиалуроновой кислоты, глюкокортикоидных гормонов, опиоидных анальгетиков и хирургических методов лечения.
Ключевые слова: остеоартрит, рекомендации ESCEO, SYSADOA, хондроитина сульфат, коморбидность.
Адреса для листування:
Сорока Микола Федорович
220116, Республіка Білорусь, Мінськ,
просп. Дзержинського, 83
Білоруський державний медичний університет
E-mail: nsoroka02011949@gmail.com

Leave a comment