НПЗП У ПАЦІЄНТІВ З РЕВМАТОЛОГІЧНОЮ ПАТОЛОГІЄЮ ТА ХРОНІЧНОЮ ХВОРОБОЮ НИРОК: ПРИЗНАЧАТИ ЧИ НЕ ПРИЗНАЧАТИ?
Резюме. Курація больового синдрому у пацієнтів з ревматологічними захворюваннями та хронічною хворобою нирок (ХХН) ускладнена через застереження щодо застосування у цієї групи хворих нестероїдних протизапальних препаратів (НПЗП). Метою даної публікації було представити можливі підходи до призначення НПЗП ревматологічним хворим з ХХН та вибору раціонального НПЗП. Методи. Проведено огляд літератури та наведено відомості щодо можливих ризиків застосування різних НПЗП. Результати та обговорення. Розглянуто ризики застосування НПЗП у різних категорій хворих на ХХН, можливі побічні реакції, а також вплив факторів ризику розвитку побічних реакцій з боку нирок при застосуванні НПЗП. Наведені дані щодо ризику розвитку нефротоксичності при застосуванні різних НПЗП, а також рекомендації щодо їх використання у окремих категорій пацієнтів. Увагу привертають диклофенак як представник «традиційних» НПЗП, що має один із найнижчих ризиків розвитку нефротоксичності для цієї групи препаратів, а також німесулід — селективний інгібітор ЦОГ-2, що продемонстрував сприятливий профіль безпеки щодо нирок, потребують подальшого аналізу кетопрофен та окремі коксиби. Висновки. НПЗП можуть застосовуватися у деяких категорій ревматологічних пацієнтів з ХХН з урахуванням індивідуального ризику розвитку нефротоксичності і тривалості прийому, а також під пильним медичним наглядом.
DOI: 10.32471/rheumatology.2707-6970.80.15159
Вступ
 Нестероїдні протизапальні препарати (НПЗП) широко застосовуються з метою курації хронічного больового синдрому у пацієнтів з ревматологічними захворюваннями. Хронічне запалення, характерне для багатьох із цих патологій, обґрунтовано розглядається медичним співтовариством як фактор ризику розвитку тяжких коморбідних хронічних захворювань [1]. Найчастіше у пацієнтів з ревматологічними захворюваннями спостерігаються такі коморбідні патології, як серцево-судинні захворювання, інтерстиціальні ураження легень, остеопороз, хронічні захворювання нирок, злоякісні новоутворення та ін. [2–5]. Безсумнівний і виправданий інтерес дослідників до коморбідних станів при ревматичних захворюваннях не згасає в останнє десятиліття і зумовлений їхнім впливом на перебіг і прогноз ревматичного захворювання, вибір тактики лікування і якість життя хворих [1].
Нестероїдні протизапальні препарати (НПЗП) широко застосовуються з метою курації хронічного больового синдрому у пацієнтів з ревматологічними захворюваннями. Хронічне запалення, характерне для багатьох із цих патологій, обґрунтовано розглядається медичним співтовариством як фактор ризику розвитку тяжких коморбідних хронічних захворювань [1]. Найчастіше у пацієнтів з ревматологічними захворюваннями спостерігаються такі коморбідні патології, як серцево-судинні захворювання, інтерстиціальні ураження легень, остеопороз, хронічні захворювання нирок, злоякісні новоутворення та ін. [2–5]. Безсумнівний і виправданий інтерес дослідників до коморбідних станів при ревматичних захворюваннях не згасає в останнє десятиліття і зумовлений їхнім впливом на перебіг і прогноз ревматичного захворювання, вибір тактики лікування і якість життя хворих [1].
Підвищений ризик розвитку хронічної хвороби нирок (ХХН) у пацієнтів з ревматичними захворюваннями, як припускають, пов’язаний з тривалим системним запаленням. Показано, що у тій чи іншій мірі зниження швидкості клубочкової фільтрації (ШКФ) — основного маркера розвитку ХХН, відмічається майже у 95% пацієнтів ревматологічного профілю [6]. При цьому легке зниження ШКФ спостерігається у більш ніж 50% хворих, а помірне — у 30%, що відповідає ХХН 2–4-ї стадій або ХХН 1–3-ї стадій відповідно. Водночас у пацієнтів зі зниженою ШКФ відмічають підвищений ризик розвитку токсичних ефектів, пов’язаних з прийомом лікарських засобів, що пов’язано з порушеннями метаболізму та виведення діючих речовин, і, відповідно, накопиченням препаратів та їх метаболітів. Упродовж тривалого часу медична спільнота з обережністю застосовувала НПЗП у пацієнтів з ХХН, і цей консенсус продовжує впливати на рутинну практику й до сьогодні [7–9]. В основі консенсусу щодо обмеженого застосування НПЗП при ХХН лежать міркування щодо ролі простагландинів у функціонуванні нирок [10]. У той же час рівень застосування НПЗП у пацієнтів з ХХН є значним [11, 12]. Більше половини пацієнтів із ХХН потребує призначення анальгетиків [13]. При цьому 27,5% пацієнтів з ХХН отримують парацетамол, а 17,2% — інші НПЗП. В іншому метааналізі було показано, що рівень застосування НПЗП у пацієнтів із ХХН варіює в межах 8–21% [14].
Враховуючи труднощі з курацією больового синдрому у даній популяції хворих, далі буде наведено огляд досліджень щодо застосування НПЗП у пацієнтів із ХХН, та рекомендації, що передбачають більш індивідуалізований підхід, який приймає до уваги стадію ХХН та наявність інших супутніх захворювань, що впливають на ризик розвитку побічних ефектів при прийомі НПЗП.
Можливі механізми розвитку нефротоксичності при застосуванні НПЗП
НПЗП виявляють знеболювальну, протизапальну та жарознижувальну дію за рахунок пригнічення ферментів циклооксигенази (ЦОГ). Ферменти ЦОГ перетворюють арахідонову кислоту, вивільнену з клітинної мембрани, на різні ейкозаноїди, а саме тромбоксани та простагландини (PG). Ці похідні жирних кислот діють локально паракринним та аутокринним чином, насамперед, як модулятори дії системних гормонів [15].
Дві ізоформи циклооксигенази, ЦОГ-1 і ЦОГ-2, мають різні функції, які, втім, частково перекриваються. ЦОГ-1 експресується конститутивно у багатьох тканинах і підтримує фізіологічні функції, включаючи сприяння перфузії та функції нирок, регуляцію агрегації тромбоцитів та захист слизової оболонки шлунка [16]. Експресія ЦОГ-2 модифікується факторами росту, цитокінами та іншими зовнішніми сигналами і активується у відповідь на запалення [15]. Хоча відмінності в генорегуляції обох ізоформ ЦОГ призводять до більш вираженої конститутивної експресії ЦОГ-1 та індукованої експресії ЦОГ-2 у багатьох тканинах, ЦОГ-2 також конститутивно експресується в нирках [15,17].
ЦОГ-2 значною мірою відповідає за збільшення вироблення простагландину за обставин, що вимагають збільшення ниркового кровотоку, в тому числі у випадках зменшення ефективного циркуляційного об’єму та зниження ШКФ [15]. Експресія ЦОГ-2 активується в нирках тварин у відповідь на зменшення об’єму та наявність циркулюючого ангіотензину‑II, посилюючи синтез простагландинів, що призводить до локальної адаптації [18–21]. Незважаючи на те, що між людьми та тваринами існують відмінності в локалізації ЦОГ-2, стратегічні місця розташування цього ферменту та його регуляція під фізіологічним навантаженням в обох моделях свідчать про те, що ЦОГ-2 відіграє вирішальну роль в адаптаційних механізмах, спрямованих на захист функціональної стабільності нирок [15]. Отже, інгібування НПЗП ЦОГ-2, ймовірно, є основною причиною їх нефротоксичності [15, 22].
Основними ейкозаноїдами в нирках є PGI2, PGE2, тромбоксан A2 (TXA2) та PGF2α [15]. Простагландини відіграють значну роль у модуляції ниркового кровотоку та ШКФ. Вазодилатуючі простагландини протидіють судинозвужувальним ефектам для підтримки ниркового кровотоку, ШКФ та перитубулярної капілярної перфузії [23, 24]. Простагландини також впливають на нирковий метаболізм натрію, води та калію [23, 24]. Простагландини пригнічують реабсорбцію натрію та пом’якшують ефекти антидіуретичного гормону, що призводить до натрійурезу та акварезу, тоді як стимуляція простагландинами реніну призводить до синтезу альдостерону та секреції калію [23, 24]. На відміну від багатьох системних гормонів, які діють однонаправлено, простагландини контролюють делікатний баланс, впливаючи як на процеси виведення, так і на процеси утримання натрію, води та калію, а тому їх вплив є складним і локалізованим.
Зменшення ефективного циркуляційного об’єму внаслідок різних обставин спостерігається під впливом збільшення продукції простагландину, що призводить до збільшення ниркового кровотоку, продукції реніну та затримки натрію та води [25]. Продукція простагландину збільшується при ХХН як механізм поліпшення перфузії нефронів, що залишились функціональними, навіть за відсутності зменшення циркуляційного об’єму [10]. Це важливо для підтримання базових значень ШКФ [15].
Ризик розвитку нефротоксичності при прийомі НПЗП
На даний час у клінічних настановах рекомендують уникати тривалого застосування НПЗП при ХХН із ШКФ > мл/хв/1,73 м2 та повністю відмовитися від їх застосування при ШКФ <30 мл/хв/1,73 м2 [26–28]. Занепокоєння щодо нефротоксичності НПЗП у пацієнтів із ХХН виникли в епоху комбінованих анальгетиків, у яких НПЗП випускалися разом із фенацетином, парацетамолом або саліциламідом та кофеїном чи кодеїном, і було засноване на застереженнях щодо відсутності ниркового резерву у пацієнтів з ХХН [29].
Епідеміологічні дослідження свідчать про підвищення ризику розвитку нефротоксичності при самостійному застосуванні НПЗП у пацієнтів із ХХН. Однак доступні епідеміологічні дослідження, у ході яких вивчали ризик прогресування ХХН на фоні прийому НПЗП, мають ряд недоліків, що можуть спотворювати результати [30]. Це, вірогідно, і є причиною суттєвих відмінностей у результатах таких досліджень. Результати цих досліджень свідчать про здатність НПЗП викликати розвиток нефротоксичності при ХХН та водночас про наявність сильних модифікаторів цього ефекту, таких як стан здоров’я, тягар хронічних захворювань та застосування інших лікарських засобів (табл. 1), що робить ці висновки дещо суперечливими. У багатьох дослідженнях також відсутня стратифікація пацієнтів за стадією ХХН або взагалі було виключено хворих з ХХН 4–5-ї стадії.
Таблиця 1. Фактори ризику розвитку нефротоксичності при застосуванні НПЗП
| Несприятлива побічна реакція | Фактори ризику |
|---|---|
| Гостре ураження нирок |
|
| Гіперкаліємія |
|
| Гіпонатріємія |
|
| Гіперволемія |
|
| Збільшення вираженості артеріальної гіпертензії |
|
| Прогресування ХНН |
|
Ризик розвитку деяких із цих станів, спровокованих нефротоксичністю НПЗП, розглянуто нижче.
Гостре ураження нирок (ГУН)
Основне занепокоєння, пов’язане із застосуванням НПЗП, викликає розвиток гострого ураження нирок (acute kidney injury — АКІ). Незважаючи на це, ГУН та інші несприятливі наслідки, такі як порушення обміну рідини та електролітів, рідко розвиваються при регулярному застосуванні НПЗП у пацієнтів, у яких відмічають незначну кількість факторів ризику або не відмічають взагалі (див. табл. 1) [31–36]. Коефіцієнти ризику розвитку ГУН для окремих НПЗП для пацієнтів без ХХН знаходяться в межах 1,6–2,2 [37]. Хоча нефротоксичність окремих НПЗП може варіювати в певних межах, метааналіз, що характеризує ризик розвитку ГУН з використанням багатьох популярних препаратів, продемонстрував приблизно однакове підвищення ризику серед усіх НПЗП, хоча найвищий ризик відмічався для рофекоксибу [37]. Важливо, що селективні інгібітори ЦОГ-2 мають співставний ризик виникнення та аналогічний рівень тяжкості побічних ефектів щодо нирок порівняно з неселективними НПЗП [22, 38–41].
НПЗП-асоційоване ГУН пов’язане переважно з порушенням гемодинаміки, що призводить до зворотної дисфункції нирок або ішемічної травми канальців. Пацієнти з найвищим ризиком розвитку ГУН — це ті, у кого перфузія нирок залежить від простагландин-індукованої вазодилатації, спрямованої на боротьбу з ефектами циркулюючих системних та місцевих судинозвужувальних засобів. У разі станів, за яких спостерігається зменшення ефективного циркуляційного об’єму, ангіотензин II та ендотелін знижують ШКФ та постгломерулярну капілярну перфузію, підвищуючи ризик розвитку ішемічної травми канальців. Незворотне зменшення ефективного циркуляційного об’єму, як це спостерігається при ХХН, нефротичному синдромі та цирозі, підвищує ризик розвитку гемодинамічного ГУН при застосуванні НПЗП [42, 43]. Стани, пов’язані із судинною дисфункцією, такі як похилий вік та артеріальна гіпертензія, асоційовані з підвищеним ризиком розвитку ГУН при прийомі НПЗП, що, ймовірно, є наслідком зменшеного судинного резерву через атеросклероз та звуження ниркової артеріоли, що підвищує значення простагландинів для забезпечення належної перфузії [10, 44–46]. При цьому хоча дослідження й демонструють, що НПЗП підвищують ризик розвитку ГУН у хворих на ХХН, кількісна оцінка цього ризику сильно відрізняється в різних дослідженнях, у яких вивчали популяції з різними базовими характеристиками та схемами застосування НПЗП.
Так, ретроспективне когортне дослідження, яке включало понад 35 тис. літніх пацієнтів з артеріальною гіпертензією, ХХН та застійною серцевою недостатністю, не показало різниці щодо ризику розвитку ускладнень з боку нирок між тими, хто отримував та не отримував НПЗП за рецептом [47]. Однак у цьому дослідженні пацієнти не були стратифіковані за стадією ХХН. Систематичний метааналіз обсерваційних популяційних досліджень високої якості виявив, що пов’язаний з НПЗП ризик розвитку ГУН у хворих на ХХН був подібним до загальної популяції, однак існувала значна гетерогенність даних, що свідчить про наявність важливих модифікаторів цього ризику [40]. Надаючи достатньо інформації щодо пацієнтів із ХХН середньої тяжкості (3-тя стадія), багато великих досліджень та метааналізів все ж характеризують пацієнтів з ХХН як гомогенну групу хворих із ШКФ <60 мл/хв/1,73 м2, тому висновки щодо ризику застосування НПЗП на основі цих досліджень не можуть бути застосовані до пацієнтів із ХХН більшої тяжкості (стадії 4–5), які часто або виключені, або недостатньо представлені у вибірці.
Ризик розвитку ГУН, асоційованого з прийомом НПЗП, виявився вищим у літніх пацієнтів із ХХН, хоча у таких хворих без ХХН також відмічають підвищений ризик, як згадувалося раніше. Велике когортне дослідження, в якому брали участь люди похилого віку, не виявило зв’язку між зміною базових показників ШКФ та ризиком розвитку ГУН, асоційованого з прийомом НПЗП, проте спостерігалася тенденція до більшого абсолютного підвищення ризику розвитку ГУН зі зниженням базового рівня ШКФ [46]. Інше дослідження продемонструвало аналогічний ризик розвитку зворотного гемодинамічного ГУН при застосуванні НПЗП пацієнтами похилого віку з ХХН помірного ступеня вираженості та тих, у кого не відмічають ХХН [44].
Ризик розвитку ГУН при прийомі НПЗП підвищується при застосуванні їх разом з деякими іншими препаратами. Одночасне застосування НПЗП з інгібіторами РААС, діуретиками або обома пов’язане з підвищеним ризиком розвитку ГУН, особливо протягом перших 30 днів комбінованого застосування [45, 48]. Вважається, що ризик розвитку ГУН ще більш виражений у випадку одночасного застосування вказаних двох чи трьох класів препаратів у пацієнтів із 1–3-ю стадіями ХХН, і, ймовірно, підвищений і на пізніх стадіях розвитку захворювання [45]. Простагландини послаблюють вазоконстрикцію артеріол, опосередковану ангіотензином II, а експресія ЦОГ-2 посилюється інгібіторами ангіотензинперетворювального ферменту (АПФ) [49], що пояснює, чому інгібітори РААС підвищують ризик розвитку ГУН на тлі прийому НПЗП. Інші відомі приклади включають інгібітори кальциневрину, судинозвужувальні ефекти яких підвищують ризик розвитку ішемічної травми в реципієнтів трансплантатів [50, 51].
Незважаючи на те, що ХХН пізньої стадії, старший вік та специфічна медикаментозна терапія можуть призвести до підвищення ризику розвитку ГУН, пов’язаного з прийомом НПЗП, найбільшою небезпекою для терапії НПЗП слід вважати мультиморбідність хворих на ХХН, а не саму ХХН. Популяція ХХН — це складна група пацієнтів зі значним навантаженням коморбідними захворюваннями, і ці супутні хвороби, їх ускладнення та менеджмент часто є важливими факторами ризику розвитку ГУН.
Ризик прогресування ХХН на фоні прийому НПЗП
Занепокоєння щодо прогресування ХХН стало ще одним бар’єром для застосування НПЗП у хворих на ХХН. Втім доступні літературні дані з цього приводу є досить дискутабельними та містять суперечливі висновки. У багатьох ранніх, часто цитованих, дослідженнях було встановлено взаємозв’язок між застосуванням НПЗП (відповідно до повідомлень пацієнтів) та наявністю ХХН [33, 34, 52–54]. Однак ці дослідження викликають питання щодо неупередженості, а також демонструють суперечливі висновки [33, 34, 52–54].
У проспективному обсерваційному дослідженні за участю більше 10 тис. пацієнтів віком старше 65 років із ШКФ>60мл/хв/1,73 м2 було показано, що у хворих, які отримували НПЗП, відмічали незначне, але статистично достовірне підвищення ризику пришвидшення прогресування ХХН порівняно з пацієнтами, що не отримували НПЗП [55]. Однак не було зв’язку між застосуванням НПЗП та прогресуванням ХХН із ШКФ <60мл/хв/1,73 м2 [55]. Це та інші подібні дослідження критикували через нездатність дизайну виключати пацієнтів, упереджених щодо застосування НПЗП при ХХН, а також недостатнє представлення пацієнтів з пізніми стадіями ХХН.
З метою зменшити вплив цих факторів у деяких дослідженнях вивчали дію НПЗП на популяцію, яка потребує тривалого застосування таких препаратів. Велике рандомізоване 3-річне дослідження, в якому порівнювали профіль безпеки целекоксибу, напроксену та ібупрофену у понад 24 тис. пацієнтів із артритом та з ХХН на ранній стадії або без ХХН, показало низьку частоту розвитку гострого та тривалого зниження ШКФ при застосуванні всіх 3 препаратів [56]. Це дослідження, однак, має інший недолік — 70% пацієнтів перестали застосовувати препарати під час дослідження. За допомогою контрольованого багатофакторного аналізу результатів ретроспективного когортного дослідження, в якому взяли участь майже 2000 пацієнтів, які застосовували ібупрофен, та 4000 хворих, які отримували парацетамол, вдалося показати, що вік ≥65 років та ішемічна хвороба серця, не пов’язана із ХХН, були факторами ризику погіршення перебігу захворювання нирок при застосуванні ібупрофену [57]. Хоча стадія ХХН не була проаналізована в цьому дослідженні, результати показали, що ібупрофен не викликав прогресування ХХН щонайменше при ХХН помірної тяжкості [57]. Інше проспективне когортне дослідження за участю понад 4000 пацієнтів з ревматоїдним артритом продемонструвало відсутність різниці в швидкості зміни ШКФ між пацієнтами із 1–3-ю стадіями ХХН, що отримували НПЗП, та тими, що ці препарати не приймали, однак у 17 пацієнтів з 4–5-ю стадіями ХХН, які отримували НПЗП, відмічалося значне зниження ШКФ [58].
Подібно до інших нефротоксичних проявів, ризик прогресування ХХН є дозозалежним. Метааналіз, покликаний визначити силу асоціації між застосуванням НПЗП та прогресуванням ХХН при помірному та тяжкому перебігу ХХН, показав відсутність зв’язку між використанням НПЗП у звичайній дозі та прогресуванням ХХН (відносний ризик 0,96) [59]. При високих дозах спостерігалося статистично достовірне підвищення ризику прогресування ХХН, але абсолютний ризик був невисоким — відносний ризик 1,26 [59].
Ретроспективне довготривале когортне дослідження за участю солдатів армії США без наявних захворювань нирок продемонструвало на 20% вищий ризик прогресування ХХН серед пацієнтів, які отримували понад 7 встановлених добових доз (defined daily dose — DDD) за визначенням ВООЗ, щомісяця в порівнянні з тими, хто їх не отримував [60]. Аналогічно, в іншому дослідженні було виявлено зв’язок між розвитком 5-ї стадії ХХН та прийомом НПЗП лише у пацієнтів, що приймали найвищі дози НПЗП [52].
Підсумовуючи, варто зазначити, що хоча ризик прогресування ХХН внаслідок застосування НПЗП має значення, він все ж таки є невисоким і пов’язаний з кумулятивною дозою, та є нижчим для пацієнтів із легким та середнім ступенем ХХН.
Рекомендації щодо застосування НПЗП у пацієнтів ревматологічного профілю із ХХН
На основі наявних даних щодо нефротоксичності НПЗП у пацієнтів із ХХН лікарями Медичної школи Єльського університету (Yale University School of Medicine) були розроблені рекомендації щодо застосування НПЗП у хворих на ХХН за певних обставин (табл. 2) [7]. При застосуванні НПЗП найважливіше уникати виникнення потенційно небезпечних для життя ускладнень, пов’язаних з НПЗП, таких як розвиток ГУН, гіперкаліємії та гіперволемії у пацієнтів із ХХН. Погіршення контролю артеріального тиску та посилення прогресування ХХН — це інші можливі несприятливі ефекти, які слід враховувати до початку прийому НПЗП.
Таблиця 2. Рекомендації щодо застосування НПЗП на різних стадіях ХНН
| Несприятлива побічна реакція | ХНН, стадія 1–2 | ХНН, стадія 3 | ХНН, стадія 4 | ХНН, стадія 5, без трансплантації нирок |
|---|---|---|---|---|
| Гостре ураження нирок | Низький ризик, подібний до такого у загальній популяції | Низький ризик, подібний до такого у загальній популяції, дещо підвищений для людей похилого віку | Щонайменше помірно підвищений ризик порівняно із загальною популяцією | Високий ризик порівняно із загальною популяцією |
| Ризик, що виникає при одночасному застосуванні інгібіторів РААС та/або діуретиків, вищий, ніж у загальній популяції | ||||
| Гіперкаліємія | Низький ризик, подібний до такого у загальній популяції | Низький ризик, подібний до такого у загальній популяції | Помірно підвищений ризик порівняно із загальною популяцією | Високий ризик порівняно із загальною популяцією |
| Гіпонатріємія | Низький ризик, подібний до такого у загальній популяції. Ризик може підвищуватися за наявності цукрового діабету | Низький ризик, подібний до такого у загальній популяції. Ризик може підвищуватися при наявності цукрового діабету | Ризик може бути підвищений порівняно із загальною популяцією, але даних бракує | Ризик може бути підвищений порівняно із загальною популяцією, але даних бракує |
| Гіперволемія | Ризик подібний до такого у загальній популяції | Ризик подібний до такого у загальній популяції | Підвищений ризик через ризик затримки Na+ та води та зменшення ШКФ | Високий ризик через ризик затримки Na+ і води та зменшення ШКФ |
| Погіршення артеріальної гіпертензії | Ймовірно, підвищений ризик порівняно із загальною популяцією залежно від рівня гіпоренінемії | Дещо підвищений ризик порівняно із загальною популяцією залежно від рівня гіпоренінемії | Підвищений ризик у зв’язку з можливістю виникнення гіперволемії та системної вазоконстрикції | Високий ризик у зв’язку з можливістю виникнення гіперволемії та системної вазоконстрикції. |
| Прогресування ХНН | Не спостерігається підвищення ризику при застосуванні НПЗП | Не спостерігається підвищення ризику при застосуванні НПЗП | Ймовірно, помірно підвищений ризик | Помірний чи високий ризик |
| Надійність даних | Висока/середня | Середня | Слабка | Слабка |
| Рекомендації | Прийнятне короткочасне застосування НПЗП протягом ≤5 днів. Довготривале застосування також прийнятне, але рішення про застосування має прийматися в кожному випадку окремо, а під час прийому слід ретельно моніторувати нефротоксичність та появу факторів ризику її розвитку | Можна розглядати короткочасне застосування низьких доз НПЗП у кожному конкретному випадку з ретельним моніторингом. Пацієнтам з гіперкаліємією НПЗП протипоказані | НПЗП абсолютно протипоказані, за винятком обставин паліативної допомоги | |
Для стабільних хворих із ХХН 1–2-ї стадій без факторів ризику розвитку ускладнень при прийомі НПЗП моніторинг може бути подібним до пацієнтів без захворювання нирок. У пацієнтів із ХХН 3-ї стадії, у яких фактори ризику були мінімізовані, короткочасне застосування НПЗП до 5 днів є прийнятною стратегією боротьби з болем із прийнятно низьким нефротоксичним ризиком. Планові лабораторні дослідження та спостереження протягом 2–3 тиж використання НПЗП є достатніми для моніторингу несприятливих ефектів. Тривале використання НПЗП у цих пацієнтів несе вищий ризик щодо розвитку несприятливих наслідків, однак це стосується більш тривалого періоду впливу, протягом якого можуть з’являтися додаткові фактори ризику розвитку токсичності НПЗП. Отже, тривала терапія є прийнятною для пацієнтів, які інформовані щодо станів підвищеного ризику, які можуть виникнути, при яких слід утриматися від прийому НПЗП, при цьому слід продовжувати ретельне медичне спостереження. Препарати короткої дії мають більше переваг порівняно з лікарськими засобами тривалої дії (табл. 3), поряд із оптимізацією ефективного циркуляційного об’єму та серцевої функції до та під час лікування [7]. Коригування інтервалу дозування НПЗП слід проводити з урахуванням зменшеної елімінації препарату при ХХН [7]. НПЗП, ймовірно, слід уникати людям із простагландин-залежним зниженням ниркового кровотоку, включаючи стани зменшеного ефективного циркуляційного об’єму, цирозу, ішемічної хвороби серця або нефротичного синдрому [7]. Додаткова обережність при застосуванні НПЗП необхідна пацієнтам із ХХН та з порушеннями обміну калію, яким призначають інгібітори РААС, діуретики та інші препарати, що спричиняють розвиток гіперкаліємії, такі як інгібітори мінералокортикоїдів та триметоприм.
Таблиця 3. Дозування НПЗП у пацієнтів з ХНН
| НПЗП | Період напіввиведення, год | Дозування* | Рекомендації щодо дозування при ХНН** |
|---|---|---|---|
| Холін Mg++ трисаліцилат | 0,25 | 1,5–3,0 г (bid-tid) | Знизити дозу bid |
| Індометацин | 5–10 | 75–150 мг (bid-qid) | Звичайне дозування qd-bid |
| Толметін | 1 | 400–2400 мг (bid-tid) | Знизити дозу bid |
| Диклофенак | 1–2 | 100–150 мг (bid) | Знизити дозу bid |
| Етодолак | 6,4 | 400–1200 мг (bid-qid) | Звичайне дозування qd-bid |
| Кеторолак | 5–6 | 40 мг (qid) | Знизити дозу qd-bid |
| Ібупрофен | 1,8–2 | 800–3200 мг (qid) | Звичайне дозування bid |
| Напроксен | 12–17 | 450 мг (bid) | Знизити дозу qd |
| Кетопрофен | 2–4 | 225 мг (tid) | Знизити дозу qd-bid |
| Флурбіпрофен | 5–7 | 200–300 мг (bid-tid) | Знизити дозу qd |
| Піроксикам | 45–50 | 10–20 мг (qd) | Утриматися від застосування |
| Мефенамінова кислота | 2 | 1000 мг (qid) | Знизити дозу bid-tid |
| Целекоксиб | 11 | 100–400 мг (qd-bid) | Знизити дозу qd-bid |
Пацієнти із ХХН 4-ї стадії потребують більш збалансованого підходу до терапії НПЗП, оскільки ризик нефротоксичності в цій групі недостатньо вивчений. Багато пацієнтів, що належать до цієї групи, борються із явищами, пов’язаними із ГУН, порушенням електролітного обміну та кислотно-лужного балансу (зокрема гіперкаліємія та метаболічний ацидоз) та гіперволемією, тому індивідуальний підхід до застосування НПЗП у цьому разі є обов’язковим. Застосування НПЗП, ймовірно, посилить усі ці проблеми у багатьох пацієнтів зі ХХН 4-ї стадії, особливо за наявності супутніх захворювань (ішемічна хвороба серця, нефроз, цироз, артеріальна гіпертензія та нирковий тубулярний ацидоз 4-го типу) та прийомі лікарських засобів для їх менеджменту (блокатори РААС, діуретики, антагоністи мінералокортикоїдів). Якщо НПЗП необхідно застосовувати у хворих на ХХН 4-ї стадії, рекомендується призначати низькі дози препаратів з коротким періодом напіввиведення з відповідним інтервалом дозування протягом ≤5 днів та ретельним контролем протягом періоду лікування.
За винятком обставин, за яких надають перевагу паліативній допомозі над продовженням життя, хворі на ХХН 5-ї стадії ніколи не повинні приймати НПЗП, оскільки ризик летальних ниркових ускладнень високий, незважаючи на відсутність даних. Рішення про уникнення НПЗП для лікування болю у пацієнтів із хворобою нирок на стадії діалізу має прийматися індивідуально, базуючись на доступних даних. Аналогічно, рішення про застосування НПЗП у пацієнтів з трансплантованою ниркою має прийматися індивідуально, ґрунтуючись на показниках ШКФ та супутніх факторах ризику розвитку несприятливих наслідків. Оскільки у цих пацієнтів відсутні нормальні ауторегуляторні механізми для захисту від зниження рівня простагландинів і вони часто приймають імуносупресивні засоби, що підсилюють потенційну токсичність, викликану НПЗП, обережне застосування та ретельний моніторинг є обов’язковим.
Вибір НПЗП для терапії больового синдрому у пацієнтів із ХХН
Диклофенак є золотим стандартом ефективності НПЗП. Висока ефективність даного препарату добре вивчена та доведена в ході багатьох досліджень. Показано, що диклофенак максимально ефективно пригнічує синтез прозапальних PGE2 [61]. Так, згідно з результатами рандомізованого плацебо-контрольованого клінічного дослідження застосування диклофенаку дозволяє знизити рівень PGE2 на 93%, що є значно (майже на 20%) ефективнішим за аналогічні показники як ЦОГ-2-селективних рофекоксибу й мелоксикаму, так і неселективних — ібупрофену і напроксену [62].
У метааналізі було показано, що диклофенак у дозі 150 мг на добу є ефективнішим щодо курації больового синдрому та обмеженості рухів порівняно з ібупрофеном, напроксеном та целекоксибом у високих дозах [63]. В іншому систематичному огляді літератури, який включав дані від майже 150 тис. пацієнтів, було отримано аналогічні дані, зокрема показано, що диклофенак у дозі 150 мг на добу є ефективнішим за целекоксиб у дозі 200 мг на добу, напроксен у дозі 1000 мг на добу та ібупрофен у дозі 2400 мг на добу [64].
Крім того, диклофенак є ефективнішим за мелоксикам клінічно. Згідно з результатами дослідження MELISSA, в якому взяли участь понад 9 тис. осіб з остеоартритом, пацієнти, які застосовували мелоксикам, на 38% частіше відмовлялися від лікування через його неефективність (80 з 4635; р <0,01) в порівнянні з когортою, що одержувала диклофенак (48 з 4688) [65].
Поряд із цим диклофенак має один з найнижчих ризиків розвитку нефротоксичності у пацієнтів із ХХН серед традиційних НПЗП. Диклофенак при застосуванні коротким курсом з метою зменшення вираженості гострого больового синдрому не спричиняв статистично достовірних змін рівня креатиніну в порівнянні з плацебо [66]. При цьому побічні реакції, пов’язані із застосуванням диклофенаку, були поодинокими (3 на 318 пацієнтів) та легкої або середньої тяжкості, а їх частота була такою ж як у групі плацебо. При цьому відносний ризик ускладнень з боку нирок становив 1,4 для диклофенаку проти 2,08 для кеторолаку.
Диклофенак, призначений у терапевтичній дозі коротким курсом здоровим добровольцям і пацієнтам хірургічних стаціонарів, не впливав на функцію нирок у порівнянні з неселективними НПЗП [67, 68]. Диклофенак продемонстрував менший відносний ризик розвитку побічних явищ з боку нирок порівняно з ібупрофеном, ацетамінофеном та кеторолаком, поступившись лише напроксену, кетопрофену та целекоксибу. Втім слід відмітити, що целекоксиб має значно вищий порівняно з диклофенаком ризик розвитку побічних ефектів з боку серцево-судинної системи (відносний ризик 2,26 проти 1,55 відповідно), а напроксен — вищий ризик смерті (відносний ризик 3,00 у напроксену проти 2,00 у диклофенаку) (рисунок) [69]. Також слід відмітити, що ризик розвитку ниркової недостатності при застосуванні диклофенаку більш ніж у 2,5 раза нижчий, ніж при застосуванні мелоксикаму [70]. Водночас диклофенак демонструє кращий профіль безпеки щодо розвитку ГУН порівняно з піроксикамом, ібупрофеном, напроксеном та індометацином [71].
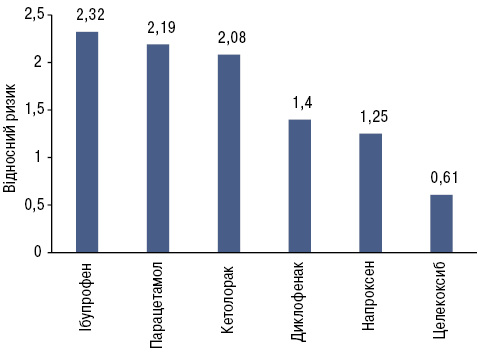
Адаптовано за [34, 44, 66, 72].
Однак при тривалому прийомі (понад 6 міс з перервами) диклофенак може спровокувати зниження кліренсу креатиніну. Це необхідно враховувати при призначенні препарату на тривалий термін пацієнтами з порушенням швидкості клубочкової фільтрації [73].
Результати ретроспективного дослідження застосування НПЗП у майже 1,5 млн пацієнтів показали, що ризик розвитку ГУН є нижчим при застосуванні селективних НПЗП порівняно з неселективними «традиційними» НПЗП [71]. Тому в разі необхідності тривалого застосування НПЗП доцільно звернути увагу на препарати з прийнятним профілем безпеки щодо функції нирок при довготривалому застосуванні, а саме деякі селективні інгібітори ЦОГ-2, такі як німесулід. Так, показано, що при прийомі німесуліду пацієнтами з ревматоїдним артритом упродовж щонайменше 14 днів не було зафіксовано жодних небажаних змін рівнів креатиніну та сечової кислоти або зниження кліренсу креатиніну [74]. В іншому метааналізі, в якому було зібрано дані більш ніж 1 тис. пацієнтів, що брали участь у 16 клінічних дослідженнях, також не було зафіксовано жодних побічних ефектів з боку нирок [75].
У ряді інших досліджень також показано, що для німесуліду характерна низька частота розвитку побічних реакцій з боку нирок, що повністю узгоджується з особливостями фармакокінетики препарату [76]. Важливо, що на швидкість виведення препарату не впливає вік, стать або наявність помірної ниркової недостатності (наприклад у людей літнього віку) [77, 78].
Таким чином, прийом НПЗП асоційований з можливістю розвитку несприятливих наслідків з боку нирок, і на цей ризик слід зважати при оцінці користі від зменшення виразності больового синдрому. Оцінка ризику при цьому має бути високо індивідуалізованою з урахуванням стадії ХХН, віку, супутніх захворювань та застосування інших ліків. Так само індивідуалізовано слід підходити до вибору конкретного НПЗП, адже для кожного з них є характерним різний профіль безпеки. При цьому доцільно звернути увагу на рівень нефротоксичності того чи іншого НПЗП, а також його інтегрований профіль безпеки, особливо у такої групи пацієнтів високого ризику, як хворі на ревматологічну патологію та ХХН. У цьому контексті увагу привертають диклофенак — серед «традиційних» НПЗП, а також німесулід як представник селективних інгібіторів ЦОГ-2.
Список використаної літератури
- 1. Насонов Е.Л., Гордеев А.В., Галушко Е.А. (2015) Ревматические заболевания и мультиморбидность. Терапевт. архив, 87(5): 4–9.
- 2. Solomon D.H., Peters M.J.L., Nurmohamed M.T., Dixon W. (2013) Motion for debate: the data support evidence-based management recommendations for cardiovascular diseases in rheumatoid arthritis. Arthritis Rheum., 65: 1675–1683. doi: 10.1002/art.37975
- 3. Marigliano B., Soriano A., Margiotta D. et al. (2013) Lung involvement in connective tissue diseases: A comprehensive review and a focus on rheumatoid arthritis. Autoimmun Rev., 12(11): 1076–1084.
- 4. Anders H.-J., Vielhauer V. (2011) Renal co-morbidity in patients with rheumatic diseases. Arthritis Res Ther., 13: 222–232.
- 5. Turesson E.L. (2013) Malignancy as a comorbidity in rheumatic diseases. Rheumatology, 52(1): 5–14.
- 6. Зотова Л.А., Булгаков А.А. (2016) Анализ функции почек у пациентов с ревматологическими заболеваниями. Междунар. науч.-исследоват. журн., 8–2 (50): 82–87.
- 7. Baker M., Perazella M.A. (2020) NSAIDs in CKD: Are They Safe? American Journal of Kidney Diseases. Available online 30 May 2020 (https://doi.org/10.1053/j.ajkd.2020.03.023).
- 8. Koncicki H.M., Unruh M., Schell J.O. (2017) Pain Management in CKD: A Guide for Nephrology Providers. Am. J. Kidney Dis., 69: 451–460.
- 9. By the 2019 American Geriatrics Society Beers Criteria® Update Expert Panel. American Geriatrics Society 2019 Updated AGS Beers Criteria® for Potentially Inappropriate Medication Use in Older Adults (2019) J. Am. Geriatr. Soc., 67: 674–694.
- 10. Nath K.A., Chmielewski D.H., Hostetter T.H. (1987) Regulatory role of prostanoids in glomerular microcirculation of remnant nephrons. Am. J. Physiol., 252: F829–F837.
- 11. Hull S., Mathur R., Dreyer G., Yaqoob M.M. (2014) Evaluating ethnic differences in the prescription of NSAIDs for chronic kidney disease: a cross-sectional survey of patients in general practice. Br. J. Gen. Pract., 64: e448–e455.
- 12. Patel K., Diamantidis C., Zhan M. et al. (2012) Influence of creatinine versus glomerular filtration rate on non-steroidal anti-inflammatory drug prescriptions in chronic kidney disease. Am. J. Nephrol., 36: 19–26.
- 13. Davison S.N., Rathwell S., George C. et al. (2020) Analgesic Use in Patients With Advanced Chronic Kidney Disease: A Systematic Review and Meta-Analysis. Canad. J. Kidney Health Dis., 7: 2054358120910329.
- 14. Lefebvre C., Hindié J., Zappitelli M. et al. (2020) Non-steroidal anti-inflammatory drugs in chronic kidney disease: a systematic review of prescription practices and use in primary care. Clin. Kidney J., 13(1): 63–71.
- 15. Eras J., Perazella M.A. (2001) NSAIDs and the kidney revisited: are selective cyclooxygenase-2 inhibitors safe? Am. J. Med. Sci., 321: 181–190.
- 16. Cooper C., Chapurlat R., Al-Daghri N. et al. (2019) Safety of Oral Non-Selective Non-Steroidal Anti-Inflammatory Drugs in Osteoarthritis: What Does the Literature Say? Drugs Aging., 36: 15–24.
- 17. Hao C.M., Kömhoff M., Guan Y. et al. (1999) Selective targeting of cyclooxygenase-2 reveals its role in renal medullary interstitial cell survival. Am. J. Physiol., 277: F352–F359.
- 18. Ferreri N.R., Escalante B.A., Zhao Y. (1998) Angiotensin II induces TNF production by the thick ascending limb: functional implications. Am. J. Physiol., 274: F148–F155.
- 19. Ferreri N.R., An S.J., McGiff J.C. (1999) Cyclooxygenase-2 expression and function in the medullary thick ascending limb. Am. J. Physiol., 277: F360–F368.
- 20. Ohnaka K., Numaguchi K., Yamakawa T., Inagami T. (2000) Induction of cyclooxygenase-2 by angiotensin II in cultured rat vascular smooth muscle cells. Hypertension., 35: 68–75.
- 21. Kester M., Coroneos E., Thomas P.J., Dunn M.J. (1994) Endothelin stimulates prostaglandin endoperoxide synthase-2 mRNA expression and protein synthesis through a tyrosine kinasesignaling pathway in rat mesangial cells. J. Biol. Chem., 269: 22574–22580.
- 22. Gambaro G., Perazella M.A. (2003) Adverse renal effects of anti-inflammatory agents: evaluation of selective and nonselective cyclooxygenase inhibitors. J. Intern. Med., 253: 643–652.
- 23. Clive D.M., Stoff J.S. (1984) Renal syndromes associated with nonsteroidal antiinflammatory drugs. N. Engl. J. Med., 310: 563–572.
- 24. Smith W.L. (1992) Prostanoid biosynthesis and mechanisms of action. Am. J. Physiol., 263: F181–F191.
- 25. Palmer B.F., Henrich W.L. (1995) Clinical acute renal failure with nonsteroidal anti-inflammatory drugs. Semin. Nephrol., 15: 214–227.
- 26. Kidney Disease: Improving Global Outcomes CKD Work Group. KDIGO clinical practice guideline for the evaluation and management of chronic kidney disease (2012) Kidney Int., Suppl. 3: 1–150.
- 27. Inker L.A., Astor B.C., Fox C.H. et al. (2014) KDOQI US commentary on the 2012 KDIGO clinical practice guideline for the evaluation and management of CKD. Am. J. Kidney Dis., 63: 713–735.
- 28. Launay-Vacher V., Karie S., Fau J.-B. et al. (2005) Treatment of pain in patients with renal insufficiency: the World Health Organization three-step ladder adapted. J. Pain., 6: 137–148.
- 29. Bennett W.M., DeBroe M.E. (1989) Analgesic nephropathy–a preventable renal disease. N Engl J Med.; 320: 1269–1271.
- 30. Sriperumbuduri S., Hiremath S. (2019) The case for cautious consumption: NSAIDs in chronic kidney disease. Curr. Opin. Nephrol. Hypertens., 28: 163–170.
- 31. Gertz B.J., Krupa D., Bolognese J.A. et al. (2002) A comparison of adverse renovascular experiences among osteoarthritis patients treated with rofecoxib and comparator non-selective non-steroidal anti-inflammatory agents. Curr. Med. Res. Opin., 18: 82–91.
- 32. Patrono C., Dunn M.J. (1987) The clinical significance of inhibition of renal prostaglandin synthesis. Kidney Int., 32: 1–12.
- 33. Kurth T., Glynn R.J., Walker A.M. et al. (2003) Analgesic use and change in kidney function in apparently healthy men. Am. J. Kidney Dis., 42: 234– 244.
- 34. Curhan G.C., Knight E.L., Rosner B. et al. (2004) Lifetime nonnarcotic analgesic use and decline in renal function in women. Arch. Intern. Med., 164: 1519–1524.
- 35. Agodoa L.Y., Francis M.E., Eggers P.W. (2008) Association of analgesic use with prevalence of albuminuria and reduced GFR in US adults. Am. J. Kidney Dis., 51: 573–583.
- 36. Perazella M.A., Buller G.K. (1991) Can ibuprofen cause acute renal failure in a normal individual? A case of acute overdose. Am. J. Kidney Dis., 18: 600–602.
- 37. Ungprasert P., Cheungpasitporn W., Crowson C.S., Matteson E.L. (2015) Individual non-steroidal anti-inflammatory drugs and risk of acute kidney injury: A systematic review and meta-analysis of observational studies. Eur. J. Intern. Med., 26: 285–291.
- 38. Brewster U.C., Perazella M.A. (2004) Acute tubulointerstitial nephritis associated with celecoxib. Nephrol. Dialys. Transplant., 1017–1018. doi: 10.1093/ndt/gfh033.
- 39. Perazella M.A., Tray K. (2001) Selective cyclooxygenase-2 inhibitors: a pattern of nephrotoxicity similar to traditional nonsteroidal anti-inflammatory drugs. Am. J. Med., 111: 64–67.
- 40. Zhang X., Donnan P.T., Bell S., Guthrie B. (2017) Non-steroidal anti-inflammatory drug induced acute kidney injury in the community dwelling general population and people with chronic kidney disease: systematic review and meta-analysis. BMC Nephrology. doi: 10.1186/s12882-017-0673-8.
- 41. Brater D.C. (1999) Effects of nonsteroidal anti-inflammatory drugs on renal function: focus on cyclooxygenase -2 – selective inhibition. Am. J. Med., 107: 65–70.
- 42. Lipman G.S., Shea K., Christensen M. et al. (2017) Ibuprofen versus placebo effect on acute kidney injury in ultramarathons: a randomised controlled trial. Emerg. Med. J., 34: 637–642.
- 43. Blackshear J.L., Davidman M., Stillman M.T. (1983) Identification of risk for renal insufficiency from nonsteroidal anti-inflammatory drugs. Arch. Intern. Med., 143: 1130–1134.
- 44. Griffin M.R., Yared A., Ray W.A. (2000) Nonsteroidal Antiinflammatory Drugs and Acute Renal Failure in Elderly Persons. Am. J. Epidemiol., 488–496. doi: 10.1093/oxfordjournals.aje.a010234,
- 45. Dreischulte T., Morales D.R., Bell S., Guthrie B. (2015) Combined use of nonsteroidal antiinflammatory drugs with diuretics and/or renin–angiotensin system inhibitors in the community increases the risk of acute kidney injury. Kidney Intern., 396–403. doi: 10.1038/ki.2015.101
- 46. Nash D.M., Markle-Reid M., Brimble K.S. et al. (2019) Nonsteroidal anti-inflammatory drug use and risk of acute kidney injury and hyperkalemia in older adults: a population-based study. Nephrol. Dial. Transplant., 34: 1145–1154.
- 47. Bouck Z., Mecredy G.C., Ivers N.M. et al. (2018) Frequency and Associations of Prescription Nonsteroidal Anti-inflammatory Drug Use Among Patients With a Musculoskeletal Disorder and Hypertension, Heart Failure, or Chronic Kidney Disease. JAMA Intern. Med., 178: 1516–1525.
- 48. Lapi F., Azoulay L., Yin H. et al. (2013) Concurrent use of diuretics, angiotensin converting enzyme inhibitors, and angiotensin receptor blockers with non-steroidal antiinflammatory drugs and risk of acute kidney injury: nested case-control study. BMJ, 346: e8525.
- 49. Cheng H.F., Wang J.L., Zhang M.Z. et al. (1999) Angiotensin II attenuates renal cortical cyclooxygenase-2 expression. J. Clin. Invest., 103: 953–961.
- 50. Chiasson J.M., Fominaya C.E., Gebregziabher M., Taber D.J. (2019) Long-term Assessment of NSAID Prescriptions and Potential Nephrotoxicity Risk in Adult Kidney Transplant Recipients. Transplantation., 103: 2675–2681.
- 51. Delzer L.M., Golightly L.K., Kiser T.H. et al. (2018) Calcineurin Inhibitor and Nonsteroidal Anti-inflammatory Drug Interaction: Implications of Changes in Renal Function Associated With Concurrent Use. J. Clin. Pharmacol., 1443–1451. doi: 10.1002/jcph.1264
- 52. Perneger T.V., Whelton P.K., Klag M.J. (1994) Risk of kidney failure associated with the use of acetaminophen, aspirin, and nonsteroidal antiinflammatory drugs. N. Engl. J. Med., 331: 1675–1679.
- 53. Sandler D.P., Burr F.R., Weinberg C.R. (1991) Nonsteroidal anti-inflammatory drugs and the risk for chronic renal disease. Ann. Intern. Med., 115: 165–172.
- 54. Rexrode K.M., Buring J.E., Glynn R.J. et al. (2001) Analgesic use and renal function in men. JAMA, 286: 315–321.
- 55. Gooch K., Culleton B.F., Manns B.J. et al. (2007) NSAID use and progression of chronic kidney disease. Am. J. Med., 120: 280.e1–7.
- 56. Nissen S.E., Yeomans N.D., Solomon D.H. et al. (2016) Cardiovascular Safety of Celecoxib, Naproxen, or Ibuprofen for Arthritis. New Engl. J. Med., 2519–2529.
- 57. Murray M.D., Craig Brater D., Tierney W.M. et al. (1990) Ibuprofen-associated Renal Impairment in a Large General Internal Medicine Practice. Am. J. Med. Scienc., 299(4): 222–229. doi: 10.1097/00000441-199004000-00002.
- 58. Möller B., Pruijm M., Adler S. et al. (2015) Chronic NSAID use and long-term decline of renal function in a prospective rheumatoid arthritis cohort study. Ann. Rheum. Dis., 74: 718–723.
- 59. Nderitu P., Doos L., Jones P.W. et al. (2013) Non-steroidal anti-inflammatory drugs and chronic kidney disease progression: a systematic review. Fam. Pract., 30: 247– 255.
- 60. Nelson D.A., Marks E.S., Deuster P.A. et al. (2019) Association of Nonsteroidal Anti-inflammatory Drug Prescriptions With Kidney Disease Among Active Young and Middle-aged Adults. JAMA Netw Open., 2: e187896.
- 61.Dey I., Lejeune M., Chadee K. (2006) Prostaglandin E2 receptor distribution and function in the gastrointestinal tract. British. J. Pharmacol., 149(6): 611–623.
- 62. Hecken A., Schwartz J.I., Depré M. et al. (2000) Comparative inhibitory activity of rofecoxib, meloxicam, diclofenac, ibuprofen, and naproxen on COX-2 versus COX-1 in healthy volunteers. J. Clin. Pharmacol., 40(10): 1109–1120.
- 63. Chou R., McDonagh M.S., Nakamoto E., Griffin J. (2011) Analgesics for osteoarthritis: an update of the 2006 comparative effectiveness review. Rockville: Agency for Healthcare Research and Quality (US).
- 64. van Walsem A., Pandhi S., Nixon R.M. et al. (2015) Relative benefit-risk comparing diclofenac to other traditional non-steroidal anti-inflammatory drugs and cyclooxygenase-2 inhibitors in patients with osteoarthritis or rheumatoid arthritis: a network meta-analysis. Arthr. Res. Ther., 17(1): 66.
- 65. Hawkey C., Kahan A., Steinbrück K. et al. (1998) Gastrointestinal tolerability of meloxicam compared to diclofenac in osteoarthritis patients. International MELISSA Study Group. Meloxicam Large-scale International Study Safety Assessment. British J. Rheumatol., 37(9): 937–945.
- 66. Daniels S.E., Gan T.J., Hamilton D.A. et al. (2016) A pooled analysis evaluating renal safety in placebo-and active comparator-controlled phase III trials of multiple-dose injectable HPβCD-diclofenac in subjects with acute postoperative pain. Pain Med., 17(12): 2378–2388.
- 67. Dilger K., Herrliinger C., Peters J. et al. (2002) Effects of celecoxib and diclofenac on blood pressure, renal function, and vasoactive prostanoids in young and elderly subjects. J. Clin. Pharmacol, 42: 985–994.
- 68. Lee A., Cooper M.G., Craig J.C. et al. (2007) Effects of nonsteroidal anti-inflammatory drugs on postoperative renal function in adults with normal renal function. Cochrane Rev. (Online), 1–41.
- 69. Aweid O., Haider Z., Saed A., Kalairajah Y. (2018) Treatment modalities for hip and knee osteoarthritis: A systematic review of safety. J. Orthopaed. Surg., 26(3): 2309499018808669.
- 70. Fine M. (2013) Quantifying the impact of NSAID-associated adverse events. Am. J. Manag. Care, 19(14 Suppl.): s267–s272.
- 71. Sandler D.P., Smith J.C., Weinberg C.R. et al. (1989) Analgesic use and chronic renal disease. New Engl. J. Med., 320(19): 1238–1243.
- 72. Zhang J., Ding E.L., Song Y. (2006) Adverse effects of cyclooxygenase 2 inhibitors on renal and arrhythmia events metaanalysis of randomized trials. JAMA, 296: 1619–1632.
- 73. Whelton A., Lefkowith J.L., West C.R. et al. (2006) Cardiorenal effects of celecoxib as compared with the nonsteroidal anti-inflammatory drugs diclofenac and ibuprofen. Kidney Int., 70: 1495–1502.
- 74. Barskova V.G., Nasonova V.A., Tsapina T.N. et al. (2004) The effectiveness and safety of nimesulide (nimesile) in patients with gouty arthritis. Klinichesk. Med., 82(12): 49–54.
- 75. Gupta P., Sachdev H. P. S. (2003). Safety of oral use of nimesulide in children: systematic review of randomized controlled trials. Indian pediatrics, 40(6): 518–533.
- 76. Bjarnason I., Bissoli F., Conforti A. et al. (2005) Adverse reactions and their mechanisms from nimesulide. In: Rainsford K.D. (Еd.) Nimesulide. Actions and uses. Birkhäuser, Basel, р. 415.
- 77. Bernareggi A. (1998) Clinical pharmacokinetics of nimesulide. Clin. Pharmacokinet., 35(4): 247–274.
- 78. Bernareggi A., Rainsford K.D. (2005) Pharmacokinetics of nimesulide. In: Rainsford K.D. (ed.). Nimesulide. Actions and uses. Birkhäuser, Basel, 120.
НПВП у пациентов с ревматологической патологией и хронической болезнью почек: назначать или не назначать?
Резюме. Купирование болевого синдрома у пациентов с ревматологическими заболеваниями и хронической болезнью почек (ХБП) затруднена из-за предостережений относительно применения у этой группы больных нестероидных противовоспалительных препаратов (НПВП). Целью данной публикации было представить возможные подходы к назначению НПВП ревматологическим больным с ХБП и выбору оптимального НПВП. Методы. Проведен обзор литературы и приведены сведения о возможных рисках применения различных НПВП. Результаты и обсуждение. Рассмотрены риски применения НПВП у различных категорий больных ХБП, возможные побочные реакции, а также влияние факторов риска развития побочных реакций со стороны почек при применении НПВП. Представлены данные относительно риска развития нефротоксичности при применении различных НПВП, а также рекомендации по их использованию у отдельных категорий пациентов. В этом отношении внимание привлекают диклофенак, который как представитель «традиционных» НПВП, имеет один из самых низких рисков развития нефротоксичности для этой группы препаратов, а также нимесулид — селективный ингибитор ЦОГ-2, продемонстрировавший благоприятный профиль безопасности в отношении почек, нуждаются в дальнейшем анализе кетопрофен и отдельные коксибы. Выводы. НПВП могут применяться у некоторых категорий ревматологических пациентов с ХБП с учетом индивидуального риска развития нефротоксичности и длительности приема, а также под пристальным контролем.
Ключевые слова: НПВП, ХБП, ревматологические заболевания, боль, диклофенак, нимесулид.
Адреса для листування:
Іванов Дмитро Дмитрович
E-mail: ivanovdd@i.kiev.ua

Leave a comment