СИСТЕМНИЙ ЧЕРВОНИЙ ВОВЧАК: СТАН ПРОБЛЕМИ В УКРАЇНІ ТА СВІТІ
Резюме. Системний червоний вовчак (СЧВ) залишається недостатньо вивченим захворюванням, попри велику кількість досліджень, що проводяться. З кожним роком з’являється все більше даних, що поглиблюють розуміння етіології та патогенезу захворювання, відкривають нові можливості для діагностики та лікування. Мета дослідження — висвітлення нових та узагальнення раніше відомих даних, щодо епідеміології, етіопатогенезу, діагностики та лікування СЧВ, а також актуалізація більш глибокого вивчення цієї проблеми в Україні. Матеріали і методи. Здійснено науковий пошук серед друкованих і електронних видань, наукових пошукових баз. Застосовано методи порівняння, аналізу й узагальнення даних. Результати. У статті наведено рівні захворюваності та поширеності СЧВ у різних країнах світу. Також розглянуто залежність статистичних показників від віку, статі, етнічної та расової приналежності. Описано етіологічні фактори захворювання, які вважаються основними на цьому етапі вивчення проблеми, та сучасні уявлення про патогенез. Публікація містить нові класифікаційні критерії СЧВ, розроблені Європейською антиревматичною лігою (EULAR) спільно з Американським коледжем ревматології (ACR) у 2019 р. Їхньою особливістю порівняно з попередніми версіями є наявність вхідного критерію — титр антинуклеарних антитіл 1:80 і більше, присвоєння ознакам балів відповідно до значимості та розподіл за клінічними та імунологічними доменами. Також коротко розглянуто основні принципи медикаментозної терапії — застосування глюкокортикоїдів, гідроксихлорохіну, цитостатиків (метотрексат, азатіоприн, мофетилу мікофенолат, циклофосфамід), імунобіологічних препаратів (белімумаб, ритуксимаб та низка інших, що на сьогодні проходять клінічні випробування). Висновки. В Україні порівняно з країнами Європи та США виявляють значно нижчі рівні захворюваності та поширеності СЧВ, що найімовірніше пов’язано з недостатнім виявленням пацієнтів із цією патологією. Це потребує глибшого вивчення стану проблеми в нашій країні та розроблення методів удосконалення діагностики і лікування СЧВ.
УДК: 616.5-002.525.2(477+100)
DOI: 10.32471/rheumatology.2707-6970.82.15749
Системний червоний вовчак (СЧВ) — хронічне системне автоімунне захворювання невідомої етіології, що виникає на тлі генетичних порушень імунорегуляторних процесів і впливу факторів навколишнього середовища та характеризується гіперпродукцією органонеспецифічних аутоантитіл до різних компонентів клітинного ядра з розвитком імунозапального пошкодження тканин і внутрішніх органів. Наявні кілька фенотипів СЧВ з різними клінічними проявами — від легких слизово-шкірних до тяжких мультиорганних уражень [1].
Захворюваність і поширеність значно відрізняються в різних регіонах Земної кулі, залежать від статі, віку, расової та етнічної приналежності. Наприклад, у різних штатах США захворюваність коливається від 1,0 до 7,6 випадка на 100 тис. населення на рік, а поширеність — від 53,3 до 149,5 хворого на 100 тис. населення (в середньому — 81,1). У Великій Британії ці показники становлять 4,9 та 65,0 відповідно [2]. В Україні станом на 2017 р. захворюваність становила всього 0,7 випадка на 100 тис. осіб, а поширеність —17,1 на 100 тис. населення, що значно нижче світових показників. Зазначимо суттєве коливання статистичних показників у різних регіонах України, що відображено у таблиці [3].
Таблиця. Показники ураження дорослого населення системним червоним вовчаком у 2017 р. (на 100 тис. населення)
| Найменування областей | Поширеність | Захворюваність |
|---|---|---|
| Вінницька | 29,6 | 1,5 |
| Волинська | 26,9 | 0,8 |
| Дніпропетровська | 13,6 | 0,7 |
| Донецька | 13,4 | 0,7 |
| Житомирська | 39,4 | 0,8 |
| Закарпатська | 47,9 | 2,3 |
| Запорізька | 12,4 | 0,3 |
| Івано-Франківська | 17,8 | 0,5 |
| Київська | 12,7 | 0,6 |
| Кіровоградська | 12,7 | 0,6 |
| Луганська | 8,7 | 0,5 |
| Львівська | 17,9 | 1,1 |
| Миколаївська | 14,2 | 0,9 |
| Одеська | 12,1 | 0,5 |
| Полтавська | 30,3 | 0,8 |
| Рівненська | 14,6 | 0,6 |
| Сумська | 14,4 | 0,6 |
| Тернопільська | 12,0 | 0,5 |
| Харківська | 13,1 | 0,8 |
| Херсонська | 11,0 | 0,7 |
| Хмельницька | 30,9 | 1,5 |
| Черкаська | 16,4 | 0,8 |
| Чернівецька | 14,6 | 0,1 |
| Чернігівська | 12,9 | 0,8 |
| місто Київ | 27,9 | 0,8 |
Загалом у світі показники захворюваності та поширеності СЧВ постійно зростають, що пов’язують із покращенням якості діагностики, частішим виявленням легких форм, підвищенням ефективності лікування і тривалості життя хворих.
У всіх вікових та етнічних групах жінки хворіють частіше, ніж чоловіки у співвідношенні між 1.2:1 і 15:1 (в середньому — 9:1.) [2]. У чоловіків захворювання зазвичай має більш раптовий початок і тяжчий перебіг. У жінок ризик знижується після менопаузи, але залишається вдвічі вищим порівняно із чоловіками [4]. Основною причиною вищої захворюваності серед жінок вважається вплив статевих гормонів. Їх рецептори наявні в більшості імунокомпетентних клітин. Встановлено, що естрогени пришвидшують інволюцію тимусу, порушення функції якого є одним із факторів ризику розвитку СЧВ [5]. Також відома їх здатність у високих дозах зміщувати співвідношення між Т-хелперами-1 і Т-хелперами-2 у сторону останніх, що веде до надмірної проліферації В-лімфоцитів та синтезу аутоантитіл. Ймовірно, цей механізм робить значний внесок у загострення СЧВ у період вагітності [6]. Крім того, естрогени посилюють вивільнення прозапальних цитокінів — інтерлейкіну (IL)-1 та IL-6, фактора некрозу пухлини (ФНП)-альфа активованими макрофагами за допомогою модуляції експресії CD16 [7].
Нещодавні дані свідчать також про інші генетичні та епігенетичні фактори, що зумовлюють статевий диморфізм поширеності СЧВ. Серед них — наявність однонуклеотидних поліморфізмів (ОНП), порушення процесів метилювання ДНК та модифікації гістонів. Припускається, що дисбіоз кишечнику також може робити свій внесок внаслідок посиленого вироблення естрогенів мікроорганізмами [8].
У більшості досліджень спостерігається поступове зростання захворюваності з віком, досягнення піку та подальше поступове зниження. У жінок пік коливається від третього десятку життя у Тайвані до сьомого у США. У чоловіків пік захворюваності зазвичай спостерігається пізніше — на п’ятому-сьомому десятках життя [2]. Наприклад, у Великій Британії середній вік діагностики СЧВ у жінок становить 49 років, а у чоловіків — 48 років [9].
Відзначається суттєве коливання поширеності СЧВ у представників різних рас. Найвищий показник у всіх країнах серед представників негроїдної раси, найнижчий — європеоїдної; монголоїди та латиноамериканці займають проміжне становище. Ця закономірність є справедливою для представників обох статей. У білошкірого населення спостерігається нижча частота вовчакового нефриту та дискоїдного вовчака, але вища частота фотосенсибілізації [2,10].
У пацієнтів із СЧВ виявляють вищу смертність порівняно із середньопопуляційними показниками. Загальний стандартизований коефіцієнт смертності (СКС) становить 2,6. Значно підвищеним є ризик смертності від інфекційних захворювань (СКС — 4,98), захворювань нирок (СКС — 4,89) та серцево-судинних захворювань (СКС — 2,23), але не від раку (СКС 1,16). У разі пізнього початку СЧВ, незважаючи на нижчі показники ураження нирок, спостерігається вища смертність внаслідок вищого поширення супутніх захворювань. Наявність шкірного вовчака не впливає на смертність, і загальний СКС становить 0,6 [11].
На сьогодні етіологія СЧВ залишається не до кінця з’ясованою. Розвиток захворювання ґрунтується на генетичній схильності, але його виникнення та загострення індукуються впливом факторів навколишнього середовища, таких як ультрафіолетове (УФ)-опромінення, вірусні інфекції, дія ліків і токсинів, дефіцит вітаміну D [12].
Доказом значної ролі генетичних факторів є вищий рівень захворюваності серед родичів. Так, серед родичів першого ступеня спорідненості цей ризик підвищується в 10,3 раза, а другого і третього порядків — у 3,6 раза. Ризик інших аутоімунних захворювань підвищується відповідно у 2,1 та 1,4 раза [11].
Багато генів схильності до СЧВ мають відомі імунні функції та кодують компоненти кількох імунних процесів. Зокрема це процес кліренсу імунних комплексів за участю системи комплементу (дефіцит С1q, С2, С4) та фагоцитів; механізми вродженого імунітету (вироблення інтерферону та NFκB); внутрішньо-клітинної передачі сигналу у Т- і В-лімфоцитах. Крім того, зараз активно вивчається роль епігенетичних модифікацій та мікроРНК у розвитку СЧВ [13, 14].
Носійство алелей HLA-DR2 та HLA-DR3 генів головного комплексу гістосумісності підвищує ризик розвитку СЧВ у 2–3 рази [15]. У гомозиготних осіб з дефіцитом С1q-компонента комплементу спостерігається ранній розвиток тяжких форм СЧВ із вираженим гломерулонефритом та шкірними проявами. Дефіцит С2 та С4 є рідкісним (один на 10 000 та менше ніж один на 10 000 відповідно) і призводить до легкої форми захворювання з переважним ураженням шкіри та суглобів [16].
У хворих на СЧВ виявлено значне зниження інтенсивності фагоцитозу апоптотичних тілець, внаслідок чого вони піддаються процесу вторинного некрозу і їхні аутоантигени стають доступними для клітин імунної системи [17].
Також у деяких пацієнтів із СЧВ спостерігається надмірна експресія генів Тол-подібних рецепторів (англ. Toll-like receptor, TLR) 7-го та 9-го типу, лігандами яких є нуклеїнові кислоти мікроорганізмів. Як відомо, при їх активації індукується вироблення прозапальних цитокінів та інтерферону (ІФН) І типу (ІФН-1) [18].
У багатьох дослідженнях виявлено зв’язок між СЧВ та Епштейна — Барр вірусною (ЕБВ) інфекцією. У більшості хворих на СЧВ (99,5%) спостерігається інфікованість EБВ [19]. Однак статистична значимість цієї знахідки зменшується великою часткою заражених здорових дорослих (95%). У людей віком до 20 років різниця між хворими на СЧВ та здоровим контролем є більш очевидною, оскільки поширеність ЕБВ-інфекції у контрольній популяції нижча — інфіковано лише 70%, тоді як по суті всі хворі на СЧВ педіатричного профілю, інфіковані ЕБВ (99,6%). Показано, що у пацієнтів із СЧВ є принаймні в 10 разів збільшена кількість периферичних В-клітин, інфікованих EБВ, порівняно зі здоровими контрольними групами. Це збільшення пов’язане з підвищеною активністю захворювання та не залежить від прийому імуносупресивних препаратів [20]. Крім того, у мононуклеарних клітинах периферичної крові виявлено аномально високе вірусне навантаження у хворих на СЧВ порівняно зі здоровим контролем [21]. Також існують дані про зв’язок СЧВ із цитомегаловірусною інфекцією, парвовірусом В19, бактеріальними інфекціями.
Згідно з даними метааналізу виявлено невеликий, але статистично значущий зв’язок між поточним курінням та розвитком СЧВ (ризик підвищується у 1,5 раза). Однак у колишніх курців цей рівень залишався на рівні загальнопопуляційного [22].
Відомо, що надмірне УФ-опромінення може посилити прояви СЧВ. Проте його роль у виникненні захворювання залишається сумнівною. Експериментальні дані дозволяють припустити, що УФ-випромінювання призводить до посиленого утворення активних форм кисню та подальшого пошкодження ДНК, утворення нових форм аутоантигенів та автореактивних Т-клітин [23, 24].
Існують дані про підвищення ризику виникнення СЧВ внаслідок впливу деяких факторів навколишнього середовища: силікатний пил, пестициди, нафтопродукти, промислові розчинники, хлорорганічні сполуки, ртуть [25].
Доведена здатність деяких лікарських препаратів викликати медикаментозний системний червоний вовчак (МСЧВ). Найпоширенішими з них є інтерферон-альфа, ізоніазид, рифампін, фенітоїн, метилдопа, сульфасалазин, хлорпромазин, карбамазепін, етосуксимід, пропілтіоурацил. Існують повідомлення про асоціацію МСЧВ із застосуванням статинів, інгібіторів АПФ, інгібіторів протонної помпи, нестероїдних протизапальних препаратів (НПЗП), пероральних контрацептивів, препаратів мелатоніну, ехінацеї, паростків люцерни [26, 27]. Серед імунобіологічних препаратів відома здатність інгібіторів ФНП-альфа індукувати МСЧВ. При застосуванні інфліксимабу у пацієнтів із ревматоїдним артритом (РА) у 63,8% з них виявляють підвищений титр антинуклеарних антитіл (АНА) та у 13% — антитіл до двоспіральної ДНК. Для етанерцепту цей показник становить 11 та 15% відповідно [28–30].
Патогенез СЧВ характеризується значною гетерогенністю відповідно до різних генетичних та зовнішніх етіологічних чинників. Проте спільним є порушення імунної толерантності та утворення аутоантитіл до ядерних антигенів (нуклеїнових кислот і зв’язаних з ними білків), деяких компонентів клітинних мембран, імуноглобулінів, факторів коагуляції. Ураження органів опосередковується імунними комплексами і аномальною активацією Т-лімфоцитів та інших імунних клітин [31]. У патогенезі СЧВ важливу роль відіграють механізми як вродженого, так і набутого імунітету.
Роль вродженого імунітету
Ураження ДНК (зокрема УФ-випромінюванням), порушення механізмів репарації ДНК, аномальна активація апоптозу, порушення кліренсу апоптотичних тілець, виділення нейтрофілами ядерного матеріалу в процесі нетозу (NETosis від англ. Neutrophil extracellular traps) призводять до потрапляння хроматину у міжклітинний простір. Таким чином ядерні білки та ДНК стають доступними для контакту з Тол-подібними рецепторами дендритних клітин. Це веде до активації останніх, презентації ядерних антигенів Т-лімфоцитам, інтенсивного вироблення ІФН-альфа, серед яких основним є ІФН-альфа [32, 33].
За сучасними уявленнями саме ІФН-альфа відводиться ключова роль у патогенезі СЧВ [34]. Основні його ефекти такі:
1. Збільшення синтезу та виділення фактора активації В-лімфоцитів (англ. B-cell activating factor (BAFF) або B Lymphocyte Stimulator (BLyS)) моноцитами та дендритними клітинами [35].
2. Стимуляція дозрівання мієлоїдних дендритних клітин, які у свою чергу, активують аутореактивні Т-лімфоцити (за посередництва IL-12) [36].
3. Активація нейтрофілів та посилення виділення ними ядерного матеріалу у процесі нетозу [37].
Нещодавно доведена роль ІФН-альфа в патогенезі нейролюпусу у результаті здатності активувати мікрогліальні клітини, які набувають здатності поглинати нейронні структури, зменшуючи кількість синапсів [38].
Роль набутого імунітету
В-лімфоцити. Порушена центральна і периферична імунна толерантність та посилена стимуляція B-клітинних рецепторів (англ. B-cell receptor, BCR), TLR, рецепторів BAFF призводить до виживання та клональної проліферації аутореактивних В-лімфоцитів, їх диференціації у плазмоцити, що синтезують аутоантитіла [39]. В експериментах на мишачих моделях СЧВ показано підвищену активність Брутон-кінази у В-лімфоцитах тварин. Цей фермент активується при стимуляції В-клітинних рецепторів і запускає процес диференціації В-лімфоцитів та синтезу антитіл. Блокатори Брутон-кінази вже використовуються для лікування В-клітинних лімфом, досліджується їх можливе використання при РА та СЧВ [40, 41]. Продукція ІФН-альфа дендритними клітинами у відповідь на нуклеїнові кислоти також опосередковується Брутон-кіназою через активацію TLR9 [42].
Т-лімфоцити відіграють одну з ключових ролей у патогенезі СЧВ завдяки секреції прозапальних цитокінів, стимуляції синтезу аутоантитіл В-лімфоцитами, підтримання активності захворювання за рахунок накопичення автореактивних Т-клітин пам’яті [43]. На сьогодні відомо багато патогенетичних механізмів порушення функції Т-лімфоцитів. Найважливішими серед них є:
1. Зниження продукції IL-2 Т-лімфоцитами внаслідок аномальної відповіді на активацію T-клітинних рецепторів (англ. T-cell receptor — TCR). ІЛ-2 зазвичай є прозапальним цитокіном, але також необхідний для розвитку та функціонування Т-супресорів, функція яких порушена при СЧВ. У мишачих моделях СЧВ доведено позитивний ефект застосування IL-2 [44, 45].
2. Підвищена активність кінази mTOR (mammalian target of rapamycin — «мішень рапаміцину у ссавців») у Т-лімфоцитах [46].
3. Підвищення синтезу Т-лімфоцитами ІФН-гамма, який сприяє втраті імунної толерантності та стимулює виділення BAFF моноцитами. Доведено, що підвищення рівня ІФН-гамма відбувається швидше, ніж синтез аутоантитіл та ІФН-альфа [47].
4. Активація синтезу прозапального IL-17 T-хелперами-17 [48].
5. Спадкові порушення транспорту холестеролу з Т-лімфоцитів, внаслідок чого він накопичується всередині клітин і стимулює їх активацію та проліферацію. Цей механізм характерний і для дендритних клітин [49].
6. Надмірна активація В-лімфоцитів. У Т-хелперах пацієнтів із СЧВ відзначається підвищена експресія ліганда CD40 (CD40L), який при взаємодії із CD40 на поверхні В-лімфоцитів посилює вироблення ними антитіл до двоспіральної ДНК [50].
Вищенаведені механізми схематично представлені на рис. 1.
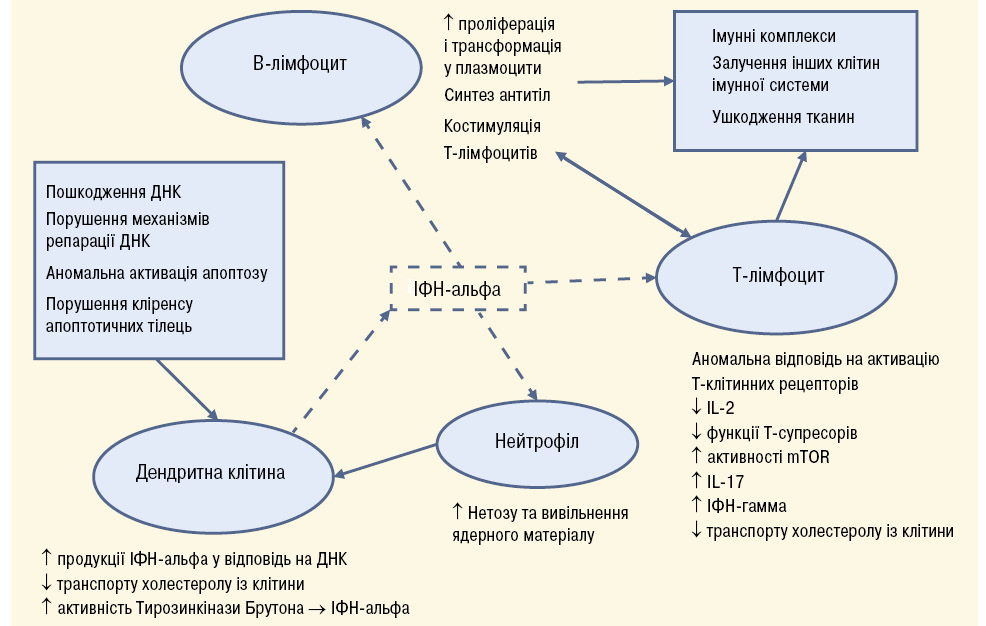
Основним механізмом ушкодження тканин є відкладення імунних комплексів із подальшою активацією системи комплементу. Далі виникає інфільтрація тканин макрофагами та іншими клітинами, розвивається запальний процес [32].
Діагностика СЧВ часто викликає значні труднощі, за міжнародними даними від моменту появи симптомів до встановлення діагнозу проходить у середньому 2 роки [51]. У 2019 р. Європейською антиревматичною лігою (EULAR) спільно з Американським коледжем ревматології (ACR) створено нові класифікаційні критерії СЧВ. Згідно з ними вхідним критерієм є наявність ANA у титрі 1:80 і більше при використанні клітин перещеплювальної епітеліоїдної лінії аденокарциноми гортані людини HEp-2 або еквівалентному позитивному тесті хоча б 1 раз. Далі оцінюється наявність клінічних проявів СЧВ (їх розділено на кілька доменів; з кожного домену враховують лише критерій з найбільшою кількістю балів), кожному з яких присвоєно певний бал:
Конституційний:
- Лихоманка (температура тіла >38,3 °C) — 2.
Гематологічний:
- Лейкопенія (<4,0∙109/л) — 3.
- Тромбоцитопенія (<100∙109/л) — 4.
- Аутоімунний гемоліз — 4.
Нейропсихіатричний:
- Делірій — 2.
- Психоз — 3.
- Судоми — 5.
Слизово-шкірний:
- Нерубцева алопеція — 2.
- Виразки у ротовій порожнині — 2.
- Підгострий шкірний або дискоїдний вовчак — 4.
- Гострий шкірний вовчак — 6.
Серозний:
- Плевральний або перикардіальний випіт — 5.
- Гострий перикардит — 6.
Суглобовий:
- Ураження суглобів (синовіт двох чи більше суглобів, що характеризується набряком чи випотом або біль у двох чи більше суглобах, що супроводжується ранковою скутістю тривалістю щонайменше 30 хв) — 6.
Нирковий:
- Добова протеїнурія >0,5 г/л — 4.
- Вовчаковий нефрит ІІ або V класу — 8.
- Вовчаковий нефрит ІІI або IV класу — 10.
Антифосфоліпідні антитіла:
- Позитивні антитіла до кардіоліпіну, β-2-глікопротеїну, вовчаковий антикоагулянт — 2.
Білки комплементу:
- Низький рівень С3 або С4–3.
- Низький рівень С3 і С4 — 4.
СЧВ-специфічні антитіла:
- Позитивні антитіла до двоспіральної ДНК або Сміт-антигену — 6.
Діагноз СЧВ встановлюється за наявності 10 і більше балів і хоча б одного клінічного критерію [52].
Диференційну діагностику СЧВ найчастіше проводять із такими нозологіями:
- Інші аутоімунні захворювання.
Ревматоїдний артрит (РА) може проявлятися поліартикулярним запальним артритом та позасуглобовими проявами. Позитивні ANA, Anti-Ro та Anti-La антитіла також можуть спостерігатися при РА, хоча інші специфічні для СЧВ антитіла та гіпокомплементемія рідкісні. СЧВ може бути пов’язаний із позитивним ревматоїдним фактором, але рівень антитіл до циклічного цитрулінового пептиду не підвищується [53].
Медикаментозний СЧВ характеризується зникненням симптомів після відміни ліків та відсутністю тяжчих проявів, хоча аутоантитіла можуть залишатися позитивними протягом декількох років [54].
Дебют хвороби Стілла у дорослих характеризується артралгією, лихоманкою, лімфаденопатією, спленомегалією, лейкоцитозом, але відсутній типовий для СЧВ висип, ураження інших органів та специфічні антитіла [53].
Хвороба Бехчета характеризується афтозними виразками, увеїтом та артралгією, але не має інших системних та серологічних особливостей СЧВ [55].
Саркоїдоз проявляється лихоманкою, кашлем, задишкою, артритом, втомою, нічною пітливістю, висипом, увеїтом. Проте для цього захворювання характерне формування гранульом, двобічної аденопатії на рентгенографії грудної клітки, які рідко трапляються при СЧВ [56].
- Інфекції.
Кілька вірусних захворювань можуть імітувати СЧВ. Інфекція, викликана парвовірусом В19, супроводжується лихоманкою, висипом, запальним артритом і цитопенією, іноді — позитивними АНА та РФ. Гепатити В і С можуть бути пов’язаними з артралгією, запальним артритом і позитивними АНА та РФ. Герпесвірусні інфекції (цитомегаловірус (CMV) та ЕБВ) викликають лихоманку, втому, цитопенію та підвищення трансаміназ. При ВІЛ-інфекції можливі лихоманка, втома, виразки у роті та цитопенія. Специфічні серологічні ознаки та системні прояви СЧВ відсутні при вірусних інфекціях. Крім того, позитивні вірусні серологічні маркери можуть допомогти встановити правильний діагноз.
Інфекційний ендокардит, що характеризується лихоманкою, артеріальною емболією, артралгіями, міалгіями та шумом у серці, може бути схожим до серцевих проявів СЧВ. Відсутність специфічних аутоантитіл та позитивний результат посіву крові дозволяють виключити СЧВ [53].
- Злоякісні утворення.
Лімфоми, особливо неходжкінські, можуть проявлятися втомою, втратою маси тіла, лихоманкою, артралгіями, цитопеніями, лімфаденопатією та позитивними АНА, тому у пацієнтів літнього віку, що мають симптоми СЧВ, показаний детальний онкоскринінг [53].
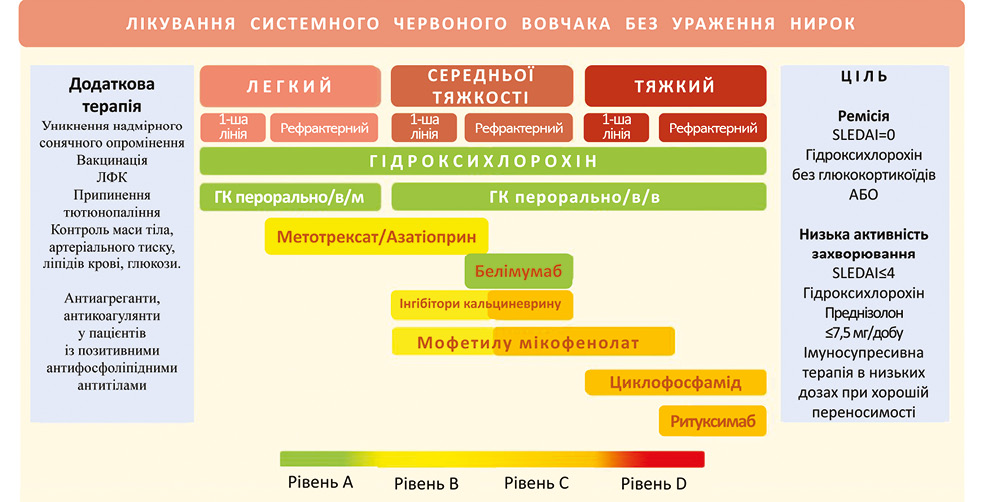
Лікування СЧВ часто викликає значні труднощі, що зумовлено швидким прогресуванням захворювання, мультиорганним ураженням та відсутністю чітких уявлень про етіологію та патогенез захворювання. Усім пацієнтам рекомендована модифікація способу життя: відмова від куріння, дозовані фізичні навантаження, нормалізація маси тіла, дієта з підвищеним вмістом поліненасичених жирних кислот, захист від надмірного сонячного опромінення, контроль артеріального тиску, рівня глюкози, ліпідного профілю, планова вакцинація [57, 58].
При лікуванні СЧВ досягнути повної ремісії (відсутність клінічної активності без застосування глюкокортикоїдів (ГК) та цитостатиків (ЦС)) вдається рідко [59]. Проте в ряді досліджень показано, що низька активність хвороби (SLEDAI ≤3 при прийомі антималярійних препаратів або SLEDAI ≤4 при прийомі ГК≤7,5 мг/добу в перерахунку на преднізолон та цитостатиків, що добре переносяться) має порівнянні показники з ремісією щодо запобігання загостренням та ушкодження органів [60, 61].
Глюкокортикоїди (ГК) показані всім пацієнтам на тривалий прийом. Доза залежить від активності захворювання за індексами SELENA-SLEDAI або SLEDAI-2K:
- низька (1–5 балів) —≤7,5 мг/добу (в перерахунку на преднізон);
- середня (6–10 балів) — 7,5–30 мг/добу впродовж 4 тиж із поступовим зниженням до підтримувальної терапії низькими дозами.
- висока (11–20 балів) і дуже висока (>20 балів) — 30–100 мг/добу або 0,5–1 мг/кг/добу протягом 4–12 тиж із поступовим зниженням до низьких доз.
Пульс-терапія (250–1000 мг метилпреднізолону внутрішньовенно (в/в) крапельно протягом 3 і більше днів) застосовується при ураженні життєво важливих органів (нефрит, нейролюпус, пневмоніт, мезентеріальний васкуліт), при недостатній ефективності попередньої терапії, для досягнення швидкого ефекту та подальшого використання нижчих доз пероральних ГК. Застосування пульс-терапії можливе за умови виключення інфекційного процесу [62–65].
Гідроксихлорохін (ГХХ) у дозі не вище 5 мг/кг/добу рекомендований усім пацієнтам із СЧВ за відсутності протипоказань. Препарат проявляє протизапальну, антиагрегантну, гіполіпідемічну дію, зменшує чутливість до УФ-опромінення, знижує частоту загострень та ризик ураження нирок, має антиканцерогенний вплив, знижує серцево-судинний ризик [57, 66]. Основним побічним ефектом є ретинопатія, для запобігання якої рекомендується офтальмологічне обстеження перед призначенням препарату і 1 раз на рік — під час прийому. Останнім часом оптична когерентна томографія (ОКТ) сітківки розглядається як більш чутливий метод ранньої діагностики ретинопатії [67].
НПЗП рекомендовані для лікування у разі лихоманки, головного болю, артриту, міозиту та серозиту в стандартних дозах максимально коротким курсом з урахуванням можливих ризиків, особливо з боку шлунково-кишкового тракту та нирок [68].
Застосування цитостатиків дозволяє швидше знижувати дозу ГК та запобігати загостренням хвороби. Метотрексат (МТ) та азатіоприн (АЗА) застосовують при недостатній ефективності ГХХ та ГК, за неможливості знизити дозу ГК до цільової або як препарати першої лінії при помірній активності. Згідно з даними літератури, МТ — ефективніший за азатіоприн, проте останній можна застосовувати у період вагітності [57, 65, 69, 70]. Мікофенолату мофетил (ММФ) є потужним імуносупресантом, який призначають при помірній та високій активності, в тому числі при вовчаковому нефриті, проте він є неефективним при нейролюпусі. Попри високу ефективність обмеженнями до його застосування є тератогенна дія (повинен бути відмінений мінімум за 6 тиж до зачаття) та висока ціна [57, 71]. Циклофосфамід (ЦФ) застосовується при загрозливих ураженнях нирок, центральної нервової системи (ЦНС), серця та легень з урахуванням гонадотоксичного ефекту, підвищення ризику онкологічних та інфекційних захворювань. Препарат потрібно з обережністю використовувати у чоловіків та жінок фертильного віку. Перед початком лікування вони мають бути поінформовані про можливість кріоконсервації статевих клітин [57, 72, 73].
Серед імунобіологічних препаратів у світі на сьогодні при СЧВ активно використовують белімумаб (не зареєстрований в Україні) та ритуксимаб (зареєстрований в Україні для лікування пацієнтів із В-клітинними лімфомами та РА, при СЧВ застосовується off-label).
Белімумаб — людські моноклональні антитіла до фактора активації В-лімфоцитів (BAFF, BlyS). Препарат є ефективним при помірній активності без активного вовчакового нефриту та ураження ЦНС. Найбільш чутливими до белімумабу є хворі зі шкірними, м’язово-суглобовими проявами та високою імунологічною активністю. Схема введення препарату — 10 мг/кг в/в з інтервалом у 2 тиж при перших трьох інфузіях, надалі — раз на 4 тиж [73, 74].
Ритуксимаб — химерні моноклональні антитіла миші/людини, що специфічно зв’язуються із трансмембранним антигеном CD20, розташованим на поверхні пре-В-лімфоцитів та зрілих В-лімфоцитів. Використовується як препарат резерву в разі неефективності інших методів лікування, проте є препаратом першої лінії при тяжкій аутоімунній тромбоцитопенії та гемолітичній анемії. Схема введення — 2 в/в введення по 500–1000 мг з інтервалом у 2 тиж, повторення курсу через півроку [75, 76]. Вищеописані принципи лікування СЧВ — на рис. 2.
Низка нових імунобіологічних препаратів, що можуть бути ефективними у разі СЧВ, зараз проходять клінічні дослідження. Серед них:
- аніфролумаб — антитіла до інтерферону-альфа;
- устекінумаб — антитіла до IL-12 та IL-23;
- алдеслейкін — препарат IL-2;
- барицитиніб, тофацитиніб — інгібітори Янус-кінази;
- рапаміцин — блокатор mTOR;
- фенебрутиніб — інгібітор Брутон-кінази;
- окрелізумаб — повністю людські антитіла до CD20 [77].
Особливої уваги заслуговує лікування пацієнтів із вовчаковим нефритом (ВН). Основні принципи викладені в нових рекомендаціях, створених EULAR спільно з Європейською нирковою асоціацією та Європейською асоціацією діалізу і трансплантації (ERA-EDTA) у 2019 р. Золотим стандартом діагностики є проведення нефробіопсії, що в Україні, на жаль, не є рутинним методом. Вона показана при персистуючій добовій протеїнурії ≥0,5 г/добу або співвідношенні протеїну до креатиніну в сечі ≥500 мг/г. Виділяють 6 морфологічних класів ВН:
I — мінімальний мезангіальний;
II — мезангіопроліферативний;
III — фокальний (<50% уражених клубочків);
IV — дифузний (>50% уражених клубочків);
V — мембранозний (стовщення базальної мембрани клубочків, можуть бути зміни, притаманні III і IV класам);
VI — склеротичний (нефросклероз без ознак активності).
Для ІІІ та ІV класів додатково використовують буквені уточнення: А — активний, С — хронічні ураження, S — сегментарне ураження клубочка, G — глобальне ураження клубочка.
У лікуванні виділяють індукційну (3–6 міс) та підтримувальну фази лікування.
При ВН І і ІІ класу проводять лікування тільки позаниркових проявів СЧВ, проте при появі протеїнурії ≥0,5 г/добу і еритроцитурії застосовують ГК у середніх або високих дозах протягом 4–6 тиж з можливим додаванням азатіоприну в дозі 1–2 мг/кг/добу.
При ВН ІІІ і ІV класів застосовують:
- ГК: пульс-терапія метилпреднізолоном у сумарній дозі 500–2500 мг і подальше призначення пероральних форм у дозі 0,3–0,5 мг/кг/добу (за преднізолоном) показали однакову ефективність із застосуванням високих доз перорально без проведення пульс-терапії. Дозу поступово знижують до ≤7,5 мг/добу за 3–6 міс;
- цитостатики: ММФ 2–3 г/добу або ЦФ в/в у низькодозовому режимі (6 доз по 500 мг кожні 2 тиж).
За наявності несприятливих прогностичних факторів (зниження швидкості клубочкової фільтрації, наявність півмісяців або фібриноїдних некрозів у біоптаті) рекомендоване проведення пульс-терапії з переходом на високі пероральні дози ГК та застосування циклофосфаміду у високих дозах (6 доз по 0,5–0,75 г/м2 з інтервалом в 1 міс).
При ВН V класу препаратом першої лінії є ММФ у дозі 2–3 г/добу разом із пульс-терапією метилпреднізолоном (500–2500 г сумарно) та переходом на оральний преднізолон у дозі 20 мг/добу та подальшим зниженням до ≤5 мг/д протягом 3 міс. Альтернативою є інгібітори кальциневрину (особливо такролімус) як монотерапія чи в комбінації з ММФ, а також циклофосфамід.
У разі відсутності ефекту від індукційної терапії протягом 6 міс або розвитку загострення через 3 міс рекомендується зміна цитостатичного препарату і проведення пульс-терапії. У разі неефективності однієї–двох схем рекомендовано застосування ритуксимабу 500–1000 мг з інтервалом 2 тиж.
Як підтримувальну терапію застосовують ММФ 1–2 г/добу (особливо, якщо він застосовувався для індукції ремісії) або азатіоприн 2 мг/кг/добу (особливо при плануванні вагітності).
Додатково при активному вовчаковому нефриті призначають:
- інгібітори ангіотензинперетворювального ферменту або блокатори рецепторів ангіотензину ІІ — при співвідношенні протеїну до креатиніну в сечі ≥500 мг/г або артеріальній гіпертензії;
- статини — при дисліпідемії;
- препарати кальцію та вітаміну D;
- антикоагулянти — при нефротичному синдромі з гіпоальбумінемією <20 г/л [57, 65, 78].
Плазмаферез та введення в/в імуноглобуліну (ВВІГ) — методи резерву при лікуванні пацієнтів із СЧВ.
ВВІГ використовують у разі тяжкого ураження нирок та ЦНС, вираженої тромбоцитопенії, приєднанні бактеріальної інфекції. Препарат застосовується у дозі 2 г/кг, яку ділять на рівномірні введення упродовж 2–5 днів поспіль [79, 80].
Плазмаферез застосовується при високій активності захворювання, резистентності до медикаментозної терапії; особливо ефективним є при катастрофічному антифосфоліпідному синдромі, гіпергамаглобулінемічному та кріоглобулінемічному васкулітах, значній лейкопенії, яка обмежує застосування цитостатиків [81].
Завдяки розвитку в діагностиці та лікуванні СЧВ середня виживаність за останні роки значно зросла. 5-річна виживаність становить 95%, тоді як у 1950-х роках цей показник становив лише 50%. При ранній діагностиці 10-річна виживаність становить 85%, а 20-річна — 75% [82].
Підсумовуючи, наголосимо, що в Україні порівняно з країнами Європи та США значно нижчі рівні захворюваності та поширеності СЧВ, що найімовірніше пов’язано з недостатнім виявленням хворих із цією патологією. Це потребує глибшого вивчення стану проблеми в нашій країні та розроблення методів удосконалення діагностики та лікування СЧВ.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- 1. Лила В. А. (2020) Клинико-лабораторные взаимосвязи у пациентов с различными вариантами течения системной красной волчанки. Соврем. ревматол., 14(1): 26–31.
- 2. Rees F., Doherty M., Grainge M.J. et al. (2017) The worldwide incidence and prevalence of systemic lupus erythematosus: a systematic review of epidemiological studies. Rheumatol. (Oxford)., 56(11): 1945–1961.
- 3. Коваленко В.М., Корнацький В.М. (2019) Стан здоров’я народу України та медичної допомоги третинного рівня: Посібник. ДУ ННЦ Інститут кардіології імені акад. М.Д. Стражеска, Київ, с. 193.
- 4. Angel A., Justiz V., Amandeep G. et al. (2020) Systemic Lupus Erythematosus (SLE). StatPearls Publishing, Treasure Island (FL), 2020 Jan.
- 5. Kassi E., Moutsatsou P. (2010) Estrogen Receptor Signaling and Its Relationship to Cytokines in Systemic Lupus Erythematosus. BioMed. Res. International., 2010: 14.
- 6. Maret A., Coudert J.D., Garidou L. et al. (2003) Estradiol enhances primary antigen-specific CD4 T cell responses and Th1 development in vivo. Essential role of estrogen receptor alpha expression in hematopoietic cells. Eur. J. Immunol., 33(2): 512–521.
- 7. Kramer P.R., Kramer S.F., Guan G. (2004) 17 beta-estradiol regulates cytokine release through modulation of CD16 expression in monocytes and monocyte-derived macrophages. Arthritis. Rheum., 50(6): 1967–1975.
- 8. Christou E.A.A., Banos A., Kosmara D. et al. (2019) Sexual dimorphism in SLE: above and beyond sex hormones. Lupus, 28(1): 3–10.
- 9. Nightingale A.L., Davidson J.E., Molta C.T. et al. (2017) Presentation of SLE in UK primary care using the Clinical Practice Research Datalink. Lupus Sci. & Med., 4: e000172.
- 10. Lewis M.J., Jawad A.S. (2017) The effect of ethnicity and genetic ancestry on the epidemiology, clinical features and outcome of systemic lupus erythematosus. Rheumatol. (Oxford)., 56(Suppl. 1): i67–i77.
- 11. Stojan G., Petri M. (2018) Epidemiology of systemic lupus erythematosus: an update. Curr. Opin. Rheumatol., 30(2): 144–150.
- 12. Finzel S., Schaffer S., Rizzi M. et al. (2018) Pathogenese des systemischen Lupus erythematodes [Pathogenesis of systemic lupus erythematosus]. Z. Rheumatol., 77(9): 789–798.
- 13. Ramos P.S., Brown E.E., Kimberly R.P. et al. (2010) Genetic factors predisposing to systemic lupus erythematosus and lupus nephritis. Semin. Nephrol., 30(2): 164–176.
- 14. Zan H., Tat C., Casali P. (2014) MicroRNAs in lupus. Autoimmun.,
47(4): 272–285. - 15. Morris D.L., Fernando M.M., Taylor K.E. et al. (2014) MHC associations with clinical and autoantibody manifestations in European SLE. Genes Immunol., 15(4): 210–217.
- 16. Pickering M.C., Botto M., Taylor P.R. et al. (2000) Systemic lupus erythematosus, complement deficiency, and apoptosis. Adv. Immunol., 76:
227–324. - 17. Munoz L.E., Gaipl U.S., Franz S. et al. (2005) SLE — a disease of clearance deficiency? Rheumatol., 44(9): 1101–1107.
- 18. Horton C.G., Farris A.D. (2012) Toll-like receptors in systemic lupus erythematosus: potential targets for therapeutic intervention. Curr. Allergy. Asthma Rep., 12(1): 1–7.
- 19. James J.A., Neas B.R., Moser K.L. et al. (2001) Systemic lupus erythematosus in adults is associated with previous Epstein-Barr virus exposure. Arthritis Rheum., 44(5): 1122–1126.
- 20. Gross A.J., Hochberg D., Rand W.M. et al. (2005) EBV and systemic lupus erythematosus: a new perspective. J. Immunol., 174(11): 6599–6607.
- 21. Draborg A.H., Duus K., Houen G. (2012) Epstein-Barr virus and systemic lupus erythematosus. Clin. Dev. Immunol., 2012: 370516.
- 22. Costenbader K.H., Kim D.J., Peerzada J. et al. (2004) Cigarette smoking and the risk of systemic lupus erythematosus: a meta-analysis. Arthritis Rheum., 50(3): 849–857.
- 23. Barbhaiya M., Costenbader K.H. (2016) Environmental exposures and the development of systemic lupus erythematosus. Curr. Opin. Rheumatol., 28(5): 497–505.
- 24. Клюквина Н.Г. (2015) Системная красная волчанка и витамин D. Современ. ревматол., 9(2): 57–65.
- 25. Parks C.G., Cooper G.S. (2005) Occupational exposures and risk of systemic lupus erythematosus. Autoimmun., 38(7): 497–506.
- 26. Solhjoo M., Bansal P., Goyal A., Chauhan K. (2020) Drug-Induced Lupus Erythematosus. StatPearls Publishing, Treasure Island (FL), Jan. 2020.
- 27. He Y., Sawalha A.H. (2018) Drug-induced lupus erythematosus: an update on drugs and mechanisms. Curr. Opin. Rheumatol., 30(5): 490–497.
- 28. Atzeni F., Turiel M., Capsoni F. et al. (2005) Autoimmunity and anti-TNF-alpha agents. Ann. N. Y. Acad. Sci., 1051: 559–569.
- 29. Shakoor N., Michalska M., Harris C.A. et al. (2002) Drug-induced systemic lupus erythematosus associated with etanercept therapy. Lancet, 359(9306): 579–580.
- 30. De Rycke L., Kruithof E., Van Damme N. et al. (2003) Antinuclear antibodies following infliximab treatment in patients with rheumatoid arthritis or spondylarthropathy. Arthritis. Rheum. 48(4): 1015–1023.
- 31. Lo M.S., Tsokos G.C. (2018) Recent developments in systemic lupus erythematosus pathogenesis and applications for therapy. Curr. Opin. Rheumatol., 30(2): 222–228.
- 32. Choi J., Kim S.T., Craft J. (2012) The pathogenesis of systemic lupus erythematosus-an update. Curr. Opin. Immunol., 24(6): 651–657.
- 33. Кучинская Е.М., Суспицын Е.Н., Костик М.М. (2020) Генетические аспекты патогенеза системной красной волчанки у детей. Современ. ревматол., 14(1): 101–107.
- 34. Crow M.K. (2014) Type I Interferon in the Pathogenesis of Lupus. J. Immunol., 192(12): 5459–5468.
- 35. López P., Scheel-Toellner D., Rodríguez-Carrio J. et al. (2014) Interferon-α-induced B-lymphocyte stimulator expression and mobilization in healthy and systemic lupus erthymatosus monocytes. Rheumatol. (Oxford), 53(12): 2249–2258.
- 36. Blanco P., Palucka A.K., Gill M. et al. (2001) Induction of dendritic cell differentiation by IFN-alpha in systemic lupus erythematosus. Sci., 294(5546): 1540–1543.
- 37. Craft J.E. (2011) Dissecting the immune cell mayhem that drives lupus pathogenesis. Sci. Transl. Med., 3(73): 73ps9.
- 38. Bialas A.R., Presumey J., Das A. et al. (2017) Microglia-dependent synapse loss in type I interferon-mediated lupus. Nature, 546(7659): 539–543.
- 39. Liu Z., Davidson A. (2011) BAFF and selection of autoreactive B cells. Trends. Immunol., 32(8): 388–394.
- 40. Hutcheson J., Vanarsa K., Bashmakov A. et al. (2012) Modulating proximal cell signaling by targeting Btk ameliorates humoral autoimmunity and end-organ disease in murine lupus. Arthritis Res. Ther., 14(6): R243.
- 41. Kim Y.Y., Park K.T., Jang S.Y. et al. (2017) HM71224, a selective Bruton’s tyrosine kinase inhibitor, attenuates the development of murine lupus. Arthritis Res. Ther., 19(1): 211.
- 42. Wang J., Lau K.Y., Jung J., Ravindran P. et al. (2014) Bruton’s tyrosine kinase regulates TLR9 but not TLR7 signaling in human plasmacytoid dendritic cells. Eur. J. Immunol., 44(4): 1130–1136.
- 43. Suárez-Fueyo A., Bradley S.J., Tsokos G.C. (2016) T cells in Systemic Lupus Erythematosus. Curr. Opin. Immunol., 43: 32–38.
- 44. Lieberman L.A., Tsokos G.C. (2010) The IL-2 defect in systemic lupus erythematosus disease has an expansive effect on host immunity. J. Biomed. Biotechnol., 2010: 740619.
- 45. Mizui M., Koga T., Lieberman L.A. et al. (2014) IL-2 protects lupus-prone mice from multiple end-organ damage by limiting CD4-CD8- IL-17-producing T cells. J. Immunol., 193(5): 2168–2177.
- 46. Fernandez D.R., Telarico T., Bonilla E. et al. (2009) Activation of mammalian target of rapamycin controls the loss of TCRzeta in lupus T cells through HRES-1/Rab4-regulated lysosomal degradation. J. Immunol., 182(4): 2063–2073.
- 47. Munroe M.E., Lu R., Zhao Y.D. et al. (2016) Altered type II interferon precedes autoantibody accrual and elevated type I interferon activity prior to systemic lupus erythematosus classification. Ann. Rheum. Dis., 75(11): 2014–2021.
- 48. Kato H., Perl A. (2014) Mechanistic target of rapamycin complex 1 expands Th17 and IL-4+ CD4-CD8- double-negative T cells and contracts regulatory T cells in systemic lupus erythematosus. J. Immunol., 192(9): 4134–4144.
- 49. Armstrong A.J., Gebre A.K., Parks J.S. et al. (2010) ATP-binding cassette transporter G1 negatively regulates thymocyte and peripheral lymphocyte proliferation. J. Immunol., 184(1): 173–183.
- 50. Vaishali R., Tsokos G.C. et al. (2015) T cell signaling abnormalities contribute to aberrant immune cell function and autoimmunity. J. Clin. Invest., 125(6): 2220–2227.
- 51. Gergianaki I., Bertsias G. (2018) Systemic Lupus Erythematosus in Primary Care: An Update and Practical Messages for the General Practitioner. Front. Med. (Lausanne), 5: 161.
- 52. Aringer M., Costenbader K., Daikh D. et al. (2019) European League Against Rheumatism/American College of Rheumatology classification criteria for systemic lupus erythematosus. Ann. Rheum. Dis., 78(9): 1151–1159.
- 53. Justiz Vaillant A.A., Goyal A., Bansal P. et al. (2020) Systemic Lupus Erythematosus (SLE). StatPearls Publishing, Treasure Island (FL), 2020 Jan.
- 54. Solhjoo M., Bansal P., Goyal A. et al. (2020) Drug-Induced Lupus Erythematosus. StatPearls Publishing, Treasure Island (FL), 2020 Jan.
- 55. Adil A., Goyal A., Bansal P. et al. (2020) Behcet Disease. StatPearls Publishing, Treasure Island (FL), 2020 Jan.
- 56. Lam N.C., Ghetu M.V., Bieniek M.L. (2016) Systemic Lupus Erythematosus: Primary Care Approach to Diagnosis and Management. Am. Fam. Physician., 94(4): 284–294.
- 57. Fanouriakis A., Kostopoulou M., Alunno A. et al. (2019) 2019 update of the EULAR recommendations for the management of systemic lupus erythematosus. Ann. Rheum. Dis., 78: 736–745.
- 58. Rodríguez Huerta M.D., Trujillo-Martín M.M., Rúa-Figueroa Í. et al. (2016) Healthy lifestyle habits for patients with systemic lupus erythematosus: A systemic review. Semin. Arthritis. Rheum., 45(4): 463–470.
- 59. Medina-Quiñones C.V., Ramos-Merino L., Ruiz-Sada P. et al. (2016) Analysis of complete remission in systemic lupus erythematosus patients over a 32-year period. Arthritis. Care Res., 68: 981–987.
- 60. Tsang-A-Sjoe M.W., Bultink I.E., Heslinga M. et al. (2017) Both prolonged remission and Lupus Low Disease Activity State are associated with reduced damage accrual in systemic lupus erythematosus. Rheumatol. (Oxford), 56(1): 121–128.
- 61. Tselios K., Gladman D.D., Touma Z. et al. (2019) Clinical remission and low disease activity have comparable outcomes over 10 years in systemic lupus erythematosus. Arthritis Care Res. (Hoboken), 71(6): 822–828.
- 62. Chen H.L., Shen L-J., Hsu P-N. et al. (2018) Cumulative Burden of Glucocorticoid-related Adverse Events in Patients with Systemic Lupus Erythematosus: Findings from a 12-year Longitudinal Study. J. Rheumatol.,
45(1): 83–89. - 63. Al Sawah S., Zhang X., Zhu B. et al. (2015) Effect of corticosteroid use by dose on the risk of developing organ damage over time in systemic lupus erythematosus–the Hopkins Lupus Cohort. Lupus Sci. Med., 2(1): e000066.
- 64. Singh J.A., Hossain A., Kotb A. et al. (2016) Risk of serious infections with immunosuppressive drugs and glucocorticoids for lupus nephritis: a systematic review and network meta-analysis. BMC Med., 14(1): 137.
- 65. Коваленко В.М., Рекалов Д.Г., Яцишин Р.І. та ін. (2020) Системний червоний вовчак (клінічні настанови). Всеукр. Асоц. Ревматол. України, Київ, с. 74.
- 66. Dörner T. (2010) Therapy: Hydroxychloroquine in SLE: old drug, new perspectives. Nat. Rev. Rheumatol., 6(1): 10–11.
- 67. Sakir G.Y. Atılgan C.U. Tekin K. et al. (2019) Validity of Optical Coherence Tomography Angiography as a Screening Test for the Early Detection of Retinal Changes in Patients with Hydroxychloroquine Therapy. J. Curr. Eye Res., 44,(3): 311–315.
- 68. Ostensen M., Villiger P.M. (2000) Nonsteroidal anti-inflammatory drugs in systemic lupus erythematosus. Lupus, 9(8): 566–572.
- 69. Pego‐Reigosa J.M., Cobo‐Ibáñez T., Calvo‐Alén J. et al. (2013), Efficacy and Safety of Nonbiologic Immunosuppressants in the Treatment of Nonrenal Systemic Lupus Erythematosus: A Systematic Review. Arthritis & Rheum.,
65: 1775–1785. - 70. Sakthiswary R., Suresh E. (2014) Methotrexate in systemic lupus erythematosus: a systematic review of its efficacy. Lupus, 23(3): 225–235.
- 71. Tselios K., Gladman D.D., Su J. et al. (2016) Mycophenolate mofetil in nonrenal manifestations of systemic lupus erythematosus: an observational cohort study. J. Rheumatol. 43(3): 552–558.
- 72. Mok C.C., Chan P.T., To C.H. (2013) Anti-müllerian hormone and ovarian reserve in systemic lupus erythematosus. Arthritis Rheum., 65(1): 206–210.
- 73. Hsu C.Y., Lin M-S, Su Yu-J. et al. (2017) Cumulative immunosuppressant exposure is associated with diversified cancer risk among 14 832 patients with systemic lupus erythematosus: a nested case-control study. Rheumatol. (Oxford), 56: 620–628.
- 74. Iaccarino L., Andreoli L., Bartoloni Boc E. et al. (2018) Clinical predictors of response and discontinuation of belimumab in patients with systemic lupus erythematosus in real life setting. Results of a large, multicentric, nationwide study. J. Autoimmun., 86: 1–8.
- 75. Iaccarino L., Bartoloni E., Carli L. et al. (2015) Efficacy and safety of off-label use of rituximab in refractory lupus: data from the Italian Multicentre Registry. Clin. Exp. Rheumatol., 33(4): 449–456.
- 76. Gomez Mendez L.M. Cascino M.D., Garg J. et al. (2018) Peripheral Blood B Cell Depletion after Rituximab and Complete Response in Lupus Nephritis.
Clin. J. Am. Soc. Nephrol., 13(10): 1502–1509. - 77. Vukelic M., Li Y., Kyttaris V.C. (2018) Novel Treatments in Lupus. Front. Immunol., 9: 2658.
- 78. Fanouriakis A., Kostopoulou M., Cheema K. et al. (2020) 2019 Update of the Joint European League Against Rheumatism and European Renal Association–European Dialysis and Transplant Association (EULAR/ERA–EDTA) recommendations for the management of lupus nephritis. Ann. Rheum. Dis., 79(6): 713–723.
- 79. Sakthiswary R., D’Cruz D. (2014) Intravenous immunoglobulin in the therapeutic armamentarium of systemic lupus erythematosus: a systematic review and meta-analysis. Med. (Baltimore), 93(16): e86.
- 80. Binello N., Cancelli C., Passalacqua S. et al. (2018) Use of Intravenous Immunoglobulin Therapy at Unconventional Doses in Refractory Fulminant Systemic Lupus Erythematosus. Eur. J. Case Rep. Intern. Med., 5(9): 000934.
- 81. Soyuöz A., Karadağ Ö., Karaağaç T. et al. (2018) Therapeutic plasma exchange for refractory SLE: A comparison of outcomes between different sub-phenotypes. Eur. J. Rheumatol., 5(1): 32–36.
- 82. Olesińska M., Saletra A. (2018) Quality of life in systemic lupus erythematosus and its measurement. Reumatol., 56(1): 45–54.
СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА: СОСТОЯНИЕ ПРОБЛЕМЫ В УКРАИНЕ И МИРЕ
ГУ «ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины», Киев
Резюме. Системная красная волчанка (СКВ) остается недостаточно изученным заболеванием, несмотря на большое количество проводимых исследований. С каждым годом появляется все больше данных, углубляющих понимание этиологии и патогенеза заболевания, открывающих новые возможности для диагностики и лечения. Цель исследования — освещение новых и обобщение ранее известных данных об эпидемиологии, этиопатогенезе, диагностике и лечении СКВ, а также актуализация более глубокого изучения данной проблемы в Украине. Материалы и методы. Осуществлен научный поиск среди печатных и электронных изданий, научных поисковых баз. Применены методы сравнения, анализа и обобщения данных. Результаты. В статье приведены уровни заболеваемости и распространенности СКВ в разных странах мира. Также рассмотрены зависимость статистических показателей от возраста, пола, этнической и расовой принадлежности. Описаны этиологические факторы заболевания, которые считаются основными на данном этапе изучения проблемы, и современные представления о патогенезе. Публикация содержит новые классификационные критерии СКВ, разработанные Европейской антиревматической лигой (EULAR) совместно с Американским колледжем ревматологии (ACR) в 2019 г. Их особенностью по сравнению с предыдущими версиями является наличие входного критерия — титр антинуклеарных антител 1:80 и более, присвоение признакам баллов в соответствии со значимостью и их распределение по клиническим и иммунологическим доменам. Также кратко рассмотрены основные принципы медикаментозной терапии — применение глюкокортикоидов, гидроксихлорохина, цитостатиков (метотрексат, азатиоприн, мофетила микофенолат, циклофосфамид), иммунобиологических препаратов (белимумаб, ритуксимаб и ряд других, которые на данный момент проходят клинические испытания). Выводы. В Украине по сравнению со странами Европы и США отмечаются значительно более низкие уровни заболеваемости и распространенности СКВ, что, вероятнее всего, связано с недостаточным выявлением больных с этой патологией. Это требует более глубокого изучения состояния проблемы в нашей стране и разработки методов совершенствования диагностики и лечения СКВ.
Ключевые слова: системная красная волчанка, заболеваемость, распространенность, этиология, диагностика, лечение, глюкокортикоиды, цитостатики, иммунобиологические препараты.
Адреса для листування:
Проценко Галина Олександрівна
03151, Київ, вул. Народного ополчення, 5А
ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України»
E-mail: g_protsenko@yahoo.com

Leave a comment