МІСЦЕ СЕРЕДНЬОМОЛЕКУЛЯРНИХ СПОЛУК У КЛІНІКО-ПАТОГЕНЕТИЧНИХ ПОБУДОВАХ РЕВМАТОЇДНОГО АРТРИТУ
Синяченко О.В., Єрмолаєва М.В., Лівенцова К.В., Верзілов С.М., Алієва Т.Ю., Потапов Ю.О., Пилипенко В.В., Федоров Д.М.
Резюме. Актуальність. У хворих на ревматоїдний артрит (РА) зміни рівнів молекул середньої маси (МСМ) різних фракцій у біологічних рідинах гіпотетично можуть визначати розвиток вісцеритів, характер кістководеструктивних суглобових ушкоджень і темпи прогресування захворювання, але ці питання є маловивченими. Мета і завдання дослідження: встановити клінікопатогенетичну значимість МСМ різних фракцій у біологічних рідинах хворих на РА, вивчити клініко-лабораторні та рентгеносонографічні чинники, що їх визначають, обґрунтувати інформативні прогностичні критерії. Матеріали та методи. Під спостереженням перебували 105 хворих на РА. МСМ визначали скринінговим методом з осадженням білків трихлороцтовою кислотою і визначенням спектрів поглинання світла кислоторозчинною фракцією. Результати. РА супроводжується підвищенням у сироватці крові концентрацій окремих фракцій МСМ, що пов’язано із загальною активністю захворювання та артикулярного синдрому, зокрема наявністю окремих кістководеструктивних суглобових ушкоджень і системних проявів захворювання. Зі змінами концентрацій середньомолекулярних гормонів пов’язана активність і стадійність РА, темпи його прогресування, розвиток остеопорозу, формування кістководеструктивних ушкоджень, а рівень остеокальцину виявляє прогностичну значимість. Висновки: окремі фракції МСМ різних біологічних рідин беруть участь у патогенетичних побудовах РА, залежать від клінічних, лабораторних, рентгенологічних і сонографічних ознак захворювання, можуть бути використані для прогнозування перебігу патологічного процесу, контролю ефективності лікування і розроблення нових медичних лікувальних технологій.
DOI: 10.32471/rheumatology.2707-6970.83.15913
УДК 616.72-036.11:547.857]-07-092
Актуальність
Клініко-експериментальні дослідження продемонстрували роль низько- і високомолекулярних речовин у патогенетичних побудовах ревматоїдного артриту (РА) (Meo Burt P. et al., 2018; Tootsi K. et al., 2018). У суглобах хворих накопичуються речовини з такою молекулярної масою (м.м.), які беруть участь у процесах деструкції хряща, сухожиль і зв’язок (Dickinson S.C. et al., 2013; Sheridan C. et al., 2018). Необхідно зазначити, що вміст низько- і високомолекулярних сполук у синовії корелює з їхніми рівнями в сироватці крові (Xu H. et al., 2004).
Біомаркерами РА є рівні в суглобовій рідині понад 300 метаболітів білкового, ліпідного й вуглеводного походження, зокрема середньомолекулярних речовин (Talabot-Ayer D. et al., 2012; Adams S.B. et al., 2014; Altobelli E. et al., 2017), які належать до прогнознегативних складових перебігу захворювання (Masakane I., Sakurai K., 2018). Підкреслимо, що клініко-патогенетичну роль молекул середньої маси (МСМ) при РА вивчено недостатньо, а дані суперечливі (Hampel U. et al., 2018). Гіпотетично МСМ окремих фракцій у різних біологічних рідинах (кров, синовій, легеневий експірат) можуть у хворих на РА визначати розвиток вісцеритів, характер кістково-деструктивних суглобових уражень і темпи прогресування артикулярного синдрому.
Мета і завдання дослідження
Мета дослідження — встановити клініко-патогенетичну значимість середньомолекулярних сполук різних фракцій в біологічних рідинах хворих на РА, вивчити клініко-лабораторні та рентгено-сонографічні чинники, що їх визначають, зіставити з фізико-хімічними параметрами крові, синовії та експіратів, які пов’язані із вмістом високо-, середньо- й низькомолекулярних поверхнево-активних речовин, визначити інформативні прогностичні критерії.
Пацієнти і методи дослідження
Обстежено 105 хворих на РА віком 19–69 років (у середньому — 45,5±1,16 року), серед яких 21,0% чоловіків і 79,0% — жінок. Тривалість від першої маніфестації захворювання становила 2–29 років (у середньому —10,4±0,78 року). Серопозитивність РА за ревматоїдним фактором (RF) встановлено у 77,1% кількості хворих, а за антитілами до циклічного цитрулінового пептиду (аССР) — у 81,0%; І, ІІ і ІІІ ступені загальної активності РА відповідно констатовано у 26,7; 39,3 і 34,3% випадка, а співвідношення I, II, III і IV стадій патологічного процесу становило 1:22:19:11. Системний остеопороз діагностовано у 69,5% спостережень.
Усім хворим виконували рентгенологічне дослідження легень, периферичних суглобів, крижово-здухвинних і хребцевих зчленувань (апарат «Multix-Compact-Siеmens», Німеччина), проводили комп’ютерну пневмотомографію («Somazom-Emotion-6-Siemens», Німеччина), ехокардіографію («Acuson-Aspen-Siemens», Німеччина, та «Еnvisor-C-Philips», Нідерланди), спірографію («Master-Scope-Jaeger», Німеччина), ультразвукове обстеження опорно-рухового апарату («Envisor-Philips», Нідерланди), двоенергетичну рентгенівську остеоденситометрію проксимального відділу стегнової кістки («QDR-4500-Delphi-Hologic», США).
Індекс активності артриту (DAS) становив 4,6±0,12 в.о., прогресування суглобового синдрому (PAI) — 2,0±0,24 в.о., Лансбурі (IL) — 131,2±6,45 бала, тяжкості перебігу РА (SAI) — 87,9±2,34 в.о., остеопорозний рентгенологічний Барнетта — Нордіна (BNI) — 41,6±0,53 ´102 в.о., мінеральної щільності кісткової тканини (BMD) — 1,7±0,07 –SD; показник у крові RF становив 15,0±0,83 мМО/мл, аССР — 26,4±1,28 О/мл, С-реактивного протеїну (CRP) — 15,1±0,83 мг/л, фібриногену (FG) — 7,7±0,40 г/л. Рівень DAS визначали за формулою:
DAS=[( ·0,54)+(J·0,065) + (lnQ·0,33)+0,224]·1,072+0,94,
·0,54)+(J·0,065) + (lnQ·0,33)+0,224]·1,072+0,94,
де RI — індекс Річі, J — кількість болючих суглобів, Q — швидкість осідання еритроцитів. Параметр SAI вираховували за формулою: SAI=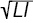 ·DAS, а PAI визначали за формулою: PAI=[(ARS)2+∑]:d, де ∑ — сума рентгеносонографічних ознак РА, d — тривалість клінічної маніфестації захворювання.
·DAS, а PAI визначали за формулою: PAI=[(ARS)2+∑]:d, де ∑ — сума рентгеносонографічних ознак РА, d — тривалість клінічної маніфестації захворювання.
У сироватці крові (b), синовії (s) та легеневих експіратах (е) спектрофотометрично («СФ46», Росія) досліджували вміст окремих фракцій МСМ при довжині хвилі 238 нм (амінопептидна фракція — AF), 254 нм (пептидна — PF), 260 нм (нуклеотидна — NF) і 280 нм (хроматофорна — CF), підраховували показник усередненої фракції МСМ (IF). Застосовували скринінговий метод, заснований на осадженні білків 10% розчином трихлороцтової кислоти з подальшим центрифугуванням і визначенням спектрів поглинання світла кислоторозчинною фракцією. За допомогою біоаналізатора «Olympus-AU640» (Японія) вивчали в сироватці крові показники RF, CRP і FG, в синовіальному лікворі — рівні CRP, загального білка, імуноглобулінів (Ig) G та М, β2-мікроглобуліну, α2-макроглобуліну й сечової кислоти. З використанням комп’ютерного тензіометра «PAT2-Sinterface» (Німеччина) досліджували параметри поверхневого натягу (ST) сироватки крові при «часі життя поверхні», що дорівнює 1 с (ST1) і 100 с (ST100), які відображають показники МСМ, а також співвідношення міжфазної активності (ST) при часі, який наближається до нескінченності (віддзеркалює рівень високомолекулярних речовин) та при 0,01 с (для низькомолекулярних сполук). Підраховували індекс інтегрального ступеня тяжкості накопичення в біологічних рідинах МСМ (II) за формулою: II=IF:[(ST1)–(ST100)].
Легеневі експірати (конденсат повітря, що видихується — КПВ) збирали в ранкові години за допомогою скляних приймачів, занурених у лід, що тане. Використані пристрої мали резервуари для збору слини. Після полоскання рота водою хворі в положенні сидячи спокійно дихали через рот протягом 20 хв. Для виключення носового дихання застосовували спеціальні затискачі носа. Визначали швидкість вологовиділення (ШВВ) і його об’єм (ОВВ).
Імуноферментним методом (рідер «PR2100-Sanofi diagnostic pasteur», Франція) вивчали вміст у сироватці крові аССР, а також рівень середньомолекулярних гормонів: адренокортикотропіну — АС (м.м.~4,5 кД), остеокальцину — ОС (м.м.~5,8 кД), кальцитоніну — СТ (м.м.~3,4 кД), інсуліну — IN (м.м.~5,8 кД), С-пептиду (м.м.~3,0 кД), трийодтироніну — Т3 (м.м.~0,7 кД), тироксину — Т4 (м.м.~0,8 кД), вазопресину — VP (м.м.~1,1 кД). Показник кожного гормону в крові конкретного хворого оцінювали в «0 балів» (при значенні £M±SD здорових людей контрольної групи), у випадках зміни показника від ³M±SD до <M±2SD — в «1 бал», від ³M±2SD до <M±3SD — в «2 бали», ³M±3SD — в «3 бали». Підраховували суму балів (∑), а інтегральний індекс дисбалансу середньомолекулярних гормонів (ІН) визначали за формулою: IH=(ln∑)2·lnIF.
Як контроль лабораторні показники досліджено у 30 практично здорових людей віком від 18 до 62 років (в середньому — 36,5±0,41 року), серед яких — 11 чоловіків і 19 жінок. Статистичну обробку результатів досліджень проведено за допомогою програм «Microsoft Excel» і «Statistica-Stat-Soft» (США). Оцінювали середні значення (M), їх стандартні похибки й відхилення (SD), коефіцієнти параметричної кореляції Пірсона та непараметричної Кендалла, критерії дисперсії, однорідності дисперсії Брауна — Форсайта, багатофакторного аналізу Вілкоксона — Рао, відмінностей Стьюдента, а також вірогідность статистичних показників. Підраховували ступінь прогнозування пропонованого результату моделі (PPV).
Результати та їх обговорення
Показники AFb становили 821,2±10,39 О/л, PFb — 281,6±7,60 О/л, NFb — 276,7±9,98 О/л, CFb — 338,4±7,51 О/л, IFb — 427,7±7,05 О/л, STb — 56,1±0,39%, IIb — 56,1±0,39 в.о. Порівняно з параметрами здорових людей контрольної групи констатовано вірогідне збільшення NF, IF, AF, PF і CF на 30,6; 17,9; 17,0; 16,6 і 14,6%, що відповідно виявлено (>M+SD здорових) у 63,8; 61,9; 66,7; 53,3 і 24,8% кількості обстежених хворих. За результатами дисперсійного аналізу на рівень PF впливає позасуглобова (системна) форма РА.
Як свідчить багатофакторний аналіз Вілкоксона — Рао, на «інтегральне дзеркало» різних фракцій МСМ («середньомолекулярний пейзаж») чинять вплив значення LI. Рівень МСМ у крові хворих на РА тісно пов’язаний із тяжкістю ураження великих суглобів (колінних, плечових, кульшових), про що свідчить чіткий дисперсійний зв’язок з LI рівнів AFb, PFb, NFb, CFb і IFb. Такі співвідношення наявні при паралельній дії на МСМ показників у крові RF. Зазначимо, що на рівень PFb впливають ступені загальної активності захворювання та DAS, а вміст NFb визначає PAI. Від PFb і CFb МСМ не залежать складові перебігу суглобового синдрому, тоді як з AFb пов’язані PAI, а з IFb — SAI. Виявлено прямий взаємовплив один на одного DAS і STb, що підтверджено й позитивною кореляцією цих показників. Значення DAS прямо корелюють з рівнями PFb, а SAI — з IFb. З урахуванням виконаного варіаційного, дисперсійного і кореляційного аналізу зроблено такі висновки, що мають певну практичну спрямованість: 1) показник STb>60% (>M+SD хворих) відображає високий ступінь активності РА (PPV=69,4%); 2) показник IFb>420 О/л (>M+SD хворих) вказує на тяжкий перебіг РА (PPV=65,4%).
Як свідчить багатофакторний аналіз Вілкоксона — Рао, на інтегральні показники МСМ у крові хворих на РА впливають ураження колінних та кульшових суглобів, зміни менісків, наявність епіфізарного остеопорозу), остеокістозу, інтраартикулярних хондромних тіл. Нами відібрані ті показники перебігу РА, які з концентраціями МСМ у крові одночасно мали зв’язки однорідності дисперсії Брауна — Форсайта й непараметричного кореляційного аналізу Кендалла. Виявилося, що рівень AFb залежить від наявності кіст Бейкера, PFb — від внутрішньосуглобових тіл Штайді, NFb — від хондромних тіл, CFb — від ураження менісків, IFb — від розвитку остеоузур, IIb — від асептичного остеонекрозу.
Біомаркерами стану організму при РА є середньомолекулярні гормони (Steckl A.J., Ray P., 2018). На тваринах з експериментальним колаген-індукованим артритом продемонстровано дисфункцію остеобластів під впливом середньомолекулярного ОС (Sun W. et al., 2018). Рівень ОС у крові хворих на РА також зростає, прямо корелюючи з концентраціями остеопротегерину й остеопонтину (Liu L.N. et al., 2019). Водночас наявні дані, згідно з якими показник остеокальцинемії обернено корелює з активністю РА і ступенем резорбції кісткової тканини (Seriolo B. et al., 2012). Середньомолекулярний СТ перешкоджає руйнуванню кісткового колагену (Moskowitz R.W., 2019), зменшує резорбцію кісток за рахунок пригнічення зрілих активних остеокластів і володіє анальгезивною дією, опосередкованою β-ендорфінами й центральною модуляцією сприйняття болю (Hamdy R.C., Daley D.N., 2012; Bhandari K.H. et al., 2015).
Показник АС у хворих на РА становив 29,5±0,73 пг/мл, ОС — 15,9±0,40 нг/мл, СТ — 7,8±0,38 пг/мл, IN — 13,1±0,34 мкМО/мл, CP — 2,1±0,12 нг/мл, T3 — 2,9±0,08 пг/мл, T4 — 16,3±0,48 пмоль/л, VP — 8,4±0,32 пмоль/л. Порівняно зі здоровими людьми (рис. 1) виявлено підвищення рівнів ОС в 3,0 раза на тлі зменшення параметрів АС на 17,4%, СТ на 51,5% і СР — на 51,2%, що (<M±SD> контрольної групи) відповідно встановлено у 99,1; 15,2; 82,9; 64,8% кількості хворих (рис. 2). Як свідчить багатофакторний аналіз Вілкоксона — Рао, на ітегральні показники гормонів при РА впливають позасуглобова (системна) форма захворювання, наявність остеопорозу, ревматоїдний аутоімунний тиреоїдит і коморбідний цукровий діабет 2-го типу. Остеопороз супроводжується достовірно вищим (на 23,4%) рівнем у сироватці крові ОС та на 94,4% — СР, тиреоїдит характеризується зниженням у 3,7 раза показника Т4 і на 63,3% — Т3. Такі дані підтверджує однофакторний дисперсійний аналіз, який продемонстрував вплив остеопорозу на вміст у крові хворих СТ, цукрового діабету — на показник СР, тиреоїдиту — на значення Т3 і Т4.
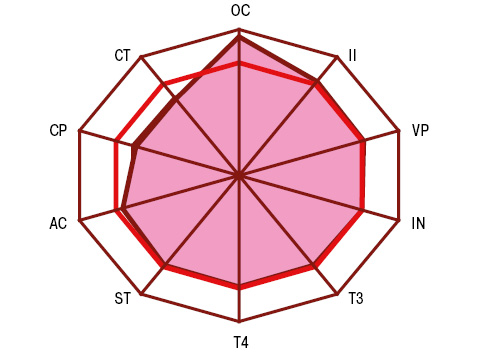
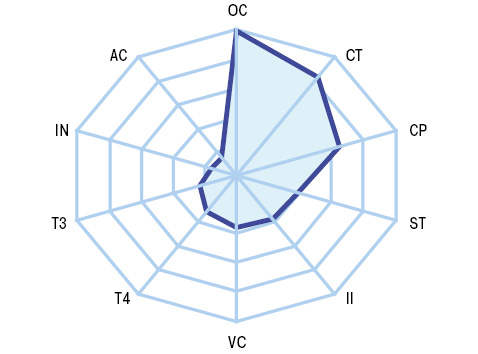
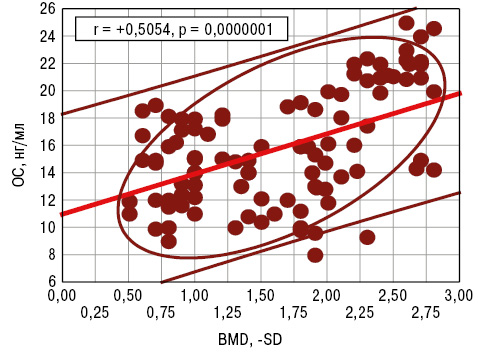
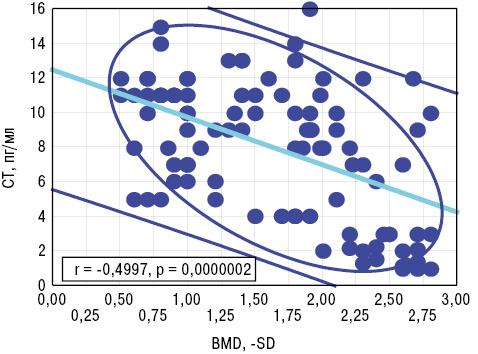
ОС і СТ мають високодостовірні різноспрямовані кореляційні зв’язки з параметром BNI та BMD. З урахуванням виконаного варіаційного, дисперсійного і кореляційного аналізу зроблено такий висновок: показник ОС>20 нг/мл (>M+SD хворих на РА) свідчить про розвиток системного остеопорозу і є прогнознегативною ознакою (PPV=68,5%). Тиреоїдні гормони впливають на рівень PFb, а АС — на NFb. Із вмістом PFb прямо корелює показник СР, з CFb позитивно співвідноситься концентрація OC, a обернено — параметри CT і IN. DAS тісно пов’язаний з OC, CT, IN, CP і VP. У свою чергу, тяжкість кістково-деструктивних змін суглобів і BMD асоціювалися з показниками ОС, СТ і IN (рис. 3 і 4). Окрім того, DAS залежав від рівнів у крові ОС, СТ і VP, а темпи його прогресування визначали параметри ОС і СР. Зауважимо, що концентрації СР і VP впливали на формування аССР, a показник фібриногенемії був тісно пов’язаний із синтезом і виділенням АС, ОС та VP.
З урахуванням результатів виконаного варіаційного, дисперсійного й кореляційного аналізу зроблено такі висновки, які мають практичну спрямованість: 1) на загальну активність РА впливають такі середньомолекулярні гормони, як ОС, СТ, АС, IN і VP, а на активність суглобового синдрому — тільки ОС та СТ; 2) показник ОС>20 нг/мл (>M+SD хворих на РА) є прогностично несприятливим щодо темпів прогресування суглобового синдрому; 3) вміст IN>16 мкМО/мл при РА належить до чинників ризику погіршення BMD (PPV=86,0%); 4) рівень фібриногенемії >8 г/л вказує на наявність при РА середньомолекулярного гормонального дисбалансу; 5) концентрація VP>10 пкмоль/л (>M+SD здорових) визначає формування у хворих на РА серопозитивності за аССР (PPV=89,2%).
Ми виокремили ті чинники перебігу РА, які одночасно з окремими гормонами мали вірогідні зв’язки показників однорідності дисперсії Брауна-Форсайта і кореляції Кендалла (тау-тест). Виявилося, що на залучення у процес колінних суглобів впливає рівень АС, плечових — Т3, ліктьових — VP, променезап’ясткових — IN. Від концентрації АС у крові обернено залежать розвиток асептичного остеонекрозу, зміни менісків та кіст Бейкера, від Т3 — субхондрального склерозу, від ОС (прямі співвідношення) — формування остеокістозу і остеоузур, від VP — інтраартикулярних кальцинатів.
Інтегральний гормональний показник IH становив 16,5±0,70 в.о., а на його рівень достовірно впливала позасуглобова (системна) форма РА і РАІ. Виконаний однофакторний дисперсійний аналіз демонструє дію IH на показники стадійності РА, PAI, BNI і BMD. Із параметром BMD існують прямі кореляційні зв’язки Пірсона, а з BNI — обернений зв’язок. На нашу думку, рівень IH>20 в.о. (>M+SD хворих) вказує на наявність виражених кістково-деструктивних ознак РА.
Згідно з даними однофакторного дисперсійного аналізу, ІН впливає на ураження грудиноключичних, крижово-здухвинних і хребцевих зчленувань, діє на формування інтраартикулярних хондромних тіл, жирових тіл Гоффа, кіст Бейкера і розвиток дигітального артеріїту, що демонструє аналіз Брауна — Форсайта. За результатами виконаного непараметричного кореляційного аналізу Кендалла, ІН прямо співвідноситься з виникненням субхондрального склерозу, внутрішньосуглобових хондромних тіл, периферичної параартикулярної полінейропатії та дигітального артеріїту. Отже, при РА рівень IH>20 o.e. (>M+SD хворих) є чинником ризику розвитку інтраартикулярних хондромних тіл і дигітального артеріїту.
Завдяки прямому контакту з хрящем, поверхнями кістки й синовіоцитів дослідження синовіального ліквору при РА має суттєве діагностичне значення (Awisat A. et al., 2017; Mahendran S.M. et al., 2017; Baillet A. et al., 2019). Зміни показників суглобової рідини чітко корелюють із даними морфологічного вивчення уражених суглобових тканин (Coiffier G. et al., 2018; Manzo A. et al., 2018) і ступенем апоптозу інтраартикулярних клітин (Raza K. et al., 2016). Водночас надійних диференційно-діагностичних біомаркерів синовії при патології суглобів поки не існує (Peffers M.J. et al., 2019).
У хворих на РА показники AFs становили 406,0±4,39 О/л, PFs — 101,2±3,05 О/л, NFs — 38,8±1,32 О/л, CFs — 13,9±1,20 О/л, IFs — 139,9±2,23 О/л, AFs/b — 47,2±1,60%, PFs/b — 12,9±1,28%, NFs/b — 14,6±1,21%, SFs/b — 4,0±0,47%, STs — 86,2±1,61%, IIs — 76,0±10,53 в.о., IIs/b — 30,9±1,46%. За даними багатофакторного аналізу Вілкоксона — Рао, на інтегральний рівень МСМ в синовії впливають серопозитивність захворювання за RF і aCCP. Як свідчить однофакторний дисперсійний аналіз, темпи PAI впливають на параметри NFs, CFs, PFs/b, NFs/b і IIs/b. У свою чергу, показники AFs/b та IIs/b визначають ступінь тяжкості кістково-деструктивних змін суглобів, рівні CFs, PFs/b та CFs/b — SAI, AFs/b — BMD. Існує прямий кореляційний зв’язок Пірсона показника PFs/b із вмістом у крові RF, тоді як достовірні обернені співвідношення PFs і CFs стосуються CRP, а NFs — рівня FG у сироватці крові.
У суглобовому лікворі концентрація загального білка становила 31,5±1,68 г/л, СRP — 11,7±0,93 мг/л, IgG — 17,4±0,26 ммоль/л, IgM — 3,0±0,18 ммоль/л, β2-мікроглобуліну — 3,8±0,20 нг/мл, α2-макроглобуліну — 1,1±0,06 г/л, сечової кислоти — 27,3±0,98 мкмоль/л. У хворих на РА вміст у синовії МСМ всіх фракцій прямо корелює з рівнем у цій біологічній рідині високомолекулярного IgG (м.м.~150 кД). Зазначене стосується AFs, PFs, NFs, CFs, IFs, NFs/b, CFs/b, IIs/b.
Дисперсійний аналіз продемонстрував вплив на показники NFs, CFs, IFs, NFs/b, CFs/b та IIs/b. З урахуванням виконаного варіаційного, дисперсійного й кореляційного аналізу зроблено такий висновок: рівень у синовіальному лікворі хворих на РА IgG>17 ммоль/л (>M+SD хворих) свідчить про накопичення в ньому МСМ різних фракцій (PPV=88,2%). Нами визначено ті показники МСМ синовії, які одночасно мали вірогідні дисперсійні зв’язки Брауна — Форсайта й кореляційні Кендалла з рентгеносонографічними ознаками суглобового синдрому. Виявилося, що наявність у хворих на РА артрокальцинатів прямо впливає на показник CFs, а жирових тіл Гоффа — на рівень IFs. У свою чергу, від значень в артикулярній рідині AFs/b та IIs/b залежить формування остеоузур, а від NFs/b та DFs/b — внутрішньосуглобових хондромних тіл.
До найчастіших вісцеральних проявів РА належить специфічна патологія легень, причому у кожного четвертого хворого вона може виникати до маніфестації суглобового синдрому (Duarte A.C. et al., 2019). Перші ознаки пульмональної патології виявляються при комп’ютерній томографії високої роздільної здатності вже в самому дебюті РА (Picchianti Diamanti A. et al., 2017; Krause A., Rubbert-Roth A., 2019). Переважно захворювання супроводжується інтерстиціальним пневмонітом (Ibraheim M.K., Govindu R.R., 2020), який характеризується кількома гістопатологічними підтипами (Assayag D. et al., 2014), часто-густо проявляється тяжким перебігом, що прямо корелює зі ступенем активності суглобового синдрому і багато в чому визначає виживаність хворих (Pancaldi F. et al., 2018; Spagnolo P. et al., 2018). Прогнознегативним чинником є розвиток ревматоїдного фіброзуючого альвеоліту (Jacob J. et al., 2019) і облітеруючого бронхіоліту (Lin E. et al., 2018). Підкреслимо, що патогенез ревматоїдної пневмопатії залишається недостатньо вивченим (Poole J.A. et al., 2019).
Показники AFе у хворих на РА становили 523,7±4,96 О/л, PFе — 76,4±2,18 О/л, NFе — 40,0±1,98 О/л, CFе — 13,0±1,55 О/л, IFе — 163,3± 2,48 О/л, AFe/b — 61,2±1,84%, PFe/b — 28,7±1,55%, NFe/b — 14,7±1,23%, CFe/b — 4,0±0,57%, STе — 72,9±2,56%, IIе — 15,0±0,52 в.о., IIe/b — 36,4±1,38%. Порівняно зі здоровими людьми контрольної групи виявлено вірогідне підвищення рівнів PFe/b на 78,3%, AFе — на 8,2%, IFе — на 6,7%, при зменшенні параметрів АFe/b на 11,9%, IIe/b — на 14,1%, STе на 17,6%, NFe/b — на 18,8%, CFe/b — на 25,9%, що (<M±SD> здорових людей) відповідно встановлено у 77,4; 74,2; 48,4; 71,0; 74,2; 83,9; 54,8 і 74,2% кількості хворих.
Ревматоїдний інтерстиціальний пневмоніт діагностовано у 51,6% хворих (основна група), при цьому співвідношення з фіброзуючим альвеолітом, ревматоїдними вузлами при синдромі Коліне — Каплана, облітеруючим бронхіолітом на тлі інтерстиціального процесу становило 3:2:1. Співвідношення рестриктивного, змішаного і обструктивного типів порушень функції зовнішнього дихання було 6:2:1. Систолічний тиск у легеневій артерії дорівнював 25,4±1,24 мм рт. ст., діастолічний — 7,3±0,59 мм рт. ст., легеневий судинний опір — 275,0±31,70 дин·с·см–5, кінцево-діастолічний розмір правого шлуночка серця — 2,7±0,11 см, резерв вдиху — 1,9±0,18 л, резерв видиху — 1,0±0,12 л, хвилинний обсяг дихання — 11,8±0,62 л/хв, форсована життєва ємність легень — 3,4±0,23 л, співвідношення об’єму форсованого видиху за 1-шу секунду до життєвої ємності легень — 79,6±1,80%, ШВВ — 13,6±1,22 мл/год, ОВВ — 2,6±0,21 мл/л.
За даними багатофакторного аналізу Вілкоксона — Рао, на інтегральні показники КПВ впливають рівні середнього тиску в легеневій артерії, легеневого судинного опору і стан бронхопрохідності. Порівняно із хворими на РА без легеневої патології ревматоїдний пневмоніт супроводжувався достовірним підвищенням показника СFe/b в 2,1 раза, NFe/b — на 75,5%, STе — на 17,1%, IIe/b — на 15,9% і AFе на 4,8%. Одночасно вірогідні дисперсійні зв’язки Брауна — Форсайта і кореляційні Кендалла з параметрами функції дихання мали такі показники експіратів: систолічний тиск у легеневій артерії залежав від рівня СFe/b, діастолічний тиск і характер бронхопрохідності — від STе, дихальні об’єми — від PFe/b.
Як свідчить багатофакторний аналіз Вілкоксона — Рао, ШВВ і ОВВ впливають на інтегральний рівень МСМ у КПВ. Однофакторний дисперсійний аналіз показав вплив вологовидільної функції легень на показник STе. У свою чергу, від швидкості й об’єму виділення респіраторної рідини залежать показники PFе, NFе, IFе і STе. Крім того, виявлена пряма кореляція Пірсона рівня IFе з респіраторним характером виведення вологи.
Як добре відомо, імунодепресант цитотоксичної дії метотрексат (антагоніст фолієвої кислоти) є препаратом першої лінії при РА, знижує його темпи прогресування і збільшує тривалість життя хворих, але може бути причиною грізних ятрогенних респіраторних ускладнень терапії (Conway R., Carey J.J., 2017). До них належить розвиток інтерстиціально-фіброзуючого захворювання легень («метотрексат-пневмоніту»), який проявляється задишкою, кашлем і лихоманкою з гострим або підгострим перебігом, а морфологічно у проміжній легеневій тканині спостерігаються лімфогістіоцитарна й еозинофільна інфільтрація з неказеозними гранульомами (Fragoulis G.E. et al., 2019). Зазначимо, що формування пневмоніту при РА на тлі лікування хворих метотрексатом залишається спірним (Rojas-Serrano J. et al., 2017).
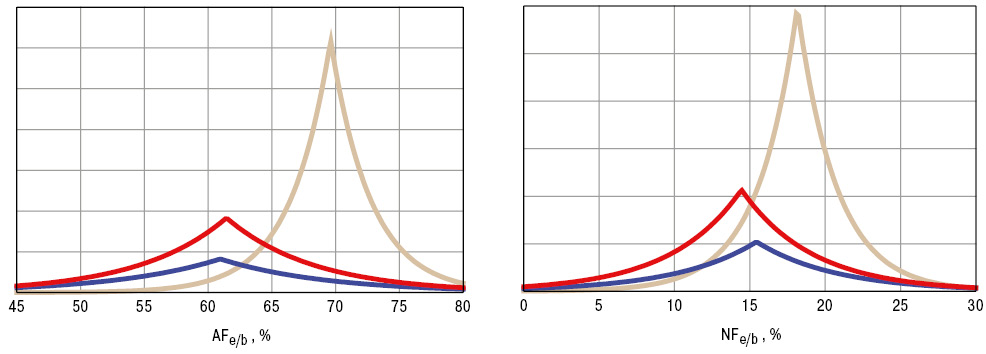
За даними багатофакторного аналізу Вілкоксона — Рао, застосування на попередніх етапах метотрексату (5–20 мг/тиж протягом 3–28 міс) впливало на інтегральне «середньомолекулярне дзеркало» експіратів. У хворих на РА, які отримували метотрексат, виявилися достовірно більшими (на 17,5%) показники в КПВ AFe/b і NFe/b (рис. 5). Хоча нами не виявлено випадків «метотрексатної легені», застосування такого цитотоксичного імунодепресанта у хворих на РА впливає на респіраторне виведення МСМ за рахунок змін концентрацій амінопептидної та нуклеотидної фракцій крові. У перспективі доцільним є вивчення рівнів МСМ в експіратах у разі метотрексаттерапії хворих на тлі поєднаного застосування фолієвої кислоти.
Висновки
1. РА супроводжується підвищенням концентрацій AFb у 67% хворих, NFb — у 64%, PFb — у 53%, CFb — у 25%, IFb — у 62%, що пов’язано із загальною активністю захворювання та DAS, з ураженням великих суглобів, наявністю епіфізарного остеопорозу, остеокістозу, інтраартикулярних хондромних тіл і системних проявів захворювання, визначають поверхневий натяг крові, показники якого мають прогностичну значущість, а гіперпродукція МСМ чинить вплив на процеси остеоузурації, уражень менісків, формувань асептичного остеонекрозу, внутрішньосуглобових тіл Штайді та кіст Бейкера.
2. При РА виникає достовірне підвищення концентрації ОС у крові у 99% хворих на тлі зниження СТ в 83% випадків, СР — у 65% i АС — у 15%, що залежить від наявності остеопорозу, вісцеритів, тиреоїдиту і коморбідного цукрового діабету, причому з гормональним середньомолекулярним дисбалансом пов’язані активність і стадійність РА, темпи його прогресування, стан BMD, формування субхондрального склерозу, остеокістозу, остеоузур, остеонекрозу й артрокальцинатів, ураження менісків і розвиток кіст Бейкера, а рівень ОС володіє прогностичною значимістю.
3. Інтегральний склад середньомолекулярних сполук в синовії залежить від рівнів RF та aCCP у сироватці крові, а за темпами прогресування артикулярного синдрому пов’язані показники NFs і CFs МСМ, які поряд з AFs та PFs визначають високу активність захворювання, кістково-деструктивні зміни суглобів, формування остеоузур і внутрішньосуглобових хондромних тіл, прямо корелюють із вмістом у суглобовому лікворі IgG, причому CFs прямо співвідноситься з наявністю артрокальцинатів і тіл Гоффа.
4. Інтерстиціальний пневмоніт розвивається у 52% хворих на РА, який супроводжується фіброзивним альвеолітом, ревматоїдними вузлами в легенях і облітеруючим бронхіолітом, перебіг його відбувається зі співвідношенням рестриктивного, змішаного й обструктивного типів порушень функцій зовнішнього дихання 6:2:1, з підвищенням показників AFе у 74% хворих і рівня PFе/b у 77% на тлі зменшення AFе/b (у 71%), NFе/b (у 55%, CFе/b (у 74%) i STе.
5. Склад експіратів тісно взаємопов’язаний зі станом гемодинаміки малого кола кровообігу і бронхопрохідності, залежить від швидкості та обсягу респіраторного вологовиділення, а також тривалого використання в комплексному лікуванні хворих імунодепресанта цитотоксичної дії метотрексату.
Список використаної літератури
- Adams S.B., Nettles D.L., Jones L.C. et al. (2014) Inflammatory cytokines and cellular metabolites as synovial fluid biomarkers of posttraumatic ankle arthritis. Foot. Ankle Int., 35(12): 1241–1249.
- Altobelli E., Angeletti P.M., Piccolo D., De Angelis R. (2017) Synovial fluid and serum concentrations of inflammatory markers in rheumatoid arthritis, psoriatic arthritis and osteoarthitis: a systematic review. Curr. Rheumatol. Rev., 13(3): 170–179.
- Assayag D., Lee J.S., King T.E. (2014) Rheumatoid arthritis associated interstitial lung disease: a review. Medicina, 74(2): 158–165.
- Awisat A., Slobodin G., Jiries N. et al. (2017) Pseudoseptic arthritis with low synovial fluid glucose in familial mediterranean fever. Isr. Med. Assoc. J., 19(7): 461–462.
- Baillet A., Trocme C., Romand X. et al. (2019) Calprotectin discriminates septic arthritis from pseudogout and rheumatoid arthritis. Rheumatology, 58(9): 1644–1648.
- Bhandari K.H., Asghar W., Newa M. et al. (2015) Evaluation of bone targeting salmon calcitonin analogues in rats developing osteoporosis and adjuvant arthritis. Curr. Drug Deliv., 12(1): 98–107.
- Coiffier G., Ferreyra M., Albert J.D. et al. (2018) Ultrasound-guided synovial biopsy improves diagnosis of septic arthritis in acute arthritis without enough analyzable synovial fluid: a retrospective analysis of 176 arthritis from a French rheumatology department. Clin. Rheumatol., 37(8): 2241–2249.
- Conway R., Carey J.J. (2017) Methotrexate and lung disease in rheumatoid arthritis. Panminerva Med., 59(1): 33–46.
- Dickinson S.C., Vankemmelbeke M.N., Buttle D.J. et al. (2013) Cleavage of cartilage oligomeric matrix protein (thrombospondin-5) by matrix metalloproteinases and a disintegrin and metalloproteinase with thrombospondin motifs. Matrix Biol., 22(3): 267–278.
- Duarte A.C., Porter J.C., Leandro M.J. (2019) The lung in a cohort of rheumatoid arthritis patients-an overview of different types of involvement and treatment. Rheumatology, 58(11): 2031–2038.
- Fragoulis G.E., Nikiphorou E., Larsen J. (2019) Methotrexate-associated pneumonitis and rheumatoid arthritis-interstitial lung disease: current concepts for the diagnosis and treatment. Front Med., 23(6): 00238.
- Hamdy R.C., Daley D.N. (2012) Oral calcitonin. Int. J. Womens Health, 4(4): 471–479.
- Hampel U., Sesselmann S., Iserovich P. (2018) Chemokine and cytokine levels in osteoarthritis and rheumatoid arthritis synovial fluid. J. Immunol. Methods, 396(1–2): 134–139.
- Ibraheim M.K., Govindu R.R. (2020) Rheumatoid arthritis associated interstitial lung disease. Am. J. Med. Sci., 359(5): 312–313.
- Jacob J., Hirani N., van Moorsel C.H.M. et al. (2019) Predicting outcomes in rheumatoid arthritis related interstitial lung disease. Eur. Respir. J., 53(1): 1800869.
- Krause A., Rubbert-Roth A. (2019) Pulmonary involvement in rheumatoid arthritis. Z. Rheumatol., 78(3): 228–235.
- Lin E., Limper A.H., Moua T. (2018) Obliterative bronchiolitis associated with rheumatoid arthritis: analysis of a single-center case series. BMC Pulm. Med., 18(1): 105–109.
- Liu L.N., Mao Y.M., Zhao C.N. et al. (2019) Circulating levels of osteoprotegerin, osteocalcin and osteopontin in patients with rheumatoid arthritis: a systematic review and meta-analysis. Immunol. Invest., 48(2): 107–120.
- Mahendran S.M., Oikonomopoulou K., Diamandis E.P., Chandran V. (2017) Synovial fluid proteomics in the pursuit of arthritis mediators: An evolving field of novel biomarker discovery. Crit. Rev. Clin. Lab. Sci., 54(7–8): 495–505.
- Manzo A., Bugatti S., Caporali R., Montecucco C. (2018) Histopathology of the synovial tissue: perspectives for biomarker development in chronic inflammatory arthritides. Reumatismo, 70(3): 121–132.
- Masakane I., Sakurai K. (2018) Current approaches to middle molecule removal: room for innovation. Nephrol. Dial. Transplant., 33(3): 12–21.
- Meo Burt P., Xiao L., Hurley M.M. (2018) FGF23 regulates Wnt/β-catenin signaling-mediated osteoarthritis in mice overexpressing high-molecular-weight FGF2. Endocrinology, 159(6): 2386–2396.
- Moskowitz R.W. (2019) Role of collagen hydrolysate in bone and joint disease. Semin. Arthritis Rheum., 30(2): 87–99.
- Pancaldi F., Sebastiani M., Cassone G. et al. (2018) Analysis of pulmonary sounds for the diagnosis of interstitial lung diseases secondary to rheumatoid arthritis. Comput. Biol. Med., 96(5): 91–97.
- Peffers M.J., Smagul A., Anderson J.R. (2019) Proteomic analysis of synovial fluid: current and potential uses to improve clinical outcomes. Expert. Rev. Proteomics, 16(4): 287–302.
- Picchianti Diamanti A., Markovic M., Argento G. et al. (2017) Therapeutic management of patients with rheumatoid arthritis and associated interstitial lung disease: case report and literature review. Ther. Adv. Respir. Dis., 11(1): 64–72.
- Poole J.A., Thiele G.M., Janike K. et al. (2019) Combined collagen-induced arthritis and organic dust-induced airway inflammation to model inflammatory lung disease in rheumatoid arthritis. J. Bone Miner. Res., 34(9): 1733–1743.
- Raza K., Scheel-Toellner D., Lee C.Y. et al. (2016) Synovial fluid leukocyte apoptosis is inhibited in patients with very early rheumatoid arthritis. Arthritis Res. Ther., 8(4): 120.
- Rojas-Serrano J., Herrera-Bringas D., Pérez-Román D.I. (2017) Rheumatoid arthritis-related interstitial lung disease (RA-ILD): methotrexate and the severity of lung disease are associated to prognosis. Clin. Rheumatol., 36(7): 1493–1500.
- Seriolo B., Ferretti V., Sulli A. et al. (2012) Serum osteocalcin levels in premenopausal rheumatoid arthritis patients. Ann. NY Acad. Sci., 966(6): 502–507.
- Sheridan C. (2018) Low-molecular-weight albumin drug touted for severe osteoarthritis. Nat. Biotechnol., 36(4): 293.
- Spagnolo P., Lee J.S., Sverzellati N. et al. (2018) The lung in rheumatoid arthritis: focus on interstitial lung disease. Arthritis Rheumatol., 70(10): 1544–1554.
- Steckl A.J., Ray P. (2018) Stress biomarkers in biological fluids and their point-of-use detection. ACS Sens., 10(3): 2025–2044.
- Sun W., Meednu N., Rosenberg A. et al. (2018) B cells inhibit bone formation in rheumatoid arthritis by suppressing osteoblast differentiation. Nat. Commun., 9(1): 5127.
- Talabot-Ayer D., McKee T., Gindre P. et al. (2012) Distinct serum and synovial fluid interleukin (IL)-33 levels in rheumatoid arthritis, psoriatic arthritis and osteoarthritis. Joint Bone Spine, 79(1): 32–37.
- Tootsi K., Kals J., Zilmer M. et al. (2018) Medium- and long-chain acylcarnitines are associated with osteoarthritis severity and arterial stiffness in end-stage osteoarthritis patients: a case-control study. Int. J. Rheum. Dis., 21(6): 1211–1218.
- Xu H., Geddes R., Roberts-Thomson P.J. (2004) Low molecular weight IgM and CD5 B lymphocytes in rheumatoid arthritis. Ann. Rheum. Dis., 53(6): 383–390.
МЕСТО СРЕДНЕМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ В КЛИНИКО-ПАТОГЕНЕТИЧЕСКИХ ПОСТРОЕНИЯХ РЕВМАТОИДНОГО АРТРИТА
Донецкий национальный медицинский университет, Лиман
Резюме. Актуальность. У больных ревматоидным артритом (РА) изменения уровней молекул средней массы (МСМ) различных фракций в биологических жидкостях гипотетически могут определять развитие висцеритов, характер костно-деструктивных суставных повреждений и темпы прогрессирования заболевания, но эти вопросы малоизучены. Цель и задачи исследования: установить клинико-патогенетическую значимость МСМ различных фракций в биологических жидкостях больных РА, изучить определяющие клинико-лабораторные и рентгено-сонографические факторы, обосновать информативные прогностические критерии. Материалы и методы. Под наблюдением находились 105 больных. МСМ определяли скрининговым методом с осаждением белков трихлоруксусной кислотой и определением спектров поглощения света кислоторастворимой фракцией. Результаты. РА сопровождается повышением в сыворотке крови концентраций отдельных фракций МСМ, что связано с активностью заболевания и артикулярного синдрома, в частности отдельных костнодеструктивных суставных повреждений и системных проявлений заболевания. С изменениями среднемолекулярных гормонов связана активность и стадийность РА, темпы его прогрессирования, развитие остеопороза, формирование костно-деструктивных повреждений, а уровень остеокальцина обнаруживает прогностическую значимость. Выводы: отдельные фракции МСМ различных биологических жидкостей участвуют в патогенетических построениях РА, зависят от клинических, лабораторных, рентгенологических и сонографических признаков заболевания, могут быть использованы для прогнозирования течения патологического процесса, контроля эффективности лечения и разработки новых медицинских лечебных технологий.
Ключевые слова: артрит ревматоидный, течение, патогенез, кровь, синовий, легочный экспират, молекулы средней массы.
Адреса для листування:
Синяченко Олег Володимирович
84404, Донецька обл., Лиман,
вул. Привокзальна, 27
Донецький національний медичний університет,
кафедра внутрішньої медицини № 1
E-mail: synyachenko@ukr.net

Leave a comment