ДОСВІД ЗАСТОСУВАННЯ НАБУМЕТОНУ У ХВОРИХ З РЕАКТИВНИМИ АРТРИТАМИ
Резюме. У роботі представлено дані клінічного дослідження нестероїдного протизапального препарату (НПЗП) набуметон у хворих з реактивними артритами. Відпрацьовано дози та тривалість його прийому залежно від клініко-лабораторної активності реактивного артриту. Вперше описано групу пацієнтів з постковідним реактивним артритом та обґрунтовано доцільність застосування набуметону в комплексному лікуванні таких хворих. Ефективність даного НПЗП оцінювали за загальним станом пацієнта, динамікою суглобового та запального індексів, кількістю уражених суглобів, об’ємом активних та пасивних рухів. У пацієнтів з реактивним артритом на тлі остеоартрозу аналізували запальний індекс Річі. Через 30 днів лікування в цілому по групі суглобовий індекс зменшився на 77%, запальний — на 78,5%, індекс Річі — на 55,6%, що підтверджує ефективність симптоматичної дії набуметону. У пацієнтів з наявністю синовіту за даними ультразвукового дослідження суглобів відмічено регрес випоту. Переносимість лікарського засобу була задовільною і не викликала будь-яких негативних наслідків як з боку шлунково-кишкового тракту, так і з боку серцево-судинної системи, що дозволяє включати його в комплексну терапію реактивних артритів.
DOI: 10.32471/rheumatology.2707-6970.86.16631
Реактивні артрити (РеА) — це запальні негнійні захворювання суглобів, які розвиваються в тісному хронологічному зв’язку з перенесеною кишечною або урогенітальною інфекцією [8].
Частота РеА, за даними літератури, становить 30–40 випадків на 100 000 населення. На відміну від септичних (інфекційних) артритів, при РеА у пошкодженому суглобі збудник відсутній. РеА є класичним прикладом HLA-B27-асоційованого захворювання і належить до групи серонегативних спондилоартропатій [1, 11, 19, 20]. Терапія суглобового синдрому будь-якого походження спрямована на зменшення вираженості болю та запалення. Нестероїдні протизапальні препарати (НПЗП) займають центральне місце у лікуванні при цій симптоматиці [10]. У нашому дослідженні ми обрали молекулу набуметону для вивчення її ефективності у пацієнтів з РеА. Дослідження проведено у відділі некоронарних хвороб серця, ревматології та терапії ДУ «ННЦ «Інститут кардіології ім. академіка М.Д. Стражеска» НАМН України.
Мета дослідження. Вивчити особливості протизапальної дії препарату набуметон у пацієнтів з РеА за даними клінічних, лабораторних та інструментальних методів дослідження.
Матеріал і методи дослідження
Для вирішення поставлених задач дослідження обстежено 30 хворих, у яких діагностовано РеА. На початку дослідження усі хворі проходили повне обстеження згідно з розробленим протоколом. Переважали пацієнти з гонартрозом та ураженням дрібних суглобів кистей з наявністю синовіту, які були розподілені за чинником артриту (табл. 1).
Таблиця 1. Розподіл хворих з РеА залежно від чинника
| Загальна кількість пацієнтів n=30 | |
|---|---|
|
Після перенесеної кишкової інфекції, з них: спричиненої Shigella flexneri, спричиненої Salmonella enteritidis |
5
2 3 |
|
Після перенесеної урогенітальної інфекції, з них: спричиненої Chlamydia trachomatis, спричиненої Ureaplasma urealyticum |
7
5 2 |
| Після гострого респіраторного захворювання | 5 |
| Після перенесеного COVID-19 | 13 |
Серед усіх обстежених хворих чоловіків було 18, середній вік 38,5±4,12 року, жінок — 12 віком 50,5±4,5 року.
На сьогодні РеА є найбільш поширеним видом гострого артриту у людей молодого віку, але багато фактів стосовно РеА досі не з’ясовані остаточно: не всі збудники відомі, а ті, що вже визначені, викликають захворювання з різною частотою; точні механізми ураження суглобів також невідомі. Ймовірно, найбільш важливу роль у цьому процесі відіграють імунні механізми, особливо Т-клітинна ланка імунітету та зміни рівня цитокінів [4, 6, 7, 9]. При лікуванні за сучасними стандартами захворювання РеА все одно часто рецидивує та набуває хронічного перебігу, навіть призводить до інвалідизації, що спонукає до постійного пошуку нових засобів лікування.
У пацієнтів, що були включені в наше дослідження, після перенесеної кишкової інфекції протягом 1 міс розвинувся артрит, причому практично у всіх зазначених випадках відмічено тріаду ознак (артрит — уретрит — кон’юнктивіт) [12, 14]. За даними літератури, залежно від виду сальмонел, які викликають гостру кишкову інфекцію, частота розвитку РеА у дорослих становить близько 30% [13].
Роль Chlamydia trachomatis y розвитку РеА не викликає сумнівів [5, 17]. Це пов’язано зі значною поширеністю хламідійної інфекції, особливостями шляхів її передачі, циклу розвитку хламідій та реакції організму пацієнта на терапію. З одного боку, це найбільш відомий та вивчений збудник РеА, а з іншого — хламідіоз сечостатевих органів діагностується погано. Це відбувається з таких причин: у 70% пацієнтів хламідійна інфекція має безсимптомний перебіг, близько 30% хворих чоловіків не звертають увагу на наявні у них ознаки уретриту і більше 90% — не знають про наявність у них хронічного простатиту. Як наслідок ці пацієнти або взагалі не звертаються до лікарів, або лікарі не приділяють уваги обстеженню їх сечостатевої системи навіть за наявності суглобового синдрому [3,15]. Крім того, навіть при призначенні цілеспрямованого обстеження частота виявлення Сhlamydia trachomatis у сечостатевому тракті при РеА коливається у широких межах (32–100%), що пов’язано з різним ступенем чутливості лабораторних методів дослідження та із попереднім застосуванням антибактеріальної терапії [16]. У нашому випадку у 5 хворих виявлено Сhlamydia trachomatis. У двох пацієнтів етіологічним чинником РеА виявлена Ureaplasma urealyticum. За даними Інституту дерматології та венерології НАМН України, найбільш частими збудниками РеА є саме Сhlamydia trachomatis (у 92,6% хворих) та Ureaplasma urealyticum (у 26,6% хворих). При цьому хламідійна моноінфекція визначається у 68,5% загальної кількості хворих, хламідійно-уреаплазменна — у 16,3%, хламідійно-трихомонадна — у 3,9%, хламідійно-гонорейна — у 0,5%, поєднання трьох етіологічних чинників — у 3,5%. Таким чином, при РеА часто відзначається мікст-інфекція, причому найчастіше має місце хламідійно-уреаплазменна [2].
На особливу увагу заслуговує РеА, який виникає після COVID-19 [18]. Це питання на сьогодні є абсолютно новим викликом для ревматологів, що потребує вивчення і тривалого спостереження. Тяжкий гострий респіраторний синдром, спричинений коронавірусом 2 (SARS-CoV-2) є новим патогеном, відповідальним за спалах коронавірусної хвороби 19 (COVID-19) [25]. Дослідники та клініцисти вивчають патогенетичні механізми ураження, спричиненого вірусом, і зростаючий інтерес зосереджується на короткострокових та довгострокових імуноопосередкованих наслідках, спричинених інфекцією. Припускається, що молекулярна мімікрія може бути основним імунологічним механізмом, що відповідає за виникнення артриту, пов’язаного з COVID-19, на основі сучасних знань про гостру респіраторну вірусну інфекцію-CoV-2 та відомого патогенетичного механізму вірусно-індукованого артриту.
Вірусний РеА може бути пізнім ускладненням, яке виникає через 2–4 тиж після появи вірусних симптомів, розвиваються тяжка артралгія переважно міжфалангових суглобів кистей, гострий перебіг гонартрозу, який триває іноді протягом 4 тиж. Лабораторні аналізи не виявляють суттєвих лабораторних змін, і симптоми зникають при короткому курсі прийому пероральних НПЗП, одним із яких у нашому дослідженні є набуметон.
У відповідь на нещодавню появу коронавірусу-2 — тяжкого гострого респіраторного синдрому (SARS-CoV-2), збудника COVID-19, підрозділом Virus Émergents проведено доклінічну оцінку препаратів-кандидатів проти SARS-CoV-2. Це проміжний звіт, який ще не рецензувався і його дані доступні тільки за запитом.
Була протестована молекула набуметону: НПЗП з протизапальною, жарознижувальною та знеболювальною дією.
Проведена оцінка ефективності набуметону in vitro: набуметон був ідентифікований як потенційно ефективний антивірусний скринінг на основі цитопатичного препарату SARS-CoV-2 [23, 24].
Також противірусна активність була додатково охарактеризована від 40 мкМ до 0,6 мкМ в клітинах Vero-E6 із застосуванням аналізу зниження виходу вірусної РНК [23, 24]. Оскільки виявлено, що набуметон ефективний проти SARS-CoV-2 з індексом селективності (SI) 3,5, його противірусна активність була оцінена in vivo.
Після схвалення місцевим етичним комітетом (C2EA-14) і французькою владою (APAFIS № 23975) було проведено експеримент на самках сирійських хом’яків, яких інфікували штамом BavPat1 SARS-CoV-2. Група з 6 хом’яків отримувала набуметон перорально двічі на добу (BID). Використовували одну дозу 590 мг/кг/добу. Лікування починали в день зараження, закінчували через 2 дні після зараження (dpi), далі тварин умертвляли через 3 dpi. Контрольна група з 6 інфікованих/необроблених тварин отримувала перорально 0,9% розчину хлориду натрію. Реплікацію вірусу вимірювали в легенях (вихід вірусної РНК) і в плазмі крові (вихід вірусної РНК). Результати показали недостатнє зниження реплікації вірусу в легенях і плазмі порівняно з контрольною групою.
Отже, набуметон інгібує реплікацію SARS-CoV-2 in vitro з використанням клітин Vero-E6, проте результати, отримані на моделі хом’яка, припускають, що ця молекула недостатньо інгібує реплікацію SARS-CoV-2 in vivo.
Спираючись на представлені експериментальні дані, ми провели клінічне дослідження набуметону у групі пацієнтів з РеА після перенесеної інфекції COVID-19.
Усі пацієнти отримували препарат в рекомендованій дозі — 1500 мг/добу (по 750 мг двічі на добу) або 1000 мг/добу (по 500 мг двічі на добу) залежно від активності запального процесу в суглобах та активності метаболізму. Тривалість лікування становила 30 діб. Препарат призначали відповідно до рекомендацій виробника згідно з інструкцією для застосування. Протягом усього періоду дослідження інші НПЗП пацієнти не приймали.
Нами визначалися: загальний стан хворого, суглобовий та запальний індекси, кількість уражених суглобів, об’єм активних та пасивних рухів.
Комплексна оцінка больового синдрому включала десятибальну візуальну аналогову шкалу (ВАШ) болю, яку пацієнт заповнював до та після лікування. Оцінювали обсяг рухів, аналізували суглобовий, запальний індекс Річі, ранкову скутість, а також ефективність лікування з точки зору лікаря і пацієнта. У пацієнтів з РеА на тлі остеоартрозу визначали ступінь функціонального порушення за допомогою індексу Лекена. Лабораторну активність визначали за показниками швидкості осідання еритроцитів (ШОЕ), С-реактивного білка (СРБ). Також враховувалася побічна дія препарату при тривалому (не менше місяця) лікуванні РеА.
Для виявлення синовіту в суглобах проводилося ультразвукове дослідження (УЗД) опорно-рухового апарату [22] на апараті Medison Sonoace X8, лінійним датчиком з частотою випромінювання 5–12 МГц з використанням програм двомірної томографії (В-режим) та енергетичного кольорового допплерівського картування в режимі реального часу. УЗД проводилося на базі ТОВ «НПЦ «Кардіомед».
Паралельно у всіх хворих оцінювали стан верхнього завороту колінного суглоба, зокрема, товщину синовіального шару і ширину суглобового випоту в ньому. Зміна товщини синовіальної оболонки і наявність випоту в порожнині суглоба вважалися основними маркерами запалення суглобів. Проводили ультразвукове сканування колінних суглобів за стандартною методикою. При кожному дослідженні лікар УЗД дотримувався певної послідовності огляду і розташування датчика відносно колінних суглобів. Для відображення основних елементів SONOLINE Omnia (Siemens) з лінійним датчиком 7,5L70 (частота 7,5 мгц) і проводилося в режимі «ortho», причому для кожного обстежуваного суглоба застосовувалися стандартні позиціонування датчика. Оцінювалися кісткові суглобові поверхні (зміни поверхні субхондральної кістки — наявність кист, ерозій, інших вад), суглобова щілина (СЩ), синовіальна оболонка, навколосуглобові м’які тканини, наявність випоту, змін зв’язкового апарату [21]. Синовіальна оболонка досліджувалася нами в надколінниковій бурсі на всій доступній для візуалізації ділянці. Отримані значення були розподілені на 4 групи: 0 — товщина <2 мм; 1 — в межах 2–4 мм; 2 — 4–6 мм; 3 — товщина > 6 мм. Кількість суглобового випоту, виявленого при скануванні, вимірювали за максимальною шириною анехогенного шару. Суглобовий випіт був класифікований так: 0 — відсутність рідинних структур у суглобовій порожнині; 1 — максимальна ширина шару рідини <2 мм; 2 — в межах 2–4 мм; 3 — товщина шару рідини > 4 мм.
Оцінка статусу пацієнта проводилася перед початком випробування та на 30-й день від початку лікування. При цьому враховувалася інтенсивність болю в стані спокою й при активних рухах, порушення функції, а також запалення/припухлість суглобів за 10-бальною аналоговою шкалою. Моніторинг побічної дії препарату проводився протягом усього місяця лікування. Переносимість враховувалася як хороша, задовільна, незадовільна.
Фінальна загальна ефективність оцінювалася пацієнтом і дослідником із застосуванням 4-бальної вербальної оціночної шкали: значне покращення, покращення, без змін, погіршення.
Результати
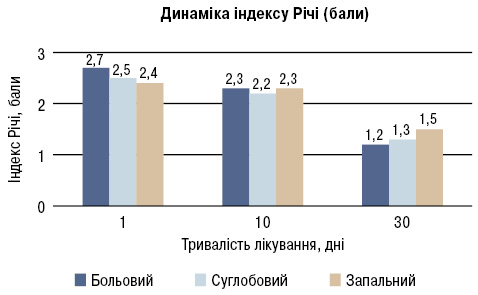
У результаті проведеного лікування протягом місяця препаратом набуметону у 100% пацієнтів (n=30) відмічена позитивна динаміка показників, що досліджувалися, включаючи фізичне самопочуття. Аналіз болю за ВАШ (10-бальна шкала) показав, що достовірне зменшення вираженості больового синдрому в середньому реєструвалося з 3-ї доби від початку прийому препарату. Поступово зменшувалася кількість болючих суглобів і через 10 днів лікування у 18 пацієнтів даний показник знизився в середньому на 50%. Через 30 днів лікування в цілому по групі суглобовий індекс знизився на 77%, запальний — на 78,5%, індекс Річі — на 55,6%, що підтверджує ефективність симптоматичної дії набуметону (рис. 1).
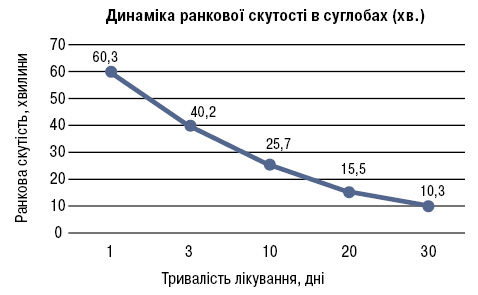
У 14 пацієнтів з активним артритом і наявністю синовіту інтенсивність болю та активність артриту за ВАШ через 14 днів знизилася в середньому на 55%, що дозволило знизити дозу до 1000 мг/добу (тобто по 500 мг двічі на добу). Зменшення ранкової скутості реєструвалося, починаючи з 2-ї доби після прийому препарату, причому вона у наступні дні мала позитивну динаміку протягом усього курсу лікування (рис. 2). У цілому цей показник знизився у 6 разів.
Щодо динаміки обсягу згинання в колінному суглобі, виявлена стійка тенденція до підвищення цього показника (в середньому з 112,2±4,1° до 118,3±6,4°).
Найважче піддавалися лікуванню хворі з РеА після перенесеної урогенітальної інфекції, у яких відзначалися п’яткова ентезопатія, підп’ятковий бурсит, тендиніт і плантарний фасцит, у 2 пацієнтів зберігалися прояви кон’юнктивіту. Довелося застосовувати препарат в дозі 1500 мг/добу протягом 21 дня з подальшим зниженням до 500–1000 мг/добу залежно від вираженості больового синдрому. За даними УЗД суглобів, відмічено досить повільний регрес синовіального випоту, що потребувало якнайшвидшого застосування базисної терапії цитостатиками з метою запобігання системному ураженню при даному процесі.
У пацієнтів з РеА після перенесеного гострого респіраторного захворювання, який в основному супроводжувався артралгіями, достатнім було застосування 1000 мг протягом 10 днів з подальшим зниженням дози до 500 мг/добу, а до кінця лікування 3 пацієнтам препарат було відмінено через досягнення знеболювального і протизапального ефекту.
Отримані результати УЗД колінних суглобів встановили, що у хворих на РеА на тлі остеоартрозу з синовітом відмічено майже вдвічі більшу кількість синовіальної рідини (більше 3 мм) та тяжчу стадію синовіту колінних суглобів, про що свідчать розміри верхнього завороту, локальне та дифузне потовщення синовіальної оболонки — більше 6 мм.
При гострому процесі в синовіальній оболонці переважали явища неспецифічного запалення у вигляді набряку, інфільтрації нейтрофільними лейкоцитами, а в разі рецидивуючого і хронічного перебігу виникають лімфоїдна плазмоклітинна інфільтрація та фіброз синовію.
У нашому дослідженні встановлено, що у пацієнтів з постковідним артритом за даними УЗД відмічено збільшення кількості синовіальної рідини у колінних суглобах від 2 мм до більш ніж 3 мм, особливо це стосується пацієнтів з наявним остеоартрозом, у яких через 2 тиж після перенесеної інфекції COVІD-19 випіт у колінному суглобі становив близько 3,5 мм. У суглобових сумках вміст був неоднорідним і гіпоехогенним зі згустками фібрину. Це свідчило про гострий перебіг РеА та потребувало в перші 10–14 днів призначати препарат у дозі 1500 мг/добу. У процесі зменшення вираженості запального процесу за клініко-лабораторними показниками дозу препарату знижували до 1000 мг на добу протягом наступних 2 тиж. Через місяць лікування препарат було відмінено. Результати УЗД-контролю підтвердили позитивну динаміку у суглобі, де відмічено регрес синовіального випоту майже вдвічі (на 50%).
Альгофункціональний індекс Лекена в групі пацієнтів з перенесеним COVІD-19 до лікування становив 8,34±1,02 бала, а в процесі проведеного лікування із застосуванням набуметону відмічено його зниження на 30%. ШОЕ у цій групі хворих становила 30 мм/год. На 10–14 -й день лікування ШОЕ знизилася до 23 мм/год. Стійкий анальгезивний ефект отримано з 5–7-го дня від початку лікування. Після проведення фармакологічної підтримки у 9 осіб відзначалося істотне зменшення вираженості больових відчуттів, а у 4 хворих відмічено повне зникнення артралгії.
У загальному для всієї групи обстежених (n=30) в процесі лікування набуметоном не виявлено патологічних змін з боку лабораторних показників крові, сечі, електрокардіограми. Щодо показників лабораторної активності запального процесу (ШОЕ, СРБ), які до лікування були помірно підвищеними: ШОЕ — 24,6±3,1; СРБ — 4,6±0,8, виявлена позитивна динаміка (табл. 2).
Таблиця 2. Показники лабораторної активності запального процесу
| Показники | До лікування | Після лікування(на 30-й день) |
|---|---|---|
| ШОЕ, мм/год | 24,6±3,1 | 15,0±3,4 |
| СРБ, мг/л | 4,6±0,8 | 2,4±0,6 |
Таким чином, покращення різного ступеня вираженості вдалося досягти у більшості хворих, зокрема відмічено позитивний ефект щодо основних проявів РеА, таких як біль, обмеження рухомості, зменшення вираженості синовіту за даними УЗД.
У більшості пацієнтів відмічали покращення загального стану, переносимість в середньому відмічали як задовільну.
Отримані результати свідчать про позитивний вплив препарату на артрологічний статус хворих з РеА при практичній відсутності клінічних ознак побічної дії на шлунково-кишковий тракт. Препарат може використовуватися в лікуванні хворих на РеА як ефективний знеболювальний і протизапальний засіб. Це пояснюється головним чином тим, що набуметон не має кислих хімічних властивостей і має переваги у пригніченні циклооксигенази (ЦОГ)-2, а не ЦОГ-1, тобто його профіль безпеки щодо шлунково-кишкового тракту є вищим порівняно з іншими НПЗП [26].
За оцінкою ефективності лікування з боку лікаря: недостатній ефект відзначено у 5%, сприятливий — у 40%, хороший — у 30%, відмінний — у 25% пацієнтів.
За оцінкою ефективності лікування з боку пацієнта: недостатній ефект відзначено у 3%, сприятливий — у 40%, хороший — у 32%, відмінний — у 25% хворих.
Висновки
1. Оцінка клінічної ефективності препарату показала позитивний вплив на артрологічний статус: зменшення вираженості болю на 50% (за шкалою ВАШ); зниження больового індексу Річі на 55,6%, суглобового — на 77%, запального — на 78,6%; тяжкість гонартрозу за індексом M. Lequesne знизилася на 30%; відмічено зменшення ранкової скутості у 6 разів, підвищення обсягу згинання в колінних суглобах.
2. У пацієнтів з високою активністю запального процесу виявлена позитивна динаміка лабораторних показників крові: нормалізація ШОЕ, СРБ.
3. Протизапальна дія препарату підтверджується даними УЗД суглобів — регрес прояву синовіту (об’єм випоту знизився в середньому на 68,6%).
4. У 100% пацієнтів з РеА відмічали покращення загального стану і якості життя через 30 днів лікування.
5. При високому ступені активності запального процесу доцільно призначати в початковій дозі 1500–2000 мг (750 мг двічі на добу) протягом 10–14 днів з подальшим переходом на підтримувальну дозу до 500–1000 мг (500 мг 1–2 рази на добу залежно від вираженості больового синдрому) з подовженою тривалістю лікування (2–3 міс).
6. Пацієнтам з артралгіями та невисокою активністю запального процесу рекомендовано розпочинати лікування з дози 1000 мг (500 мг двічі на добу) протягом 7–14 днів з подальшим переходом на підтримувальну дозу по 500 мг/добу тривалістю до 1 міс.
7. За період спостереження побічної дії препарату не виявлено, проте при тривалому застосуванні, для раціонального контролю ризиків з боку травного тракту можливе додаткове призначення інгібіторів протонної помпи.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- 1. Агабабова Э.Р. (1997) Реактивные артриты и синдром Рейтера. Ревматические болезни: руководство для врачей. Под ред. В.А. Насоновой, Н.В. Бунчука, Москва, Медицина, 324–331.
- 2. Бондаренко Г.М. (2004) Этиопатогенез болезни Рейтера: современное состояние проблемы. Дерматологія та венерологія, 2(24): 73–80.
- 3. Бондаренко Г.М. (2009) Болезнь Рейтера: современные взгляды на этиологию и патогенез. Здоровье мужчны, 3(30): 152–156.
- 4. Гапонова Т.В., Лила А.М., Шемеровская Т.Г. и др. (2008) Изучение цитокинового статуса больных реактивным артритом. Мед. иммунология, 10(2–3): 167–172.
- 5. Гомозова Е.А., Синяченко О.В., Снопко Е.Ю., Супрунова В.О. (2008) Клинико-патогенетическое значение нарушений пуринового обмена при хламидийассоциированном реактивном артрите (болезни Рейтера). Дерматологія та венерологія, 1(39): 67–69.
- 6. Джус М.Б. (2004) Клініко-імунологічні особливості перебігу реактивного артриту. Укр. ревматол. журн., 3(17): 44–48.
- 7. Жеребкин В.В. (2007) Диагностика и лечение реактивного артрита. Клінічна імунологія. Алергологія. Інфектологія, 1(6): 64–69.
- 8. Коваленко В.Н., Шуба Н.М. (ред.) (2002) Ревматические болезни: номенклатура, классификация, стандарты диагностики и лечения. Киев, с. 121–122.
- 9. Кундер Е.В. (2010) Роль цитокинов в развитии системного и локального воспаления при спондилоартропатиях. Иммунопатология, аллергология, инфектология, 2: 12–17.
- 10. Ногаева М.Г., Исаева Б.Г. (2010) Эффективность нестероидных противовоспалительных препаратов в купировании воспалительного процесса при реактивном артрите. Клин. геронтология, 16(3–4): 15–19.
- 11. Colmegna I., Cuchacovich R., Espinoza L.R. (2004) HLA-B27-associated reactive arthritis: pathogenetic and clinical considerations. Clin. Microbiol. Rev., 17(2): 348–369.
- 12. Driouich J.S., Cochin M., Lingas G. et al. (2021) Favipiravir antiviral efficacy against SARS-CoV-2 in a hamster model. Nat. Commun. Mar. 19; 12(1): 1735.
- 13. Dworkin M.S., Shoemaker P.C., Goldoft M.J. et al. (2001) Reactive arthritis and Reiter’s syndrome following an outbreak of gastroenteritis caused by Salmonella enteritidis (2001) Clinical Infectious Diseases, Volume 33, Issue 7, 1 October: 1010–1014.
- 14. Ekman, Pivi & Kirveskari, Juha & Granfors, Kaisa (2000) Modification of disease outcome in Salmonella-infected patients by HLA–B27. Arthritis and rheumatism. 43: 1527–34.
- 15. Foot tendinopathies in rheumatic diseases: etiopathogenesis, clinical manifestations and therapeutic options.
- 16. Frizziero A., Bonsangue V., Trevisan M. et al. (2013) Clin. Rheumatol. Vol. 32, № 5: 547–555.
- 17. Gaston J.S. (2000) Immunological basis of Chlamydia induced reactive arthritis. Sex. Transm. Infect., 76(3): 156–161.
- 18. Gasparotto M., Framba V., Piovella C. et al. (2021) Post-COVID-19 arthritis: a case report and literature review. Clin. Rheumatol. Feb 15: 1–6.
- 19. Horst-Bruinsma I.E. (2012) Management and evaluation of extra-articular manifestations in spondyloarthritis. Rheum. Dis. Clin. North. Am. Vol. 38, № 3: 523–38.
- 20. Horst-Bruinsma I.E., Nurmohamed M.T. (2012) Ther. Adv. Musculoskelet. Dis. Vol. 4, № 6: 413–422.
- 21. Kim P.S, Klausmeier T.L., Orr D.P. (2009) Реактивный артрит: обзор литературы. Therapia, 11(41): 3844.
- 22. Paramarta J.E. (2013) Spondyloarthritis: from unifying concepts to improved treatment. J. E. Paramarta, D. Baeten. Rheumatology (Oxford). Vol. 20, № 6: 30–34.
- 23. Touret F., Baronti C., Goethals O. et al. (2019) Phylogenetically based establishment of a dengue virus panel, representing all available genotypes, as a tool in dengue drug discovery. Antiviral Res. Aug; 168: 109–113.
- 24. Touret F., Gilles M., Barral K. et al. (2020) In vitro screening of a FDA approved chemical library reveals potential inhibitors of SARS-CoV-2 replication. Sci Rep. Aug. 4; 10(1): 13093.
- 25. http://www.umj.com.ua/article/195550/koronavirusna-hvoroba-2019-covid-19-ta-vagitnist-oglyad-literaturi 6(140), т. 1-XI/XII 2020.
- 26. http://www.mif-ua.com/archive/article/21712 том 12, № 2, 2011.
Опыт применения набуметона у больных с реактивными артритами
ГУ «ННЦ «Институт кардиологии им. акад. Н.Д. Стражеско» НАМН Украины
Резюме. В работе представлены данные клинического исследования нестероидного противовоспалительного препарата (НПВП) набуметон у больных с реактивными артритами. Отработаны дозы и продолжительность его приема в зависимости от клинико-лабораторной активности реактивного артрита. Впервые описана группа пациентов с постковидным реактивным артритом и обоснована целесообразность применения набуметона в комплексном лечении таких больных. Эффективность данного НПВП оценивали по общему состоянию пациента, динамике суставного и воспалительного индексов, количеству пораженных суставов, объему активных и пассивных движений. У пациентов с РеА на фоне остеоартроза анализировали воспалительный индекс Ричи. Через 30 дней лечения в целом по группе суставной индекс снизился на 77%, воспалительный — на 78,5%, индекс Ричи — на 55,6%, что подтверждает эффективность симптоматического действия набуметона. У пациентов с наличием синовита по данным ультразвукового исследования суставов наблюдался регресс выпота. Переносимость лекарственного средства набуметон была удовлетворительной и не вызывала каких-либо негативных последствий как со стороны желудочно-кишечного тракта, так и со стороны сердечно-сосудистой системы, что позволяет включать его в комплексную терапию реактивных артритов.
Ключевые слова: реактивный артрит, диагностика, лечение, набуметон.
Адреса для листування:
Проценко Галина Олександрівна
Київ, вул. Народного Ополчення, 5
ДУ ННЦ «Інститут кардіології ім. акад. М.Д. Стражеска» НАМН України

Leave a comment