ФАРМАКОТЕРАПІЯ ЗАХВОРЮВАНЬ ОПОРНО-РУХОВОГО АПАРАТУ У ПАЦІЄНТІВ З РИЗИКОМ COVID-19-АСОЦІЙОВАНОГО ТРОМБОЗАПАЛЕННЯ
Рекалов Д.Г.1, Головач І.Ю2, Костенко В.О.3, Шевченко М.В.1, Кулинич Р.Л.1
- 1Запорізький державний медичний університет
- 2Клінічна лікарня «Феофанія» Державного управління справами
- 3Полтавський державний медичний університет
Резюме. У статті обговорюється здатність хондроїтин сульфатів (ХС), окрім покращення структури та функції хрящової та кісткової тканини, знижувати активацію ядерного фактора капа B (NF-κB), прозапальну гіперцитокінемію, рівень C-реактивного білка, позитивно впливати на гемокоагуляцію. Обґрунтовано переваги стандартизованого біоактивного екстракту дрібної морської риби (Алфлутопу) як препарату вибору в фармакотерапії захворювань опорно-рухового апарату у пацієнтів з ризиком COVID-19-асоційованого тромбозапалення. Підкреслено його здатність коригувати тромбозапалення завдяки пригніченню NF-κB-опосередкованого «цитокінового шторму». Акцентовано увагу на позитивній дії препарату на параметри гемокоагуляції та його низькій імуногенності. Обговорюється фармакотерапевтичне значення компонентів препарату, зокрема, фізико-хімічних особливостей ХС, наявності певних амінокислот (L-аргініну) та мінералів (сполук цинку) при його застосуванні в умовах пандемії COVID-19.
DOI: 10.32471/rheumatology.2707-6970.87.16832
УДК 616.7:616.151.5:616.9:615.4
ТРОМБОЗАПАЛЕННЯ
Термін «тромбозапалення» нещодавно був запропонований для назви процесу, пов’язаного з активацією каскадних захисних систем крові (системи комплементу, коагуляційної та фібринолітичної систем), ендотеліальних клітин, лейкоцитів і тромбоцитів, що в кінцевому підсумку призводить до тромботичних та запальних реакцій [1].
COVID-19 І ТРОМБОЗАПАЛЕННЯ
У патогенезі COVID-19-асоційованої коагулопатії чітко простежується взаємодія між гіперпродукцією прозапальних цитокінів, що отримала назву «цитокіновий шторм», гіпоксією, активацією та пошкодженням судинного ендотелію, пов’язаного в тому числі з прямою цитопатичною дією коронавірусу SARS-CoV-2 на ендотеліоцити [2, 3]. Виявлено, що ймовірність розвитку тромботичних ускладнень та дисемінованого внутрішньосудинного згортання крові у хворих на гострий респіраторний дистрес-синдром, викликаний SARS-CoV-2 є вищою, ніж при дії інших етіологічних чинників [3].
Зв’язування SARS-CoV-2 з його рецептором, тобто ангіотензинперетворювальним ферментом 2 (ACE2), за участю клітинної серинової протеази TMPRSS2 запускає процес ендоцитозу у клітині-хазяїні [4] (рис. 1).
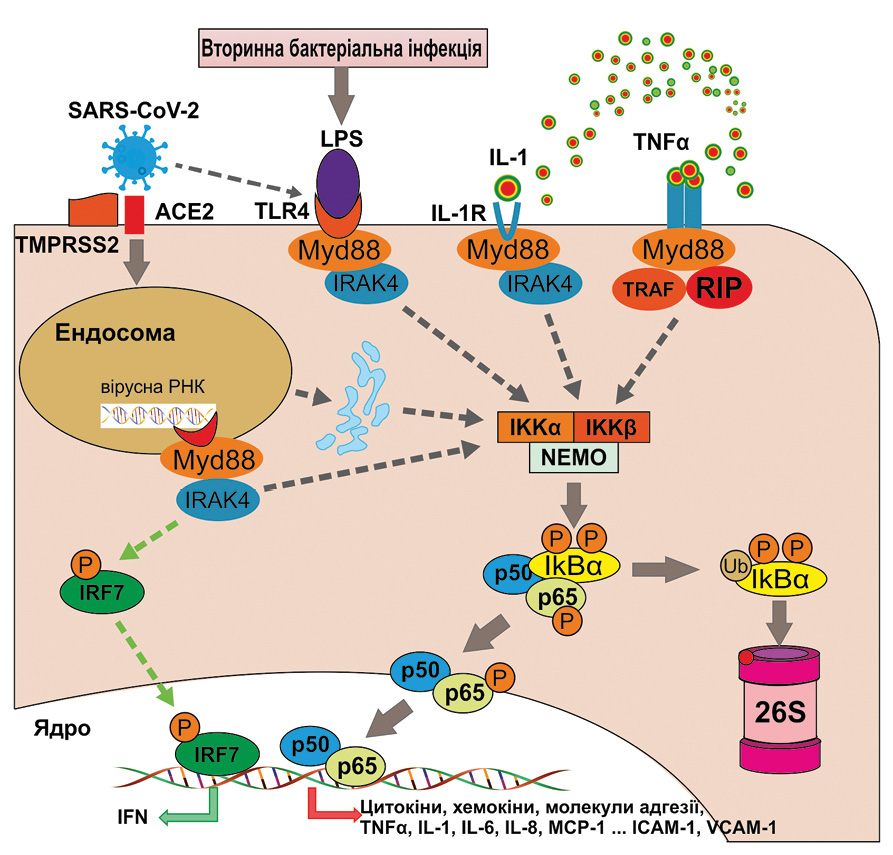
Відомо, що в ендосомах одноланцюгова РНК вірусу активує Toll-подібні рецептори TLR7 і TLR8. Проміжні дволанцюгові РНК, що утворюються під час реплікації вірусу, можуть бути розпізнані TLR3. Активація TLR7/8 та/або TLR3 призводить до активації транскрипції інтерферон (IFN)-регуляторного фактора (IRF).
У той же час активація TLR може викликати активацію сигнального шляху, пов’язаного з ядерним фактором капа B (NF-κB). Спочатку через різні проміжні продукти активується IκB-кіназний комплекс (IKK), що призводить до фосфорилювання інгібіторного білка IκBα. Це викликає убіквітинування останнього з наступною деградацією у 26S-протеасомі. Завдяки цьому гетеродимери NF-κB, що складаються з білкових субодиниць p50 і p65, вивільняються, транслокуються у ядро, де ініціюють транскрипцію генів, що кодують прозапальні білки, такі як цитокіни, хемокіни, молекули клітинної адгезії та фактори росту. Важливо, що ця послідовність активації NF-κB є спільною з сигнальними каскадами, опосередкованими рецепторами цитокінів і Toll-подібними рецепторами, включаючи зв’язування фактора некрозу пухлин-альфа (TNF-α) або інтерлейкіну (IL)-1 з їх рецепторами, або зв’язування ліпополісахаридів (LPS) з TLR4 у разі дії вторинних бактеріальних інфекцій.
Окрім того, повідомляється, що SARS-CoV-2 індукує TLR4-опосередковану активацію NF-κB, а також активацію NF-κB, викликану стресом ендоплазматичного ретикулуму. Надмірна активація NF-κB запускає експресію генів широкого спектру прозапальних цитокінів і хемокінів, молекул клітинної адгезії та білків гострої фази (С-реактивного білка, прокальцитоніну, феритину, церулоплазміну та ін.).
Продукція цих сполук викликає позитивний зворотний зв’язок з іншими імунними клітинами, які залучаються до місць запалення, що призводить до пошкоджень різних органів. Дослідження показують, що «цитокіновий шторм» може бути важливим чинником прогресування COVID-19 та призводити до поліорганної недостатності та смерті.
Нещодавно виявлено, що SARS-CoV-2 через білок ORF7a може активувати сигнальний шлях NF-κB, який зумовлює експресію прозапальних цитокінів [5]. Окрім NF-κB-залежних запальних цитокінів (IL-1α, IL-1β, IL-6, IL-8, IL-10, TNF-α, та IFNβ), ORF7a також індукує інші інтерлейкіни (IL-3, IL-4, IL-7, IL-23) та хемокіни.
Крім зв’язку з «цитокіновим штормом», добре відомо, що шлях NF-κB пов’язаний з патогенезом остеоартриту, оскільки після стимуляції активовані молекули NF-κB запускають експресію низки генів, що викликають руйнування суглобів [6, 7]. Таким чином, цілеспрямовані стратегії, які перешкоджають передачі сигналів NF-κB, розглядаються як нові потенційні терапевтичні технології лікування остеоартриту.
З іншого боку, SARS-CoV-2 через білок ORF3a індукує пошкодження мітохондрій і вироблення мітохондріальних активних форм кисню, що стимулює експресію транскрипційного фактора HIF-1α (англ. hypoxia-inducible factor-1α), посилює вірусну інфекцію та зумовлює вироблення цитокінів [8]. За цих умов значно зростає ризик розвитку як тромбоемболії легеневої артерії, так і мікротромбозів дрібних легеневих судин. HIF-залежні сигнальні шляхи посилюють тромбоз і, отже, порушують легеневий газообмін. Це викликає сильне запалення легень і викликає погіршення гіперкоагуляції [9].
У наш час запалення розглядається як механізм, завдяки якому різні фактори ризику запускають тромбогенез [10]. При COVID-19 прозапальні цитокіни разом з ураженням ендотелію посилюють експресію тканинного фактора, що супроводжується розвитком протромботичного стану [11, 12].
Патогенез COVID-19-асоційованої коагулопатії пов’язують із взаємодією чинників запалення з активованими ендотеліальними клітинами, тромбоцитами та системою комплементу (рис. 2).
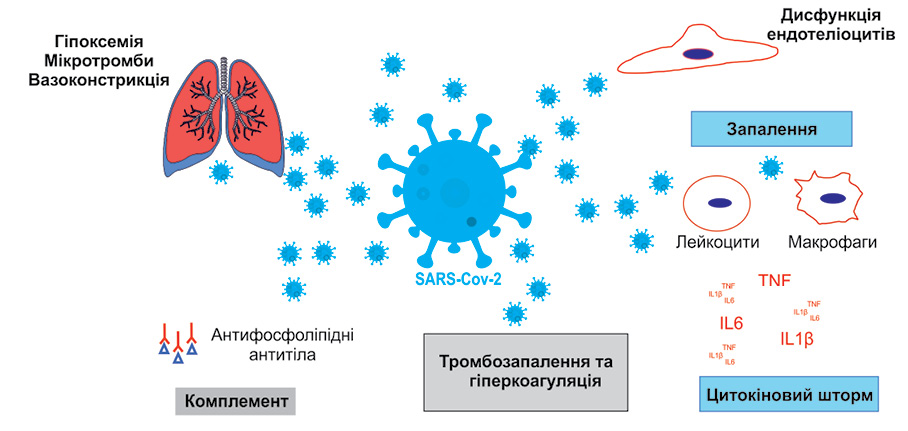
Активація/пошкодження ендотеліальних клітин ініціюється кількома шляхами, включаючи прозапальні цитокіни, гіпоксію, активацію комплементу, а також нетоз (англ. NETosis від Neutrophil extracellular traps) — програмовану клітинну загибель нейтрофілів, що супроводжується викиданням ними «тенет» у вигляді ДНК [13, 14]. Пошкоджені ендотеліоцити внаслідок дії прозапальних цитокінів, таких як IL-6, IL-8 і TNF-α, збільшують секрецію великих фрагментів фактора фон Віллебранда (англ. Von Willebrand factor — vWF), які, у свою чергу, стимулюють адгезію та активацію тромбоцитів [14]. Активовані тромбоцити не тільки посилюють запалення через секрецію прозапальних цитокінів, але й забезпечують відкриту поверхню для збирання комплексів фермент — кофактор — субстрат упродовж всього каскаду коагуляції. Розщеплення білків комплементу C3 і C5 також призводить до дегрануляції мастоцитів, що зумовлює посилення експресії тканинного фактора і пошкодження ендотеліальних клітин.
 Окрім того, SARS-CoV-2, взаємодіючи з ACE2, може викликати розвиток гіперкоагуляції з подальшим утворенням мікротромбів. Це пов’язано з підвищенням концентрації ангіотензину II у плазмі крові з подальшим звуженням легеневих судин та розвитком гіпоксемії, яка, у свою чергу, стимулює стан гіперкоагуляції [15].
Окрім того, SARS-CoV-2, взаємодіючи з ACE2, може викликати розвиток гіперкоагуляції з подальшим утворенням мікротромбів. Це пов’язано з підвищенням концентрації ангіотензину II у плазмі крові з подальшим звуженням легеневих судин та розвитком гіпоксемії, яка, у свою чергу, стимулює стан гіперкоагуляції [15].
Через надмірну активацію каскаду згортання та споживання тромбоцитів підвищується рівень D-димеру, який є продуктом деградації фібрину, та виникає тромбоцитопенія. Понад 95% пацієнтів, які надійшли до відділень реанімації з приводу COVID-19, мали підвищений рівень D-димеру та фібриногену, а у 87,7% виявляли маркер антифосфоліпідного синдрому — вовчаковий антикоагулянт [16]. Зниження кількості тромбоцитів розглядається авторами як маркер тяжкого перебігу хвороби [17, 18].
Підвищення рівня D-димеру асоціюється з більш високим рівнем смертності, зокрема від тромбоемболії легеневої артерії, що відображає роль гіперкоагуляції в патофізіології COVID-19 [19, 20]. У пацієнтів, які лікувалися у відділенні реанімації, середній рівень D-димеру був значно вищим, ніж у тих, хто не потребував інтенсивної терапії, — 0,5 та 2,4 мг/л відповідно [21]. На підставі цього рівень D-димеру розглядається як прогностичний маркер для стратифікації ризику при COVID-19. Примітно, що D-димер може стимулювати вивільнення прозапальних цитокінів, зокрема IL-6 [22].
Внаслідок ефекту вторинного поліорганного пошкодження тромбозапалення має здатність до саморозвитку та зберігається тривалий час після елімінації SARS-CoV-2 [23]. Слід також враховувати, що тривале системне запалення лежить в основі патогенезу остеоартриту [24, 25].
ХОНДРОЇТИН СУЛЬФАТИ У ПАТОГЕНЕТИЧНІЙ ТЕРАПІЇ ТРОМБОЗАПАЛЕННЯ: ПЕРСПЕКТИВИ ТА РИЗИКИ
Хондроїтин сульфати (ХС) у вигляді хондроїтин-4-сульфату та хондроїтин-6-сульфату є найпоширенішими глікозаміногліканами в організмі людини та, зокрема, важливими складовими компонентами агрекану — основного протеоглікану хрящового матриксу, де вони беруть участь у регуляції адгезії, проліферації та диференціації клітин, транспорту води, амінокислот і ліпідів у гіаліновий хрящ, визначають ключові біомеханічні властивості хрящової тканини (її еластичність), а також в’язкість синовіальної рідини [26, 27].
Численні клінічні дослідження та метааналізи дали підстави для рекомендації Європейського альянсу асоціацій ревматологів (European Alliance of Associations for Rheumatology — EULAR) та іншими впливовими медичними організаціями використовувати ХС-вмісні засоби як симптоматичні препарати уповільненої дії (SYmptomatic Slow Acting Drugs for OsteoArthritis — SYSADOA) для лікування остеоартриту [28, 29]. У вітчизняній літературі SYSADOA мають традиційну назву — «хондропротектори».
Недавні метааналізи також продемонстрували значний позитивний вплив ХС на структуру хрящової та кісткової тканини, а також функцію суглоба при остеоартриті при помірному обмеженні хронічного больового синдрому [30, 31].
Лише в останні роки з’явилися дослідження, що пояснюють молекулярні механізми протизапальних властивостей ХС. Показано, що ХС чинять сприятливий вплив на уповільнення розвитку ад’ювантного артриту та на зниження маркерів запалення [28]. Нарешті кілька досліджень in vitro обґрунтовують погляд, що ХС можуть зменшувати вираженість запальних процесів, діючи на ядерну транслокацію NF-κB, яка тісно пов’язана з такими показниками системної запальної відповіді, як концентрація у сироватці крові IL-1, IL-6 і C-реактивного білка [32–34].
Показано, що ХС не тільки пригнічують активацію NF-κB, але й впливають на інший шлях утворення прозапальних білків, пов’язаний з індукцією однієї з підгруп мітогенактивованих протеїнкіназ, що має назву p38 [35]. Все це призводило до зменшення утворення не тільки цитокінів (зокрема, IL-1β і TNF-α), але і низки прозапальних ферментів (фосфоліпази A2, циклооксигенази-2, індуцибельної ізоформи NO-синтази). Механізм дії ХС пояснює їх сприятливий вплив на морфофункціональний стан хрящів, синовіальної оболонки та субхондральної кістки. З іншого боку, ХС запобігають розвитку системного запалення, що важливо враховувати при одночасній патогенетичній терапії остеоартриту та коморбідних станів, що супроводжуються «цитокіновим штормом» різної інтенсивності, у тому числі пов’язаним з COVID-19 та його наслідками. Експериментальні та клінічні дані свідчать про те, що ХС можуть бути корисними терапевтичними засобами при запальних захворюваннях кишечнику, атеросклерозі, пародонтиті, хворобах Паркінсона та Альцгеймера, розсіяному склерозі, бічному аміотрофічному склерозі, псоріазі, ревматоїдному артриті та системному червоному вовчаку [35–37].
Ці ефекти ХС важливо враховувати у патогенетичній терапії запалення у період пандемії COVID-19, оскільки, на думку експертів, застосування нестероїдних протизапальних препаратів (НПЗП) може асоціюватися з несприятливими наслідками [38, 39]. Названі лікарські засоби, зокрема, здатні маскувати один із головних симптомів COVID-19 — лихоманку, що може спричинити пізню діагностику цього захворювання або його ускладнень [40]. Проте переривання протизапальної терапії викликає посилення больового синдрому, прогресування незворотних структурних змін суглоба, зниження якості життя. Тому доцільними є рекомендації щодо протизапальної терапії, спрямованої на зниження концентрації прозапальних цитокінів IL-1, IL-6 і TNF-α [38].
Деякі метааналізи вказують на певні протиріччя у результатах клінічних досліджень, що пов’язують з ризиками упередженості, бренду та розміру вибірки [30, 31]. Інколи використання ХС не викликало зменшення вираженості болю або функціонального стану суглобів при остеоартриті [42].
Такі неоднозначні результати клінічних досліджень можуть бути пов’язані з призначенням пацієнтам ХС у вигляді різних лікарських форм (для перорального або парентерального застосування), або виготовлених із різної сировини та за наявності або відсутності у складі препарату певних фізіологічно активних сполук (інших глікозаміногліканів, амінокислот, мінералів та ін.).
Так, ХС, отримані з бичачої та свинячої сировини відрізняються високим вмістом сульфатних груп у 4-му положенні і низькою щільністю заряду, що відповідають за утримання ХС на гіалуроновій кислоті. Крім того, тваринне походження цих продуктів створює потенційну небезпеку для споживачів, пов’язану з можливою контамінацією сировини пріонами, що викликають губчастоподібну енцефалопатію великої рогатої худоби та є етіологічними чинниками хвороби Кройцфельда — Якоба у людей, або через обмеження у використанні, пов’язані з релігійними поглядами [43]. ХС, одержані синтетичним шляхом, характеризуються наявністю три- і тетрасульфатних груп, які не виявляють у ХС природного походження, з чим пов’язана низька біосумісність таких препаратів. У той же час ХС, отримані з морських організмів, мають низький вміст сульфатних груп у 4-му положенні, високу щільність аніонного заряду, що сприяє утриманню ХС на гіалуроновій кислоті [43–45]. Ланцюги ХС-E <GlcA-GalNAc(4S,6S)>, виділені з морських організмів, виявляють противірусну та антиметастатичну активність, мають певні сигнальні властивості та покращують механічні характеристики хрящової тканини [44].
ХС із залишками фукози, виділені з морських організмів (морських огірків), поряд з противірусними властивостями, виявляють також антикоагулянтну та антитромботичну активність. Запропоновано 2 механізми антикоагулянтної дії цих сполук: активація інгібування тромбіну гепариновим кофактором II та пригнічення утворення фактора Ха та тромбіну комплексами тенази та протромбінази відповідно [46, 47].
Необхідно звернути також увагу на той факт, що ХС, які виявлялися як контамінанти у деяких партіях гепаринів, не викликали опосередкованого антитілами гепарин-індукованого підвищення агрегації тромбоцитів [48]. Це важливо враховувати, оскільки подібний механізм є характерним для розвитку тромботичної тромбоцитопенії при застосуванні гепарину при COVID-19 [49]. З іншого боку, дію гепарину можуть імітувати антитіла, що утворюються після введення SARS-CoV-2 вакцин, виготовлених на базі аденовірусних векторів. Такі антитіла зв’язуються з відповідним сайтом на тромбоцитарному факторі 4 (PF4), але вже без участі гепарину. Після цього тетрамери PF4 кластеризуються та утворюють імунні комплекси, які, в свою чергу, викликають FcγRIIa (CD32a)-залежну активацію тромбоцитів [50].
Проте не всі препарати ХС мають однаковий профіль безпеки. Деякі з них навіть виявляють небажані ефекти, пов’язані з ризиком тромбоутворення, що характерно, наприклад, для натрієвих солей ХС А та С, протипоказанням до використання яких є тромбофлебіти.
Таким чином, з урахуванням особливостей патогенезу COVID-19 та його ускладнень у групі SYSADOA перевагу слід надавати парентеральним препаратам, які не посилюють протромбогенні властивості крові.
ПЕРЕВАГИ АЛФЛУТОПу ЗА УМОВ COVID-19-АСОЦІЙОВАНОГО ТРОМБОЗАПАЛЕННЯ
Алфлутоп (Biotehnos S.A., Румунія) складається з 0,01 г стандартизованого очищеного біоактивного екстракту 4 видів дрібної морської риби: шпроту чорноморського (Sprattus sprattus phalericus), мерлану чорноморського (Merlangius euxinus), пузанки чорноморської (Alosa tanaica nordmanni) й анчоусу чорноморського (Engraulis encrassicholus ponticus). Цей екстракт поряд з ХС (хондроїтином-4-сульфатом і хондроїтином-6-сульфатом) також містить інші глікозаміноглікани (гіалуронову кислоту, дерматансульфат, кератансульфат), а також низькомолекулярні поліпептиди (з молекулярною масою до 50 кДа), амінокислоти (аланін, валін, лейцин, ізолейцин, аргінін, пролін, серин, треонін, аспарагін, метіонін, гідроксипролін, глутамінову кислоту, фенілаланін, лізин, тирозин) та мікроелементи (Na+, K+, Fe2+, Са2+, Mg2+, Cu2+, Mn+, Zn+), що відіграють важливу роль у метаболізмі сполучної тканини [51]. Препарат призначений для парентерального (внутрішньом’язового та внутрішньосуглобового) введення хворим на первинний і вторинний остеоартит різної локалізації, а також на дегенеративно-дистрофічні захворювання хребта та патологію м’яких тканин.
У клінічних дослідженнях Алфлутоп продемонстрував хондропротекторний (уповільнення прогресування остеоартриту та зростання остеофітів, зниження деградації матриксу суглобового хряща), протизапальний, антиоксидантний, анальгезивний ефекти, зумовив істотну корекцію функції суглобів і хребта та покращення якості життя [52–57]. Лікарський засіб знижував терміни епітелізації виразкових та ерозивних вад, що виникали при прийомі НПЗП, що дозволило дослідникам рекомендувати його як препарат вибору у хворих на остеоартрит з НПЗП-гастропатією [58]. Застосування Алфлутопу у складі стартової терапії захворювань опорно-рухового апарату поєднано з НПЗП прискорювало початок знеболювального ефекту та знижувало потребу в НПЗП [52]. Показана ефективність Алфлутопу у комплексній фармакотерапії больового синдрому в ділянці спини, що пов’язують з його здатністю послаблювати аферентну ноцицептивну активність за рахунок зменшення вираженості запалення у структурах хребта та зниження центральної сенситизації [59–61]. Позитивною дією препарату є його тривалий (до 1 міс після закінчення терміну лікування) анальгезивний ефект.
Закономірності впливу Алфлутопу на запалення та регенерацію детально з’ясовані у низці експериментальних досліджень, що виявили його здатність пригнічувати експресію генів та вивільнення прозапальних цитокінів (IL-1β, IL-6, IL-8), інгібувати активність агресивних протеолітичних ферментів — матриксних металопротеїназ і ADAMTS4 (англ. A Disintegrin And Metalloproteinase with ThromboSpondin-like motif 4), зв’язувати молекули клітинної адгезії (ICAM), внаслідок чого знижуються альтерація та апоптоз хондроцитів та остеоцитів [62–65]. Важливим механізмом транскрипційного пригнічення прозапальних цитокінів є зниження експресії NF-κB, зокрема його субодиниці p50 (NF-κB1) [65].
За умов стимуляції IL-1β і TNF-α екстракт дрібної морської риби ефективно протидіяв зниженню числа хондроцитів як шляхом пригнічення апоптозу, так і стимуляції швидкості їх проліферації [66].
Регенераторний ефект Алфлутопу підтверджується його здатністю стимулювати як проліферацію хондроцитів (синтез ДНК та мітотичну активність), так і синтез компонентів позаклітинного матриксу — агрекану та гіалуронану [63, 65, 67]. Крім того, використання стандартизованого екстракту дрібної риби позитивно впливало також на рівень трансформувального фактора росту бета (TGF-β), урівноважений пул якого важливий для клітинної регенерації хрящової тканини [63].
Фармакологічні ефекти Алфлутопу та профіль його безпеки є особливо важливими для фармакотерапії захворювань опорно-рухового апарату у пацієнтів з ризиком розвитку COVID-19-асоційованого тромбозапалення. По-перше, цей препарат виявляє здатність не тільки зменшувати вивільнення прозапальних цитокінів, але й пригнічувати експресію їх генів, у тому числі NF-κB-опосередковану [62–65], що важливо для попередження та обмеження «цитокінового шторму» при COVID-19 та його ускладненнях, пов’язаних з тривалим розвитком системної запальної відповіді різної інтенсивності, що підтримує хронічне запалення — провідний патогенетичний механізм остеоартриту та багатьох коморбідних станів.
По-друге, важливою перевагою Алфлутопу, що призначається в умовах пандемії COVID-19, є відсутність негативного впливу на параметри гемокоагуляції та забезпечення меншої потреби в НПЗП, які можуть маскувати ранні симптоми коронавірусної інфекції [39, 40]. Така дія відрізняє Алфлутоп від інших препаратів ХС, зокрема, натрієвих солей ХС А та С.
Не менш цікавим моментом, що обґрунтовує перевагу Алфлутопу перед іншими представниками групи SYSADOA у пацієнтів із захворюваннями опорно-рухового апарату, що мають ризик розвитку COVID-19-асоційованого тромбозапалення, є низька імуногенність препарату. У той же час засоби, що містять так звані глікозаміноглікан-пептидні комплекси кісткового мозку та міжреберних хрящів великої рогатої худоби, потенційно здатні викликати утворення антитіл до самих себе. Перед початком лікування такими препаратами від пацієнта вимагається консультація лікаря для виключення наявності системної аутоімунної патології (ревматоїдного артриту, анкілозуючого спондиліту, системного червоного вовчака, склеродермії). Усі ці захворювання, як відомо, супроводжуються розвитком тромбозапалення [41].
Наведені переваги Алфлутопу, на нашу думку, можуть бути пов’язані не тільки з технологією виробництва очищеного біоактивного екстракту дрібної морської риби (знежирення і депротеїнізація), але і з наявністю у складі цього комплексного препарату поряд з ХС інших фізіологічно активних сполук. Наприклад, наявність L-аргініну є необхідною умовою для нормального функціонування ендотеліальних та імунних клітин [68]. Доведеною є метаболічна роль L-аргініну як субстрату NO-синтази й аргінази, попередника низки життєво важливих речовин (оксиду азоту, поліамінів, глутаміну, глутатіону, γ-аміномасляної кислоти та ін.). Примітно, що продукування оксиду азоту вважається однією з найбільш ранніх противірусних реакцій організму хазяїна, а непрямі ефекти цієї сполуки забезпечують регуляцію запалення та імунної відповіді [69].
У недавньому дослідженні, присвяченому COVID-19, виявлено, що і у дорослих, і у дітей, уражених SARS-CoV-2, відмічають значно нижчі рівні L-аргініну в плазмі крові, а також біодоступність L-аргініну, порівняно зі здоровими особами [70]. В іншій роботі показано, що рівень L-аргініну в плазмі крові зворотно корелює з тяжкістю COVID-19 [71]. Це дослідження також виявило, що експресія активованого комплексу GPIIb/IIIa (Procaspase Activating Compound 1 — PAC-1), який, як відомо, бере участь в активації тромбоцитів і тромбоемболічних подіях [72], вища на тромбоцитах у пацієнтів із тяжким перебігом COVID-19 порівняно зі здоровими особами та зворотно корелює з концентрацією L-аргініну в плазмі крові [71]. Додавання перорального L-аргініну до стандартної терапії пацієнтів із тяжким перебігом COVID-19 значно зменшувало тривалість госпіталізації та необхідність респіраторної підтримки [73].
Іншою важливою складовою Алфлутопу, що вигідно відрізняє його від інших SYSADOA, є наявність у його складі іонів цинку. В організмі людини цинк є другим за поширеністю мікроелементом після заліза, він бере участь у найважливіших молекулярно-біологічних процесах (синтезі білків та нуклеїнових кислот, стабілізації структури ДНК, РНК та рибосом, трансляції, клітинному циклі, стабілізації та проникності мембран), впливає на антиоксидантний стан організму, функціонування імунної системи, остеогенез тощо [74, 75]. Показано, що застосування глюконату цинку знижувало нейтрофільну інфільтрацію дихальних шляхів і вивільнення TNF-α шляхом інгібування NF-κB-залежної транскрипції генів запалення [76].
Нині цинк розглядається як чинник профілактичної або допоміжної терапії COVID-19 та його ускладнень [77, 78], хоча повідомлялося щодо лікування COVID-19 високими дозами солей цинку зі зменшенням вираженості симптомів захворювання протягом 24 год після початку їх споживання [79]. Як засіб допоміжної терапії сполуки цинку (у відповідній дозі) зменшували вираженість запалення легень, підвищували мукоциліарний кліренс, покращували імунний стан пацієнтів з COVID-19 [80].
ВИСНОВКИ
1. Тривала пандемія, спричинена коронавірусом SARS-CoV-2, виявляє додаткові ризики у пацієнтів із захворюваннями опорно-рухового апарату, пов’язані з можливістю розвитку COVID-19-асоційованого тромбозапалення. Нещодавні дослідження виявили патогенетичний зв’язок цього процесу з активацією сигнального шляху, асоційованого з транскрипційним фактором NF-κB, з подальшим розвитком «цитокінового шторму», реакції гострої фази запалення, ураженням ендотеліальних клітин та тромбоцитів, протромботичних змін. Внаслідок ефекту вторинного поліорганного пошкодження тромбозапалення має здатність до саморозвитку та зберігається тривалий час після елімінації SARS-CoV-2, впливаючи на патогенез захворювань опорно-рухового апарату.
2. Експериментальні та клінічні дослідження виявляють здатність ХС, окрім покращення структури та функції хрящової та кісткової тканини, знижувати активацію NF-κB, прозапальну гіперцитокінемію, рівень C-реактивного білка, позитивно впливати на гемокоагуляцію. Проте фармакологічна дія цих сполук значною мірою залежить від лікарської форми (для перорального або парентерального застосування), виду сировини для виготовлення препарату та наявності у його складі певних фізіологічно активних сполук (інших глікозаміногліканів, амінокислот, мінералів та ін.). З урахуванням особливостей патогенезу COVID-19 серед препаратів, що містять ХС, перевагу слід надавати парентеральним препаратам, які не посилюють протромбогенні властивості крові. Прикладом таких лікарських засобів є стандартизований біоактивний екстракт дрібної морської риби (Алфлутоп), здатний коригувати тромбозапалення завдяки пригніченню NF-κB-опосередкованого «цитокінового шторму», а також через позитивну дію на параметри гемокоагуляції та низьку імуногенність препарату. Обговорюється значення компонентів Алфлутопу, зокрема, фізико-хімічних особливостей ХС, наявності певних амінокислот (L-аргініну) та мінералів (сполук цинку), що забезпечують високу ефективність цього препарату як засобу фармакотерапії захворювань опорно-рухового апарату у пацієнтів з ризиком COVID-19-асоційованого тромбозапалення.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- 1. Ekdahl K.N., Teramura Y., Asif S. et al. (2015) Nilsson B. Thromboinflammation in Therapeutic Medicine. Adv. Exp. Med. Biol., 865: 3–17.
- 2. Насонов Е.Л., Бекетова Т.В., Решетняк Т.М. и др. (2020) Коронавирусная болезнь 2019 (COVID-19) и иммуновоспалительные ревматические заболевания: на перекрестке проблем тромбовоспаления и аутоиммунитета. Научно-практическая ревматология, 58(4): 353–367.
- 3. Ferrari F., Martins V.M., Teixeira M. et al. (2021) COVID-19 and Thromboinflammation: Is There a Role for Statins? Clinics (Sao Paulo), 76 :e2518.
- 4. Kircheis R., Haasbach E., Lueftenegger D. et al. (2020) NF-κB Pathway as a Potential Target for Treatment of Critical Stage COVID-19 Patients. Front. Immunol., 11: 598444.
- 5. Su C.M., Wang L., Yoo D. (2021) Activation of NF-κB and induction of proinflammatory cytokine expressions mediated by ORF7a protein of SARS-CoV-2. Sci Rep., 11: 13464.
- 6. Choi M.C., Jo J., Park J. et al. (2019) NF-κB Signaling Pathways in Osteoarthritic Cartilage Destruction. Cells, 8(7): 734.
- 7. Rigoglou S., Papavassiliou A.G. (2013) The NF-κB signalling pathway in osteoarthritis. Int. J. Biochem. Cell Biol., 45(11): 2580–2584.
- 8. Tian M., Liu W., Li X. et al. (2021) HIF–1α promotes SARS-CoV-2 infection and aggravates inflammatory responses to COVID-19. Sig. Transduct. Target Ther., 6: 308.
- 9. Marchandot B., Sattler L., Jesel L. et al. (2020) COVID-19 Related Coagulopathy: A Distinct Entity? J. Clin. Med., 9(6): 1651.
- 10. Libby P., Loscalzo J., Ridker P.M. et al. (2018) Inflammation, Immunity, and Infection in Atherothrombosis: JACC Review Topic of the Week. J. Am. Coll. Cardiol., 72: 2071–2081.
- 11. Jackson S.P., Darbousset R., Schoenwaelder S.M. (2019) Thromboinflammation: Challenges of therapeutically targeting coagulation and other host defense mechanisms. Blood, 133: 906–918.
- 12. Lillicrap D. (2020) Disseminated intravascular coagulation in patients with 2019-nCoV pneumonia. J. Thromb. Haemost., 18:786–787.
- 13. Gillot C., Favresse J., Mullier F., Lecompte T. et al. (2021) NETosis and the Immune System in COVID-19: Mechanisms and Potential Treatments. Front. Pharmacol., 12: 708302.
- 14. Kohansal Vajari M., Shirin M., Pourbagheri-Sigaroodi A. et al. (2021) COVID-19–related coagulopathy: A review of pathophysiology and pharmaceutical management. Cell. Biol. Int., 45(9): 1832–1850.
- 15. Henry B.M., Vikse J., Benoit S. et al. (2020). Hyperinflammation and derangement of renin-angiotensin-aldosterone system in COVID-19: A novel hypothesis for clinically suspected hypercoagulopathy and microvascular immunothrombosis. Clin. Chim. Acta, 507: 167–173.
- 16. Helms J., Tacquard C., Severac F. et al. (2020). High risk of thrombosis in patients with severe SARS-CoV-2 infection: a multicenter prospective cohort study. Intensive Care Med., 46(6): 1089–1098.
- 17. Guan W.J., Ni Z.Y., Hu Y. et al. (2020). Clinical Characteristics of Coronavirus Disease 2019 in China. N. Engl. J. Med., 382(18): 1708–1720.
- 18. Lippi G., Plebani M., Henry B.M. (2020). Thrombocytopenia is associated with severe coronavirus disease 2019 (COVID-19) infections: A meta-analysis. Clin. Chim. Acta., 506: 145–148.
- 19. Wang F., Hou H., Luo Y. et al. (2020). The laboratory tests and host immunity of COVID-19 patients with different severity of illness. JCI Insight, 5(10): e137799.
- 20. Zhang L., Yan X., Fan Q. et al. (2020). D-dimer levels on admission to predict in–hospital mortality in patients with COVID-19. J. Thromb. Haemost., 18(6): 1324–1329.
- 21. Huang C., Wang Y., Li X. et al. (2020). Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet, 395(10223): 497–506.
- 22. Lowe G.D., Rumley A., McMahon A.D. et al. (2004). Interleukin-6, fibrin D-dimer, and coagulation factors VII and XIIa in prediction of coronary heart disease. Arterioscler. Thromb. Vasc. Biol., 24(8): 1529–1534.
- 23. Connors J.M., Levy J.H. (2020) Thromboinflammation and the hypercoagulability of COVID-19. J. Thromb. Haemost., 18(7): 1559–1561.
- 24. Robinson W.H., Lepus C.M., Wang Q. et al. (2016) Low-grade inflammation as a key mediator of the pathogenesis of osteoarthritis. Nat. Rev. Rheumatol., 12(10): 580–592.
- 25. Molnar V., Matišić V., Kodvanj I. et al. (2021) Cytokines and Chemokines Involved in Osteoarthritis Pathogenesis. Int. J. Mol. Sci., 22(17): 9208.
- 26. Родичкин П.В., Шаламанов Н.С. (2012) Клиническая фармакология хондропротекторов. Обзоры по клинической фармакологии и лекарственной терапии, 10(3): 18–27.
- 27. Messina O.D., Vidal Wilman M., Vidal Neira L.F. (2019) Nutrition, osteoarthritis and cartilage metabolism. Aging Clin. Exp. Res., 31(6): 807–813.
- 28. Volpi N. (2011) Anti-inflammatory activity of chondroitin sulphate: new functions from an old natural macromolecule. Inflammopharmacology, 19(6): 299–306.
- 29. Сорока М.Ф. (2020). Остеоартрит і коморбідність: особливості лікування хворих на сучасному етапі. Український ревматологічний журнал, (2): 1–10.
- 30. Honvo G., Bruyère O., Geerinck A. et al. (2019) Efficacy of Chondroitin Sulfate in Patients with Knee Osteoarthritis: A Comprehensive Meta-analysis Exploring Inconsistencies in Randomized, Placebo-Controlled Trials. Adv. Ther., 36(5): 1085–1099.
- 31. Honvo G., Reginster J.Y., Rabenda V. et al. (2019) Safety of Symptomatic Slow-Acting Drugs for Osteoarthritis: Outcomes of a Systematic Review and Meta-analysis. Drugs Aging, 36 (Suppl. 1): 65–99.
- 32. Campo G.M., Avenoso A., Campo S. et al. (2008) Purified human plasma glycosaminoglycans reduced NF-kappa B activation, pro-inflammatory cytokine production and apoptosis in LPS-treated chondrocytes. Innate Immun., 14(4): 233–246.
- 33. Stabler T.V., Huang Z., Montell E. et al. (2017) Chondroitin sulphate inhibits NF-κB activity induced by interaction of pathogenic and damage associated molecules. Osteoarthritis Cartilage, 25(1): 166–174.
- 34. Kim B.H., Lee K.H., Chung E.Y. et al. (2006) Inhibitory effect of chroman carboxamide on interleukin-6 expression in response to lipopolysaccharide by preventing nuclear factor–kappaB activation in macrophages. Eur. J. Pharmacol., 543(1–3): 158–165.
- 35. du Souich P., García A.G., Vergés J., Montell E. (2009) Immunomodulatory and anti-inflammatory effects of chondroitin sulphate. J. Cell. Mol. Med., 13(8A): 1451–1463.
- 36.Vallières M., du Souich P. (2010) Modulation of inflammation by chondroitin sulfate. Osteoarthritis Cartilage, 18 (Suppl. 1): S1–S6.
- 37. Yelins’ka A.M., Shvaykovs’ka O.O., Kostenko V.O. (2018) Epigallocatechin-3-gallate prevents disruption of connective tissue in periodontium and salivary glands of rats during systemic inflammation. Wiad. Lek., 71(4): 869–873.
- 38. Гайдукова И.З., Мазуров В.И., Инамова О.В. (2020) Особенности лечения остеоартрита в период коронавирусной инфекции. Opinion Leader. Междисциплинарный подход: ревматология, гастроэнтерология, (9): 24–28.
- 39. Беляева И.Б., Мазуров В.И., Саранцева Л.Е. (2021) Рациональная фармакотерапия коморбидных пациентов с заболеваниями опорно-двигательного аппарата в условиях пандемии COVID-19. Эффективная фармакотерапия, 17(21): 40–46.
- 40. Bruce E., Barlow-Pay F., Short R. et al. (2020) Prior Routine Use of Non-Steroidal Anti-Inflammatory Drugs (NSAIDs) and Important Outcomes in Hospitalised Patients with COVID-19. J. Clin. Med., 9(8): 2586.
- 41. Anyfanti P., Gavriilaki E., Nikolaidou B. et al. (2021) Patients with autoimmune chronic inflammatory diseases present increased biomarkers of thromboinflammation and endothelial dysfunction in the absence of flares and cardiovascular comorbidities. J. Thromb. Thrombolysis, Jul 5. Available from: https://link.springer.com/article/10.1007/s11239–021–02517–0#citeas
- 42. Rojas-Briones V., Harrison-Muñoz S., Irarrázaval S. (2017) Is chondroitin sulfate effective for osteoarthritis? Medwave, 17(Suppl. 2): e6929.
- 43. Valoti E., Miraglia N., Bianchi D. et al. (2014) inventors; Gnosis S.p.A., Desio, assignee. Shark-like chondroitin sulphate and process for the preparation thereof. United States Patent US 8,664,196 B2. Mar. 4.
- 44. Valcarcel J., Novoa-Carballal R., Pérez-Martín R.I. et al. (2017) Glycosaminoglycans from marine sources as therapeutic agents. Biotechnol. Adv., 35(6): 711–725.
- 45. Abdallah M.M., Fernández N., Matias A.A., Bronze M.D.R. (2020) Hyaluronic acid and Chondroitin sulfate from marine and terrestrial sources: Extraction and purification methods. Carbohydr. Polym., 243: 116441.
- 46. Glauser B.F., Pereira M.S., Monteiro R.Q., Mourao P.A. (2008) Serpin-independent anticoagulant activity of a fucosylated chondroitin sulfate. Thromb. Haemost., 100: 420–428.
- 47. Buyue Y., Sheehan J.P. (2009). Fucosylated chondroitin sulfate inhibits plasma thrombin generation via targeting of the factor IXa heparin-binding exosite. Blood, 114: 3092–3100.
- 48. Iqbal O., Plamoottil G., Sadeghi N. et al. (2009) Oversulfated Chondroitin Sulfate Does Not Cause Augmentation in HIT Antibody Mediated Heparin-Induced Platelet Aggregation (HIPA). Blood, 114(22): 2417.
- 49. Bailly J., Haupt L., Joubert J. et al. (2021) Heparin-induced thrombocytopenia: An update for the COVID-19 era. S. Afr. Med. J., 111(9): 841–848.
- 50. Huynh A., Kelton J.G., Arnold D.M. et al. (2021) Antibody epitopes in vaccine-induced immune thrombotic thrombocytopaenia. Nature, 596: 565–569.
- 51. Мамчур В.И., Носивец Д.С. (2018) Фармакологічні властивості і клінічна ефективність препарату Алфлутоп при лікуванні патології опорно-рухового апарату. Травма, 19(1): 34–40.
- 52. Алексеева Л.И., Шарапова Е.П., Таскина Е.А. и др. (2013) Многоцентровое слепое рандомизированное плацебоконтролируемое исследование симптом- и структурно-модифицирующего действия препарата алфлутоп у больных остеоартрозом коленных суставов. Сообщение 1: Оценка симптом-модифицирующего действия препарата. Научно-практическая ревматология, 51(5): 532–538.
- 53. Алексеева Л.И., Шарапова Е.П., Таскина Е.А. и др. (2014) Многоцентровое слепое рандомизированное плацебоконтролируемое исследование симптом- и структурно-модифицирующего действия препарата алфлутоп у больных остеоартрозом коленных суставов. Сообщение 2: Оценка структурномодифицирующего действия препарата. Научно-практическая ревматология, 52(2): 174–177.
- 54. Алексеева Л.И., Таскина Е.А., Лила А.М. и др. (2019) Многоцентровое проспективное рандомизированное исследование эффективности и безопасности препарата Алфлутоп в альтернирующем режиме по сравнению со стандартным режимом. Сообщение 1: Оценка эффективности препарата при различных схемах применения. Современная ревматология, 13(3): 51–59.
- 55. Коршунов Н.И., Марасаев В.В., Баранова Э.Я. и др. (2003) Роль воспаления и оценка хондропротективного действия Алфлутопа у больных с остеоартрозом по данным магнитно-резонансной томографии коленного сустава. Русский медицинский журнал, 11(2): 13–20.
- 56. Пешехонова Л.К., Красюков П.А., Пешехонов Д.В. (2016) Оценка роли алфлутопа в терапии остеоартроза: показания, клиническая эффективность, переносимость и влияние на качество жизни. Медицинский совет, Ревматология, (11): 100–104.
- 57. Каратеев А.Е. (2020) Биоактивный концентрат мелкой морской рыбы: оценка эффективности и безопасности препарата на основании анализа 37 клинических исследований. Современная ревматология, 14(4): 111–124.
- 58. Дроздов В.Н., Ших Е.В., Сереброва С.Ю. и др. (2019) Алфлутоп в современной симптом-модифицирующей терапии остеоартрита. Терапевтический архив, 91(5): 134–140.
- 59. Живолупов С.А., Данилов А.Б., Баранцевич Е.Р. и др. (2020) Эффективность и безопасность применения препарата алфлутоп при лечении болевого синдрома в нижней части спины. Manage Pain, (1): 24–31.
- 60. Опрышко В.И., Носивец Д.С. (2018) Системный обзор международных исследований по применению Алфлутопа в комплексной фармакотерапии болевого синдрома в области спины. Международный неврологический журнал, (1): 64– 69.
- 61. Самарцев И.Н., Живолупов С.А., Баранцевич Е.Р., Данилов А.Б. (2021) Оценка терапевтической эффективности Алфлутопа в комплексном лечении пациентов с хронической болью в нижней части спины. Журнал неврологии и психиатрии имени С.С. Корсакова, 121(2): 24–30.
- 62. Olariu L., Dumitriu B., Buse E., Rosoiu N. (2015). The in vitro effect of Alflutop product on some extracellular signaling factors involved in the osteoarticular pathology inflammation. Analele AOSR, 4(2): 7–18.
- 63. Olariu L., Pyatigorskaya N., Dumitriu B. et al. (2016) «In vitro» chondro-restitutive capacity of Alflutop proved on chondrocytes cultures. Romanian Biotechnological Letters, 22(16): 12047–12053.
- 64. Olariu L., Dumitriu B., Ene D.M. et al. (2017) Alflutop modulates «in vitro» relevant mechanisms of osteoarthritic pathology. Academy of Romanian Scientists, Annals Series on Biological Sciences, 6(1): 100–113.
- 65. Buse E., Dumitriu B., Olariu L. et al. (2018) Cellular and Molecular Activity of a Standartized Small Fish Extract In an Experimental Model of Primary Human Cartilage Cells. Romanian Journal of Rheumatology, 27: 23–31.
- 66. Olariu L., Dumitriu B., Craciun L. et al. (2018) The in vitro influence of a pharmaceutically active small sea fish extract on apoptosis and proliferation mechanisms amplified by inflammatory conditions. Farmacia, 66(3): 524–529.
- 67. Черкасова В.Г., Муравьев С.В., Чайников П.Н. и др. (2019) Особенности патогенетической терапии остеоартроза крупных суставов в клинике спортивной медицины. Гений ортопедии, 25(3): 413–423.
- 68. Lorin J., Zeller M., Guilland J.C. et al. (2014) Arginine and nitric oxide synthase: regulatory mechanisms and cardiovascular aspects. Mol. Nutr. Food Res., 58(1): 101–116.
- 69. Adebayo A., Varzideh F., Wilson S. et al. (2021) L-Arginine and COVID-19: An Update. Nutrients, 13(11): 3951.
- 70. Rees C.A., Rostad C.A., Mantus G. et al. (2021) Altered amino acid profile in patients with SARS-CoV-2 infection. Proc. Natl. Acad. Sci U S A, 118(25): e2101708118.
- 71. Sacchi A., Grassi G., Notari S. et al. (2021) Expansion of Myeloid Derived Suppressor Cells Contributes to Platelet Activation by L-Arginine Deprivation during SARS-CoV-2 Infection. Cells, 10(8): 2111.
- 72. Chen Z., Mondal N.K., Ding J. et al. (2015) Activation and shedding of platelet glycoprotein IIb/IIIa under non–physiological shear stress. Mol. Cell. Biochem., 409(1–2): 93–101.
- 73. Fiorentino G., Coppola A., Izzo R. et al. (2021) Effects of adding L-arginine orally to standard therapy in patients with COVID-19: A randomized, double-blind, placebo-controlled, parallel-group trial. Results of the first interim analysis. EClinicalMedicine, 40:101125.
- 74. Преснякова М.В., Костина О.В., Альбицкая Ж.В. (2019) Биологическая роль цинка и его значимость в патогенезе расстройств аутистического спектра. Социальная и клиническая психиатрия, 29(3): 63–70.
- 75. Pal A., Squitti R., Picozza M. et al. (2021) Zinc and COVID-19: Basis of Current Clinical Trials. Biol. Trace Elem. Res., 199(8): 2882–2892.
- 76. Morgan C.I., Ledford J.R., Zhou P., Page K. (2011) Zinc supplementation alters airway inflammation and airway hyperresponsiveness to a common allergen. J. Inflamm. (Lond.), 8: 36.
- 77. Joachimiak M.P. (2021) Zinc against COVID-19? Symptom surveillance and deficiency risk groups. PLoS Negl. Trop. Dis., 15(1): e0008895.
- 78. Rahman M.T., Idid S.Z. (2021) Can Zn Be a Critical Element in COVID-19 Treatment? Biol. Trace Elem. Res., 199(2): 550–558.
- 79. Finzi E. et al. (2020) Treatment of SARS-CoV-2 with high dose oral zinc salts: A report on four patients. Int. J. Infect. Dis., 99: 307–309.
- 80. Skalny A.V., Rink L., Ajsuvakova O.P. et al. (2020) Zinc and respiratory tract infections: Perspectives for COVID‑19 (Review). Int. J. Mol. Med., 46(1): 17–26.
ФАРМАКОТЕРАПИЯ ЗАБОЛЕВАНИЙ ОПОРНО-ДВИГАТЕЛЬНОГО АППАРАТА У ПАЦИЕНТОВ С РИСКОМ COVID-19-АССОЦИИРОВАННОГО ТРОМБОВОСПАЛЕНИЯ
¹Запорожский государственный медицинский университет
²Клиническая больница «Феофания» Государственного управления делами
³Полтавский государственный медицинский университет
Резюме. В статье обсуждается способность хондроитин сульфатов (ХС), кроме улучшения структуры и функции хрящевой и костной ткани, снижать активацию ядерного фактора капа B (NF-κB), провоспалительную гиперцитокинемию, уровень C-реактивного белка, положительно влиять на гемокоагуляцию. Обоснованы преимущества стандартизированного биоактивного экстракта мелкой морской рыбы (Алфлутопа) как препарата выбора в фармакотерапии заболеваний опорно-двигательного аппарата у пациентов с риском COVID-19-ассоциированного тромбовоспаления. Подчеркнута его способность корректировать тромбовоспаление благодаря угнетению NF-κB-опосредованного «цитокинового шторма». Акцентировано внимание на положительном действии препарата на параметры гемокоагуляции и его низкую иммуногенность. Обсуждается фармакотерапевтическое значение компонентов Алфлутопа, в частности, физико-химических особенностей ХС, наличия определенных аминокислот (L-аргинина) и минералов (соединений цинка) при его использовании в условиях пандемии COVID-19.
Ключевые слова: COVID-19, тромбовоспаление, заболевания опорно-двигательного аппарата, хондроитина сульфат, стандартизированный биоактивный экстракт мелкой морской рыбы.

Leave a comment