Неконтрольована подагра як можлива причина коморбідності та ризик тяжкого перебігу COVID-19
Резюме. Вступ. Незважаючи на поширеність коморбідної патології при подагрі, інформація щодо ведення пацієнтів даної когорти при коронавірусній хворобі 2019 (COVID-19) недостатньо висвітлюється у провідних ревматологічних наукових публікаціях. Мета дослідження. Визначити фактори несприятливого перебігу подагри, порівняти поширеність коморбідної патології та її терапії у пацієнтів з контрольованою та неконтрольованою подагрою, проаналізувати зв’язок сироваткового рівня сечової кислоти (СК) із тяжкістю перебігу COVID-19. Матеріали і методи. Обстежено 136 чоловіків з подагрою. Залежно від сироваткового рівня СК їх розподілено на дві групи: контрольована (СК <360 мкмоль/л) та неконтрольована подагра (СК ≥360 мкмоль/л). Між двома вибірками визначали відмінності у клінічному перебігу подагри, її менеджменті, поширеності та веденні коморбідної патології. Для оцінки впливу урикемії на тяжкість перебігу COVID-19 у групі з неконтрольованою подагрою ми виділили ще 3 підгрупи за рівнем СК: 360–479, 480–599 та ≥600 мкмоль/л. Результати. У пацієнтів з неконтрольованою подагрою (77,9%) виявлено достовірно вищі показники кількості гострих спалахів подагри за останній рік (р<0,001), активності подагри (р<0,001), а також нижчі значення рівня фізичного функціонування (р<0,001), частоти контролю сироваткового рівня СК за останній рік (р<0,001) та прийому уратзнижувальної терапії (р<0,001) порівняно з групою із цільовим рівнем СК. Поширеність дисліпідемії (р<0,001), ожиріння (р<0,001), цукрового діабету (р=0,005), артеріальної гіпертензії (р=0,03), уражень шлунково-кишкового тракту (р=0,003), хронічної хвороби нирок 3–4-ї категорії (р=0,004), нефролітіазу (р=0,02), як і кількість лікарських препаратів для терапії коморбідної патології на тривалий прийом (4 (2–6) проти 1 (0–3), р<0,001) була вищою у групі з неконтрольованою подагрою при зіставленні з групою із СК<360 мкмоль/л. Вищий сироватковий рівень СК є предиктором тяжчого перебігу COVID-19 у пацієнтів з подагрою (χ2=37,154; р<0,001). Висновки. У групі з неконтрольованою подагрою констатовано вищу поширеність коморбідних станів, що суттєво збільшує потребу у використанні лікарських засобів для цієї когорти. Більш тяжкий перебіг COVID-19 асоціювався з вищим рівнем урикемії.
DOI: 10.32471/rheumatology.2707-6970.87.16902
УДК 616.72-002.78:616.98:578.834.1]-06
ВСТУП
Тягар подагри є значним, адже епідеміологічні дані свідчать про те, що поширеність та захворюваність на подагру різко зростає у всьому світі [8]. Вчені з Данії повідомили, що поширеність подагри підвищилася майже на 130%, а річний показник захворюваності — на 80% у період з 1995 до 2015 р. [40].
Слід зазначити, що подагра — це не лише гострий перехідний артрит, а хронічне системне запальне захворювання із широкою платформою для коморбідності [29], яка може поставити під загрозу стратегії лікування до досягнення цілі, знизити якість життя або бути предиктором передчасної смерті [1, 22]. Зростання поширеності та захворюваності на подагру протягом останніх десятиліть пов’язане зі зростаючими тенденціями у виникненні коморбідних та супутніх хвороб [10].
Дослідження глобального тягаря захворювань, травм та факторів ризику 2017 р. (Global Burden of Diseases, Injuries, and Risk Factors Study 2017) виявило, що серед коморбідних хвороб, часто асоційованих з подагрою, у період з 2007 до 2017 р. відмічали значне підвищення рівня інвалідності з приводу інсульту (на 43,6%), хронічної хвороби нирок (ХХН) (на 24,4%), ішемічної хвороби серця (ІХС) (на 23,5%), цукрового діабету (ЦД) (на 30,1%), панкреатиту (на 26,6%), гастриту та дуоденіту (на 18,2%). Втрата працездатності з приводу подагри підвищилася на 30,9%, а серед захворювань опорно-рухового апарату поступалася лише ревматоїдному артриту (33,5%) та остеоартриту (31,4%) у вищезазначений період [12].
Коморбідна патологія суттєво збільшує потребу у стаціонарній допомозі з приводу подагри. Так, серед госпіталізацій в Австралії та Новій Зеландії подагра була основною причиною госпіталізації лише в 36,5% випадків. Більшість із них (63,5%) були ускладнені серцево-судинними захворюваннями, інфекціями, інсультом, аритмією та ЦД [31].
Існують складні взаємозв’язки між подагрою та коморбідними захворюваннями. Гіперурикемія є прогностичним фактором розвитку артеріальної гіпертензії (АГ), метаболічного синдрому, ЦД 2-го типу, ІХС, гіпертрофії лівого шлуночка, фібриляції передсердь, інфаркту міокарда, інсульту, серцевої недостатності та ХХН [4].
Однак відмінності між контрольованою та неконтрольованою подагрою недостатньо добре відомі, особливо у контексті тяжкості перебігу COVID-19. Загальновизнано, що деякі з цих коморбідних станів, такі як АГ, ЦД, хронічне обструктивне захворювання легень (ХОЗЛ), серцево-судинні та цереброваскулярні захворювання, а також вік та чоловіча стать є основними факторами ризику для тяжчого клінічного перебігу коронавірусної хвороби 2019 (COVID-19) та летальності [13, 34].
Як відомо, гіперурикемія асоціюється з гіпоксією, системним запаленням, частим загостренням, тяжкістю та ускладненнями при ХОЗЛ [3, 16, 17], але зв’язок між сироватковим рівнем сечової кислоти (СК) та тяжкістю перебігу COVID-19 у пацієнтів з подагрою так і не встановлений.
З огляду на вищезазначене, метою дослідження було розширити обмежені дані щодо причин та наслідків недосягнення цільового сироваткового рівня СК, порівняти поширеність коморбідної патології та її терапії у пацієнтів з контрольованою та неконтрольованою подагрою, проаналізувати зв’язок сироваткового рівня СК з тяжкістю перебігу COVID-19.
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
До одноцентрового тривалого дослідження, яке проводили у ревматологічному відділенні комунального некомерційного підприємства «Тернопільська обласна клінічна лікарня» Тернопільської обласної ради у період з 2018 по 2022 р., включили 136 пацієнтів із подагрою.
У ході роботи дотримувалися основних положень Гельсінської декларації Всесвітньої медичної асоціації «Етичні принципи проведення наукових медичних досліджень за участю людини» (1964–2008 рр.), міжнародних етичних та наукових стандартів належної клінічної практики (GCP, 1996 р.). Це дослідження схвалено комітетом з етики людини Тернопільського національного медичного університету імені І.Я. Горбачевського МОЗ України (протокол № 54 від 27 серпня 2019 р.). Усі пацієнти підписали інформовану згоду на включення у дослідження.
Критеріями залучення пацієнтів у дослідження були вік 38–65 років, тривалість подагри 3 і більше років, отримання інформованої згоди. Критеріями невключення хворих у дослідження були жіноча стать, асимптоматична гіперурикемія, супутні захворювання у стадії декомпенсації, псоріаз, ХХН V ступеня, онкологічні хвороби.
Діагноз подагри встановлювали згідно з класифікаційними критеріями Американського коледжу ревматології (American College of Rheumatology — ACR) та Європейської ліги проти ревматизму (нині — Європейський альянс асоціацій ревматологів, European Alliance of Associations for Rheumatology — EULAR) 2015 р. [23].
Клінічна оцінка стану пацієнта включала попередній катанамнез, фізикальний огляд, лабораторне та інструментальне обстеження. Коморбідні захворювання верифікували згідно з (1) попередніми медичними записами або (2) консультативними висновками суміжних спеціалістів у КНП «Тернопільська обласна клінічна лікарня» Тернопільської обласної ради, або (3) ліпідним профілем.
Загальну оцінку стану здоров’я пацієнта за останній тиждень проводили за 10-бальною шкалою Patient Global Assesment (PGA) згідно з відповіддю на таке запитання: «Якщо враховувати вплив артриту на всі аспекти вашої діяльності, як ви почувалися протягом останнього тижня?» (1 — дуже добре, 10 — дуже погано) [24]. Для визначення функціонального статусу користувалися опитувальником стану здоров’я — Health Assessment Questionnaire Disability Index (HAQ-DI), що складається з 20 запитань щодо активності пацієнта у повсякденному житті [5]. Для аналізу активності подагри використовували валідовану з українським перекладом шкалу активності подагри Gout Activity Score (GAS 3-step-c) [2]. За рекомендаціями Всесвітньої організації охорони здоров’я ожиріння діагностували за показником індексу маси тіла (ІМТ) [38]. Функцію нирок оцінювали відповідно до розрахункової швидкості клубочкової фільтрації (рШКФ), яку обчислювали за допомогою рівняння Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) з використанням сироваткового рівня креатиніну й онлайн-калькулятора (qxmd.com/calculate/calculator_251/egfr-using-ckd-epi) [19, 33].
З метою визначення причин та наслідків нетаргетного лікування подагри ми провели поділ нашої вибірки на дві групи: контрольована (сироватковий рівень СК <360 мкмоль/л) та неконтрольована подагра (СК ≥360 мкмоль/л). Оцінювали статистичні відмінності демографічних, клініко-анамнестичних, лабораторних даних, а також попереднього менеджменту подагри за останні 6 міс, поширеності та актуального лікування коморбідних станів у двох групах. Щоб проаналізувати поширеність коморбідних захворювань та тяжкість перебігу COVID-19 у групі з неконтрольованою подагрою, ми додатково виділили такі її підгрупи за рівнем СК у крові: 360–479 мкмоль/л, 480–599 мкмоль/л та ≥600 мкмоль/л. При розподілі на підгрупи керувалися класифікаційними критеріями подагри ACR/EULAR 2015 р. [23].
При повторному візиті до ревматолога проаналізовано вищезгадану когорту щодо факту інфікування коронавірусом-2, що спричиняє тяжкий гострий респіраторний синдром (SARS-CoV-2), а також тяжкість перебігу COVID-19 залежно від рівня СК (у період з 1 березня 2020 до 30 січня 2022 р.). Діагноз COVID-19 підтверджений позитивною полімеразною ланцюговою реакцією зі зворотною транскрипцією на назофарингеальних або орофарингеальних зразках. Тяжкість перебігу COVID-19 визначали згідно з настановами Всесвітньої організації охорони здоров’я та наказом Міністерства охорони здоров’я України «Про затвердження протоколу «Надання медичної допомоги для лікування COVID-19» від 02.04.2020 р. № 762 зі змінами і доповненнями у період від 10.04.2020 до 13.05.2021 р. [37].
Статистичну обробку отриманих результатів здійснено за допомогою «STATISTICA 10.0» (StatSoft. Inc.) і табличного редактора Microsoft Excel 2016. Кількісні дані у випадку правильного розподілу ознак подавали у вигляді середнього значення (М) та його довірчих інтервалів (95% ДІ), у випадку неправильного розподілу — як медіана (Ме) та міжквартильний розмах (25-й–75-й перцентилі) (Ме (IQR)). Статистичні відмінності кількісних ознак з нормальним розподілом визначали за критерієм Стьюдента, а з ненормальним розподілом — за критерієм Манна — Уїтні для двох непов’язаних вибірок. Порівняння категорійних показників між групами проводилося з використанням критерію Хі-квадрат (χ2) Пірсона, а при значеннях менше 5 з частотою більше 20% — точного критерію Фішера. Значення р<0,05 вважали статистично значущим.
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ
У дослідження включено 136 хворих з подагрою чоловічої статі (табл. 1). Середній вік (М (95% ДІ)) цих пацієнтів становив 50,49 (49,41–51,58) року з тривалістю недуги 8,5 (5–15) року. Встановлено, що більшість пацієнтів на період пандемії (77,94%) не досягли цільового сироваткового рівня СК.
Таблиця 1. Характеристика обстежених пацієнтів із подагрою
| Показник | Показники у всій когорті
(n=136) |
Контрольована подагра
(n=30) |
Неконтрольована подагра
(n=106) |
p |
|---|---|---|---|---|
| Вік, років, М (95% ДІ) | 50,49 (49,41–51,58) | 48,33 (46,15–50,52) | 51,1 (49,86–52,34) | 0,03 |
|
Працевлаштування, n (%) Адміністративно-розумова робота Працює Не працює |
28 (20,59)
25 (18,38) 83 (61,03) |
7 (23,33)
6 (20) 17 (56,67) |
21 (19,81))
19 (17,92) 66 (62,27) |
0,85 |
|
Місце проживання, n (%) Місто Село |
77 (56,62)
59 (43,38) |
19 (63,33)
11 (36,67) |
58 (54,72)
48 (45,28) |
0,4 |
|
Тютюнокуріння, n (%) Не курить Курить Кинув |
64 (47,06)
31 (22,79) 41 (30,15) |
17 (56,67)
1 (3,33) 12 (40) |
47 (44,34)
30 (28,3) 29 (27,36) |
0,015 |
| Тривалість захворювання, років, Ме (IQR) | 8,5 (5–15) | 6,5 (4–14) | 9,0 (5–15) | 0,14 |
| Вік дебюту подагри, років, Ме (IQR) | 40 (36–45) | 40 (35–42) | 40 (36–46) | 0,37 |
|
Клінічна стадія подагри, n (%) Гостра Інтермітуюча Хронічна |
25 (18,38)
11 (8,09) 100 (73,53) |
10 (33,33)
11 (36,67) 9 (30) |
15 (14,15)
0 (0) 91 (85,85) |
<0,001 |
| Кількість загострень подагри за останній рік, Ме (IQR) | 4 (1,5–6,0) | 1 (0–1) | 5 (3–6) | <0,001 |
| Кількість уражених суглобів, Ме (IQR) | 8 (4–11) | 2 (1–3) | 9 (7–12) | <0,001 |
| PGA, бали, Ме (IQR) | 5 (3–7) | 2 (2–3) | 6 (4–7) | <0,001 |
| Наявність тофусів, n (%) | 53 (38,97) | 0 (0) | 53 (50) | <0,001 |
| Кількість тофусів, Ме (IQR) | 0 (0–14) | 0 (0–0) | 2 (0–18) | <0,001 |
| Шкала активності подагри (GAS), Ме (IQR) | 4,86 (4,02–7,34) | 3,2 (3–3,54) | 5,73 (4,56–7,55) | <0,001 |
| HAQ-DI, Ме (IQR) | 0,63 (0,38–1) | 0,25 (0,25—0,5) | 0,75 (0,5—1) | <0,001 |
| Сироватковий рівень СК, мкмоль/л, Ме(IQR) | 488 (399,5–545) | 340 (301–351) | 510,5 (468–557) | <0,001 |
| Частота контролю сироваткового рівня СК за останній рік, Ме (IQR) | 1 (0–1) | 2 (1–2) | 1 (0–1) | <0,001 |
| Екскреція СК із сечею, ммоль/24 год, Ме (IQR) | 2,95 (1,94–3,6) | 2,96 (2,45–3,08) | 2,92 (1,8–3,7) | 0,92 |
| рШКФ, мл/хв/1,73 м2, Ме (IQR) | 94 (79–106) | 105 (96–110) | 87,5 (72–105) | <0,001 |
| ІМТ, кг/м2, Ме (IQR) | 31,45 (28,35–35,4) | 28,4 (27,3–31,9) | 31,99 (30–35,8) | <0,001 |
При аналізі даних (див. табл. 1) у двох порівнювальних групах виявлено, що у пацієнтів з неконтрольованою подагрою достовірно вищі показники віку (р=0,03), кількості гострих спалахів подагри за останній рік (р<0,001), уражених суглобів (р<0,001), тофусів (р<0,001), активності подагри (р<0,001), ІМТ (р=0,001), а також нижчі значення частоти контролю сироваткового рівня СК за останній рік (р<0,001), рівня фізичного функціонування (р<0,001) та рШКФ (р<0,001). Слід зазначити, що статус тютюнокуріння (р=0,01) та клінічна стадія подагри (р<0,001) також асоціювалися з недосягненням цільового рівня СК.
Порівнювальні вибірки не відрізнялися за працевлаштуванням (р=0,85), місцем проживання (р=0,4) та добовою екскрецією СК (р=0,92).
Щодо попереднього менеджменту подагри протягом останніх 6 міс до госпіталізації у ревматологічне відділення (табл. 2) встановлено, що уратзнижувальну терапію (УЗТ) отримували 66,9% хворих з подагрою, але лише 22,06% досягли цільового сироваткового рівня СК.
Таблиця 2. Амбулаторне лікування подагри протягом останніх 6 міс у пацієнтів із подагрою
| Фармакологічна група, препарати | Показники у всій когорті
(n=136) |
Контрольована подагра
(n=30) |
Неконтрольована подагра
(n=106) |
р |
|---|---|---|---|---|
| Уратзнижувальна терапія, n (%) | 91 (66,91) | 29 (96,67) | 62 (58,49) | <0,001 |
| Алопуринол, n (%) | 57 (41,91) | 9 (30) | 48 (45,28) | 0,13 |
| Алопуринол, мг/добу, Ме (IQR) | 300 (200—300) | 300 (300—400) | 200 (200—300) | <0,001 |
| Фебуксостат, n (%) | 34 (25) | 20 (66,67) | 14 (13,21) | <0,001 |
| Фебуксостат, мг/добу, Ме (IQR) | 40 (40—80) | 80 (40—80) | 40 (40—40) | 0,02 |
| Кортикостероїди, n (%) | 51 (37,5) | 3 (10) | 48 (45,3) | <0,001 |
| НПЗП, n (%) | 85 (62,5) | 12 (40) | 73 (68,87) | 0,004 |
| Колхіцин, n (%) | 25 (18,38) | 5 (16,67) | 20 (18,9) | 0,78 |
| Монотерапія протизапальними та знеболювальними засобами, n (%) | 87 (63,97) | 16 (53,33) | 71 (66,98) | 0,17 |
| Комбінована терапія протизапальними та знеболювальними засобами, n (%) | 36 (26,47) | 2 (6,67) | 34 (32,07) | 0,005 |
Переважна більшість пацієнтів отримували алопуринол у дозі ≤300 мг/добу та фебуксостат ≤40 мг/добу (рис. 1, 2). Контроль сироваткового рівня СК проводили в середньому 1 раз на рік.
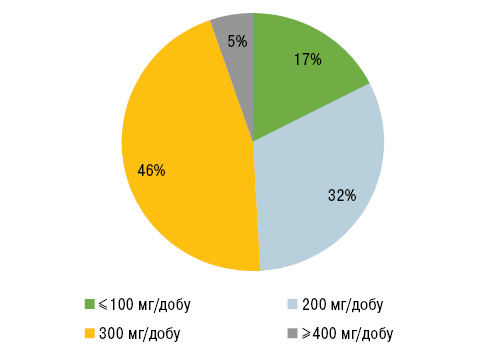
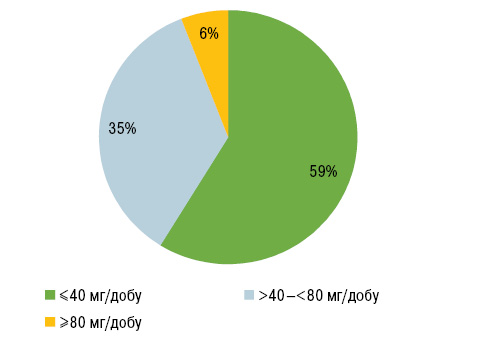
Показник УЗТ був статично значуще вищим у когорті з цільовим значенням СК порівняно з групою із СК ≥360 мкмоль/л (96,67% проти 58,49% відповідно, р<0,001), як і добові дози алопуринолу (р=0,001) та фебуксостату (р=0,02).
Пацієнти з неконтрольованою подагрою потребували частішого прийому симптоматичного лікування: кортикостероїдів (р<0,001), нестероїдних протизапальних препаратів (НПЗП) (р=0,005), а також комбінованого прийому знеболювальних та протизапальних препаратів (р=0,005) на амбулаторному етапі.
Констатована висока поширеність коморбідної патології у нашій когорті (табл. 3, рис. 3).
Таблиця 3. Поширеність коморбідної патології залежно від рівня урикемії у пацієнтів з подагрою
| Коморбідні захворювання | Показники у всій когорті
(n=136), n (%) |
Контрольована подагра
(n=30), n (%) |
Неконтрольована подагра
(n=106), n (%) |
p |
|---|---|---|---|---|
| Артеріальна гіпертензія | 102 (75) | 16 (53,33) | 86 (81,13) | 0,03 |
| Дисліпідемія | 92 (67,65) | 12 (40) | 80 (75,47) | <0,001 |
| Гіпертригліцеридемія | 74 (54,41) | 8 (26,67) | 66 (62,26) | 0,007 |
| Ожиріння (ІМТ>30 кг/м2) | 92 (67,65) | 12 (40) | 80 (75,47) | <0,001 |
| Коронарні захворювання | 20 (14,71) | 2 (6,67) | 18 (16,98) | 0,24 |
| Інфаркт міокарда | 13 (9,56) | 1 (3,33) | 12 (11,32) | 0,3 |
| Хронічна серцева недостатність | 21 (15,44) | 1 (3,33) | 20 (18,87) | 0,04 |
| Аритмія | 22 (16,18) | 3 (10) | 19 (17,92) | 0,4 |
| Інсульт/транзиторна ішемічна атака | 7 (5,15) | 0 (0) | 7 (6,60) | 0,34 |
| Периферичні захворювання артерій | 6 (4,41) | 0 (0) | 6 (5,66) | 0.34 |
| Цукровий діабет | 36 (26,47) | 2 (6,67) | 34 (32,08) | 0,005 |
| Будь-яке ураження шлунково-кишкового тракту | 60 (44,1) | 6 (20) | 54 (50,94) | 0.003 |
| Гастрит/дуоденіт | 34 (25) | 3 (10) | 31 (29,24) | 0,03 |
| Пептична виразка | 14 (10,29) | 1 (3,33) | 13 (12,26) | 0,3 |
| Неалкогольна жирова хвороба печінки | 38 (27,94) | 3 (10) | 35 (33,02) | 0,01 |
| Криптогенний гепатит | 9 (6,62) | 2 (6,67) | 7 (6,6) | 1,0 |
| Калькульозний холецистит | 15 (11,03) | 2 (6,67) | 13 (12,26) | 0,52 |
| Хронічний панкреатит | 18 (13,24) | 3 (10) | 15 (14,15) | 0,76 |
| Нефролітіаз | 37 (27,21) | 3 (10) | 34 (32,08) | 0,02 |
|
ХХН 1-ї категорії (ШКФ ≥90) ХХН 2-ї категорії (ШКФ 60–<90) ХХН 3–4-ї категорії (ШКФ 30–<60) |
79 (58,09)
35 (25,74) 22 (16,18) |
28 (93,33)
2 (6,67) 0 |
51 (48,11)
33 (31,13) 22 (20,75) |
<0,001
0,008 0.004 |
| Доброякісна гіперплазія передміхурової залози | 31 (22,79) | 3 (10) | 28 (26,42) | 0,08 |
| Хронічне обструктивне захворювання легень | 10 (7,35) | 0 | 10 (9,43) | 0,12 |
| Депресія | 15 (11,03) | 0 | 15 (14,15) | 0,04 |
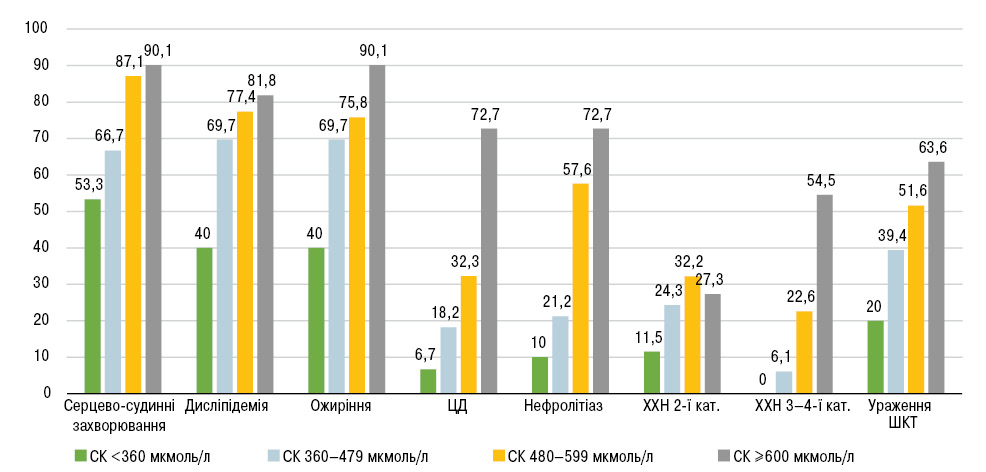
Слід підкреслити, що у 85,29% пацієнтів діагностовано ≥1 коморбідне захворювання. У хворих із нетаргетним рівнем СК виявлена вища поширеність коморбідних хвороб (див. табл. 3), при зіставленні з групою з цільовим рівнем СК у крові.
Враховуючи вищезазначене, неконтрольована подагра потребувала і ширшого призначення медикаментозного лікування коморбідних захворювань (табл. 4), а саме: блокаторів рецепторів ангіотензину II (р=0,009), блокаторів кальцієвих каналів (р<0,001), діуретиків (р=0,008), антиагрегантів (р=0,002), ліпідознижувальних (р<0,001), пероральних цукрознижувальних (р=0,005) засобів, лужного цитрату (р=0,01). Також підкреслимо, що у цій групі ведення АГ асоціювалося з частішим призначенням комбінованої антигіпертензивної терапії (р<0,001).
Таблиця 4. Терапія коморбідних захворювань у пацієнтів з подагрою
| Фармакологічна група, лікарський препарат | Показники у всій когорті
(n=136) |
Контрольована подагра
(n=30) |
Неконтрольована подагра
(n=106) |
p |
|---|---|---|---|---|
| Кількість препаратів для лікування коморбідних станів у підсумку, Ме (IQR) | 4 (2–7) | 1 (0–3) | 4,5 (2–7) | <0,001 |
| Кількість препаратів для лікування коморбідних станів на тривалий прийом, Ме (IQR) | 3 (1–6) | 1 (0–3) | 4 (2–6) | <0,001 |
| Інгібітори ангіотензинперетворювального ферменту, n (%) | 42 (30,88) | 9 (30) | 33 (31,13) | 0,4 |
| Блокатори рецепторів ангіотензину II, n (%) | 60 (44,12) | 7 (23,33) | 53 (50) | 0,009 |
| Блокатори кальцієвих каналів, n (%) | 59 (43,38) | 5 (16,67) | 54 (50,94) | <0,001 |
| Агоністи імідазолінових рецепторів, n (%) | 4 (2,94) | 0 | 4 (3,77) | 0,57 |
| Діуретики, n (%) | 34 (25) | 2 (6,67) | 32 (30,19) | 0,008 |
|
Лікування АГ (n=102) Монотерапія, n (%) Комбінована терапія |
40 (39,22)
62 (60,78) |
12 (75)
4 (25) |
28 (32,56)
58 (67,44) |
<0,001 |
| Блокатори β-адренорецепторів, n (%) | 38 (27,94) | 3 (10) | 35 (33,02) | 0,01 |
| Антиангінальні засоби, n (%) | 20 (14,71) | 2 (6,67) | 18 (16,98) | 0,24 |
| Антиагреганти, n (%) | 66 (48,53) | 7 (23,33) | 59 (55,66) | 0,002 |
| Антикоагулянти, n (%) | 4 (2,94) | 1 (3,33) | 3 (2,83) | 1,0 |
| Ліпідознижувальні препарати, n (%) | 83 (61,03) | 9 (30) | 74 (69,81) | <0,001 |
| Пероральні цукрознижувальні препарати, n (%) | 36 (26,47) | 2 (6,67) | 34 (32,08) | 0,005 |
| Інгібітори протонної помпи, n (%) | 39 (28,68) | 6 (20) | 33 (31,13) | 0,23 |
| Панкреатичні ферменти, n (%) | 18 (13,24) | 3 (10) | 15 (14,15) | 0,76 |
| Урсодезоксихолева кислота, n (%) | 15 (11,03) | 2 (6,67) | 13 (12,26) | 0,52 |
| Інгаляційні β2-адреноміметики, n (%) | 10 (7,35) | 0 (0) | 10 (9,43) | 0,1 |
| Лужний цитрат, n (%) | 31 (22,79) | 2 (6,67) | 29 (27,36) | 0,01 |
У підсумку кількість препаратів для терапії коморбідних станів була також вищою у категорії хворих з СК ≥360 мкмоль/л порівняно з другою групою (4,5 (2–7) проти 1 (0–3), р<0,001). Проаналізувавши cумарну кількість препаратів для ведення коморбідної патології на тривалий прийом (антигіпертензивні, діуретики, блокатори β-адренорецепторів, антиангінальні препарати, антиагреганти, антикоагулянти, ліпідознижувальні, перероральні цукрознижувальні засоби та інгаляційні β2-адреноміметики), їх кількість також була достовірно більшою у групі неконтрольованої подагри (4 (2–6) проти 1 (0–3), р<0,001).
За даними катанамнезу встановлено, що 84 (61,76%) пацієнти з подагрою перенесли COVID-19. У більшості хворих з подагрою (40,48%) відмічали середній ступінь тяжкості COVID-19, у кожного третього (28,57%) — легкий перебіг, у кожного п’ятого (21,43%) — тяжкий перебіг, а у 9,52% — критичний перебіг (у період з 1 березня 2020 р. до 30 січня 2022 р.). Тяжчий перебіг COVID-19 асоціювався з вищим рівнем урикемії (χ2=37,154; р=0,00002) (рис. 4).
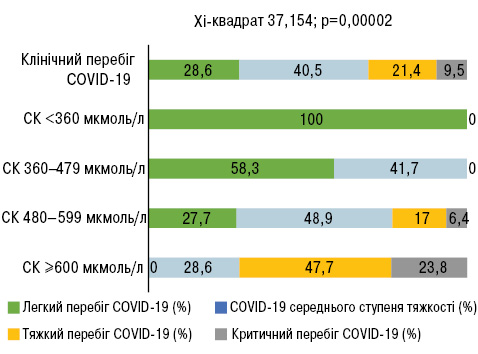
ОБГОВОРЕННЯ
Досягнення у діагностиці та лікуванні подагри набули форми постійного прогресу. Ми маємо більш складні методи діагностики та ширший спектр терапевтичних засобів у лікуванні подагри. Існують чіткі, але іноді суперечливі настанови щодо менеджменту подагри та коморбідних станів від багатьох професійних організацій (2020 ACR, 2016 EULAR, Французького товариства ревматологів 2020 р.), але подагра залишається недостатньо керованою хворобою.
Отримані нами дані свідчать про неоптимальне ведення подагри, адже більша половина хворих (66,9%) отримували УЗТ, але кожен п’ятий пацієнт (22,06%) досяг цільового сироваткового рівня СК. Результати проведеного дослідження узгоджуються з висновками дослідників з різних країн. У Японії 80,7% пацієнтів з подагрою отримували УЗТ, з яких менше половини досягали СК <360 мкмоль/л [18]. А у Філіппінах лише 36,2% досягали цільового сироваткового рівня СК [27]. Попередні дослідження продемонстрували, що 45,9% пацієнтів з подагрою не досягають цільового значення СК, отримуючи алопуринол у дозі <300 мг/добу [36]. Для цих пацієнтів ACR 2020 та 2016 EULAR рекомендують стратегію підвищення дози для досягнення цільової урикемії. Так, лікування алопуринолом у дозі 400 (100–700) мг/добу дає змогу отримати 92% успішності у досягненні сироваткового рівня СК <360 мкмоль/л [30]. Результати нашого дослідження підтверджують, що пацієнти з рівнем СК ≥360 мкмоль/л мають і підвищену частоту спалахів подагри [21].
Частота контролю рівня СК та добова доза алопуринолу або фебуксостату залишається низькою у нашій когорті. N.L. Edwards та співавтори (2020 р.) виявили, що тест на вміст уратів у сироватці крові проводили приблизно один раз на рік для пацієнтів із хронічною тофусною подагрою та рідше одного разу на рік — для пацієнтів з гострою або хронічною нетофусною подагрою [9].
Відмінності в застосуванні ліків між двома групами були помітними. Частіше застосування знеболювальних та протизапальних препаратів може відображати як клінічну інерцію з боку лікаря щодо призначення та титрування УЗТ [26], так і низьку прихильність пацієнта до УЗТ, яка, за даними літератури, є низькою у клінічній практиці (у межах 17–83,5%) [39]. Ми підтвердили значно вищі показники призначення препаратів для лікування коморбідних захворювань у групі з неконтрольованою подагрою порівняно з когортою з рівнем СК <360 мкмоль/л [11].
Не лише подагра зумовлює розвиток коморбідних захворювань, але й кращий контроль подагри може знизити поширеність чи ступінь тяжкості деяких коморбідних станів. УЗТ та протизапальні засоби, що застосовуються для лікування подагри, можуть знижувати частоту серцево-судинних захворювань за рахунок зменшення вираженості системного запалення, дисфункції ендотелію та утворення окиснювальних речовин через шляхи, залежні чи не залежні від гіперурикемії [14]. Відомо, що прийом колхіцину зменшує поширеність інфаркту міокарда [7], а прийом алопуринолу до 2 років асоціюється із зниженням ризику розвитку інсульту на 12%, а більше 2 років — на 21% [32]. У метааналізі впливу алопуринолу на артеріальний тиск виявлено, що він знижує як систолічний, так і діастолічний артеріальний тиск у пацієнтів з гіперурикемією [28]. В іншому дослідженні досягнення цільової концентрації СК <6 мг/дл знизило ризик прогресування захворювання нирок на 37% [20]. Саме тому СК може бути модифікуючим фактором ризику розвитку та прогресування коморбідних захворювань.
Результати нашого дослідження у контексті перебігу COVID-19 у пацієнтів з ≥1 коморбідним станом узгоджуються з висновками A. Osibogun та співавторів (2021) [25]. Так, близько половини пацієнтів мали перебіг середньої тяжкості (40,5% проти 43,5%), а кожен третій — легкої (28,6% проти 36,8%). Звертаємо увагу, що тяжкий (21,4% проти 13,2%) та критичний перебіг коронавірусної інфекції (9,5% проти 6,5%) верифікували частіше у пацієнтів з подагрою, ніж у загальній популяції з ≥1 коморбідною патологією [25].
Інше дослідження показало, що зв’язок між урикемією та негативним наслідком COVID-19 для госпіталізованих пацієнтів був U-подібним у загальній популяції. Так, значення СК ≥423 мкмоль/л та СК ≤278 мкмоль/л асоціюється з підвищеним ризиком госпіталізації у відділення інтенсивної терапії, штучної вентиляції легень та смертності [6]. Нові дані свідчать про те, що урати активують різні прозапальні шляхи [15]. Іншими авторами наголошується, що високий рівень СК також виявлений і у дітей з тяжким перебігом COVID-19 [35]. Ймовірно, що ми виявили явище, яке відображає складну взаємодію між СК та тяжкістю перебігу COVID-19.
Обмеження нашого дослідження заслуговують на коментар. По-перше, ми обстежили малу когорту хворих (n=136). По-друге, пацієнти на момент включення у дослідження проходили стаціонарне лікування у ревматологічному відділенні КНП «Тернопільська обласна клінічна лікарня» Тернопільської обласної ради. Саме тому наша вибірка представляє тяжку форму захворювання на подагру. Отже, результати можуть бути неузагальненими для всіх пацієнтів із подагрою.
ВИСНОВКИ
1. Констатована висока поширеність коморбідної патології у пацієнтів із подагрою, адже у 85,3% випадків вибірки верифіковано ≥1 коморбідне захворювання.
2. Встановлено, що більшість пацієнтів на період пандемії (77,9%) не досягли цільового сироваткового рівня СК. Частота контролю рівня СК (у середньому 1 раз на рік) залишається низькою у пацієнтів із подагрою. У групі з неконтрольованою подагрою виявлено вищу поширеність коморбідної патології та частіше застосування лікарських засобів.
3. Більш тяжкий перебіг COVID-19 асоціювався з вищим сироватковим рівнем СК.
Ці результати свідчать про те, що слід акцентувати увагу на таргетному веденні подагри, особливо у контексті сучасної пандемії.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- 1. Коваленко В.М., Борткевич О.П. (2019) Коморбідність: визначення, можливі напрямки діагностики та лікування. Укр. ревматол. журн., 77(3): 33–44.
- 2. Орлова І.В. (2018) Вплив активності захворювання на якість життя хворих на подагру. Укр. журн. медиц., біол. та спорту, том 3, 14(5): 127–131. doi:10.26693/jmbs03.05.127.
- 3. Bartziokas K., Papaioannou A.I., Loukides S. et al. (2014) Serum uric acid as a predictor of mortality and future exacerbations of COPD. Eur. Respir. J., 43(1): 43–53. doi: 10.1183/09031936.00209212.
- 4. Borghi C., Agabiti-Rosei E., Johnson R.J. et al. (2020) Hyperuricaemia and gout in cardiovascular, metabolic and kidney disease. Eur. J. Intern. Med., 80: 1–11. doi: 10.1016/j.ejim.2020.07.006.
- 5. Chandratre P., Mallen C., Richardson J. еt al. (2018) Health-related quality of life in gout in primary care: Baseline findings from a cohort study. Semin. Arthritis Rheum., 48(1): 61–69. doi: 10.1016/j.semarthrit.2017.12.005.
- 6. Chen B., Lu C., Gu H.Q. et al. (2021) Serum Uric Acid Concentrations and Risk of Adverse Outcomes in Patients With COVID-19. Front Endocrinol. (Lausanne),12: 633767. doi: 10.3389/fendo.2021.633767.
- 7. Crittenden D.B., Lehmann R.A., Schneck L. et al. (2012) Colchicine use is associated with decreased prevalence of myocardial infarction in patients with gout. J. Rheumatol., 39 (7): 1458–1464. doi:10.3899/jrheum.111533.
- 8. Dehlin M., Jacobsson L., Roddy E. (2020) Global epidemiology of gout: prevalence, incidence, treatment patterns and risk factors. Nat. Rev. Rheumatol., 16(7): 380–390. doi:10.1038/s41584-020-0441-1.
- 9. Edwards N.L., Schlesinger N., Clark S.et al. (2020) Management of Gout in the United States: A Claims-based Analysis. ACR Open. Rheumatol., 2(3): 180–187. doi:10.1002/acr2.11121.
- 10. Elfishawi M.M., Zleik N., Kvrgic Z. et al. (2018) The Rising Incidence of Gout and the Increasing Burden of Comorbidities: A Population-based Study over 20 Years. J. Rheumatol., 45(4): 574–579. doi:10.3899/jrheum.170806.
- 11. Francis-Sedlak M., LaMoreaux B., Padnick-Silver L. et al. (2021) Characteristics, Comorbidities, and Potential Consequences of Uncontrolled Gout: An Insurance-Claims Database Study. Rheumatol. Ther., 8(1): 183–197. doi:10.1007/s40744-020-00260-1.
- 12. GBD 2017 Disease and Injury Incidence and Prevalence Collaborators (2018) Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990–2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet (London, England), 392(10159): 1789–1858. doi:10.1016/S0140-6736(18)32279-7.
- 13. Guan W.J., Liang W.H., Zhao Y. et al. (2020) China Medical Treatment Expert Group for COVID-19. Comorbidity and its impact on 1590 patients with COVID-19 in China: a nationwide analysis. Eur. Respir. J., 55(5): 2000547. doi: 10.1183/13993003.00547-2020.
- 14. Gupta M.K., Singh J.A. (2019) Cardiovascular Disease in Gout and the Protective Effect of Treatments Including Urate-Lowering Therapy. Drugs, 79(5): 531–541. doi: 10.1007/s40265-019-01081-5.
- 15. Joosten L.A.B., Crisan T.O., Bjornstad P. et al. (2020) Asymptomatic Hyperuricaemia: A Silent Activator of the Innate Immune System. Nat. Rev. Rheumatol., 16(2): 75–86. doi: 10.1038/s41584-019-0334-3.
- 16. Kahnert K., Alter P., Welte T. et al. (2018) Uric acid, lung function, physical capacity and exacerbation frequency in patients with COPD: a multi-dimensional approach. Respir. Res., 19 (1): 110. doi:10.1186/s12931-018-0815-y.
- 17. Kir E., Güven Atici A., Güllü Y.T. et al. (2021) The relationship between serum uric acid level and uric acid/creatinine ratio with chronic obstructive pulmonary disease severity (stable or acute exacerbation) and the development of cor pulmonale. Int. J. Clin. Pract., 75(8): e14303. doi:10.1111/ijcp.14303.
- 18. Koto R., Nakajima A., Horiuchi H. et al. (2020) Real-world treatment of gout and asymptomatic hyperuricemia: A cross-sectional study of Japanese health insurance claims data. Mod. Rheumatol., 31(1): 261–269. doi:10.1080/14397595.2020.1784556.
- 19. Levey A.S., Stevens L.A., Schmid C.H. et al. (2009) CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration). A new equation to estimate glomerular filtration rate. Ann. Intern. Med., 150(9): 604–612. doi:10.7326/0003-4819-150-9-200905050-00006.
- 20. Levy G.D., Rashid N., Niu F. et al. (2014) Effect of urate-lowering therapies on renal disease progression in patients with hyperuricemia. J. Rheumatol., 41(5): 955–962. doi:10.3899/jrheum.131159.
- 21. Liang J., Jiang Y., Huang Y. et al. (2021) Comorbidities and factors influencing frequent gout attacks in patients with gout: a cross-sectional study. Clin. Rheumatol., 40(7): 2873–2880. doi: 10.1007/s10067-021-05595-w.
- 22. Moltó A., Dougados M. (2014) Comorbidity indices. Clin Exp Rheumatol., 32(5 Suppl 85): 131–134.
- 23. Neogi T., Jansen T.L., Dalbeth N. et al. (2016) 2015 Gout classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Ann. Rheum. Dis., 74(10): 1789–1798. doi:10.1136/annrheumdis-2015-208237.
- 24. Nikiphorou E., Radner H., Chatzidionysiou K. et al. (2016) Patient global assessment in measuring disease activity in rheumatoid arthritis: a review of the literature. Arthritis Res. Ther., 18(1): 251. doi:10.1186/s13075-016-1151-6.
- 25. Osibogun A., Balogun M., Abayomi A. et al. (2021) Outcomes of COVID-19 patients with comorbidities in southwest Nigeria. PLoS One, 16(3): e0248281. doi:10.1371/journal.pone.0248281.
- 26. Punzi L. (2020) The role of clinical inertia in suboptimal management of gout. Swiss. Med. Wkly., 150:w20334. doi:10.4414/smw.2020.20334.
- 27. Quilisadio J.E.C., Salido E.O., Penserga E.G. (2021) Achievement of the target serum urate level among patients with gout treated with allopurinol or febuxostat in an arthritis clinic in the Philippines. Mod. Rheumatol., 31(3): 755–761. doi: 10.1080/14397595.2020.1800557.
- 28. Qu L.H., Jiang H., Chen J.H. (2017) Effect of uric acid-lowering therapy on blood pressure: systematic review and meta-analysis. Ann. Med., 49(2): 142–156. doi:10.1080/07853890.2016.1243803.
- 29. Ragab G., Elshahaly M., Bardin T. (2017) Gout: An old disease in new perspective — A review. J. Adv. Res., 8(5): 495–511. doi:10.1016/j.jare.2017.04.008.
- 30. Rees F., Jenkins W., Doherty M. (2013) Patients with gout adhere to curative treatment if informed appropriately: proof-of-concept observational study. Ann. Rheum. Dis., 72(6): 826–830. doi:10.1136/annrheumdis-2012-201676.
- 31. Robinson P.C., Kempe S., Tebbutt I. et al. (2017) Epidemiology of inpatient gout in Australia and New Zealand: temporal trends, comorbidities and gout flare site. Int. J. Rheum. Dis., 20 (6): 779–784. doi:10.1111/1756-185X.12941.
- 32. Singh J.A., Yu S. (2016) Allopurinol and the risk of stroke in older adults receiving medicare. BMC Neurol., 16(1): 164. doi:10.1186/s12883-016-0692-2.
- 33. Stevens P.E., Levin A., Kidney Disease (2013) Improving Global Outcomes Chronic Kidney Disease Guideline Development Work Group Members. Evaluation and management of chronic kidney disease: Synopsis of the Kidney Disease: Improving Global Outcomes 2012 Clinical practice Guideline. Ann. Intern. Med., 158(11): 825–830. doi:10.7326/0003-4819-158-11-201306040-00007.
- 34. Wang B., Li R., Lu Z., Huang Y. (2020) Does comorbidity increase the risk of patients with COVID-19: evidence from meta-analysis. Aging (Albany NY), 12(7): 6049–6057. doi:10.18632/aging.103000.
- 35. Wang Y., Zhu F., Wang C. et al. (2020) Children Hospitalized With Severe Covid-19 in Wuhan. Pediatr. Infect. Dis. J., 39(7): e91–4. doi: 10.1097/INF.0000000000002739.
- 36. Wei L., Mackenzie I.S., Chen Y. et al. (2011) Impact of allopurinol use on urate concentration and cardiovascular outcome. Br. J. Clin. Pharmacol., 71(4): 600–607. doi:10.1111/j.1365-2125.2010.03887.x.
- 37. World Health Organization (2021) COVID-19 clinical management: living guidance, 25 January 2021. World Health Organization. Available on apps.who.int/iris/handle/10665/338882.
- 38. World Health Organization (2004) Global database on body mass index. Available from: http://www.euro.who.int/en/health-topics/disease-prevention/nutrition/a-healthy-lifestyle/body-mass-index-bmi.
- 39. Yin R., Li L., Zhang G. et al. (2018) Rate of adherence to urate-lowering therapy among patients with gout: A systematic review and meta-analysis. BMJ Open, 8(4): 1–10. doi:10.1136/bmjopen-2017-017542.
- 40. Zobbe K., Prieto-Alhambra D., Cordtz R. et al. (2019) Secular trends in the incidence and prevalence of gout in Denmark from 1995 to 2015: a nationwide register-based study. Rheumatology (Oxford), 58(5): 836–839. doi:10.1093/rheumatology/key390.
Адреса для листування:
Маховська Ольга Юріївна
46002, Тернопіль, вул. Клінічна, 1
КНП «Тернопільська обласна клінічна лікарня» ТОР, ревматологічне відділення
E-mail: makhovska@tdmu.edu.ua

Leave a comment