ОЦІНКА ЕФЕКТИВНОСТІ ТА БЕЗПЕКИ ХВОРОБОМОДИФІКУЮЧИХ АНТИРЕВМАТИЧНИХ ПРЕПАРАТІВ ПРИ СИСТЕМНОМУ ЧЕРВОНОМУ ВОВЧАКУ
Резюме. Актуальність. Незважаючи на наявний арсенал засобів для лікування системного червоного вовчака (СЧВ), питання контролю цієї хвороби є не до кінця вирішеним, розробка та впровадження імунобіологічних і таргетних синтетичних препаратів відбуваються повільніше порівняно з іншими ревматологічними захворюваннями. Мета. Проаналізувати частоту застосування хворобомодифікуючих антиревматичних препаратів (ХМАРП) при СЧВ (гідроксихлорохін (ГХХ), метотрексат (МТ), азатіоприн (АЗА), мофетилу мікофенолат (ММФ), циклофосфамід (ЦФ), ритуксимаб (РТК)), варіанти та поширеність побічних ефектів, причини відміни та виживаність терапії; оцінити вплив віку дебюту та тривалості відтермінування діагнозу на ці параметри. На основі отриманих даних зробити висновки щодо можливих шляхів оптимізації терапії СЧВ. Матеріали і методи. Проведено ретроспективний аналіз медичної документації 153 пацієнтів, що проходили лікування у ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України в період 2011–2021 рр., анкетування 45 з них з метою уточнення інформації. Виживаність терапії аналізували за допомогою кривих Каплана — Мейєра. Кореляційні зв’язки вивчали методом рангової кореляції Спірмена. Результати. Виявлено, що виживаність терапії ММФ є найвищою порівняно з іншими синтетичними ХМАРП, а кількість побічних ефектів — найменшою. Натомість основною причиною відміни АЗА були саме побічні ефекти, часто легкі чи помірні, що значно розходиться з даними літератури. У результаті проведеного аналізу підтверджено, що в групі пацієнтів, яким додатково призначався ГХХ, був достовірно тривалішим період до виникнення загострення порівняно з пацієнтами, яким він не призначався. Також встановлено наявність помірного негативного кореляційного зв’язку між віком дебюту СЧВ та середньою тривалістю терапії ХМАРП, що може свідчити про кращу відповідь на терапію у пацієнтів молодого віку. Висновки. ММФ може розглядатися як пріоритетний препарат у пацієнтів з обтяженим коморбідним фоном і підвищеним ризиком розвитку побічних ефектів. При легких і помірних небажаних явищах на фоні застосування ХМАРП необхідно робити спроби поновлення прийому препарату чи корекції дози і лише при їх неефективності — відміняти препарат. ГХХ слід призначати всім пацієнтам при відсутності протипоказань.
DOI: 10.32471/rheumatology.2707-6970.88.16975
УДК: 616.5-002.52+616.72-002.77+615.2.
ВСТУП
За останні десятиліття досягнуто значного прогресу в діагностиці та лікуванні СЧВ. Так, в 50-х роках ХХ століття 5-річна виживаність при СЧВ становила менше 50%, тоді як на даний момент згідно з даними більшості досліджень 10-річна виживаність перевищує 90%, а 15-річна — 80% [1]. Проте питання контролю активності даного захворювання є не до кінця вирішеним. У частини пацієнтів на певному етапі вичерпується запас наявних засобів та виникає потреба в застосуванні медичних препаратів «off-label». У деяких випадках підбір ефективного та безпечного базисного препарату може займати багато часу, що потребує застосування глюкокортикоїдів у середніх чи високих дозах протягом цього періоду. Нерідкісними є інфекційні та інші ускладнення, зумовлені застосовуваними препаратами. Саме вони зараз є основними причинами смертності у пацієнтів з СЧВ [1, 2, 3].
Порівняно із запальними артритами, в практику лікування яких за останні 20 років впроваджено низку імунобіологічних та таргетних синтетичних препаратів, при СЧВ цей процес є значно повільнішим [4].
Лише в 2011 р. Управлінням з контролю за харчовими продуктами та лікарськими засобами США (Food and drug administration — FDA) та Європейським агентством з лікарських засобів (European medicines agency — EMA) схвалено перший імунобіологічний препарат белімумаб. За механізмом дії він є моноклональним антитілом до BLyS (B-lymphocyte stimulator) [5]. Згідно з рекомендаціями Європейської антиревматичної ліги (European Alliance of Associations for Rheumatology — EULAR) препарат показаний до застосування при середній активності захворювання та є неефективним при люпус-нефриті [6].
Ті ж самі рекомендації дають можливість призначати ритуксимаб при рефрактерному люпус-нефриті та нейролюпусі, а також як препарат першої лінії при аутоімунній тромбоцитопенії та гемолітичній анемії. Проте через негативні результати проведених рандомізованих клінічних досліджень на даний момент ритуксимаб застосовується виключно «off-label» [6].
У 2021 р. FDA та EMA зареєстровано аніфролумаб — блокатор рецептора інтерферону 1-го типу, одного з ключових цитокінів у патогенезі СЧВ [7].
Ряд препаратів, що можуть бути ефективними при СЧВ, на даний момент проходять клінічні дослідження. Серед них:
- устекінумаб — антитіла до інтерлейкіну-12 та інтерлейкіну-23;
- алдеслейкін — препарат інтерлейкіну-2;
- барицитиніб, тофацитиніб, брепроцитиніб — інгібітори янус-кінази;
- рапаміцин — блокатор mTOR (мішень рапаміцину у ссавців);
- фенебрутиніб — інгібітор брутон-кінази;
- окрелізумаб — повністю людські антитіла до CD20 [8].
Опубліковано випадки та серії випадків успішного застосування aбатацепту (інгібітор костимуляції Т-клітин) [9], бортезомібу (інгібітор протеасом) [10], тоцилізумабу (інгібітор інтерлейкіну-6) [11, 12] при рефрактерному СЧВ.
Тому, зважаючи на відносно невелику кількість доступних засобів у лікуванні СЧВ, актуальним є проведення аналізу ефективності та безпеки застосування наявних препаратів для оптимізації медикаментозної терапії.
МАТЕРІАЛИ І МЕТОДИ ДОСЛІДЖЕННЯ
Для аналізу відібрано медичну документацію 153 пацієнтів, що проходили лікування в ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України в період 2011–2021 рр. З метою уточнення інформації проведено анкетування 45 з них. Діагноз СЧВ встановлювався за критеріями Американського коледжу ревматології (American College of Rheumatology — ACR) (1997), Міжнародної співпраці клінік системного вовчака (Systemic Lupus International Collaborating Clinics — SLICC) (2012) або ACR/EULAR (2019). У кожного пацієнта вивчали клінічні прояви як фактор вибору конкретного препарату, тривалість застосування, причини відміни, характер і поширеність побічних ефектів. При недостатній інформативності медичних записів стосовно будь-якого з пунктів він виключався з аналізу.
Аналіз виживаності терапії кожним препаратом проводили за допомогою методу Каплана — Мейєра. Включали як повні спостереження (від призначення препарату до припинення його прийому), так і цензуровані (контакт з хворим було втрачено до завершення спостереження або на момент закінчення спостереження прийом препарату продовжувався). Для аналізу виживаності терапії ГХХ включали лише випадки його застосування в монотерапії. Для порівняння виживаності терапії між препаратами використовували логарифмічний Логранк-тест (logrank test). Різницю вважали достовірною при р<0,05. Для оцінки застосування ГХХ з метою покращення прогнозу (без окремої оцінки ефективності щодо проявів захворювання) пацієнтів було розбито на дві групи: тих, яким цей препарат призначався додатково до іншої терапії, та тих, кому не призначався. Для кожної з груп визначено тривалість терапії до виникнення загострення та порівняно між собою вищенаведеними методами.
Розподіл значень віку дебюту СЧВ, часу відтермінування діагнозу та тривалості терапії кожним препаратом оцінювали на нормальність за допомогою методу Колмогорова — Смірнова. Зважаючи на відсутність нормального розподілу, для вивчення кореляційних зв’язків використовували метод рангової кореляції Спірмена. Зв’язок вважали достовірним при р<0,05. Силу зв’язку оцінювали за шкалою Чеддока: 0,1–0,3 — слабкий; 0,3–0,5 — помірний; 0,5–0,7 — виражений; 0,7–0,9 — сильний; 0,9–0,99 — функціональна залежність. Для статистичної обробки даних використовували комп’ютерні програми Microsoft Excel та RStudio.
РЕЗУЛЬТАТИ
У табл. 1 наведено кількість пацієнтів, що приймали кожен препарат, причини відміни та середню тривалість прийому. На рис. 1 графічно зображено причини відміни препаратів. Нижче подано більш детальну характеристику та аналіз отриманих даних щодо кожного з препаратів.
Таблиця 1. Інформація про частоту застосування, ефективність, безпеку та тривалість прийому ХМАРП при СЧВ
| ПРЕПАРАТ | Кількість пацієнтів, якіотримували препарат, n (%) | Кількість пацієнтів, дані яких достатньо інформативні, n | Продовжують прийом, n | Причини відміни | Середня тривалість прийому, місяці | ||
|---|---|---|---|---|---|---|---|
| Ремісія або низька активність, n | Побічніефекти, n | Недостатняефективність, n | |||||
| Метотрексат | 35(23) | 24 | 12 | 1 | 4 | 7 | 22,6 |
| Азатіоприн | 52(34) | 35 | 12 | 3 | 11 | 9 | 30,9 |
|
Гідроксихлорохін (монотерапія) |
48(31) | 27 | 8 | 1 | 3 | 15 | 24,5 |
| Мофетилу мікофенолат | 33(22) | 20 | 13 | 2 | 0 | 5 | 38,5 |
| Циклофосфамід | 38(25) | 27 | – | 18 | 6 | 3 | 5,5 |
| Ритуксимаб | 12(8) | 9 | 2 | 4 | 2 | 1 | 11,8 |
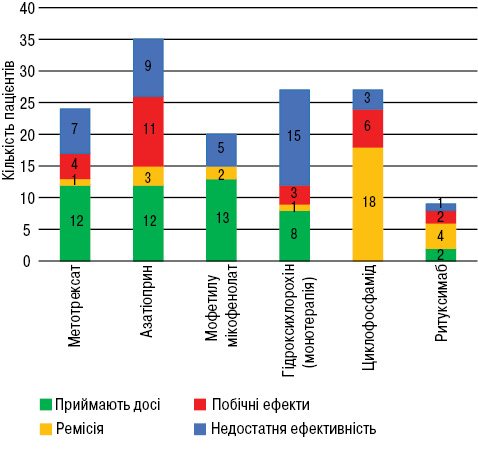
Метотрексат призначали переважно пацієнтам зі шкірно-суглобовими проявами. Звертає на себе увагу досить висока частота неефективності, в тому числі вторинної. Серед побічних ефектів відмічали такі: флегмона гомілки, що ускладнилася сепсисом; токсичний гепатит (минув після відміни препарату); виражені нудота та загальна слабкість у 2 пацієнтів. Загалом частота відміни препарату через побічний ефект зіставна з літературними даними [13].
Азатіоприн застосовували як препарат першої лінії при широкому спектрі клінічних проявів та середній активності захворювання або в якості підтримки ремісії після її індукції циклофосфамідом. Основною причиною відміни в даному аналізі були побічні ефекти, тоді як в аналогічному дослідженні L. Croyle та співавторів (2015) виявлено дещо інший спектр причин відміни азатіоприну: побічні ефекти — 3 пацієнти (10%), деескалація терапії — 14 (47%), неефективність — 12 (40%) [14]. Нижче наведено побічні ефекти, що стали причиною припинення прийому азатіоприну, та кількість пацієнтів, у яких вони відмічені:
- лейкопенія (2);
- інфекційні процеси: септичний артрит колінного суглоба (1), гостра дисемінована герпесвірусна інфекція (1); гнійний процес в ротовій порожнині (1), загострення хронічного тонзиліту (1);
- токсокароз та анемія (1);
- нудота (3);
- токсичний гепатит (1) (аланінамінострасфераза (АлАТ) — 348 Од./л; аспартатамінотрасфераза (АсАТ) — 215 Од./л, нормалізувалися через 2 міс після відміни препарату та застосування гепатопротекторів).
Примітно, що у вище згаданому дослідженні лейкопенія була єдиною причиною відміни препарату у всіх трьох пацієнтів. Тому можна зробити висновок про необхідність спроб корекції дози, тимчасового припинення терапії до купірування побічного ефекту, але не повної відміни азатіоприну у разі розвитку нудоти, локальних інфекцій, невиражених гематологічних порушень, гепатотоксичності та інших легких чи помірних побічних ефектів.
Деякі автори рекомендують визначення концентрації метаболітів азатіоприну в сироватці крові для диференціації між активністю хвороби та ефектом препарату при деяких небажаних явищах, зокрема лейкопенії та підвищенні рівня печінкових ферментів. Також цей метод може допомогти відрізнити істинну неефективність препарату від недостатнього дозування чи порушення режиму прийому пацієнтом [14, 15, 16]. З приводу безпеки застосування азатіоприну варто також згадати про можливість визначення активності основного ферменту його метаболізму — тіопуринметилтрансферази (ТПМТ) до початку терапії. При зниженні її активності відмічають високий рівень азатіоприну в крові, що зумовлює високий ризик мієлосупресії [17, 18]. Дані методи обстеження є доступними в Україні, проте інформованість лікарів стосовно них є низькою.
Вагомою перевагою азатіоприну порівняно з іншими препаратами є достатня безпека застосування у період вагітності [6]. У нашому центрі спостерігалися 2 жінки, які успішно виносили та народили здорову дитину, не перериваючи прийом азатіоприну.
Гідроксихлорохін призначали 76% пацієнтів (включаючи моно- та комбіновану терапію). Відомо, що згідно з рекомендаціями EULAR 2019 р. його слід призначати всім пацієнтам із СЧВ [6]. Практично всі пацієнти, яким цей препарат не призначався, проходили лікування в 2011–2014 рр. Ймовірно, це пов’язано з тим, що попри тривалу історію його застосування при шкірно-суглобових проявах СЧВ, лише наприкінці 2000-х років було остаточно підтверджено, що гідроксихлорохін істотно покращує прогноз даного захворювання, тому повинен призначатися всім пацієнтам за відсутності протипоказань [19]. Тому, ймовірно, причиною призначення гідроксихлорохіну не 100% пацієнтів є певна інерція імплементації міжнародних рекомендацій.
Дані щодо прийому гідроксихлорохіну в монотерапії наведені в табл. 1. На відміну від інших базисних препаратів, монотерапія була недостатньо ефективною у більше ніж половини пацієнтів (15 з 27). Проте порівнявши тривалість ремісії до виникнення загострення у групах пацієнтів, що отримували та не отримували гідроксихлорохін (незалежно від прийому інших препаратів), відмічено достовірно нижчий ризик загострень у першій групі (рис. 2), що ще раз підтверджує необхідність призначення гідроксихлорохіну всі пацієнтам з СЧВ за відсутності протипоказань. Варто наголосити, що у разі недостатньої ефективності гідроксихлорохіну у монотерапії його прийом слід продовжити та додати інший ХМАРП, а не відміняти препарат.
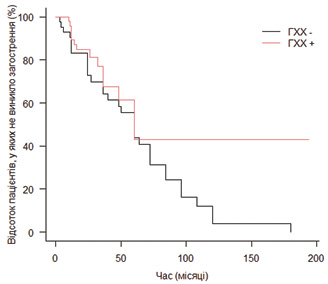
Щодо побічних ефектів, то вони виявлені лише у 8 (5,8%) зі 137 пацієнтів, чиї дані стосовно застосування гідроксихлорохіну були достатньо інформативними. Cеред них макуло-папульозний висип — 3 пацієнти, нудота — 3; ретинопатія — 1, тромбоцитопенія — 1. У одного з пацієнтів із зафіксованим висипом після призначення гідроксихлорохіну через 2 роки зроблено повторну спробу його призначення, при якій висипу не виникло, і на даний момент пацієнт приймає його вже протягом 3 років. Цей випадок ще раз підтверджує можливість і необхідність спроб повторного призначення ХМАРП після епізодів нетяжких небажаних явищ.
Мофетилу мікофенолат продемонстрував найкращий профіль ефективності та безпеки порівняно з іншими синтетичними ХМАРП. Не зафіксовано жодного випадку відміни препарату через побічний ефект. У 2 пацієнтів прийом тимчасово призупиняли у зв’язку з плануванням вагітності. Єдиним значимим зафіксованим небажаним явищем був неускладнений гострий пієлонефрит, після виліковування якого прийом мофетилу мікофенолату поновлено. Враховуючи наведені факти, слід розглядати мофетилу мікофенолат як препарат вибору у пацієнтів з обтяжливим коморбідним фоном. При аналізі виживаності терапії різними ХМАРП (рис. 3) бачимо, що для мофетилу мікофенолату цей показник є достовірно вищим, ніж для інших препаратів (циклофосфамід та ритуксимаб не включені в аналіз через коротку тривалість прийому в режимі індукції ремісії практично у всіх пацієнтів).
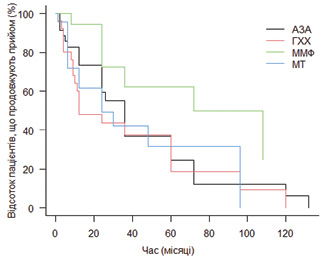
Порівняння виживаності терапії різними препаратами представлено у табл. 2.
Таблиця 2. Порівняння виживаності терапії синтетичними ХМАРП при СЧВ (Лог-ранк-тест)
| Препарат | Метотрексат | Азатіоприн | Мофетилу мікофенолат |
|---|---|---|---|
| Азатіоприн | χ2=0,34; р=0,73 | – | – |
| Мофетилу мікофенолат | χ2 =2,26; р=0,024* | χ2=2; р=0,0046* | – |
| Гідроксихлорохін (монотерапія) | χ2=0,39; р=0,69 | χ2=0,98; р=0,33 | χ2=2,58;
р=0,01* |
*Різниця достовірна при р<0,05.
Циклофосфамід призначався при люпус-нефриті та нейролюпусі. Середня кумулятивна доза становила 8,64 г. У 14 пацієнтів препарат застосовано внутрішньовенно, у 13 — перорально (достовірної різниці в результатах лікування при різних шляхах введення не відмічено). Попри високу ефективність препарату, звертає увагу висока частота побічних ефектів, серед яких переважають інфекційні (пневмонія, оперізувальний герпес, сепсис, локальні гнійні процеси) та гематологічні (лейкопенія та тромбоцитопенія). На особливу увагу заслуговує вплив циклофосфаміду на фертильну функцію. Лише в 1 жінки (із 35) підтверджено індуковану циклофосфамідом аменорею, що призвела до безпліддя. Ще у 2 пацієнтів (1 чоловік та 1 жінка) виникла необхідність застосування допоміжних репродуктивних технологій (хоча неможливо чітко простежити зв’язок між застосуванням циклофосфаміду та порушенням репродуктивної функції). Наведені дані можуть бути заниженими через ретроспективний характер дослідження і відсутність вказівок щодо репродуктивного здоров’я в медичній документації. За даними літератури, частота порушень репродуктивної функції внаслідок застосування циклофосфаміду є значно вищою [20, 21].
Ритуксимаб призначали при неефективності мофетилу мікофенолату та/або циклофосфаміду у пацієнтів з люпус-нефритом. Серед 9 пацієнтів, дані яких були достатньо інформативними, у 6 вдалося досягнути контролю захворювання (зниження добової протеїнурії до рівня нижче 0,5 г/добу, нормалізації рівня креатиніну), 2 з них продовжують застосування ритуксимабу в якості підтримувальної терапії. Лише у 1 пацієнтки ефект був недостатнім. У 2 застосування препарату припинено через побічний ефект: бронхообструктивний синдром та лейко- і лімфопенію.
Обчисливши середню тривалість періоду, протягом якого кожен з препаратів забезпечує контроль захворювання (див. табл. 1), отримали 133,8 міс (11,2 року). Частина пацієнтів продовжує прийом препаратів, тому реально цифра збільшуватиметься з плином часу. Також у більшості з них не використана опція застосування ритуксимабу в якості підтримувальної терапії та белімумабу. Проте навіть з урахуванням цих фактів у частини пацієнтів, особливо з дебютом у дитячому та молодому віці, рано чи пізно вичерпається запас базисних препаратів для контролю захворювання. Частково ця проблема може бути вирішеною спробами повторного призначення раніше відмінених препаратів, застосуванням препаратів «off-label» та підвищенням дози глюкокортикоїдів.
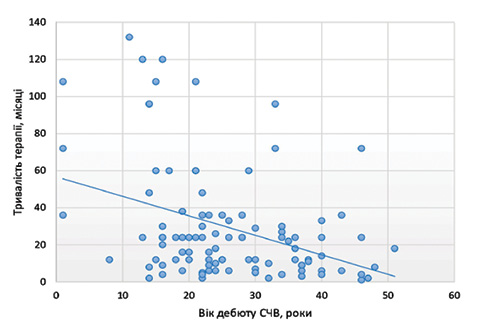
При аналізі кореляційних зв’язків виявлено, що між віком дебюту СЧВ та тривалістю терапії кожним ХМАРП існує негативний кореляційний зв’язок помірної сили (рис. 4), що може свідчити про кращу відповідь на лікування у пацієнтів молодого віку. Між часом відтермінування встановлення діагнозу та тривалістю терапії достовірного зв’язку не виявлено (рис. 5).
ВИСНОВКИ
1. Дані щодо ефективності та безпеки ХМАРП можуть бути враховані при підборі терапії в кожній конкретній ситуації.
2. Мофетилу мікофенолат продемонстрував найкращий профіль ефективності та безпеки, тому може розглядатися як пріоритетний препарат у пацієнтів з обтяженим коморбідним фоном і підвищеним ризиком розвитку побічних ефектів.
3. При легких чи помірних побічних ефектах доцільними є спроби поновлення терапії ХМАРП або тимчасове зниження їх дози без повної відміни препарату.
4. Прийом гідроксихлорохіну знижує ризик загострень, тому повинен призначатися всім пацієнтам з СЧВ за відсутності протипоказань.
5. Молодий вік дебюту СЧВ асоціюється з більшою тривалістю прийому кожного ХМАРП, що може свідчити про кращу відповідь на терапію у даної категорії пацієнтів.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- 1. Wang Z., Wang Y., Zhu R. et al. (2015) Long-term survival and death causes of systemic lupus erythematosus in China: a systemic review of observational studies. Medicine., 94(17): e794. doi: 10.1097/MD.0000000000000794.
- 2. Dall’Era M., Wofsy D. (2017) Clinical Manifestations of Systemic Lupus Erythematosus. In: Firestein G.S., Budd R.C., Gabriel S.E., MacInnes I.B., O’Dell J.R., editors. Kelley and Firestein’s Textbook of Rheumatology. 10th ed. Philadelphia, Pa: Elsevier Saunders: 1345–67.
- 3. Bultink I.E.M., De Vries F., van Vollenhoven R.F. et al. (2021) Mortality, causes of death and influence of medication use in patients with systemic lupus erythematosus vs matched controls. Rheumatology, 60(1): 207–216. doi: 10.1093/rheumatology/keaa267.
- 4. Dall’Era M., Bruce I.N., Gordon C. et al. (2019) Current challenges in the development of new treatments for lupus. Ann. Rheum. Dis., 78(6): 729–735. doi: 10.1136/annrheumdis-2018-214530.
- 5. Srivastava A. (2016) Belimumab in Systemic Lupus Erythematosus. Indian journal of dermatology., 61(5): 550–553. doi: 10.4103/0019-5154.190107.
- 6. Fanouriakis A., Kostopoulou M., Alunno A. et al. (2019) 2019 Update of the EULAR recommendations for the management of systemic lupus erythematosus. Annals of the Rheumatic Diseases., 78(6): 736–745. doi: 10.1136/annrheumdis-2019-215089.
- 7. Loncharich M.F., Anderson C.W. (2022) Interferon Inhibition for Lupus with Anifrolumab: Critical Appraisal of the Evidence Leading to FDA Approval. ACR Open Rheumatology. Online ahead of print. doi: 10.1002/acr2.11414.
- 8. Vukelic M., Li Y., Kyttaris V.C. (2018) Novel Treatments in Lupus. Front. Immunol., 9: 2658. doi: 10.3389/fimmu.2018.02658.
- 9. Danion F., Rosine N., Belkhir R. et al. (2016) Club Rhumatismes et Inflammation section of the French Society of Rheumatology. Efficacy of abatacept in systemic lupus erythematosus: a retrospective analysis of 11 patients with refractory disease. Lupus., 25(13): 1440–1447. doi: 10.1177/0961203316640911.
- 10. Segarra A., Arredondo K.V., Jaramillo J. et al. (2020) Efficacy and safety of bortezomib in refractory lupus nephritis: a single-center experience. Lupus., 29(2): 118–125. doi: 10.1177/0961203319896018.
- 11. De Matteis A., Sacco E., Celani C. et al. (2021) Tocilizumab for massive refractory pleural effusion in an adolescent with systemic lupus erythematosus. Pediatr Rheumatol., 19(1): 144. doi: 10.1186/s12969-021-00635-w.
- 12. Chaoyi M., Shrestha B., Hui L. et al. (2022) Tocilizumab therapy for persistent high-grade fever in systemic lupus erythematosus: two cases and a literature review. J. Int. Med. Res., 50(3): 3000605221088558. doi: 10.1177/03000605221088558.
- 13. Sato E.I. (2001) Methotrexate therapy in systemic lupus erythematosus. Lupus; 10(3): 162–164. doi:10.1191/096120301666080831.
- 14. Croyle L., Hoi A., Morand E.F. (2015) Characteristics of azathioprine use and cessation in a longitudinal lupus cohort. Lupus Science & Medicine., 2(1): e000105. doi: 10.1136/lupus-2015-000105.
- 15. Cuffari C. (2006) A Physician’s Guide to Azathioprine Metabolite Testing. Gastroenterology & hepatology., 2(1): 58–63.
- 16. Wilson L., Tuson S., Yang L. et al. (2020) Real-World Use of Azathioprine Metabolites Changes Clinical Management of Inflammatory Bowel Disease. J Can Assoc Gastroenterol., 4(3): 101–109. doi:10.1093/jcag/gwaa005.
- 17. No authors listed (2009) TPMT testing before azathioprine therapy? Drug Ther Bull., 47(1): 9–12. doi: 10.1136/dtb.2008.12.0033.
- 18. Torkamani A. (2020) In: Roth K. S. Editor. Azathioprine Metabolism and Thiopurine Methyltransferase (TPMT) Deficiency [Internet]. Medscape; 2020. Available from: emedicine.medscape.com/article/1829596-overview.
- 19. Basta F., Fasola F., Triantafyllias K. et al. (2020). Systemic Lupus Erythematosus (SLE) Therapy: The Old and the New. Rheumatology and therapy., 7(3): 433–446. doi: 10.1007/s40744-020-00212-9.
- 20. Sen M., Kurl A., Khosroshahi A. (2021) Pregnancy in patients with systemic lupus erythematosus after cyclophosphamide therapy. Lupus., 30(9): 1509–1514. doi: 10.1177/09612033211021163.
- 21. Ghaleb R.M., Fahmy K.A. (2019) Premature ovarian failure in systemic lupus erythematosus patients: is it related to cyclophosphamide treatment? Egypt Rheumatol Rehabil., 46: 85–91. doi.org/10.4103/err.err_53_18.
Адреса для листування:
Дубас Віталій Васильович
03151, Київ, вул. Святослава Хороброго, 5
ДУ «ННЦ «Інститут кардіології
імені академіка М.Д. Стражеска» НАМН України»
E-mail: vdubas1994@gmail.com

Leave a comment