ЕОЗИНОФІЛЬНИЙ ГРАНУЛЕМАТОЗ З ПОЛІАНГІЇТОМ ІЗ ЗАЛУЧЕННЯМ ПЕРИФЕРИЧНОЇ НЕРВОВОЇ СИСТЕМИ: КЛІНІЧНИЙ ВИПАДОК ТА ОГЛЯД ЛІТЕРАТУРИ
Яременко О.Б.1, Сидорова А.О.2, Петелицька Л.Б.1
- 1Національний медичний університет імені О.О. Богомольця, м. Київ
- 2Медичний центр «Універсальна клініка «Оберіг», м. Київ
Резюме. Еозинофільний гранулематоз з поліангіїтом (ЕГПА, стара назва — «синдром Чарга — Стросса») є рідкісним варіантом васкуліту, пов’язаного з антинейтрофільними цитоплазматичними антитілами (АНЦА). Він характеризується поєднанням васкулітних та еозинофільних проявів, що потребують таргетної терапії, яка дещо відрізняється від лікування інших видів васкулітів цієї групи. У цій статті описаний клінічний випадок загострення ЕГПА у пацієнтки віком 57 років з переважним ураженням периферичної нервової системи у вигляді множинного мононевриту. Описано фази перебігу ЕГПА, особливості відновлення втраченої функції периферичної нервової системи, а також продемонстровано перебіг коронавірусної хвороби на тлі проведеного лікування глюкокортикоїдами та циклофосфамідом. Наведено власні дані про частоту ураження нервової системи у хворих з АНЦА-асоційованими васкулітами. Розкрито підходи до диференційної діагностики гіпереозинофільних станів на прикладі цієї хворої, проаналізовано відмінності рекомендацій Американського коледжу ревматологів (American College of Rheumatology — ACR) 2021 р. та Європейського альянсу асоціацій ревматологів (European Alliance of Associations for Rheumatology — EULAR/Європейської ниркової асоціації (European Renal Association — ERA) — Європейської асоціації діалізу та трансплантації (European Dialysis and Transplant Association — EDTA) 2016 р. щодо менеджменту ЕГПА. Розглянуто нові класифікаційні критерії цього захворювання згідно з ACR/ EULAR 2022 р.
DOI: 10.32471/rheumatology.2707-6970.88.17017
Вступ
Еозинофільний гранулематоз з поліангіїтом (ЕГПА, раніше — синдром Чарга — Стросса) є одним з трьох васкулітів, що асоціюється з антинейтрофільними цитоплазматичними антитілами (АНЦА) і уражає судини дрібного калібру. Для ЕГПА характерне поєднання таких ознак, як бронхіальна астма (у близько 95–100% пацієнтів), еозинофілія та висока частота ураження периферичної та центральної нервової систем порівняно з іншими АНЦА-асоційованими васкулітами [13, 18]. На відміну від інших васкулітів цієї групи, АНЦА виявляються позитивними лише у 30–40% пацієнтів [15]. Клінічна картина ЕГПА досить варіабельна, але можна виділити два основні клініко-лабораторні фенотипи: 1) з позитивними АНЦА та переважними васкулітними проявами (наприклад гломерулонефрит, пурпура та множинний мононеврит); 2) з негативними АНЦА та вираженими еозинофільними проявами (наприклад формування легеневих інфільтратів та кардіоміопатія) [18].
Опис клінічного випадку
Пацієнтка Л., 57-річна жінка, госпіталізована зі скаргами на порушення чутливості та зниження активних рухів у нижніх кінцівках, лівій кисті, виражену загальну слабкість і задишку. Порушення чутливості з’явилися близько 1,5 міс тому, коли через прояви сенсорної атаксії пацієнтка впала, внаслідок чого отримала перелом кісток лівої гомілки, виражені обмеження рухового режиму. Обстежена лабораторно, виявляли лейкоцитоз до 12,9 Г/л з еозинофілією 55%, підвищення рівня С-реактивного білка (СРБ) до 24 мг/л та нормальний рівень ревматоїдного фактора (РФ).
Стан прогресивно погіршувався і за 3 тиж до моменту звернення до вищезгаданих скарг додалися епізод болю в епігастральній ділянці, рясна водяниста діарея без домішок крові або слизу протягом 4 діб. З цього моменту виявлено суттєве погіршення загального стану: виражене наростання загальної слабкості (у зв’язку з чим практично не встає з ліжка), серцебиття, періодично епізоди субфебрильної температури тіла. Впродовж 2 міс схудла на 5 кг. За 4 дні до моменту звернення повторно обстежена лабораторно: наростання лейкоцитозу до 19,9 Г/л (еозинофіли — 52%), гемоглобін — 113 г/л, тромбоцити — 131 Г/л, РФ — 684 МЕ/л, СРБ — 44 мг/л.
З анамнезу відомо, що у пацієнтки протягом останніх 9 років відмічається бронхіальна астма, вона застосовує будесонід/формотеролу фумарат 160/4,5 мкг двічі на добу та періодично ін’єкції дексаметазону для купірування загострень. В останні роки фіксується погіршення контролю симптомів бронхіальної астми. У результатах аналізу крові за 2015–2016 рр. (за 4–5 років до моменту звернення): рівні лейкоцитів 8,8–10,1 Г/л, частка еозинофілів 7–15% (норма 1–5%), ШОЕ в нормі або підвищене до 18 мм/год (норма до 15 мм/год). З юності має полівалентну алергію, періодично відмічає наявність висипу за типом кропив’янки, особливо після відвідування басейну, в місцях нещодавньої травматизації шкіри або після впливу інгаляційного чи іншого алергену. Висип минав самостійно або після застосування топічних антигістамінних засобів. Оперативні втручання: видалення поліпів носової порожнини. Супутні захворювання: хронічний алергічний риніт, гіпотиреоз, приймає перорально 50 мкг левотироксину один раз на добу. Дані анамнезу структуровано в хронологічній послідовності на рис. 1.
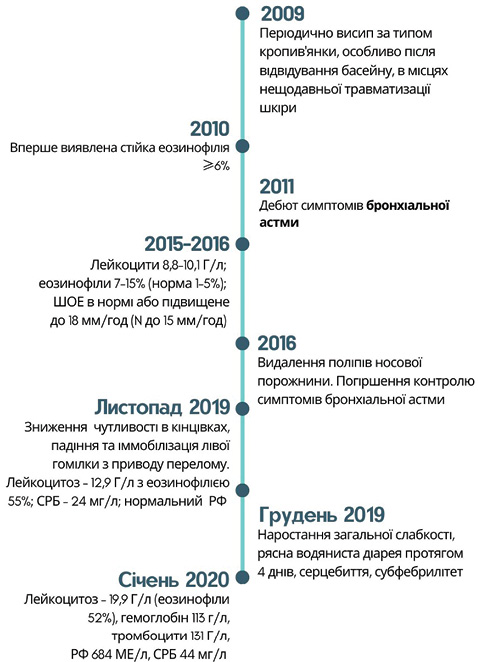
На момент госпіталізації зареєстровано лейкоцитоз 20,7 Г/л за рахунок еозинофілів 51% (абсолютне число 11 Г/л), зниження рівня гемоглобіну — 119 г/л, підвищення ШОЕ — 115 мм/год, СРБ — 85 мг/л. Рівень ІgE сягнув >2000 Од/мл. Аналіз крові на антинуклеарні антитіла, антитіла до мієлопероксидази, протеїнази-3 негативні (двічі). У загальному аналізі сечі зафіксовано протеїнурію 0,539 г/л, еритроцитурію. У неврологічному статусі виявлено тетрапарез: сила в руках знижена до 4 балів, в ногах — до 3,5 бала справа та 2,5–3 балів зліва. Черевні рефлекси з обох боків знижені. Порушення поверхневої чутливості у дистальних відділах кінцівок за поліневритичним типом (за типом «рукавичок» та «шкарпеток»). Вібраційна чутливість відсутня до рівня нижніх ребер. М’язово-суглобове відчуття порушено на рівні стоп та кистей. Враховуючи негативність за АНЦА, проводилася активна диференційна діагностика з іншими причинами гіпереозинофілії, в першу чергу з хронічною еозинофільною лейкемією, однак даних на користь гемобластозу не отримано. За допомогою мультиспіральної комп’ютерної томографії (МСКТ) органів грудної клітки виявили дисковидні ателектази задньо-нижніх сегментів обох легень, в плевральних порожнинах з обох сторін — невелику кількість вільної рідини (≈100 мл), мінімальну кількість рідини в порожнині перикарда (сепарація листків до 7 мм).
Враховуючи типову клінічну картину ЕГПА, яка відповідала класифікаційним критеріям Американського коледжу ревматологів (American College of Rheumatology — ACR), та результати лабораторно-інструментального дообстеження, діагностовано ЕГПА (синдром Чарга — Стросса), хронічний перебіг з тяжким загостренням від листопада 2019 р., ІІІ ст. активності з ураженням верхніх дихальних шляхів (хронічний алергічний риніт з поліпозом), шкіри (хронічна кропив’янка), легень (гормонозалежна бронхіальна астма з персистивним неконтрольованим перебігом, пульмоніт з дископодібними ателектазами, ДН ІІ ст.), серозних оболонок (ексудативний плеврит, перикардит), периферичної нервової системи (множинний мононеврит з тетрапарезом (легким в руках, грубим в ногах), сенсорна полінейропатія за типом «рукавичок» та «шкарпеток», вираженим порушенням функції ходи), шлунково-кишкового тракту (абдомінальний синдром з діареєю), нирок (нефропатія з легкою протеїнурією), загальнотрофічним (схуднення, лихоманка) та гематологічним синдромами (гіпереозинофілія, лейкоцитоз, гіперімуноглобулінемія Е, підвищення РФ). ANCA (-).
Бірмінгемський показник активності васкуліту (BVAS) v.3 становив 27 балів (нові симптоми/погіршення стану) та 1 бал (персистивні симптоми).
Менеджмент пацієнтки здійснювався згідно з рекомендаціями Європейського альянсу асоціацій ревматологів (European Alliance of Associations for Rheumatology — EULAR/Європейської ниркової асоціації (European Renal Association — ERA) — Європейської асоціації діалізу та трансплантації (European Dialysis and Transplant Association — EDTA) 2016 р. Як початкове лікування обрана пульс-терапія метилпреднізолоном 1000 мг 5 днів поспіль у комбінації з циклофосфамідом 200 мг в/м 2 рази на тиждень з переходом на таблетований метилпреднізолон в дозі 48 мг/добу та пероральний циклофосфамід 100 мг 3 рази на тиждень. Після зниження активності захворювання для неврологічної реабілітації пацієнтка була переведена в Інсультний центр «Універсальної клініки «Оберіг», де проводилися щоденні заняття з фахівцем з фізичної реабілітації. За період стаціонарного лікування вдалося досягти таких успіхів: пацієнтка, яка раніше втратила можливість самостійно пересуватися, частково відновила функцію ходи. Вона могла самостійно сідати та лягати, ходити з опорою на чотириопорну паличку, виконувати побутову домашню роботу. Виписана на амбулаторне лікування через 6 міс від початку лікування з планами вийти на роботу.
Після досягнення стабільної ремісії протягом 10 міс та зниження дози метилпреднізолону до 6 мг був запланований перехід з циклофосфаміду на азатіоприн, проте пацієнтка захворіла на коронавірусну хворобу з тяжким перебігом. Температура тіла підвищувалася максимально до субфебрильних цифр, однак збільшувалася вираженість загальної слабкості та задишки. Пацієнтка госпіталізована в стаціонар, на 10-й день хвороби було виконано МСКТ: ураження 75% паренхіми легень. У плевральних порожнинах з обох боків виявлено мінімальну кількість рідини: праворуч до 10 мм (≈200 мл), ліворуч — до 12 мм (≈200 мл). Рівень феритину досяг 2760 нг/мл, а інтерлейкіну-6 — 33,2 пг/мл, лейкоцити — 6,23 Г/л, еозинофіли — 0% (після введення дексаметазону). Пацієнтка потребувала кисневої підтримки (маска з резервуаром), сатурація мінімально знижувалася до 90%, після успішного лікування метилпреднізолоном внутрішньовенно 40 мг 2 рази на добу на 10-й день захворювання виписана для продовження лікування амбулаторно.
Через 11 міс після встановлення діагнозу та збереження, у тому числі після перенесеної коронавірусної хвороби, стабільної ремісії пацієнтці було призначено азатіоприн в дозі 50 мг 2 рази на добу (замість циклофосфаміду) та продовжено прийом метилпреднізолону 6 мг/добу. Через 1 рік і 4 міс після встановлення діагнозу здійснено спробу зниження дози метилпреднізолону до 4 мг, яка виявилася невдалою (підвищення рівня еозинофілів до 8%). На поточний час хвора продовжує фізичну реабілітацію в амбулаторних умовах, має позитивні зрушення в неврологічному статусі: збільшення об’єму довільних рухів у нижніх кінцівках, збільшення сили кисті лівої руки тощо.
Обговорення
Перебіг ЕГПА поділяється на 3 клініко-гістологічні стадії: продромальна (або алергічна), еозинофільна та васкулітна (рис. 2).
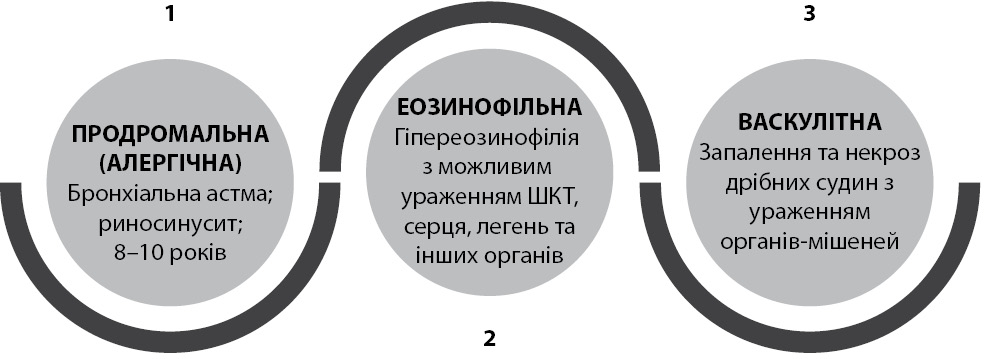
Перша стадія зазвичай триває 8–10 років і характеризується появою бронхіальної астми та синуситу. Для наступної, еозинофільної стадії, характерна поява гіпереозинофілії периферичної крові та інфільтрації цими клітинами внутрішніх органів з появою легеневих інфільтратів, залучення шлунково-кишкового тракту та формування еозинофільної кардіоміопатії [2, 18]. Васкулітна стадія характеризується розвитком нейропатії, пурпури, альвеолярної кровотечі та гломерулонефриту [1]. Однак ці стадії можуть накладатися, і у деяких пацієнтів може бути відсутня еозинофільна або васкулітна стадія. У нашої пацієнтки поява бронхіальної астми виявлена практично одночасно з появою еозинофілії за 9–10 років до початку васкулітної фази.
У 2022 р. було переглянуто та оновлено класифікаційні критерії ЕГПА (табл. 1). Ці класифікаційні критерії мають бути застосовані у пацієнтів, яким встановлено діагноз васкуліту судин дрібного чи середнього калібру та виключено альтернативні захворювання, які можуть імітувати васкуліт [7].
Таблиця 1. Класифікаційні критерії ЕГПА ACR/EULAR 2022 р. [7]
| Клінічні критерії | |
|---|---|
| 1. Обструктивне захворювання дихальних шляхів | +3 |
| 2. Поліпоз носа | +3 |
| 3. Множинний мононеврит | +1 |
| Лабораторні та патоморфологічні критерії | |
| 4. Максимальна кількість еозинофілів ≥1·109/л | +5 |
| 5. Екстраваскулярне, переважно еозинофільне запалення | +2 |
| 6. Позитивні цитоплазматичні АНЦА або антитіла до протеїнази-3 | -3 |
| 7. Гематурія | -1 |
| Діагноз ЕГПА може бути встановлений при сумарній кількості балів ≥6 | |
Якщо ретранслювати ці нові критерії на нашу пацієнтку, то на час встановлення діагнозу вона набрала б 12 балів.
Коло диференційної діагностики ЕГПА охоплює інші види васкулітів та захворювань, що супроводжуються еозинофілією [22]. Гіпереозинофільний синдром — це наявність гіпереозинофілії крові та/або тканин протягом більше ніж 1 міс з ознаками ураження чи дисфункції органів при виключенні інших захворювань чи станів, які могли до цього призвести. Якщо наявність органного ураження не є очевидною, коректніше використовувати термін «гіпереозинофілія» [19, 26]. Виражена еозинофілія має наштовхувати клініциста на думку про такі диференційні діагнози, як паразитарні інфекції, лікарські реакції, наявність злоякісного новоутворення (певні види солідних пухлин, Т-клітинні лімфоми тощо). За наявності бронхіальної астми чи легеневих інфільтратів слід також виключати алергічний бронхолегеневий аспергільоз та хронічну еозинофільну пневмонію [9, 22].
Патерн клінічної картини ЕГПА може відрізнятися залежно від позитивності за певними АНЦА-антитілами. Наявність антитіл до мієлопероксидази асоціюється з вищою частотою периферичної нейропатії (78,6% проти 57,1% у не асоційованих з АНЦА пацієнтів) та гломерулонефриту (28,9% проти 9,4%), однак характеризується нижчою частотою легеневих інфільтратів (45,3% проти 61,4%) та кардіоміопатії (14,5% проти 30,4%) [12]. І навпаки, АНЦА-негативні пацієнти мали значно вищу частоту кардіоміопатії, що, ймовірно, пояснює вищий рівень смертності в цій групі [4]. Проте типові для васкуліту клінічні ознаки, такі як гломерулонефрит або нейропатія, можуть відмічатися як при АНЦА-негативному, так і при АНЦА-позитивному ЕГПА незалежно від фази захворювання [5]. Більше того, деякі клінічні прояви, такі як кардіоміопатія та нейропатія, можуть виникнути в результаті перехресного впливу еозинофільної інфільтрації та васкуліту [8, 14].
Згідно з результатами дослідження S. Ishigaki та співавторів (2022) пацієнти з ЕГПА більше схильні до розвитку периферичної нейропатії, ніж пацієнти з мікроскопічним поліангіїтом чи гранулематозом з поліангіїтом [10]. Водночас тяжка моторна нейропатія виявлена лише у пацієнтів з ЕГПА порівняно з іншими видами АНЦА-асоційованих васкулітів, що пов’язано з активним еозинофільним запаленням.
Продемонстровано, що наявність еозинофілії на час встановлення діагнозу не має зв’язку з позитивністю пацієнта за АНЦА, однак нижчий рівень цих клітин має позитивний взаємозв’язок з рецидивом захворювання [4]. Згідно з дослідженням Z. Zhang та співавторів (2020) вихідна позитивність за АНЦА, наявність артриту або болю в суглобах, а також високий рівень BVAS були незалежними факторами розвитку ураження периферичної нервової системи при ЕГПА [25]. Зокрема пацієнти, які мали початковий рівень BVAS ≥15, були більш схильні до виникнення периферичної нейропатії в подальшому. У нашому випадку вихідний рівень BVAS v.3 становив 27 балів (нові симптоми/погіршення стану) та 1 бал (персистуючі симптоми).
Частота ураження нервової системи у хворих на ЕГПА коливається у діапазоні 55–93% за даними різних авторів [16, 17, 21]. Найпоширенішими патернами неврологічної симптоматики є множинний мононеврит і периферична полінеройпатія, рідше виникає ураження центральної нервової системи (у 5–10% хворих) та черепно-мозкових нервів (<5% хворих) [20]. Найчастіше у патологічний процес залучаються малогомілковий, великогомілковий, ліктьовий і серединний нерви. За даними нашого власного ретроспективного дослідження, в дебюті АНЦА-асоційованих васкулітів ураження периферичної нервової системи виявлено у 14% хворих, ураження центральної нервової системи та черепно-мозкових нервів — у 4% хворих. У стадії розгорнутої клінічної картини захворювання частота неврологічних проявів досягала 51% [23, 27]. Нами не виявлено вірогідних відмінностей у частоті неврологічних маніфестацій залежно від статевої та вікової приналежності хворих на АНЦА-асоційовані васкуліти.
Згідно з рекомендаціями EULAR/ERA-EDTA для індукції ремісії вперше діагностованого ЕГПА рекомендованою є комбінація глюкокортикоїдів та циклофосфаміду або ритуксимабу [24]. У табл. 2 представлено ключові положення рекомендацій ACR (2021 р.) та EULAR/ERA-EDTA (2016 р.) щодо менеджменту пацієнтів із ЕГПА. На відміну від рекомендацій EULAR/ERA-EDTA, положення ACR більше сконцентровані на відмінностях у веденні пацієнтів із ЕГПА порівняно з гранулематозом з поліангіїтом та мікроскопічним поліангіїтом.
Таблиця 2. Порівняння рекомендацій ACR (2021 р.) та EULAR/ERA-EDTA (2016 р.) щодо менеджменту ЕГПА [3, 24]
| Рекомендації ACR (2021) | Рекомендації EULAR/ERA-EDTA (2016) |
|---|---|
|
Індукція ремісії при активному тяжкому перебігу захворювання Як початкова терапія може бути призначена внутрішньовенна пульс-терапія або високі дози пероральних глюкокортикоїдів (*Дуже низький). Для індукції ремісії можуть бути призначені циклофосфамід або ритуксимаб (*Дуже низький). Умовно рекомендується лікування циклофосфамідом або ритуксимабом замість меполізумабу для індукції ремісії (*Низький). |
Індукція ремісії при органо- або життєвозагрожувальному перебігу захворювання Рекомендованою є комбінація глюкокортикоїдів та циклофосфаміду (рівень доказовості 3; ступінь рекомендації С) АБО ритуксимабу (рівень доказовості 3; ступінь рекомендації С). |
|
Індукція ремісії при активному нетяжкому перебігу захворювання Умовно рекомендується починати лікування меполізумабом і глюкокортикоїдами замість метотрексату, азатіоприну, мофетилу мікофенолату та глюкокортикоїдів (*Дуже низький/низький). Умовно рекомендується починати лікування метотрексатом, азатіоприном або мікофенолатом мофетилу та глюкокортикоїдами замість виключно глюкокортикоїдів (*Низький). |
Індукція ремісії при неорганозагрожувальному перебігу захворювання Рекомендованою є комбінація глюкокортикоїдів та метотрексату (рівень доказовості 1В; ступінь рекомендації В) АБО мофетилу мікофенолату (рівень доказовості 1В; ступінь рекомендації С). Цю рекомендацію не слід застосовувати в наступних ситуаціях:
|
| Підтримка ремісії | |
|
Пацієнтам із тяжкою формою ЕГПА, які увійшли в ремісію на фоні терапії циклофосфамідом, умовно рекомендується лікування метотрексатом, азатіоприном або мофетилу мікофенолатом замість ритуксимабу для підтримання ремісії (*Дуже низький). Пацієнтам із тяжкою формою ЕГПА, які досягли ремісії, умовно рекомендується лікування метотрексатом, азатіоприном або мофетилу мікофенолатом замість меполізумабу (*Дуже низький). |
Для підтримки ремісії АНЦА-асоційованих васкулітів рекомендується лікування комбінацією низьких доз глюкокортикоїдів та азатіоприну, ритуксимабу, метотрексату або мофетилу мікофенолату. ЕГПА: азатіоприн (рівень доказовості 3; ступінь рекомендації С). |
| Лікування рецидиву | |
|
Пацієнтам з ЕГПА, у яких відмічено рецидив із тяжкими проявами захворювання після попередньої успішної індукції ремісії: 1) циклофосфамідом → умовно рекомендується лікування ритуксимабом замість циклофосфаміду для відновлення ремісії (*Дуже низький); 2) ритуксимабом → умовно рекомендується лікування ритуксимабом замість переходу на циклофосфамід для повторної індукції ремісії (*Дуже низький). Пацієнтам з ЕГПА, у яких відмічено рецидив із нетяжкими проявами захворювання після попередньої успішної індукції ремісії під час прийому: 1) метотрексату, азатіоприну або мофетилу мікофенолату, умовно рекомендується додавати меполізумаб замість переходу на інший засіб (*Дуже низький); 2) низьких доз глюкокортикоїдів або іншої терапії, умовно рекомендується додавати меполізумаб замість метотрексату, азатіоприну або мофетилу мікофенолату (*Дуже низький). |
Для лікування серйозного органо- або життєвозагрожувального рецидиву рекомендується лікування відповідно до тактики нового захворювання: комбінація глюкокортикоїдів і циклофосфаміду (рівень доказовості 3; ступінь рекомендації С) АБО ритуксимабу (рівень доказовості 4; ступінь рекомендації D). Для лікування нетяжких рецидивів використовується тимчасове підвищення дози глюкокортикоїдів, що відновлює ремісію у більшості пацієнтів, але залишається вірогідність повторних рецидивів протягом найближчого часу. Тому рекомендується інтенсифікація або модифікація режиму імуносупресивної терапії. |
*Рівень доказовості
Попри те, що реакція ЕГПА на застосування глюкокортикоїдів зазвичай хороша, у пацієнтів в подальшому часто виникають рецидиви. Тому проводиться активний пошук нових препаратів для лікування цього захворювання [6]. Зокрема, рекомендації ACR наголошують на можливості застосування меполізумабу для лікування ЕГПА, тоді як EULAR/ERA-EDTA 2016 р. ще не згадують про цей препарат. Меполізумаб — це моноклональні антитіла проти інтерлейкіну-5 — основного чинника еозинофільного запалення [11].
Висновки
Враховуючи хронічно-прогредієнтний перебіг ЕГПА, який проходить 3 клініко-гістологічні стадії, його вчасна діагностика часто буває утрудненою. У нашої пацієнтки протягом багатьох років основними проявами захворювання були еозинофілія та бронхіальна астма, а застосування глюкокортикоїдів для купірування загострень останньої, ймовірно, деякий час маскувало інші прояви васкуліту. Відсутність у пацієнтки АНЦА утруднювало діагностику та потребувало ретельного проведення диференційної діагностики з іншими станами, які також супроводжуються гіпереозинофілією. Рання реабілітація та адекватне лікування допомогли зберегти та частково відновити функцію периферичної нервової системи.
Список використаної літератури
- 1. Berti A., Boukhlal S., Groh M. et al. (2020) Eosinophilic granulomatosis with polyangiitis: the multifaceted spectrum of clinical manifestations at different stages of the disease. Expert Rev. Clin. Immunol., 16(1): 51–61. doi: 10.1080/1744666X.2019.1697678. Epub 2020.
- 2. Choi C.B., Park Y.B., Lee S.W. (2019) Eosinophilic Granulomatosis with Polyangiitis: Experiences in Korean Patients. Yonsei Med. J., 60(8): 705–712. doi: 10.3349/ymj.2019.60.8.705.
- 3. Chung S.A., Langford C.A., Maz M. et al. (2021) American College of Rheumatology/Vasculitis Foundation Guideline for the Management of Antineutrophil Cytoplasmic Antibody-Associated Vasculitis. Arthritis Care Res. (Hoboken), 73(8): 1088–1105. doi: 10.1002/acr.24634. Epub 2021.
- 4. Comarmond C., Pagnoux C., Khellaf M. et al. (2013) French Vasculitis Study Group. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss): clinical characteristics and long-term followup of the 383 patients enrolled in the French Vasculitis Study Group cohort. Arthritis Rheum., 65(1): 270–281. doi: 10.1002/art.37721.
- 5. Cottin V., Bel E., Bottero P. et al. (2017) Revisiting the systemic vasculitis in eosinophilic granulomatosis with polyangiitis (Churg-Strauss): a study of 157 patients by the Groupe d’Etudes et de Recherche sur les Maladies Orphelines Pulmonaires and the European Respiratory Society Taskforce one. Autoimmun. Rev., 16: 1–9. doi: 10.1016/j.autrev.2016.09.018.
- 6. Furuta S., Iwamoto T., Nakajima H. (2019) Update on eosinophilic granulomatosis with polyangiitis. Allergol. Int., 68(4): 430–436. doi: 10.1016/j.alit.2019.06.004. Epub 2019.
- 7. Grayson P.C., Ponte C., Suppiah R. et al. (2022) DCVAS Study Group. American College of Rheumatology/European Alliance of Associations for Rheumatology Classification Criteria for Eosinophilic Granulomatosis With Polyangiitis. Arthritis Rheumatol., 74(3): 386–392. doi: 10.1002/art.41982. Epub 2022.
- 8. Groh M., Masciocco G., Kirchner E. et al. (2014) Heart transplantation in patients with eosinophilic granulomatosis with polyangiitis (Churg-Strauss syndrome). J. Heart Lung Transplant., 33: 842–850. doi: 10.1016/j.healun.2014.02.023.
- 9. Harish A., Schwartz S.A. (2020) Targeted Anti-IL-5 Therapies and Future Therapeutics for Hypereosinophilic Syndrome and Rare Eosinophilic Conditions. Clin. Rev. Allergy Immunol., 59(2): 231–247. doi: 10.1007/s12016-019-08775-4.
- 10. Ishigaki S., Akiyama M., Kaneko Y. (2022) Characteristics of Anti-Neutrophil Cytoplasmic Antibody Associated Vasculitis With Severe Peripheral Neuropathy. Annals of the Rheumatic Diseases. 81: 1436–1437.
- 11. McBrien C.N, Menzies-Gow A. (2018) Mepolizumab for the treatment of eosinophilic granulomatosis with polyangiitis. Drugs Today (Barc)., 54(2): 93–101. doi: 10.1358/dot.2018.54.2.2788013.
- 12. Moiseev S., Bossuyt X., Arimura Y. et al. (2020) European EGPA Study Group. International Consensus on ANCA Testing in Eosinophilic Granulomatosis with Polyangiitis. Am. J. Respir. Crit. Care Med., doi: 10.1164/rccm.202005-1628SO. Epub ahead of print.
- 13. Oiwa H., Mokuda S., Matsubara T. et al. (2017) Neurological Complications in Eosinophilic Granulomatosis with Polyangiitis (EGPA): The Roles of History and Physical Examinations in the Diagnosis of EGPA. Intern. Med., 56(22): 3003–3008. doi: 10.2169/internalmedicine.
- 14. Oka N., Kawasaki T., Matsui M. et al. (2011) Two subtypes of Churg-Strauss syndrome with neuropathy: the roles of eosinophils and ANCA. Mod. Rheumatol., 21: 290–295. doi: 10.3109/s10165-010-0400-9.
- 15. Raffray L., Guillevin L. (2020) Updates for the treatment of EGPA. Presse Med., 49(3): 104036. doi: 10.1016/j.lpm.2020.104036.
- 16. Sada K.E., Yamamura M., Harigai M et al. (2014) Research Committee on Intractable Vasculitides, the Ministry of Health, Labour and Welfare of Japan. Classification and characteristics of Japanese patients with antineutrophil cytoplasmic antibody-associated vasculitis in a nationwide, prospective, inception cohort study. Arthritis Res. Ther., 16(2): R101. doi: 10.1186/ar4550.
- 17. Solans-Laqué R., Fraile G., Rodriguez-Carballeira M. et al. (2017) Spanish Registry of systemic vasculitis (REVAS) from the Autoimmune Diseases Study Group (GEAS) of the Spanish Society of Internal Medicine (SEMI). Clinical characteristics and outcome of Spanish patients with ANCA-associated vasculitides: Impact of the vasculitis type, ANCA specificity, and treatment on mortality and morbidity. Medicine (Baltimore)., 96(8): e6083. doi: 10.1097/MD.0000000000006083.
- 18. Trivioli G., Terrier B., Vaglio A. (2020) Eosinophilic granulomatosis with polyangiitis: understanding the disease and it`s management. Rheumatology (Oxford)., 59 (Suppl. 3): iii84-iii94. doi: 10.1093/rheumatology/kez570.
- 19. Valent P., Klion A.D., Horny H.P. et al. (2012) Contemporary consensus proposal on criteria and classification of eosinophilic disorders and related syndromes. J. Allergy Clin. Immunol., 130(3): 607–612.e9. doi: 10.1016/j.jaci.2012.02.019.
- 20. Wludarczyk A., Szczeklik W. (2016) Neurological manifestations in ANCA-associated vasculitis — assessment and treatment. Expert Rev. Neurother., 16(8): 861–863. doi: 10.1586/14737175.2016.1165095. Epub 2016.
- 21. Wójcik K., Wawrzycka-Adamczyk K., Włudarczyk A. et al. (2019) Clinical characteristics of Polish patients with ANCA-associated vasculitides-retrospective analysis of POLVAS registry. Clin. Rheumatol., 38(9): 2553–2563. doi: 10.1007/s10067-019-04538-w.
- 22. Wu E.Y., Hernandez M.L., Jennette J.C., Falk R.J. (2018) Eosinophilic Granulomatosis with Polyangiitis: Clinical Pathology Conference and Review. J. Allergy Clin. Immunol. Pract., 6(5): 1496–1504. doi: 10.1016/j.jaip.2018.07.001.
- 23. Yaremenko O.B., Petelytska L.B. (2017) The spectrum of clinical manifestations and survival of patients with primary systemic vasculitis. Development and modernisation of medical science and practice: experience of Poland and prospects of Ukraine: Collective monograph. Lublin: Izdevnieciba «Baltija Publishing», 2: 213–231.
- 24. Yates M., Watts R.A., Bajema I.M. et al. (2016) EULAR/ERA-EDTA recommendations for the management of ANCA-associated vasculitis. Ann. Rheum. Dis., 75(9): 1583–1594. doi: 10.1136/annrheumdis-2016-209133.
- 25. Zhang Z., Liu S., Guo L. et al. (2020) Clinical Characteristics of Peripheral Neuropathy in Eosinophilic Granulomatosis with Polyangiitis: A Retrospective Single-Center Study in China. J. Immunol. Res., 2020: 3530768. doi: 10.1155/2020/3530768.
- 26. Zimmermann N., Wikenheiser-Brokamp K.A. (2018) Hypereosinophilic syndrome in the differential diagnosis of pulmonary infiltrates with eosinophilia. Ann Allergy Asthma Immunol., 121(2): 179–185. doi: 10.1016/j.anai.2018.05.014.
- 27. Яременко О.Б., Петелицька Л.Б. (2017) АНЦА-асоційовані васкуліти: гетерогенність клінічних проявів, прогноз, сучасні можливості фармакотерапії. Медична наука України, 13(1–2): 98–105.
Адреса для листування:
Яременко Олег Борисович
01601, Київ, бульв. Тараса Шевченка, 13
Національний медичний університет ім. О.О. Богомольця,
кафедра внутрішньої медицини № 3

Leave a comment