ЛІКУВАННЯ ТА ПРОФІЛАКТИКА НАПАДІВ ПОДАГРИ: АКЦЕНТ НА ЯКОСТІ
Резюме. Подагричний артрит діагностується з абсолютною впевненістю, успішно контролюється за допомогою фармакотерапії і навіть вважається ідеальною моделлю для дослідження належного ведення хворих із хронічною патологією [1, 2]. Причин три: по-перше, він дуже поширений; по-друге — здатний до зворотного розвитку; по-третє, існують високоефективні методи лікування. Неоптимальна терапевтична тактика, недостатня комплаєнтність, недосягнення його цілей — все це дозволяє констатувати знижену якість медичної допомоги таким пацієнтам [3]. Мета цієї публікації — підкреслити важливість зваженого ставлення до ведення пацієнтів із подагрою. Воно ґрунтується, з одного боку, на довготривалій стратегії застосування уратзнижувальної терапії, з другого — на усуненні та попередженні нападів. Не купірувані вчасно, вони відвертають пацієнта від продовження лікування із подальшими небажаними наслідками щодо їх здоров’я, працездатності та смертності. Оскільки безпека уратзнижувальної терапії, особливо у даному випадку, є наріжним каменем прихильності до лікування, препарати мають бути тільки найвищої якості, а схеми лікування — ретельно вивірені.
DOI: 10.32471/rheumatology.2707-6970.89.17382
Ревматологи традиційно ретельніше, ніж терапевти/лікарі сімейної медицини дотримуються вимог клінічних настанов щодо лікування подагри, але і серед них відповідний показник залишає бажати кращого [4]. Завдання клініциста полягає у тому, щоб обережно провести хворого до бажаної мети — підтримки сироваткового рівня сечової кислоти (СК) на рівні <6 мг/дл, що практично повністю убезпечує від нападів подагри у найближчому майбутньому [5]. Так, успішна тривала уратзнижувальна терапія (УЗТ) в одному з обсерваційних досліджень 5-річної тривалості від початку або від зникнення тофусів після її відміни була пов’язана із кількарічним періодом підтримки показника СК на безпечному рівні [6].
На жаль, пацієнтам часто не вистачає кваліфікованої підтримки для того, щоб продовжувати УЗТ згідно з рекомендаціями провідних клінічних настанов — до досягнення цільових показників (treat-to-target approach) із моніторингом рівня СК та поступовим титруванням доз. Проблемний момент: попри те, що довгострокова УЗТ запобігає загостренням (завдяки розчиненню відкладених кристалів), на її початку частота нападів подагри зростає.
Це парадоксальне початкове погіршення стану може тривати місяцями (рис. 1), змінюючись подальшим покращанням. Такий винятковий для сучасної ревматології феномен часто недооцінюють і погано пояснюють пацієнтам, що зумовлює передчасне припинення лікування [7]. У результаті майже половина хворих, що розпочали УЗТ, не продовжують її [8]. Між тим, безпечне проходження через «мобілізаційні напади» (mobilization flares), що виявляють майже у кожного четвертого пацієнта на фоні УЗТ [2], потребує кваліфікованої поради та допомоги.
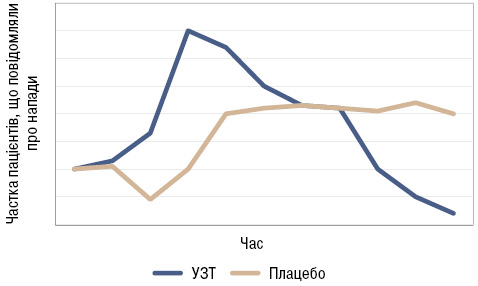
Проте якщо зовсім не застосовувати УЗТ, як передбачено розкритикованими за це рекомендаціями Американської колегії терапевтів (American College of Physicians — АСР) [9], або використовувати надто низькі дози протягом короткого періоду, результатом буде тенденція до прогресування патологічних змін (рис. 2).
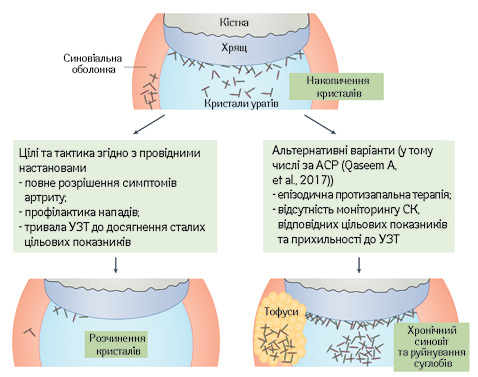
Таким чином, щоб успішно провести хворого через перипетії адекватної терапії подагри, слід вміло поєднувати різні тактичні прийоми, про що йдеться у найвідоміших світових клінічних рекомендаціях, зокрема, Європейського альянсу ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR) [3; 10; 11; 12; 13; 14].
Деякі принципи ведення хворих
1. Інформування кожного пацієнта про патофізіологію захворювання, наявність ефективних методів, принципи лікування гострих нападів і попередження утворення кристалів шляхом довічного зниження рівня СК нижче цільового.
Подагра є найпоширенішим запальним захворюванням суглобів у західному світі [16]. У Європі її поширеність коливається від 0,9% до 2,5% залежно від країни [10]. Окрім генетичної схильності, на її розвиток впливають соціальні та поведінкові фактори, такі як збільшення тривалості життя та достатку, достатні для надмірного харчування та ожиріння, а також вживання алкоголю.
Подагричний артрит викликається як гострими, так і хронічними запальними явищами у відповідь на відкладення кристалів моногідрату урату натрію. З фізико-хімічної точки зору подагра розвивається, коли рівень СК у крові перевищує точку насичення (6,8 мг/дл). Окрім стійкої гіперурикемії, зародженню та росту кристалів можуть сприяти місцеві характеристики тканин. Запалення уражує здебільшого м’язово-сухожильні структури, синовіальні оболонки та суглобові сумки. Другою за частотою ураження після суглобів і навколосуглобових структур локалізацією відкладень є шкіра та кістки. Їх ураження вказує на більшу поширеність та тяжкість процесу.
За винятком рідкісних моногенних розладів, подагра є мультифакторним захворюванням, спричиненим співіснуванням кількох факторів ризику. Подагра частіше відмічається у чоловіків, її поширеність зростає з віком. Проте у жінок поширеність швидко збільшується після менопаузи, що, ймовірно, зумовлено урикозуричним ефектом естрогенів. Гіперурикемія пов’язана з генетично детермінованими варіантами ниркових і кишкових транспортерів СК. Її розвиток зумовлюють деякі патологічні стани (наприклад ожиріння та захворювання нирок) або зовнішні фактори (деякі лікарські засоби) (таблиця). Серед останніх називають діуретики, блокатори бета-адренорецепторів, інгібітори ангіотензинперетворювального ферменту та блокатори рецепторів ангіотензину II (крім лозартану), циклоспорин і такролімус. Навпаки, антагоністи кальцію та лозартан викликають незначний урикозуричний ефект.
Таблиця. Вторинні причини гіперурикемії внаслідок порушення обміну уратів [3]
| Гіперпродукція | Гіпоелімінація |
|---|---|
|
Багата пуринами дієта Прискорений розпад аденозинтрифосфату (етанол, інтенсивне фізичне навантаження, ішемія тканин, порушення обміну глюкози) Псоріаз Хвороба Педжета Захворювання крові та онкопатологія, пов’язані з високим обміном у клітинах Цитотоксична хіміотерапія (включаючи синдром лізису пухлини) Вроджені порушення метаболізму пуринів (надактивність фосфорибозилпірофосфатсинтетази, дефіцит гіпоксантин-гуанінфосфорибозилтрансферази — синдроми Леша-Найхана і Келлі-Зегміллера) Дефіцит глюкозо-6-фосфатдегідрогенази |
Хронічна хвороба нирок Зменшення об’єму позаклітинної рідини, зневоднення Ацидоз Ліки (наприклад, тіазидні діуретики, петльові діуретики, ніацин, піразинамід, циклоспорин) Отруєння свинцем (сатурнінова подагра) Анальгетична нефропатія Полікістоз нирок Медуллярно-кістозна хвороба нирок Інші спадкові інтерстиціальні захворювання нирок Ендокринні захворювання (гіперпаратиреоз, гіпотиреоз) |
Важливо, що значну роль у патогенезі подагри відіграють генетичні фактори та захворювання нирок, що не є загальновідомим. Так, на кожні 30 мл/хв/1,73 м2 зниження розрахункової швидкості клубочкової фільтрації (ШКФ) виявлено 2–3-кратне збільшення поширеності подагри [17]. Стереотипне уявлення хворого з подагрою пухким чоловіком, не стриманим у вживанні їжі та алкогольних напоїв, мабуть, викликає небажання деяких пацієнтів звертатися за допомогою.
До розвитку подагри у хворих, як правило, відмічають високий рівень СК у сироватці крові протягом деякого часу. Останні дослідження, проведені за участю майже 19 тис. пацієнтів, показують, що 9% осіб із рівнем СК у сироватці крові 7–8 мг/дл протягом 15 років розів’ється подагра порівняно з 49% тих, у кого рівень СК у сироватці крові вище 10 мг/дл [18]. Тож, імовірно, існують місцеві фактори, які сприяють або перешкоджають локальному відкладенню кристалів у пацієнтів з гіперурикемією. До того ж у близько 15–35% пацієнтів зі стійкою гіперурикемією виявляють кристали СК, незважаючи на відсутність у них гострих нападів подагри [19].
2. Кожен пацієнт із подагрою повинен отримати поради щодо способу життя: зменшення маси тіла, уникання вживання алкоголю (особливо пива та горілки), солодких напоїв (з додаванням фруктози, а також апельсиновий та яблучний соки), надмірного споживання м’яса та морепродуктів (підвищують схильність до характерного запалення). Слід заохочувати вживання нежирних молочних продуктів та рекомендувати регулярні фізичні вправи.
Дієта, багата пуринами, наприклад червоне м’ясо або морепродукти, дещо підвищує ризик розвитку подагри. Вживання алкоголю має взаємозв’язок між дозою та реакцією на появу подагри, причому збільшення особливо помітне щодо пива, яке містить гуанозин, пурин, а також алкоголь. Також є солодкі безалкогольні напої та фруктоза, що асоціюються з ризиком розвитку подагри. Навпаки, кава, молочні продукти, вишневий сік, здається, є захисними засобами [20].
3. Гострі напади подагри слід усувати якомога раніше. Повністю поінформованих пацієнтів необхідно навчити займатися самолікуванням при перших попереджувальних симптомах («таблетка у кишені»). Вибір препарату (препаратів) має ґрунтуватися на наявності протипоказань, попередньому досвіді лікування, часу від початку загострення, а також кількості та типу уражених суглобів.
Як лікувати напади? Провідні настанови одностайно рекомендують нестероїдні протизапальні препарати (НПЗП; плюс інгібітори протонної помпи, якщо необхідно) та/або колхіцин (протягом 12 год після початку). Застосування як останнього, так і НПЗП, слід уникати пацієнтам із тяжкою нирковою недостатністю. Колхіцин не слід призначати хворим, які отримують потужні інгібітори P-глікопротеїну та/або CYP 3A4, такі як циметидин, циклоспорин, флуоксетин, кетоконазол або кларитроміцин. Рекомендованими препаратами першого ряду також є кортикостероїди (протягом 3–5 днів перорально або внутрішньосуглобово).
Робоча група EULAR не визначає пріоритету між цими варіантами через відсутність прямих порівняльних доказів, але, на відміну від попередніх рекомендацій 2006 р., радить розглянути комбіновану терапію, таку як колхіцин і НПЗП, для пацієнтів з особливо тяжкою подагрою, наприклад, коли напади включають кілька суглобів.
Профілактика нападів, згідно з EULAR, рекомендована протягом перших 6 міс УЗТ. Знову ж таки, при виборі препарату пацієнти та лікарі повинні пам’ятати про потенційну нейро- та/або м’язову токсичність колхіцину при нирковій недостатності або лікуванні статинами. Якщо немає протипоказань, слід розглянути можливість профілактики за допомогою низьких доз НПЗП.
У настанові Американського коледжу ревматології (American College of Rheumatology) йдеться про помірний доказ необхідності протизапальної профілактичної терапії на початку УЗТ (терміном 3–6 міс на основі 8 рандомізованих контрольованих та 2 обсерваційних досліджень) [10]. Продовження протизапального лікування потрібне, якщо у пацієнта тривають напади.
Більшість настанов, посилаючись на експертний консенсус, рекомендує продовження УЗТ під час гострих нападів подагри. При цьому необхідно підвищувати дози та комбінувати лікарські препарати першої лінії.
Диклофенак у лікуванні подагри
Як зазначено вище, у клінічних рекомендаціях для лікування нападів та їх профілактики рекомендують застосовувати традиційні НПЗП або селективні до циклооксигенази 2-го типу (ЦОГ-2). Характерною рисою останніх вважають нижчу гастротоксичність, проте виокремлення у такій якості лише коксибів є значною мірою умовним. Так, диклофенак належить до традиційних НПЗП, але in vitro він має вищу селективність щодо ЦОГ-2, майже як целекоксиб [21]. У терапевтичній концентрації диклофенак демонструє селективність до ЦОГ-2 також in vivo. Крім того, диклофенак є одним з найбільш ефективних інгібіторів продукції простагландину Е2 (PGE2) — потужного медіатора запалення, який утворюється шляхом перетворення арахідонової кислоти за допомогою ЦОГ-2. Диклофенак у дозі 100 мг/добу зумовлював сприятливі результати порівняно з ібупрофеном у дозі 1200 мг/добу щодо полегшення болю у суглобах [22].
Завдяки своїй слабокислій природі та високому ступеню зв’язування з білками плазми крові диклофенак накопичується та зберігається у запалених тканинах і синовіальній рідині навіть довше, ніж в плазмі, що забезпечує тривалий знеболювальний та протизапальний ефект незалежно від короткого періоду напіввиведення. In vitro диклофенак у концентраціях, еквівалентних тим, які досягаються при лікуванні пацієнтів, не пригнічує біосинтезу протеогліканів хрящової тканини. З іншого боку, короткий період напіввиведення може підвищити безпеку диклофенаку порівняно з НПЗП, що виводяться довше, завдяки більш повному відновленню активності ЦОГ у неуражених тканинах. При цьому цільової терапевтичної ефективності зазвичай досягають за умови пригнічення активності ЦОГ-2 на 80%. Подальше підвищення дози зумовлює ризик розвитку побічних ефектів. Тому серцево-судинні події, про які повідомляється в літературі, переважно відзначали при дозах вище 100–150 мг/добу [22].
Ще один досить важливий аспект безпеки стосується призначення разом із ацетилсаліциловою кислотою. Так, на відміну від багатьох інших НПЗП (напроксен), що значною мірою інгібують ЦОГ-1 і таким чином конкурують із ацетилсаліциловою кислотою, проте не реалізують цей ефект незворотно та повністю у тромбоцитах, диклофенак не перешкоджає кардіопротекторній дії ацетилсаліцилової кислоти.
Тож для повної та безпечної реалізації потенціалу протизапальної та знеболювальної дії диклофенаку необхідне адекватне точне дозування. Забезпечити це можливо при застосуванні лише якісних препаратів із точно встановленими біодоступністю та фармакокінетичним профілем. Також у нагоді стають лікарські форми препарату, що додатково підвищують безпеку, не погіршуючи ефективності. Такий потенціал повністю реалізований у лінійці препаратів під брендовою назвою Диклоберл®. Недарма препарати під цим брендом входять до топ-5 призначень лікарів усіх спеціальностей пацієнтам з подагрою в Україні у 2021 р. [23].
Диклоберл® № 75 у формі розчину для ін’єкцій (75 мг/3 мл) після введення негайно починає всмоктуватися, швидко потрапляє у кров та стрімко виводиться, тому якнайкраще підходить для лікування нападів подагри. Середня максимальна концентрація у плазмі крові, що становить близько 2,558±0,968 мкг/мл (2,5 мкг/мл приблизно дорівнює 8 мкмоль/л), досягається через 20 хв. При цьому площа під фармакокінетичною кривою (Area Under the Curve — AUC) після внутрішньом’язового або внутрішньовенного введення приблизно вдвічі більша, ніж після перорального або ректального, тому що цей шлях дає змогу уникнути метаболізму першого проходження через печінку.
Диклоберл® ретард у формі твердих капсул пролонгованої дії містить 100 мг диклофенаку натрію. Унаслідок повільного вивільнення активної речовини максимальна концентрація препарату, яка досягається у плазмі крові, нижча, ніж після застосування таблеток, вкритих кишково-розчинною оболонкою. Середній пік концентрації 0,4 мкг/мл або 0,5 мкг/мл (1,25 або 1,6 мкмоль/л) досягається у середньому впродовж 5–6 год після застосування таблетки 75 мг або 100 мг. Прийом їжі клінічно не впливає на всмоктування і системну біодоступність диклофенаку з капсул пролонгованої дії, яка становить 82% від відповідного показника після застосування внутрішньо кишково-розчинної таблетки у тій самій дозі.
Оскільки близько половини диклофенаку метаболізується під час першого проходження через печінку (ефект першого проходження), AUC після застосування капсули Диклоберл® ретард майже вдвічі менша, ніж у разі парентерального введення еквівалентної дози препарату. Після повторного застосування цього препарату показники фармакокінетики не змінюються. При дотриманні рекомендованих інтервалів між прийомами окремих доз препарату кумуляції не відзначається. Відповідні концентрації становлять 22 та 25 нг/мл (70 та 80 нмоль/л) при застосуванні диклофенаку у пролонгованій формі 75 мг 2 рази на добу. У той же час середня концентрація у плазмі крові 13 нг/мл (40 нмоль/л) може відзначатися через 24 год (16 год) після застосування диклофенаку натрію у пролонгованій формі 75 мг.
Диклофенак з препарату Диклоберл® у формі супозиторіїв по 50 та 100 мг всмоктується також повільніше, ніж при застосуванні таблеток з кишково-розчинним покриттям. Після застосування супозиторіїв 50 мг максимальна концентрація у плазмі крові досягається приблизно через 1 год, але цей показник на одиницю дози становить близько ⅔ концентрації, що досягається після застосування таблеток із кишково-розчинним покриттям (1,95 ± 0,8 мкг/мл (1,9 мкг/мл = 5,9 мкмоль/л)).
Біодоступність. Як і в разі застосування пероральних лікарських форм препарату, AUC становить приблизно половину від значення, отриманого при застосуванні парентеральної дози. Після багаторазового застосування препарату його фармакокінетика не змінюється. Кумуляції препарату не виявлено за умови дотримання рекомендованого дозування.
Після потрапляння диклофенаку до синовіальної рідини максимальна концентрація встановлюється через 2–4 год після досягнення пікового значення у плазмі крові. Очікуваний період напіввиведення із синовіальної рідини становить 3–6 год. Через 2 год після досягнення пікового значення у плазмі крові концентрація діючої речовини в синовіальній рідині стає вищою і залишається такою протягом періоду до 12 год. Кінцевий період напіввиведення у плазмі крові становить 1–2 год. 4 метаболіти, включаючи 2 активних, також мають короткий період напіввиведення з плазми крові — 1–3 год.
У пацієнтів літнього віку жодної різниці в абсорбції, метаболізмі або екскреції препарату не виявлено, як і взагалі залежно від віку хворого. У пацієнтів з порушенням функції нирок при дотриманні режиму звичайного дозування не очікується накопичення речовини, виходячи з кінетики препарату після одноразового застосування. При кліренсі креатиніну <10 мл/хв рівень гідроксиметаболітів у плазмі крові приблизно у 4 рази вищий, ніж у здорових добровольців. У пацієнтів із хронічним гепатитом або компенсованим цирозом печінки кінетика та метаболізм диклофенаку є такими ж, як і у пацієнтів без захворювання печінки.
Підсумовуючи, слід зазначити, що життя без нападів подагри є цілком здійсненним завданням, якщо пацієнт та лікар наберуться терпіння для активної співпраці та візьмуть у свій арсенал якісні ліки — такі як вироблені у Німеччині препарати під брендом Диклоберл.
Список використаної літератури
- 1. Nguyen A.D., Lind K.E., Day R.O. et al. (2022) Measuring quality of gout management in residential aged care facilities. Rheumatol Adv. Pract., Nov 28; 6(3): rkac091.
- 2. Hoskison K.T., Wortmann R.L. (2007) Management of gout in older adults: barriers to optimal control. Drugs Aging.; 24(1): 21–36.
- 3. Clinical Practice Guidelines for the Management of Patients with Gout (2020) Spanish Society of Rheumatology (SSR) at spreumatologia.pt/wp-content/uploads/2019/12/31_portuguese-recommendations-for-the-diagnosis-and-management-_file.pdf.
- 4. Oderda G.M., Shiozawa A., Walsh M. et al. (2014) Physician adherence to ACR gout treatment guidelines: perception versus practice. Postgrad. Med., May; 126(3): 257–67.
- 5. Perez-Ruiz F. (2009) Treating to target: a strategy to cure gout. Rheumatology (Oxford), May; 48 (Suppl. 2): ii9–ii14.
- 6. Perez-Ruiz F., Atxotegi J., Hernando I. et al. (2006) Using serum urate levels to determine the period free of gouty symptoms after withdrawal of long-term urate-lowering therapy: a prospective study. Arthritis Rheum., Oct 15; 55(5): 786–90.
- 7. Choi H.K., Zhang Y., Dalbeth N. (2022) When underlying biology threatens the randomization principle — initial gout flares of urate-lowering therapy. Nat. Rev. Rheumatol. 18: 543–549.
- 8. Proudman C., Lester S.E., Gonzalez-Chica D.A. et al. (2019) Gout, flares, and allopurinol use: a population-based study. Arthritis Res. Ther. 21: 132.
- 9. Qaseem A., Harris R.P., Forciea M.A. (2017) Clinical Guidelines Committee of the American College of Physicians. Management of Acute and Recurrent Gout: A Clinical Practice Guideline From the American College of Physicians. Ann. Intern. Med., Jan 3; 166(1): 58–68.
- 10. Richette P., Doherty M., Pascual E. et al. (2017) 2016 updated EULAR evidence-based recommendations for the management of gout. Ann. Rheum. Dis., Jan; 76(1): 29–42.
- 11. FitzGerald J.D., Dalbeth N., Mikuls T. et al. (2020) American College of Rheumatology Guideline for the Management of Gout. Arthritis Care Res (Hoboken), Jun; 72(6): 744–760.
- 12. Hui M., Carr A., Cameron S. et al. (2017) British Society for Rheumatology Standards, Audit and Guidelines Working Group. The British Society for Rheumatology Guideline for the Management of Gout. Rheumatology (Oxford), Jul 1; 56(7): e1–e20.
- 13. Ughi N., Prevete I., Ramonda R. et al. (2019) The Italian Society of Rheumatology clinical practice guidelines for the diagnosis and management of gout. Reumatismo, Sep 23; 71(S1): 50–79.
- 14. Araújo F., Cordeiro I., Teixeira F. et al. (2014) Portuguese recommendations for the diagnosis and management of gout. Acta Reumatol. Port., Apr-Jun; 39(2): 158–71.
- 15. Dalbeth N., Bardin T., Doherty M. et al. (2017) Discordant American College of Physicians and international rheumatology guidelines for gout management: consensus statement of the Gout, Hyperuricemia and Crystal-Associated Disease Network (G-CAN). Nat. Rev. Rheumatol., Sep; 13(9): 561–568.
- 16. Sautner J., Eichbauer-Sturm G., Gruber J. et al. (2022) 2022 update of the Austrian Society of Rheumatology and Rehabilitation nutrition and lifestyle recommendations for patients with gout and hyperuricemia. Wien Klin. Wochenschr.,134: 546–554.
- 17. Major T.J., Dalbeth N., Stahl E.A. et al. (2018) An update on the genetics of hyperuricaemia and gout. Nat. Rev. Rheumatol.; 14(6): 341–53.
- 18. Dalbeth N., Phipps-Green A., Frampton C. et al. (2018) Relationship between serum urate concentration and clinically evident incident gout: an individual participant data analysis. Ann. Rheum. Dis.; 77(7): 1048–52.
- 19. De Miguel E., Puig J.G., Castillo C. et al. (2012) Diagnosis of gout in patients with asymptomatic hyperuricaemia: a pilot ultrasound study. Ann. Rheum. Dis.; 71(1): 157–8.
- 20. Zhang Y., Chen S., Yuan M. et al. (2022) Gout and Diet: A Comprehensive Review of Mechanisms and Management. Nutrients. Aug 26; 14(17): 3525.
- 21. Franceschi F., Saviano L., Petruzziello C. et al. (2016) Safety and efficacy of low doses of diclofenac on acute pain in the emergency setting. Eur. Rev. Med. Pharmacol. Sci., Oct; 20(20): 4401–4408.
- 22. Guyot P., Pandhi S., Nixon R.M. et al. (2017) Efficacy and safety of diclofenac in osteoarthritis: Results of a network meta-analysis of unpublished legacy studies. Scand. J. Pain, Jul; 16: 74–88. doi: 10.1016/j.sjpain.2017.03.006. Epub 2017 Apr 22.
- 23. RxTest — експертно-аналітичний продукт соціологічного дослідження серед аудиторії лікарів 16 спеціальностей 28 міст України компанії «Proxima Research».

Leave a comment