РОЛЬ МОЛЕКУЛИ МІЖКЛІТИННОЇ АДГЕЗІЇ (ICAM)-1 У ПРОЦЕСІ ВИЗНАЧЕННЯ СЕРЦЕВО-СУДИННОГО РИЗИКУ У ПАЦІЄНТІВ З РЕВМАТОЇДНИМ АРТРИТОМ
Резюме. Вступ. Ревматоїдний артрит стійко асоціюється із підвищенням серцево-судинного ризику. Пошук нових предикторів розвитку атеросклеротичних змін у судинному руслі є особливо значущим на сьогодні. Мета. Вивчити роль міжклітинної молекули клітинної адгезії (ІСАМ)-1 у патогенезі кардіоваскулярної патології серед пацієнтів із ревматоїдним артритом (РА). Матеріали і методи. Дослідження проводилося за участю 120 пацієнтів з РА, розподілених на 3 групи з урахуванням активності захворювання за індексом DAS-28, та 25 осіб, що увійшли до групи контролю. Визначення товщини комплексу інтима — медіа (КІМ) проводили за стандартною методикою у місці біфуркації зовнішньої та внутрішньої сонної артерії. Субклінічним атеросклеротичним ураженням вважався показник КIM >0,9 мм. Водночас наявність атеросклеротичної бляшки була підтверджена, якщо фокальна структура проникала в просвіт сонної артерії щонайменше на 0,5 мм або 50% суміжного значення КIM або показник КIM досягав >1,5 мм. Визначення концентрації ІСАМ-1 у плазмі крові проводили за допомогою імуноферментного аналізу (ELISA). Статистичний аналіз виконано за допомогою програми Statistical Package for the Social Sciences version 26.0 software (SPSS Inc., Chicago, IL, USA). Результати. Аналіз результатів дослідження свідчить про більш часте атеросклеротичне ураження судин серед пацієнтів із РА порівняно з контрольною групою. Окрім цього, зростання ІСАМ-1 асоціювалося з активністю захворювання. Найвищі показники ІСАМ-1 відмічені у пацієнтів групи з високою активністю РА (394,8 [341,2–468,3)]). Найсильніший прямий кореляційний зв’язок простежувався між ІСАМ-1 та С-реактивним білком, DAS-28 (r=0,557 та r=0,562 відповідно). У ході дослідження вдалося підтвердити наявність взаємозв’язку між підвищенням концентрації IСAM-1 в плазмі крові та показниками товщини КІМ (відносний ризик (OR) 1,1 (1,01–1,3); p<0,001). Значення концентрації IСAM-1 289,5 нг/мл характеризувалося 85% чутливістю та 65% специфічністю в ході перевірки імовірності зростання товщини КІМ понад 0,9 мм. Висновки. ІСАМ-1 є потенційним додатковим маркером раннього атеросклеротичного ураження судин у пацієнтів із РА.
DOI: 10.32471/rheumatology.2707-6970.89.17436
УДК: 616-071+616.12-005.4+616.72-002.77+616-08
Вступ
Ревматоїдний артрит (РА) — це системне аутоімунне захворювання, що характеризується підвищеною захворюваністю та смертністю від серцево-судинних захворювань (ССЗ) [1]. Механізми, що пов’язують РА та ССЗ, досить багатогранні. Вони включають спільні медіатори запалення, посттрансляційні модифікації пептидів/білків і наступну імунну відповідь, зміни в складі та функції ліпопротеїнів, підвищений оксидативний стрес та ендотеліальну дисфункцію [2]. Незважаючи на поглиблення розуміння цих механізмів та їх складної взаємодії зі звичайними серцево-судинними факторами ризику, оптимальні підходи до стратифікації ризику, профілактики та лікування в контексті РА залишаються невідомими. Багатогранний підхід до зменшення тягаря ССЗ потребує оптимального управління традиційними факторами ризику на додаток до тих, що властиві РА, наприклад підвищена активність захворювання. Необхідні додаткові дослідження, щоб встановити, чи існують преференційні методи лікування РА з точки зору профілактики ССЗ. Зрештою, розуміння унікальних механізмів ССЗ при РА допоможе у стратифікації ризику та ідентифікації нових цілей для значущого зниження серцево-судинного ризику у пацієнтів цієї когорти.
Атеросклероз є важливою патологічною причиною ССЗ. Це прогресуюче захворювання, що характеризується накопиченням ліпідів і фіброзних елементів у стінках артерій та бере свій початок з доклінічного збільшення товщини внутрішньої та медіальної мембран артеріальної стінки.
Формування атеросклеротичних уражень — складний процес, який часто триває десятиліттями. Його зумовлює низка різноманітних факторів [3]. Деякі з гіпотез припускають, що найперші події в атерогенезі є частиною запальної відповіді [4]. Таким чином, найбільш ранні жирові смуги ураження утворюються після початкового пошкодження ендотеліальних клітин (ЕК), що призводить до активації ендотелію та підвищених рівнів молекул адгезії [5–7]. Цей процес полегшує інфільтрацію субендотеліального простору атерогенними ліпопротеїнами, моноцитами і Т-клітинами.
Зв’язування та залучення циркулюючих лейкоцитів в ендотелій судин і подальша міграція в субендотеліальні простори є основними процесами в розвитку атеросклерозу, що опосередковуються різноманітною сім’єю молекул клітинної адгезії, які експресуються на поверхні ендотеліальних клітин судин [8]. Серед ідентифікованих молекул адгезії, експресія та біологічні властивості VCAM-1, молекули адгезії ендотеліальних лейкоцитів-1 (E-селектину) та ICAM-1 добре охарактеризовані [9–11]. Накопичені дані свідчать про те, що селектини опосередковують початкову міграцію лейкоцитів уздовж ендотелію, і що VCAM-1 і ICAM-1 відіграють важливу роль у міцному прикріпленні та трансендотеліальній міграції лейкоцитів. Ці молекули постійно виявляли в середовищі атеросклеротичної бляшки. Результати імуногістохімічних досліджень показують різні рівні експресії цих молекул, які відображають їх унікальні структурні та функціональні характеристики [12–14]. Циркулюючі форми VCAM-1, E-селектину та ICAM-1 виявлені в плазмі крові, їх рівень підвищується під час запальних станів. У деяких детальних патологічних дослідженнях задокументовано підвищену експресію молекул клітинної адгезії на ендотеліальних клітинах та інших типах тканин [15].
Існує гіпотеза про те, що рівень ICAM-1 в плазмі крові може бути корисним маркером підвищеної експресії молекул клітинної адгезії при атеросклерозі. Рівень ICAM-1 підвищений в сироватці крові пацієнтів із ССЗ, аутоімунними розладами, а також онкологічними захворюваннями. У кількох дослідженнях підтверджено кореляцію рівня ICAM-1 у плазмі крові з тяжкістю цих захворювань [16].
Таким чином, наше дослідження має на меті оцінити зв’язок між ICAM-1 та маркерами запалення, активністю захворювання та товщиною КІМ у пацієнтів із РА.
Матеріали та методи дослідження
Дане дослідження включало 120 пацієнтів зі встановленим діагнозом РА на основі критеріїв класифікації Американського коледжу ревматології (American College of Rheumatology — ACR)/Європейського альянсу ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR) 2010 р. [17] та згідно з Наказом МОЗ України від 11.04.2014 р. № 263, які проходили стаціонарне лікування в ревматологічному відділенні Обласної клінічної лікарні (ОКЛ) м. Івано-Франківськ. Ще 25 осіб сформували групу контролю. Усі суб’єкти, які були залучені у дослідження, надали інформовану згоду щодо використання їхніх даних. Відповідність цієї наукової роботи визначеним нормам законодавства України та Гельсінської декларації Всесвітньої медичної асоціації підтверджена етичною комісією ОКЛ м. Івано-Франківськ.
Критеріями включення були вік ≥18 років та для пацієнтів з РА — активна форма захворювання (індекс DAS-28 >2,6). Нами виключено з дослідження курців, пацієнтів із супутніми ревматичними захворюваннями, цукровим діабетом (ЦД), артеріальною гіпертензією (АГ), із задокументованими ССЗ, вагітних, а також пацієнтів, які отримували ліпідознижувальну терапію в анамнезі. Впродовж останнього року включені у дослідження пацієнти з РА приймали стабільну дозу метотрексату 10–15 мг на тиждень.
Пацієнти, що сформували основну групу, були розподілені на 3 підгрупи залежно від індексу активності РА. Перша підгрупа — з низькою активністю захворювання (НАЗ) налічувала 40 пацієнтів (DAS-28 >2,6–3,2); друга підгрупа — з помірною активністю захворювання (ПАЗ) включала 40 пацієнтів (DAS-28 >3,2–5,1); група з високою активністю захворювання (ВАЗ) налічувала 40 пацієнтів (DAS-28 >5,1) [18].
Для клініко-лабораторної оцінки активності та запальної складової захворювання нами проведено визначення швидкості осідання еритроцитів (ШОЕ), С-реактивного білка (СРБ), фібриногену, показників візуально-аналогової шкали (ВАШ) та активності захворювання (DAS-28), кількості набряклих суглобів (КНС), кількості болючих суглобів (КБС).
Для визначення показників ІCAM-1 зразки крові відбирали у пацієнтів з 09:00 до 10:00 після 30-хвилинного відпочинку в ліжку, попередивши будь-яку ймовірність контакту з сигаретним димом. Сироватку, отриману в ході центрифугування зразків крові, зберігали до моменту аналізу при температурі –80 °C. Рівень ІCAM-1 вимірювали за допомогою методу імуноферментного аналізу (ELISA) з моноклональними антитілами проти людського ІCAM-1 (Elabscience Co., Х’юстон, Техас, США).
Оцінку товщини КІМ здійснювали з використанням ультразвукової допплерографії периферичних артерій. Визначення товщини КІМ проводили у ділянці біфуркації загальної та внутрішньої сонних артерій з правого та лівого боку. У ході дослідження використали апарат фірми «Toshiba SSH-160A» (Японія) з лінійним датчиком 5,5–7,5 МГц; процедура оцінювання товщини КІМ проходила у режимі реального часу за стандартною методикою [19]. Згідно з рекомендаціями Європейського товариства кардіологів (European Society of Cardiology — ESC)/ Європейського товариства гіпертензії (European Society of Hypertension — ESH) (2013) безсимптомне пошкодження судин визначали при КIM >0,9 мм. Водночас наявність атеросклеротичної бляшки була підтверджена, якщо фокальна структура проникала в просвіт сонної артерії щонайменше на 0,5 мм або 50% суміжного значення КIM або показник КIM досягав >1,5 мм [20].
Статистичний аналіз
Характер розподілу даних оцінювали за допомогою тесту Колмогорова — Смірнова. Статистичні дані представлені як M±SD (де M — середнє арифметичне, а SD — стандартне відхилення від середнього арифметичного) для нормально розподілених даних і Me (IQR: Q1–Q3) (де Me — медіана, а IQR — інтерквартильний діапазон) для даних з ненормальним розподілом. Статистичну різницю між категоріальними та неперервними змінними аналізували за допомогою критеріїв Хі-квадрат та Манна — Уїтні відповідно. Для порівняння трьох і більше груп змінних використовували односторонній непараметричний дисперсійний аналіз (критерій Краскела — Уолліса) з попарними порівняннями. Кореляційний аналіз Спірмена використовувався для визначення асоціацій між досліджуваними показниками. Обрані змінні оцінювали за допомогою бінарного логістичного регресійного аналізу (BLR) з поправкою на вік і стать. Значення при р<0,05 вважалися статистично значущими. Для аналізу статистичних даних використано програмне забезпечення Statistical Package for the Social Sciences версії 26.0 (SPSS Inc., Чикаго, Іллінойс, США).
Результати
У ході нашої наукової роботи вдалося підтвердити підвищення концентрації ІСАМ-1 у плазмі крові пацієнтів з РА порівняно з особами контрольної групи (173,5 (113,5–196,7) p <0,001). Окрім цього, варто звернути увагу на тенденцію до зростання значень показника ICAM-1 залежно від підвищення активності захворювання серед пацієнтів (табл. 1).
Таблиця 1. Лабораторні параметри пацієнтів з РА та осіб з контрольної групи з урахуванням активності захворювання
| Контрольна група(1-ша) | 2,6<DAS-28≤3,2(2-га) | 3,2>DAS-28≤5,1 (3-тя) | DAS-28 >5,1(4-та) | |
|---|---|---|---|---|
| CРБ, мг/л | 4,6±1,9 | 25,8±10,4 | 27,3±13,7 | 37,7 (19,2–241,5) |
| ШОЕ, мм/год | 13,2±3,7 | 22,8±9,7 | 23,5 (16–34) | 36,7±11,4 |
| ВАШ, одиниці | – | 5,5 (3,4–7,6) | 6,5 (4–9,5) | 7,5 (4,2–9,0) |
| Фібриноген, мг/дл | 285,6±43,5 | 415,6±54,8 | 477,1±49,6 | 532,6±61,2 |
| DAS-28 | – | 2,9±0,1 | 4,5±0,3 | 8,2±0,7 |
| Ревматоїдний фактор (РФ), МО/мл | 4 (3–10) | 17 (14–19) | 20 (16–24) | 22 (20–28) |
| ICAM-1, нг/мл | 173,5 (113,5–196,7) | 349,3 (294,7–415,3) | 361,5 (303,6–427,1) | 394,8 (341,2–468,3) |
| Група | Група | p (фібриноген) | p (РФ) | p (DAS-28) | р (ВАШ) | p (ШОЕ) | p (СРБ) | p (ICAM) |
|---|---|---|---|---|---|---|---|---|
| 1-ша | 2 | <0,001 | <0,001 | – | – | <0,001 | <0,001 | <0,001 |
| 3 | <0,001 | <0,001 | – | – | <0,001 | <0,001 | <0,001 | |
| 4 | <0,001 | <0,001 | – | – | <0,001 | <0,001 | <0,001 | |
| 2 | 1 | <0,001 | <0,001 | – | – | <0,001 | <0,001 | <0,01 |
| 3 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | |
| 4 | <0,005 | <0,05 | <0,05 | <0,05 | <0,005 | <0,005 | <0,05 | |
| 3 | 1 | <0,001 | <0,001 | – | – | <0,001 | <0,001 | <0,001 |
| 2 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | <0,05 | |
| 4 | <0,05 | <0,05 | <0,05 | <0,05 | <0,005 | <0,005 | <0,05 | |
| 4 | 1 | <0,001 | <0,001 | – | – | <0,001 | <0,001 | <0,001 |
| 2 | <0,005 | <0,05 | <0,05 | <0,05 | <0,005 | <0,005 | <0,05 | |
| 3 | <0,05 | <0,05 | <0,05 | <0,05 | <0,005 | <0,005 | <0,05 |
При перевірці взаємозв’язків параметра ІCAM-1 у периферичній крові пацієнтів з РА та гострофазових показників запалення й активності РА вдалося достовірно підтвердити прямий кореляційний зв’язок ІСАМ-1 з усіма розглянутими індексами (табл. 2). Найвищий рівень кореляційної залежності виявлено для індексу DAS-28 (r=0,562; р<0,05) та СРБ (r=0,557; р<0,05). Інші розглянуті параметри характеризувалися наявністю прямого кореляційного зв’язку середньої сили. Найслабшою кореляційною взаємодією з ІСАМ-1 відзначився показник ВАШ (r=0,413; р<0,05).
Таблиця 2. Кореляційний зв’язок між окремими клініко-лабораторними індексами та ICAM
| Показник | ICAM-1 | p |
|---|---|---|
| ШОЕ | 0,483 | <0,05 |
| СРБ | 0,557 | <0,05 |
| Фібриноген | 0,442 | <0,05 |
| DAS-28 | 0,562 | <0,05 |
| РФ | 0,420 | <0,05 |
| ВАШ | 0,413 | <0,05 |
У ході дослідження нами проаналізовано низку характеристик морфологічного стану судинної стінки у пацієнтів з РА з урахуванням клінічної активності захворювання. Нами підтверджено, що найвищий показник кількості пацієнтів із субклінічним атеросклерозом зафіксовано у підгрупі з високою активністю РА (n=33; 82,5%). Серед осіб з середньою активністю захворювання кількість пацієнтів із доклінічним ураженням судинної стінки становила близько 3/4 від загальної кількості (72,5%.) У близько третини (37,5%) пацієнтів з підгрупи 2,6<DAS-28≤3,2 відмічали потовщення КІМ >0,9 мм. Слід наголосити, що схожа тенденція відмічена і при аналізі фіброзних змін КІМ (табл. 3). Проте вартим уваги є той факт, що найбільшу кількість атеросклеротичних бляшок виявлено у хворих з підгрупи із середньою активністю РА (n=18; 45%; р<0,005). Фрагментацію та склерозування КІМ виявляли, як правило, у пацієнтів із середньою та високою активністю захворювання (n=33; 82,5%). Число хворих з розглянутими порушеннями судинної стінки не відрізнялося між підгрупами з середньою та високою активністю. Трохи більше третини (37,5%) пацієнтів з низькою активністю РА характеризувалися наявністю фрагментації, склерозування, а також диференціації на шари.
Таблиця 3. Характеристика параметрів стану судинної стінки у пацієнтів з РА
| 2,6<DAS-28≤3,2(1-ша) | 3,2>DAS-28≤5,1 (2-га) | DAS-28>5,1(3-тя) | р | |
|---|---|---|---|---|
| Товщина КІМ | ||||
| ≤0,9 мм, n (%) | 25 (62,5) | 11 (27,5) | 4 (17,5) | p1-2<0,005
p1-3<0,001 p2-3<0,05 |
| > 0,9 мм, n (%) | 15 (37,5) | 29 (72,5) | 33 (82,5) | p1-2<0,001
p1-3<0,001 p2-3<0,05 |
| Наявність атеросклеротичної бляшки, n (%) | 7 (17,5) | 18 (45) | 14 (35) | p1-2<0,001
p1-3<0,005 p2-3<0,05 |
| Фіброз КІМ, n (%) | 18 (45) | 30 (75) | 34 (85) | p1-2<0,005
p1-3<0,001 p2-3<0,05 |
| Диференціація на шари й ехогенність | ||||
| Наявні, n (%) | 15 (37,5) | 33 (82,5) | 33 (82,5) | p1-2<0,005
p1-3<0,005 p2-3>0,05 |
| Відсутні, n (%) | 25 (62,5) | 7 (17,5) | 7 (17,5) | p1-2<0,005
p1-3<0,005 p2-3>0,05 |
| Фрагментація КІМ, n (%) | 15 (37,5) | 33 (82,5) | 33 (82,5) | p1-2<0,005
p1-3<0,005 p2-3>0,05 |
| Склерозування КІМ, n (%) | 15 (37,5) | 33 (82,5) | 33 (82,5) | p1-2<0,005
p1-3<0,005 p2-3>0,05 |
Результати проведення бінарної логістичної регресії дозволили підтвердити факт існування взаємозв’язку між підвищенням концентрації IСAM-1 та значень товщини КІМ (OR 1,1 (1,01–1,3); p<0,001) (табл. 4).
Таблиця 4. Показники бінарної логістичної регресії для ICAM-1 та комплексу інтима — медіа
| B коефіцієнт | S.E. | Exp (B) CI (95%) | P | |
|---|---|---|---|---|
| IСAM-1 | 0,085 | 0,036 | 1,1 (1,01–1,3) | <0,001 |
| (з поправкою на вік і стать) | ||||
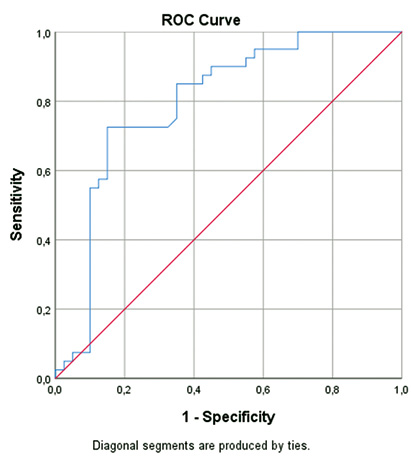
При розгляді ІСАМ-1 як предиктора потовщення КІМ >0,9 мм площа під кривою робочої характеристики приймача (AUC-ROC) була на рівні 0,797 (довірчий інтервал (СІ) 0,69–0,90), p<0,001 (рисунок). Окрім цього, вдалося визначити cut off показник ІСАМ-1 (289,5 нг/мл) у ході визначення можливого зростання товщини КІМ >0,9 мм. Це значення характеризувалося 85% чутливістю та 65% специфічністю.
Обговорення
Проаналізувавши результати нашого дослідження, можна стверджувати, що концентрація молекули ICAM-1 в плазмі крові підвищується за наявності РА та напряму залежить від інтенсивності запального процесу й активності аутоімунної патології. Окрім цього, вдалося підтвердити асоціацію ICAM-1 як фактора активації ендотеліоцитів з розвитком проявів субклінічного атеросклерозу у даної когорти пацієнтів.
Молекула міжклітинної адгезії-1 (ICAM-1) являє собою глікопротеїн, що бере участь у міцній адгезії лейкоцитів до ендотелію та їх трансендотеліальній міграції до місць запалення [9]. Важливою подією в ініціації атеросклерозу є адгезія циркулюючих моноцитів до активованих ендотеліальних клітин і їх подальша трансендотеліальна міграція в субендотеліальний простір. Ці процеси залежать від скоординованої експресії та активації кількох молекул клітинної адгезії (CAM), таких як молекула адгезії ендотеліоцитів-1 (VCAM-1), ICAM-1, E-селектин та відповідні ліганди на моноцитах [10]. Водночас відомо, що експресія білків адгезії ендотеліальних клітин індукується прозапальними цитокінами, такими як фактор некрозу пухлини α (TNF-α) та інтерлейкін-1 (IL-1β).
У попередніх дослідженнях повідомлялося про значний зв’язок між циркулюючим ICAM-1 і наслідками атеросклерозу [21, 22]. Blann і McCollum [21] повідомили про значно вищі значення циркулюючого ICAM-1 у пацієнтів із захворюваннями периферичних судин та ішемічною хворобою серця, ніж у здорових осіб. Squadrito та співавтори [22] наводили факти про значно вищі рівні циркулюючого ICAM-1 та E-селектину у пацієнтів з гострим інфарктом міокарда порівняно з пацієнтами із хронічною стабільною стенокардією та здоровими особами. Відповідно до наших результатів Rubio-Guerra та співавтори вказували, що значення товщини КІМ позитивно корелювали з концентрацією циркулюючих ICAM-1 [23]. Взаємодія між фібриногеном та ICAM-1, яка виявлена в дослідженні in vitro, свідчить також про зв’язок між ICAM-1 і тромбозом/ішемією [24]. У нашому дослідженні пряма кореляційна взаємодія між фібриногеном та ICAM-1 була середньої сили.
Спостережувані зв’язки в цілому узгоджувалися з даними експериментальних досліджень in vivo та in vitro. Cockerill та співавтори [25] повідомили про зниження експресії VCAM-1, E-селектину та ICAM-1 на культурах ендотеліальних клітин, які піддавалися впливу ізольованих частинок HDL. Попереднє дослідження також показало підвищення рівня розчинного ICAM-1 у пацієнтів із помітним підвищенням тригліцеридів і низьким рівнем холестерину ліпопротеїдів високої щільності (ЛПВЩ) [26]. У цьому дослідженні рівні Е-селектину значно корелювали з холестерином ЛПВЩ у контрольній групі. Значно вищі рівні молекул адгезії зафіксовані у пацієнтів з ЦД, що узгоджується з попередніми дослідженнями, які показали підвищені рівні E-селектину та ICAM-1 у пацієнтів з цією патологією [27]. Варто також наголосити, що значно вищі рівні ICAM-1 відзначені у курців. Також дослідники виявили значну кореляцію між ICAM -1 і показником пачко-років у щоденних курців. Kalra та співавтори [28] повідомили, що конденсат сигаретного диму індукував експресію ICAM-1 у культивованих клітинах пупкової вени людини, і припустили наявність прямого впливу куріння сигарет на стимуляцію експресії ICAM-1.
Наявність молекулярного маркера доклінічного атеросклерозу полегшить діагностику та більш спрямовані стратегії втручання для осіб із підвищеним ризиком. Очевидно, що необхідні додаткові дані стосовно достовірності їх використання як молекулярних маркерів атеросклерозу та порівняння з іншими тестами, як інвазивними, так і неінвазивними.
Наскільки нам відомо, наше дослідження є першим, яке встановило значення ICAM-1 як предиктора потовщення КIM каротидних артерій у пацієнтів із РА. AUC-ROC становив 0,797 (СІ 0,69–0,90), що вважається хорошим показником. Крім того, параметри чутливості та специфічності (85 та 65% відповідно) дозволили припустити, що ICAM-1 можна використовувати як можливий предиктор збільшення товщини КІМ.
Існують суперечливі погляди на КІМ як інструмент оцінки атеросклерозу [29]. Однак такі зміни судинної стінки можна виявити на ранніх стадіях атеросклерозу, і цей показник має важливе значення як предиктор серцево-судинного ризику для осіб молодого віку [30]. Таким чином, це дає надію, що ICAM-1 також може використовуватися в моделях прогнозування серцево-судинного ризику для пацієнтів із РА.
Однак результати цього дослідження слід інтерпретувати з обережністю, оскільки воно має деякі обмеження. По-перше, воно було розроблено як одноцентрове дослідження, розмір вибірки якого був досить малим, і чоловіки були недостатньо представлені. По-друге, існують розбіжності в думках щодо оцінки доклінічного атеросклерозу лише за допомогою КIM.
Висновки
Це дослідження підтвердило існування зв’язку між показником товщини КIM та ICAM-1. Останній може бути використаний як предиктор потовщення каротидної КIM у пацієнтів з РА з рівнем чутливості 85% і специфічністю 65%. Крім того, факт кореляції між рівнем ICAM-1, маркерами запалення та активністю захворювання демонструє нерозривний взаємозв’язок між запаленням та процесом розвитку атеросклеротичних змін судинної стінки.
Список використаної літератури
- 1. Hansildaar R., Vedder D., Baniaamam M. et al. (2021) Cardiovascular risk in inflammatory arthritis: rheumatoid arthritis and gout. Lancet Rheumatol., Jan; 3(1): e58–70.
- 2. England B.R., Thiele G.M., Anderson D.R. et al. (2018) Increased cardiovascular risk in rheumatoid arthritis: mechanisms and implications. BMJ, Apr 23: k1036.
- 3. Jebari-Benslaiman S., Galicia-García U., Larrea-Sebal A. et al. (2022) Pathophysiology of Atherosclerosis. Int. J. Mol. Sci., Mar 20; 23(6): 3346.
- 4. Libby P. (2021) Inflammation in Atherosclerosis — No Longer a Theory. Clin. Chem., Jan 8; 67(1): 131–42.
- 5. Zmysłowski A., Szterk A. (2017) Current knowledge on the mechanism of atherosclerosis and pro-atherosclerotic properties of oxysterols. Lipids Health Dis., Dec 2; 16(1): 188.
- 6. HAH A., ZBH M., M Bin I. (2020) Basic pathogenic mechanisms of atherosclerosis. Egypt J. Basic Appl. Sci., Jan 1; 7(1): 116–25.
- 7. Meiliana A., Dewi N.M., Wijaya A. (2018) Advanced in Molecular Mechanisms of Atherosclerosis: From Lipids to Inflammation. Indones Biomed. J., Aug 2; 10(2): 104–22.
- 8. Yin M., Li C., jiang J. et al. (2021) Cell adhesion molecule-mediated therapeutic strategies in atherosclerosis: From a biological basis and molecular mechanism to drug delivery nanosystems. Biochem. Pharmacol., Apr; 186: 114471.
- 9. Chen C.C., Rosenbloom C.L., Anderson D.C. et al. (1995) Selective inhibition of E-selectin, vascular cell adhesion molecule-1, and intercellular adhesion molecule-1 expression by inhibitors of I kappa B-alpha phosphorylation. The Journal of Immunology, Oct 1; 155(7): 3538–45.
- 10. Fotis L., Agrogiannis G., Vlachos I.S. et al. (2012) Intercellular adhesion molecule (ICAM)-1 and vascular cell adhesion molecule (VCAM)-1 at the early stages of atherosclerosis in a rat model. In vivo. Mar 1; 26(2): 243–50.
- 11. Gross M.D., Bielinski S.J., Suarez-Lopez J.R. et al. (2012) Circulating Soluble Intercellular Adhesion Molecule 1 and Subclinical Atherosclerosis: the Coronary Artery Risk Development in Young Adults Study. Clin. Chem., Feb 1; 58(2): 411–20.
- 12. Moore-Carrasco R., Donoso W., Sutin F. et al. (2011) ICAM-1 Expression in Endothelium of Human Arteries by Immunohistochemistry. INTERNATIONAL JOURNAL Of MORPHOLOGY; 29(4): 1351–6.
- 13. Weinkauf C.C., Concha-Moore K., Lindner J.R. et al. (2018)Endothelial vascular cell adhesion molecule 1 is a marker for high-risk carotid plaques and target for ultrasound molecular imaging. J. Vasc. Surg., Dec; 68(6): 105S–113S.
- 14. Mu W., Chen M., Gong Z. et al. (2015) Expression of vascular cell adhesion molecule-1 in the aortic tissues of atherosclerotic patients and the associated clinical implications. Exp. Ther. Med., Aug; 10(2): 423–8.
- 15. Bui T.M., Wiesolek H.L., Sumagin R. (2020) ICAM‐1: A master regulator of cellular responses in inflammation, injury resolution, and tumorigenesis. J. Leukoc. Biol., Sep 17; 108(3): 787–99.
- 16. Rashad N.M., El-Shal A.S., Abomandour H.G. et al. (2019)Intercellular adhesion molecule-1 expression and serum levels as markers of pre-clinical atherosclerosis in polycystic ovary syndrome. J. Ovarian. Res., Dec 19; 12(1): 97.
- 17. Kay J., Upchurch K.S. (2012) ACR/EULAR 2010 rheumatoid arthritis classification criteria. Rheumatology. Dec 1; 51(suppl. 6): vi5–9.
- 18. Anderson J.K., Zimmerman L., Caplan L. et al. (2011) Measures of rheumatoid arthritis disease activity: Patient (PtGA) and Provider (PrGA) Global Assessment of Disease Activity, Disease Activity Score (DAS) and Disease Activity Score With 28-Joint Counts (DAS28), Simplified Disease Activity Index (SDAI), Cl. Arthritis Care Res. (Hoboken), Nov; 63(S11): S14–36.
- 19. Mancia M.G., Fagard R., Narkiewicz K. et al. (2013) ESH/ESC guidelines for the management of arterial hypertension: the Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). Eur. Heart J.; 34: 2159–219
- 20. Touboul P.J., Hennerici M.G., Meairs S. et al. (2012) Mannheim carotid intima-media thickness and plaque consensus (2004–2006–2011). An update on behalf of the advisory board of the 3rd, 4th and 5th watching the risk symposia, at the 13th, 15th and 20th European Stroke Conferences, Mannheim, Germany, 2004, Brussels, Belgium, 2006, and Hamburg, Germany, 2011. Cerebrovasc Dis.; 34(4): 290–6.
- 21. Blann A.D., McCollum C.N. (1994) Circulating endothelial cell/leukocyte adhesion molecules in atherosclerosis. Thromb Haemost.; 72: 151–154.
- 22. Squadrito F., Saitta A., Altavilla D. et al. (1996) Thrombolytic therapy with urokinase reduces increased circulating endothelial adhesion molecules in acute myocardial infarction. Inflamm. Res.; 45: 14–19.
- 23. Rubio-Guerra A.F., Vargas-Robles H., Serrano A.M. et al. (2009) Correlation between the levels of circulating adhesion molecules and atherosclerosis in type-2 diabetic normotensive patients: Circulating adhesion molecules and atherosclerosis. Cell. Adh. Migr., Oct 27; 3(4): 369–72.
- 24. Kucukal E., Man Y., Quinn E. et al. (2020) Red blood cell adhesion to ICAM-1 is mediated by fibrinogen and is associated with right-to-left shunts in sickle cell disease. Blood Adv., Aug 11; 4(15): 3688–98.
- 25. Cockerill G.W., Rye K.A., Gamble J.R. et al. (1995) High-density lipoproteins inhibit cytokine-induced expression of endothelial cell adhesion molecules. Arteriosclerosis, thrombosis, and vascular biology, Nov; 15(11): 1987–94.
- 26. Chen W., Jump D.B., Grant M.B. et al. (2003) Effect of Dyslipidemia on Pro-inflammatory Adhesion Molecule Expression in Human Retinal Vascular Endothelial Cells. Investigative Ophthalmology & Visual Science, May 1; 44(13): 3295.
- 27. Kulkarni H., Mamtani M., Peralta J. et al. (2016) Soluble Forms of Intercellular and Vascular Cell Adhesion Molecules Independently Predict Progression to Type 2 Diabetes in Mexican American Families. PLoS One, Mar 23; 11(3): e0151177.
- 28. Kalra V.K., Ying Y., Deemer K. et al. (1994) Mechanism of cigarette smoke condensate induced adhesion of human monocytes to cultured endothelial cells. Journal of cellular physiology, Jul; 160(1): 154–62.
- 29. Spence J.D.(2020) IMT is not atherosclerosis. Atherosclerosis, Nov; 312: 117–8.
- 30. Fernández-Alvarez V., Linares Sánchez M., López Alvarez F. et al. (2022) Evaluation of Intima-Media Thickness and Arterial Stiffness as Early Ultrasound Biomarkers of Carotid Artery Atherosclerosis. Cardiol. Ther., Jun 1; 11(2): 231–47.
Адреса для листування:
Яцишин Роман Іванович
Івано-Франківський національний
медичний університет
76018, м. Івано-Франківськ, вул. Галицька, 2

Leave a comment