ДЕРМАТОМІОЗИТ: ТРУДНОЩІ ДІАГНОСТИКИ В РЕАЛЬНІЙ КЛІНІЧНІЙ ПРАКТИЦІ
Орлова І.В.1, Школіна Н.В.2, Вовк І.І.2, Станіславчук М.А.1
- 1Вінницький національний медичний університет ім. М.І. Пирогова
- 2КНП «Вінницька обласна клінічна лікарня ім. М.І. Пирогова» Вінницької обласної ради
Резюме. Представлений класичний клінічний випадок пацієнтки з дерматоміозитом з вираженою клінічною картиною захворювання. Незважаючи на типову симптоматику, маршрут пацієнтки до ревматолога видався досить тривалим. Її неодноразово оглядали лікарі різних спеціальностей, але запідозрити дерматоміозит їм не вдалося. Через 7 міс після появи перших симптомів пацієнтка потрапила на прийом до ревматолога з характерним висипом, міалгіями, слабкістю проксимальних груп м’язів верхніх та нижніх кінцівок, зменшенням маси тіла. На основі даних фізикального, лабораторного та інструментального обстеження, а також використання класифікаційних критеріїв Американського коледжу ревматології (American College of Rheumatology — ACR)/Європейського альянсу ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR) 2017 р. для ідіопатичних запальних міопатій, встановлено діагноз дерматоміозиту. Застосування комбінованої терапії зумовило зниження активності хвороби, зменшення вираженості шкірних та м’язових проявів та стійку ремісію. Висвітлення подібних клінічних випадків необхідно для підвищення поінформованості лікарів суміжних спеціальностей, що, в свою чергу, допоможе швидше встановити діагноз та розпочати лікування.
DOI: 10.32471/rheumatology.2707-6970.91.17633
Вступ
Дерматоміозит (ДМ) належить до ідіопатичних запальних міопатій (ІЗМ), що являють собою гетерогенну групу рідкісних м’язових захворювань, які характеризуються запаленням скелетних м’язів та позам’язовими проявами, зокрема, такими як шкірні прояви [6]. До підтипів IЗM належать ДМ, поліміозит, міозит тілець із включеннями, аміопатичний ДМ. Вік початку ДМ — 5–14 та 45–64 роки [1]. Поширеність ДМ становить 9,54–32,7 випадків на 100 000 населення. У середньому час від появи перших симптомів до встановлення діагнозу IЗM становить 27,9 міс або 2,25 року (95% Довірчий інтервал (ДІ) 15,03–40,79 міс) і є подібним до інших ревматичних захворювань із довгою затримкою діагностики [7]. Зокрема, у пацієнтів із аксіальним спондилоартритом середня діагностична затримка становить 6,7 року (95% ДІ 6,2–7,2); у пацієнтів із псоріатичним артритом — 2,6 року (95% ДІ 1,6–3,6) [8].
Мета: описати клінічний випадок ДМ, проаналізувати маршрут пацієнтки та оцінити в динаміці ефективність проведеного лікування.
Результати (клінічний випадок)
Пацієнтка, 52 роки. На прийомі у ревматолога скаржиться на виражені біль та слабкість у м’язах верхніх та нижніх кінцівок, значне обмеження рухів, скутість; важко підняти руки, повернути голову. Також відмічає труднощі при ковтанні, поперхування при прийомі їжі та води, висип на шкірі обличчя, навколо очей, в ділянці тулуба, гомілок, випадіння волосся, загальну слабкість, швидку втомлюваність, періодично головний біль та безсоння.
Вважає себе хворою близько 7 міс. З анамнезу відомо, що в листопаді 2019 р. після відпочинку в Єгипті перехворіла гострою респіраторною вірусною інфекцією (ГРВІ). У грудні того ж року з’явилися набряк навколо очей, свербіж, відчуття «піску в очах». У зв’язку з вищепереліченими скаргами пацієнтка зверталася до офтальмолога. Призначене лікування було неефективним. У січні 2020 р. консультована алергологом, який запідозрив алергічну реакцію і рекомендував дієту та антигістамінні засоби. Через місяць пацієнтка відмітила, що колір шкіри навколо очей змінюється на буро-червоний. У лютому цього ж року її оглядав офтальмолог, встановив попередній діагноз: демодекозний блефарит обох очей та призначив відповідне лікування. Згодом з’явився висип в ділянці декольте та нижніх кінцівок, що супроводжується свербежем, а також пацієнтка відмітила випадіння волосся. Через 2 тиж оглянута дерматологом та трихологом, які рекомендували дієтичне харчування та направляли знову до алерголога. Впродовж наступного місяця консультована ще двома алергологами. Наприкінці березня 2020 р. з’явилися слабкість м’язів верхніх та нижніх кінцівок, біль в них, а також набряк шиї. Хворій стало важко повертати голову, пацієнтка не може піднятися на 2-й поверх, важко втримати ложку та виделку. Ще через місяць — утруднене ковтання, а згодом і поперхування при прийомі їжі та води. За 3 міс схудла на 12 кг. У червні 2020 р. потрапила на консультацію до ревматолога.
При опитуванні виявлено, що сімейний та алергологічний анамнез не обтяжений. Цукровий діабет, вірусні гепатити, туберкульоз заперечує. Травм та операцій не проводилося. Пацієнтка активно займалася спортом впродовж 20 років до появи симптомів хвороби. Постійно жодних лікарських засобів не отримувала.
При огляді виявлено еритему з бузковим відтінком навколо очей за типом «окулярів»; періорбітальний набряк, сітчасте ліведо в ділянці стегон. Наявні еритематозний висип в зоні декольте, на гомілках, а також набряк шиї. При пальпації м’язів верхніх і нижніх кінцівок відмічаються болючість, зниження тонусу м’язів та обмеження рухів у верхніх та нижніх кінцівках. Маса тіла на момент огляду становить 57 кг при зрості 170 см, індекс маси тіла (ІМТ) — 19,7 кг/м2. До початку захворювання маса тіла становила 69 кг, ІМТ — 24,2 кг/м2. З боку внутрішніх органів патологічних змін не виявлено.
У загальному аналізі крові: Hb 105 г/л, еритроцити 3,87·10¹²/л, кольоровий показник (КП) 0,81, лейкоцити 12,2·109/л, тромбоцити 1161,0·109/л, швидкість осідання еритроцитів (ШОЕ) 32 мм/год. Загальний аналіз сечі — без суттєвих змін. Біохімічний аналіз крові: білірубін крові: загальний — 11,1 мкмоль/л; прямий — 1,7 мкмоль/л; аспартатамінотрансфераза (АсАТ) — 12,3 мкмоль/л; аланінамінотрансфераза (АлАТ) — 26,4 мкмоль/л; сечовина у крові — 7,3 ммоль/л; креатинін у крові — 97,5 мкмоль/л; К — 6,1 ммоль/л; Na — 144 ммоль/л; креатинфосфокіназа (КФК) — 653 (норма 26–192) од/л; HbSAg — не виявлено; anti-HCV — не виявлено. Дані імунологічних обстежень наведені у табл. 1.
Таблиця 1. Імунологічні обстеження
| Компонент | Результат | Нормативні показники |
|---|---|---|
| Антинуклеарні антитіла (ANA-Screen) | Позитивний | Негативний |
| Антитіла IgG до двоспіральної ДНК | 2 MО/мл | ≤4,0 — негативний результат; >4,0—<10 — сумнівний результат; ≥10,0 — позитивний результат |
| Антитіла IgG до хроматину | <0,2 (індекс антитіл) | <1,0 — негативний результат; ≥1 — позитивний результат |
| Антитіла IgG до рибосомального протеїну | <0,2 (індекс антитіл) | <1,0 — негативний результат; ≥1 — позитивний результат |
| Антитіла IgG до SS-A 52/60 | <0,2 (індекс антитіл) | <1,0 — негативний результат; ≥1 — позитивний результат |
| Антитіла IgG до SS-B | <0,2 (індекс антитіл) | <1,0 — негативний результат; ≥1 — позитивний результат |
| Антитіла IgG до Sm/RNP | <0,2 (індекс антитіл) | <1,0 — негативний результат; ≥1 — позитивний результат |
| Антитіла IgG до Sm | <0,2 (індекс антитіл) | <1,0 — негативний результат; ≥1 — позитивний результат |
| Антитіла IgG до RNP | 1,2 (індекс антитіл) | <1,0 — негативний результат; ≥1 — позитивний результат |
| Антитіла IgG до SCL-70 | <0,2 (індекс антитіл) | <1,0 — негативний результат; ≥1 — позитивний результат |
| Антитіла IgG до Jo-1 | <0,2 (індекс антитіл) | <1,0 — негативний результат; ≥1 — позитивний результат |
| Антитіла IgG до центромер В | <0,2 (індекс антитіл) | <1,0 — негативний результат; ≥1 — позитивний результат |
Для встановлення остаточного діагнозу нами використано класифікаційні критерії Американського коледжу ревматології (American College of Rheumatology — ACR)/Європейського альянсу ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR) 2017 р. для ІЗМ [4]. Дані критерії мають достатню чутливість та специфічність 87 та 82% відповідно та забезпечують оцінку і відповідну ймовірність наявності ІЗМ. Важливим є те, що у пацієнтів із типовим шкірним висипом критерії можна використовувати без даних біопсії м’язів. Пацієнтам без шкірних проявів рекомендована біопсія м’язів, а пацієнтам без ураження м’язів — біопсія шкіри. Діагноз IЗM вважається підтвердженим при сумі балів ≥7,5 без біопсії та ≥8,7 з біопсією. Кількість балів у нашої пацієнтки за даними критеріями становила 10,6.
Враховуючи вищенаведені відомості, а саме: дані анамнезу, клінічного та лабораторного обстеження, а також результати використання критеріїв EULAR/ACR 2017 р. для ІЗМ нам вдалося встановити діагноз: ідіопатичний дерматоміозит, підгострий перебіг, активна фаза, акт. ІІ ст. з дифузним ураженням проксимальних груп м’язів верхніх і нижніх кінцівок, м’язів шиї та ротоглотки, з ураженням шкіри — еритема обличчя, «симптом окулярів», геліотропна еритема, тулуба — «симптом декольте». Анемія легкого ступеня на фоні основного захворювання.
Пацієнтка отримала наступні рекомендації: щомісячний клініко-лабораторний контроль (загальний аналіз крові, сечі, КФК, білірубін, АлАТ, АсАТ, сечовина, креатинін, електроліти). Також, враховуючи асоціацію ДМ з онкологічними захворюваннями, було необхідно виключити паранеопластичний синдром (вторинний ДМ) [5]. Проведено весь спектр онкопошуку: комп’ютерна томографія органів грудної порожнини, органів черевної порожнини та органів малого таза, консультація гінеколога, ультразвукове дослідження щитовидної залози, мамографія, фіброгастродуоденоскопія, фіброколоноскопія.
Результати інструментальних досліджень:
- електрокардіограма (ЕКГ): ритм синусовий регулярний, частота серцевих скорочень (ЧСС) 60 уд./хв. Нормальна електрична позиція серця. Дифузні зміни в міокарді;
- ультразвукове дослідження (УЗД) серця: ехо-ознаки дифузного аортосклерозу, порожнини серця не розширені. Скоротливість ЛШ в межах норми;
- УЗД щитоподібної залози: структурних змін не виявлено;
- УЗД органів черевної порожнини: ехо-ознак об’ємної патології та структурних змін не виявлено;
- мультизрізова комп’ютерна томографія (КТ) черевної порожнини та заочеревинного простору: КТ-ознаки поперекової дистопії нирки, артеріо-венозної мальформації параметрально;
- мультизрізова КТ органів грудної клітки: інфільтративно-вогнищевих змін в легенях не виявлено;
- УЗД органів малого таза: ультразвукові ознаки інволютивних змін малого таза.
При проведенні фіброгастродуоденоскопії та фіброколоноскопії змін не виявлено.
Враховуючи клініко-лабораторну активність захворювання, призначено метилпреднізолон у дозі 48 мг/добу. Як спаринг-терапію обрали метотрексат у дозі 10 мг на тиждень у поєднанні з фолієвою кислотою 5 мг на тиждень. Також рекомендували тривале застосування інгібіторів протонної помпи, препаратів кальцію з вітаміном D3 та бісфосфонатів.
Високі дози кортикостероїдів у поєднанні з метотрексатом дали змогу знизити активність ДМ, відновити силу м’язів, зменшити вираженість шкірних проявів, і вже через 6 міс нам вдалося досягти нормалізації рівня КФК, гемоглобіну, зменшення ШОЕ (табл. 2).
Таблиця 2. Динаміка лабораторних показників
| Показники | До початку лікування | Через 1 міс | Через 3 міс | Через 6 міс |
|---|---|---|---|---|
| Hb, г/л | 105 | 115 | 123 | 125 |
| Еритроцити, ·10¹²/л | 3,87 | 3,98 | 4,2 | 4,4 |
| Лейкоцити, ·109/л | 12,2 | 7,6 | 4,6 | 4,2 |
| Тромбоцити, ·109/л | 1161 | 825 | 520 | 350 |
| ШОЕ, мм/год | 32 | 28 | 20 | 17 |
| КФК (норма 26–192) Од/л | 653 | 452 | 335 | 180 |
Зважаючи на позитивну динаміку, доза метилпреднізолону поступово була знижена до 8 мг/добу. Через рік після початку лікування пацієнтка перебувала в стані клініко-лабораторної ремісії та отримувала метотрексат 10 мг на тиждень, фолієву кислоту 5 мг 1 раз на тиждень, метилпреднізолон 8 мг 1 раз на добу, препарати кальцію з вітаміном D3 та інгібітори протонної помпи. При огляді виявлено наявну гіперемію шкіри декольте, наявні рубці та гіперпігментацію на гомілках, а також множинні геморагії як наслідок тривалого застосування глюкокортикоїдів (рис. 1, 2). У зв’язку з цим ми вирішили підвищити дозу метотрексату до 15 мг на тиждень та спробувати знизити дозу метилпреднізолону. Це вдалося реалізувати, і на сьогодні пацієнтка отримує лише метотрексат 15 мг на тиждень, фолієву кислоту 7,5 мг 1 раз на тиждень, препарати кальцію з вітаміном D3. Періодично відмічає слабкість у м’язах та появу набряку навколо очей. При об’єктивному обстеженні рубці та гіперпігментація на гомілках менш виражені, геморагічних змін не виявлено. Лабораторні показники та рівень КФК залишаються в межах норми. Маса тіла дещо збільшилася і становить 65 кг, ІМТ — 22,5 кг/м2.
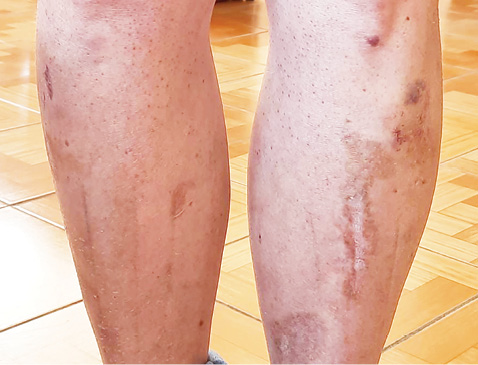
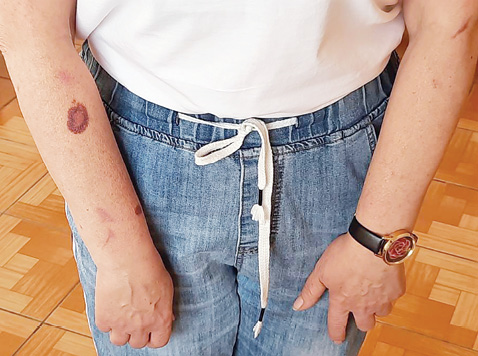
Таким чином, досягнення стійкої ремісії та повна відмова від стероїдів є досить хорошим результатом лікування, зважаючи на статистичні дані. Так, спостереження Bronner та співавторів протягом 5 років показало, що у пацієнтів із ДМ смертність, пов’язана з хворобою, становить 10%, головним чином через асоціацію з раком і легеневі ускладнення [2]. У дослідженні Danieli та співавторів, що тривало близько 8,7 року, смертність у пацієнтів з ДМ становить 24% [3]. До предикторів високого ризику смертності відносять старший вік на момент встановлення діагнозу, чоловічу стать, наявність неопластичного процесу, інтерстиціальнне захворювання легень [2]. Також встановлено, що через 5 років лише 20% пацієнтів залишаються в стані ремісії та припиняють лікування, тоді як у 80% відмічають поліциклічний або хронічний безперервний перебіг.
Висновки
Таким чином, для даної когорти пацієнтів є досить важливими вчасне встановлення діагнозу та підбір адекватного лікування, що значно підвищує якість та подовжує тривалість життя пацієнта. Описана клінічна картина випадку ДМ є досить типовою, проте шлях до встановлення діагнозу був тривалим. Поліморфізм клінічних симптомів захворювання спонукав пацієнтку звертатися до лікарів різних спеціальностей (алергологів, дерматологів, офтальмологів), але запідозрити ДМ їм не вдалося.
Таким чином, важливою є тісна співпраця ревматологів з лікарями суміжних спеціальностей, а також підвищення поінформованості лікарів щодо клінічних особливостей перебігу захворювання, що допоможе швидше встановити діагноз та розпочати лікування.
Список використаної літератури
- 1. Bendewald M.J., Wetter D.A., Li X. et al. (2010) Incidence of dermatomyositis and clinically amyopathic dermatomyositis: A population-based study in Olmsted County, Minnesota. Arch. Dermatol., 146: 26–30.
- 2. Bronner I.M., van der Meulen M.F., de Visser M. et al. (2006) Long-term outcome in polymyositis and dermatomyositis. Ann. Rheum. Dis. 65(11): 1456–61.
- 3. Danieli M.G., Gambini S., Pettinari L. et al. (2014) Impact of treatment on survival in polymyositis and dermatomyositis. A single-centre long-term follow-up study. Autoimmun. Rev. 13(10): 1048–54.
- 4. Lundberg I.E., Tjärnlund A., Bottai M. et al. (2017) 2017 European League Against Rheumatism/American College of Rheumatology classification criteria for adult and juvenile idiopathic inflammatory myopathies and their major subgroups. Ann. Rheum. Dis., 76(12): 1955–1964.
- 5. Madan V., Chinoy H., Griffiths C.E. et al. (2009) Defining cancer risk in dermatomyositis. Part I. Clin. Exp. Dermatol., 34(4): 451–455.
- 6. Malik A., Hayat G., Kalia J.S. et al. (2016) Idiopathic Inflammatory Myopathies: Clinical Approach and Management. Front Neurol., 20; 7: 64.
- 7. Namsrai T., Parkinson A., Chalmers A. et al. (2022) Diagnostic delay of myositis: an integrated systematic review. Orphanet J. Rare Dis., Nov 21; 17(1): 420.
- 8. Zhao S.S., Pittam B., Harrison N.L. et al. (2021) Diagnostic delay in axial spondyloarthritis: a systematic review and meta-analysis. Rheumatology (Oxford). 6; 60(4): 1620–1628.
Адреса для листування:
Інна Орлова
E-mail: orlovainna17@gmail.com

Leave a comment