КЛІНІЧНИЙ ВИПАДОК: ТРУДНОЩІ ДИФЕРЕНЦІЙНОЇ ДІАГНОСТИКИ ДЕРМАТОМІОЗИТУ З УРАЖЕННЯМ ЛЕГЕНЬ ТА COVID-19
Романовський А.В., Левченко В.Г.
Резюме. Представлений клінічний випадок пацієнтки віком 45 років з дерматоміозитом, труднощі діагностики якої пов’язані з типовою клінікою та даними аналізів, характерними для COVID-19, типовими рентгенологічними змінами у легенях за типом інтерстиціальної хвороби легень. Після виключення інфекції SARS-CoV-2, визначення позитивності за специфічними для дерматоміозиту антитілами застосована комбінована терапія дерматоміозиту, що призвело до зниження активності захворювання та зникнення проявів інтерстиціальної хвороби легень.
DOI: 10.32471/rheumatology.2707-6970.94.17906
Вступ
Інтерстиціальна хвороба легень (ІХЛ) — дифузне паренхіматозне захворювання легень, гетерогенна група захворювань, яка характеризується запаленням та фіброзом легеневої паренхіми, що призводить до погіршення газообміну, респіраторних порушень та може викликати летальні випадки [1]. При ІХЛ запальні клітини — лімфоцити та моноцити/макрофаги, інфільтрують легеневу паренхіму та продукують прозапальні та профібротичні медіатори: інтерлейкіни (IL)-4, IL-13, трансформуючий фактор росту β, хемокіни та ейкозаноїди. Проліферація фібробластів та продукція підвищеної кількості сполучної тканини акумулюється у легеневій паренхімі [2].
Відповідно до класифікаційного консенсусу, розробленого за участю Американського торакального товариства та Європейського респіраторного товариства, виділяють наступні гістологічні патерни інтерстиціальної пневмонії: власне інтерстиціальна пневмонія, неспецифічна інтерстиціальна пневмонія (з вираженим клітинним патерном, фіброзуючим патерном, змішаним патерном), організуюча пневмонія, дифузне альвеолярне ураження, респіраторний бронхіоліт, десквамаційна інтерстиціальна пневмонія, лімфоїдна інтерстиціальна пневмонія [3].
Таким чином, захворювання в плані ураження легень є неоднорідним, а його прояви при біопсії легень не є специфічними.
Ураження легень при дерматоміозиті (ДМ) має досить поширений характер. Запальні міопатії супроводжуються ІХЛ у 20–78% випадків залежно від методу діагностики [4] та часто зумовлюють підвищення частоти смертності, що становить 12 та 44% для поліміозиту (ПМ) та дерматоміозиту (ДМ) відповідно [5]. Функція легень порушена у 40% хворих на ПМ і ДМ, що триває в середньому 17 міс [6, 7]. У багатьох хворих на ДМ захворюванню передували вірусні інфекції, такі як Епштейна — Барр та антибіотикотерапія [8]. У клінічному перебігу при ураженні легень при ДМ переважає виражене зниження дифузійної здатності легень та прояви фіброзуючого альвеоліту (ФА) при комп’ютерній томографії (КТ). Рідкісне при ФА-ПМ/ДМ ускладнення у вигляді респіраторного дистрес-синдрому відмічають в основному у хворих, позитивних за антисинтетазними антитілами. Водночас хворі на ПМ/ДМ-асоційований антисинтетазний синдром (АСС) краще відповідають на терапію кортикостероїдами. Зменшення вираженості внутрішньогрудних змін та зворотний розвиток міопатії відбуваються внаслідок інтенсивного лікування кортикостероїдами у режимі високих доз [9]. Рентгенологічні зміни при ПМ/ДМ досить незначні. Зміни розташовуються у базальних відділах легень і представлені в основному сітчастою деформацією легеневого малюнка, множинними дрібними вогнищевими затемненнями, можлива поява феномену «матового скла» на КТ високої роздільної здатності [10, 11]. Підтвердження діагнозу стає можливим лише внаслідок зіставлення клінічних та інструментальних даних. У хворих з високою активністю імунозапальних реакцій у легенях, лабораторними ознаками міопатії (підвищення рівня креатинфосфокінази (КФК), міоглобіну) відповідь на терапію та прогноз зазвичай є більш сприятливими [12].
Виявлена певна генетично зумовлена схожість схильності до ураження легень при ДМ та легкого перебігу інтерстиціальної пневмонії при COVID-19. Дослідження китайських вчених 2017 р. свідчить [13], що генетичні послідовності DRB1*04:01 та *12:02 є генетичними факторами синтезу Anti-MDA5 антитіл, що синтезуються при ДМ. Anti-MDA5 антитіла тісно пов’язані зі швидко прогресуючою ІХЛ у пацієнтів з ДМ, особливо у групі клінічно аміопатичних ДМ [14].
Також при COVID-19 виявлена [15] значна різниця в частоті алелів HLA-DRB1*04:01 у тяжких пацієнтів порівняно з групою безсимптомного перебігу захворювання (5,1% vs 16,7%, р=0,003 після поправки на вік та стать). HLA-DRB1*04:01 алель при COVID-19 відіграє протекторну роль і може зумовлювати безсимптомний перебіг.
Також COVID-19-асоційована пневмонія має подібну до ДМ з ураженням легень клінічну картину, що проявляється підвищеною температурою тіла, загальною слабкістю, зниженням сатурації, змінами за типом «матового скла» на КТ, достовірно відповідає на лікування глюкокортикоїдами. Таким чином, диференційний діагноз між COVID-19 та ДМ може становити значні труднощі через гіпердіагностику COVID-19.
Результати (клінічний випадок)
Пацієнтка С., 45 років, бухгалтер, захворіла гостро у липні 2020 р. У дебюті захворювання відмічали почервоніння шкіри обличчя, кистей рук, підвищення температури тіла до фебрильних значень, м’язову слабкість. У динаміці виникло ураження легень, що підтвердилося за даними КТ, у зв’язку з чим пацієнтку було госпіталізовано до ревматологічного відділення за місцем проживання. Після негативних тестів на СOVID-19 встановлено діагноз недиференційованого захворювання сполучної тканини з ураженням шкіри, м’язів, легень. Призначено 40 мг/добу преднізолону та проведено терапію циклофосфаном, на тлі якої виникла еритема з ураженням більшої частини поверхні шкіри, тому циклофосфан було відмінено. У дебюті захворювання відмічали підвищення рівня аспартатамінотрансферази (АсАТ) 290 Од/л, аланінамінотрансферази (АлАТ) 191 Од/л (19.09.2020). Має позитивні показники ревматоїдного фактора (РФ), антинуклеарних антитіл (ANA) та антитіл до цитоплазматичного антигену (SS-A) (19.09.2020), антифосфоліпідні антитіла негативні. У зв’язку з відсутністю покращання стану пацієнтка звернулася та була госпіталізована в ДУ ННЦ «Інститут кардіології, клінічної та регенеративної медицини ім. акад. М.Д. Стражеска» НАМН України. Проходила стаціонарне лікування з 22.10.2020 до 05.11.2020 р., призначено мофетилу мікофенолат 2 г/добу з позитивною динамікою — зменшенням еритематозного висипу, зниження температури тіла. Однак 06.11.2020 р. з’явилися виразки на кистях, зокрема з ознаками інфікування праворуч. За медичною допомогою не зверталася. Звернулася до хірурга лише 05.12.2020 р. після виникнення набряку кисті. Рана самостійно дренувалася — 06.12.2020 р. з відходженням гною, проведено її хірургічну обробку. Увесь цей час пацієнтка приймала мофетилу мікофенолат, не повідомляла про розвиток інфекції. 08.12.2020 р. повторно звернулася до ревматолога, у зв’язку з інфекцією відмінено мофетилу мікофенолат, направлено в Національний інститут хірургії та трансплантології імені О.О. Шалімова НАМН України для консультації хірурга, бакпосіву з рани. Відзначався незначний бактеріальний ріст, призначено антибіотикотерапію з 05.12.2020 до 07.12.2020 р. З 13.12.2020 р. відновилося підвищення температури до 39 °С без ознак респіраторних інфекцій, що пов’язали з відновленням активності основного захворювання, пацієнтка була госпіталізована повторно. На момент госпіталізації основними скаргами були болючі щільні підшкірні вузлики на кистях рук, стопах, а також стегнах. Виразки в основі III пальців обох кистей рук, праворуч — суха, ліворуч — з помірним сукровичним відокремлюваним, задишка при підніманні на 0,5–1-й поверх, виражена загальна слабкість, випадання волосся, набряк слизової оболонки ротової порожнини та обличчя, сухість слизової оболонки очей.
Діагноз при госпіталізації: ДМ, гострий перебіг, позитивний за Mi-2, Ku, PL-7, PL-12, Ro-52, ANA (26.09.2020), активність ІІІ ступеня, із ураженням м’язів — міозит, легень — пульмоніт (08.2020, 12.2020), ДН ІІ ст., суглобів — поліартрит, шкіри — еритематозний висип на обличчі, тулубі, верхніх та нижніх кінцівках, синдром Готтрона, з ураженням підшкірної жирової клітковини — панікуліт ділянки сідниць, нервової системи — астеновегетативний синдром, лихоманка.
Серед супутніх захворювань: вроджена доліхосигма, хронічний геморой у стадії нестійкої ремісії, звичний запор (на момент госпіталізації затримка випорожнень 2 доби). Колоностаз в анамнезі. Виразкова хвороба дванадцятипалої кишки у стадії ремісії. Хронічний аднексит у стадії ремісії. Лейоміома матки. Безпліддя. Хронічний фарингіт у стадії ремісії.
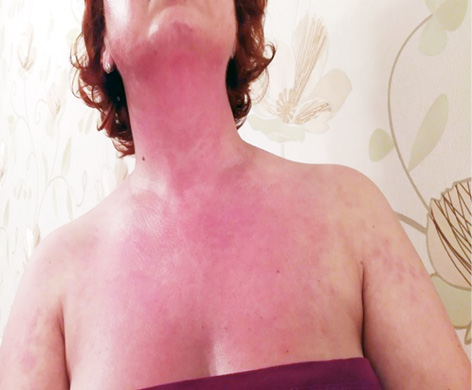
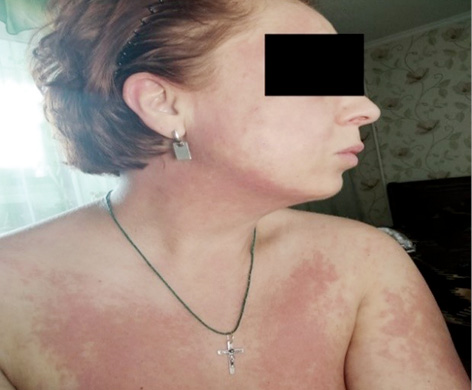
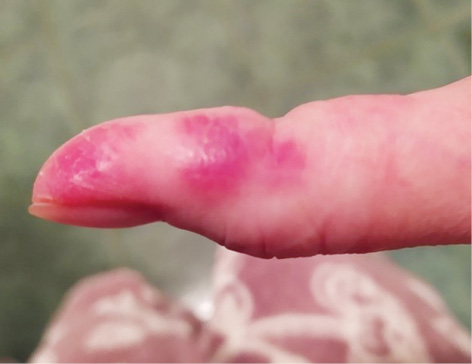
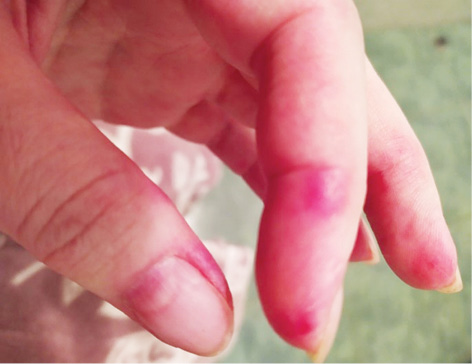
Об’єктивний статус. Шкірні покриви сухі, слизові оболонки блідо-рожеві. Еритема обличчя та грудної клітки (рис. 1.1 та 1.2). Різко-болючі щільні підшкірні вузликові утворення на кистях рук, стопах, поодинокі на стегнах, що викликають свербіж і печіння, особливо болючі на кистях рук (рис. 2.1 та 2.2). Невеликі виразки в основі III пальців обох кистей рук, праворуч — суха, зліва — з помірним сукровичним виділенням (рис. 3.1 та 3.2). Щільні утворення у підшкірній клітковині сідниць. Підвищення температури тіла до 39,0 °С в ранковий час, зі зниженням до 36,7 °С після прийому метилпреднізолону. Набряк слизової оболонки ротової порожнини та обличчя. Сухість слизових оболонок очей. Щитовидна залоза візуально та пальпаторно не збільшена. Периферичні лімфовузли не збільшені. Зів чистий, гіперплазії лімфоїдного апарату глотки не виявлено. Межі серця у рамках норми. Тони серця приглушені, ритмічні, прискорені — 96 уд./хв. Вени шиї, гомілок — без особливостей. Пульс симетричний, задовільні пальпаторні властивості. Артеріальний тиск 120/80 мм рт. ст. Грудна клітка кіфотичної форми, симетрична при диханні та у спокої. Змішаний тип дихання. Частота дихання 22/хв. Над легенями легеневий звук, ослаблене везикулярне дихання. Порожнина рота санована, язик сухий, обкладений білим нальотом. Живіт округлої форми, при пальпації м’який, безболісний, ознак асциту немає. Печінка, селезінка пальпаторно та перкуторно не збільшені, перистальтика кишечнику не порушена.
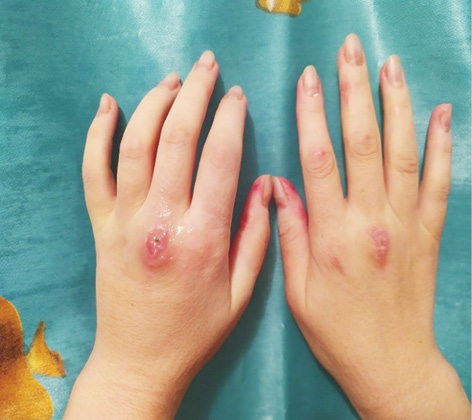
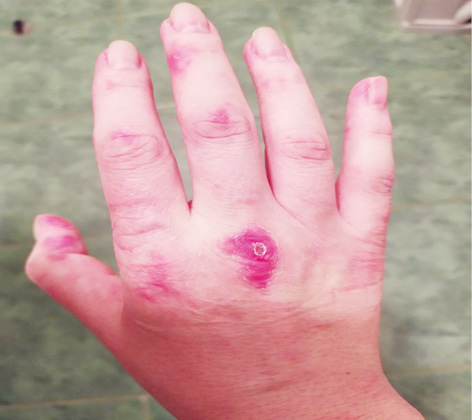
За даними попередніх обстежень пацієнтки встановлено, що вона ніколи не хворіла на туберкульоз, вірусні гепатити, не інфікована ВІЛ. Перенесла апендектомію у віці 12 років. Має вроджену доліхосигму, хронічний геморой, виразкову хворобу дванадцятипалої кишки, безпліддя пов’язує з хронічними аднекситами. Хронічний фарингіт. За словами пацієнтки, після початку терапії глюкокортикоїдами відзначає припинення менструації, що триває 2 міс. За даними мультиспіральної КТ (МСКТ) від 03.11.2020 р., у пацієнтки виявлено утворення тіла матки, що потребувало виключення злоякісної пухлини ендометрія. Оглянута гінекологом 09.11.2020 р., встановлено діагноз «вузлова фіброміома матки», рекомендовано спостереження у динаміці.
Епідеміологічний анамнез пацієнтки виключає контакт протягом останніх 2 тиж з хворими на СOVID-19, на момент огляду та протягом останніх 14 днів не виявлено симптомів гострої респіраторної вірусної інфекції (ГРВІ). Надала довідку про результат тестування методом полімеразної ланцюгової реакції (ПЛР) на СOVID-19 від 13.12.2020 р. — негативний, експрес-тест на СOVID-19 негативний від 15.12.2020 р.
Пацієнтку госпіталізовано до ізолятора, 16.12.2020 р. за погодженням з пацієнткою вже після госпіталізації проведено повторний тест ПЛР до СOVID-19 — негативний.
За даними біохімічного аналізу крові, на момент загострення не виявлено підвищення КФК, АлАТ, AсАТ, значного підвищення ЛДГ, незважаючи на посилення задишки, появу лихоманки до 39,6 °С, що виникла у період госпіталізації (табл. 1–3).
Таблиця 1. Загальний аналіз крові
| Показник | 15.12.2020 | 17.12.2020 | 19.12.2020 | 21.12.2020 | 22.12.2020 | Референтні значення |
|---|---|---|---|---|---|---|
| Еритроцити,´1012/л | 4,66 | 4,29 | 4,74 | 4,65 | 4,49 | 3,6–5,8 |
| Гемоглобін, г/л | 135 | 132 | 134 | 141 | 134 | 120–170 |
| Лейкоцити,´109/л | 6,19 | 6.6 | 5,9 | 8,35 | 7,19 | 4,3–10,8 |
| Гранулоцити, % | 79,1 | 75 | 78,4 | 74,4 | 74,6 | 50,0–80,0 |
| Лімфоцити, % | 18,9* | 22,1* | 17,9* | 22,1* | 23,6* | 25,0–50,0 |
| Моноцити, % | 2,0 | 2.9 | 3,7 | 3,6 | 1,8 | 2,0–10,0 |
| Тромбоцити,´109/л | 211 | 286 | 262 | 364 | 338 | 140–400 |
| ШОЕ, мм/год | 20* | 26* | 29* | 32* | 34* | 1–15 |
*Відхилення від референтних значень. ШОЕ — швидкість осідання еритроцитів.
Таблиця 2. Біохімічний аналіз крові
| Показник | 17.12.2020 | 21.12.2020 | Референтні значення |
|---|---|---|---|
| Білірубін загальний, мкмоль/л | 12 | 11 | 4,0–25,7 |
| Креатинін, ммоль/л | 83 | 96 | 62–133 |
| Сечова кислота, мкмоль/л | 340 | – | 140–415 |
| AлАТ, Од/л | 27 | 26 | 5–40 |
| AсАТ, Од/л | 28 | 25 | 11–40 |
| Глюкоза, ммоль/л | 4,0 | 4,2 | 3,85–6,05 |
| Холестерин загальний, ммоль/л | 6,6* | 6,4* | 3,64–5,2 |
| Тригліцериди, ммоль/л | 2,55* | 3,0* | 0,4–1,8 |
| ЛДГ, Од/л | – | 437* | 210–425 |
| КФК, ммоль/л | – | 40 | 24–170 |
| Протеїн, г/л | 70 | 71 | 66–87 |
| Альбумін, г/л | 37 | 42 | 35–54 |
*Відхилення від референтних значень. ЛДГ — лактатдегідрогеназа.
Таблиця 3. Коагулограма
| Показник | 17.12.2020 | 21.12.2020 | Референтні значення |
|---|---|---|---|
| Тромбіновий час, % | 98 | 98 | 90–105 |
| Вільний гепарин, с | 3 | 3 | 3–6 |
| Фібриноген, г/л | 4,25* | 3,5 | 1,9–3,7 |
| Протромбіновий індекс, % | 74* | 100 | 80–110 |
| Міжнародне нормалізоване відношення | 1,45* | 1,0 | 0,8–1,2 |
*Відхилення від референтних значень.
Виявлено помірне підвищення рівня С-реактивного білка (СРБ) — 9,68–9,74 г/л; D-димер — 0,14 мг/л та прокальцитонін — 0,05 нг/мл були в межах норми.
Враховуючи можливість інфікування СOVID-19 та рекомендації щодо обстеження пацієнтів з лихоманкою у стаціонарі в період пандемії пацієнтка була ретельно перевірена на коронавірус. Вона при госпіталізації надала довідку про результат ПЛР до SARS-CoV-2 від 13.12.2020 р. — негативний, проведено експрес-тест на СOVID-19 — негативний 15.12.2020 р. Однак у зв’язку з фебрильною температурою та посиленням задишки 16.12.2020 р. проведено повторний ПЛР до SARS-CoV-2 — негативний. Після отримання результатів КТ 18.12.2020 р., з огляду на типову для коронавірусної пневмонії КТ-картину проведено повторний експрес-тест на SARS-CoV-2 — негативний; 21.12.2020 р. проведено контроль антитіл до SARS-CoV-2: IgM — 0,11 — негативний, IgG — 0,08 — негативний (табл. 4).
Таблиця 4. Імунограма
| Клітини | CD-рецептор | Результат | Референтні значення |
|---|---|---|---|
| Абс/мкл | Абс/мкл | ||
| В-лімфоцити | CD20+ | 312 | 111–376 |
| Натуральні кілери (NK) | CD3–16ɤ5ô+ | 49* | 123–369 |
| Т-лімфоцити з цитотоксичною активністю | CD3+16ɤ56+ | 22 | 7–165 |
| Т-лімфоцити (усі) | CD3+19– | 779* | 946–2079 |
| Т-хелпери | CD3+4+ | 607 | 576–1336 |
| Т-кілери/супресори | CD3+8+ | 206* | 372–974 |
| Індекс імуногенності | CD4+/СD8+ | 2,95* | 1,5–2,6 |
*Відхилення від референтних значень.
Дані імунограми дають змогу відзначити деяку схожість між COVID-19 і цим випадком ДМ. При СOVID-19 лімфопенія пов’язана із тяжкістю захворювання. У тяжких випадках СOVID-19 майже завжди відмічають помітне зниження кількості Т-лімфоцитів [15]. Крім того, численні дослідження показали, що у пацієнтів, інфікованих SARS-CoV-2, значно зменшилася кількість NK та CD8+ Т-клітин [16–18], що загалом відповідає імунограмі пацієнтки.
За даними інструментальних обстежень: ЕКГ — синусова тахікардія з частотою серцевих скорочень (ЧСС) 102 уд./хв. Нормальне положення, ЕВС (кут α-36°). Скорочення інтервалу P–Q — 102 мс.
Ехокардіографія: кінцевий діастолічний об’єм (КДО) 95 мл, кінцевий систолічний об’єм (КСО) 30 мл, ФВ 68%, товщина міжшлуночкової перегородки (ТМШП) 1,0–1,1 см, товщина задньої стінки лівого шлуночка (ТЗСЛШ) 0,6 см, систолічний тиск в легеневій артерії (СТЛА) 35,5 мм. рт. ст. Перикард помірно ущільнений. Діагональна хорда від базального відділу міжшлуночкової перегородки (МШП) із потовщенням у місці відходження до 1,1 см, додаткові хорди у верхівці ЛШ. Шунтів у міжпередсердній перегородці (МПП), МШП, об’ємних утворень не виявлено. Порожнини не збільшені, міокард не потовщений. Крайове потовщення стулок аортального клапана (АК), незначне ущільнення інших стулок та клапанних кілець. Мінімальна недостатність АК. Порушення діастолічної функції ЛШ за типом псевдонормалізації. Низька ймовірність легеневої гіпертензії. Скорочувальна здатність міокарда ЛШ збережена.
Після госпіталізації стан пацієнтки погіршився: температура тіла зросла до 39,6 °C, посилилася задишка, сатурація знизилася до 93%, пацієнтка спрямована на МСКТ із контрастуванням органів грудної клітки. За даними МСКТ органів грудної клітки, черевної порожнини та малого таза (18.12.2020) в обох легенях визначаються дифузні ділянки ущільнення за типом «матового скла» S1, S2, S3, S6 білатерально, перибронховаскулярно, з нечіткими контурами (рис. 4.1 та 4.2). Тяжисті смуги на рівні костальної плеври сегментів S10, S9 білатерально. Трахеобронхіальне дерево без ознак порушення вентиляції. Серце, легеневі артерії, аорта нормальних розмірів, конфігурації. Органи середостіння, м’які тканини грудної стінки без особливостей. Ознак лімфаденопатії, кістково-деструктивних змін не виявлено.
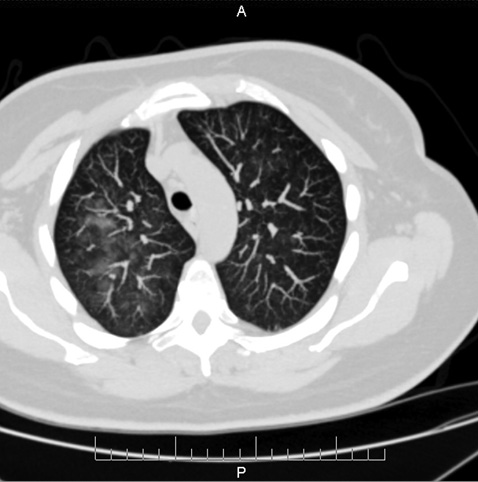
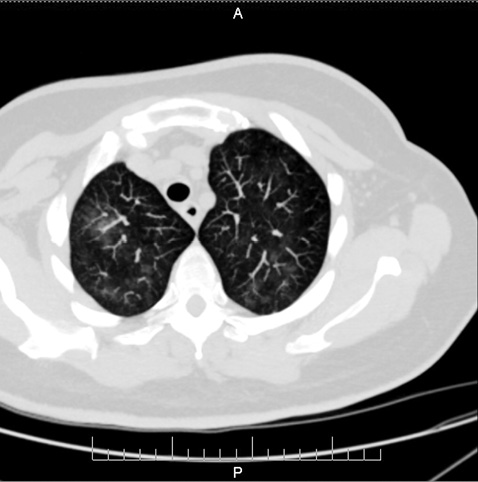
Печінка збільшена, краніокаудальний розмір 185 мм, нормальної щільності. У S5 кіста 17×27 мм. Внутрішні та позапечінкові жовчні протоки, ворітна, селезінкова вени не розширені. Жовчний міхур підвищеної щільності, рентгенконтрастних конкрементів не містить. Підшлункова залоза нормальних розмірів, контури чіткі, паренхіма однорідна. Вірсунгова протока, внутрішньопанкреатична частина холедоха не розширені. Перипанкреатична клітковина не ущільнена. Селезінка нормальних розмірів 107x44x108 мм, у воротах додаткова частка 8 мм. Надниркові залози без структурних, об’ємних змін. Нирки розташовані типово, форма, паренхіма нормальної товщини. Чашково-мискова система, сечоводи не розширені, рентгенконтрастних конкрементів не містять, периренальна клітковина тяжиста. У шлунково-кишковому тракті визначаються численні округлі кальцинати в стінках тонкого кишечнику (дванадцятипалої, клубової кишки), нисхідної ободової, сигмовидної кишки (рис. 5.1 та 5.2). Ці зміни в легенях та кальцинати в кишечнику у попередньому КТ-дослідженні від 03.11.2020 р. не визначалися. Інфільтратів у черевній порожнині, заочеревинному просторі не виявлено.
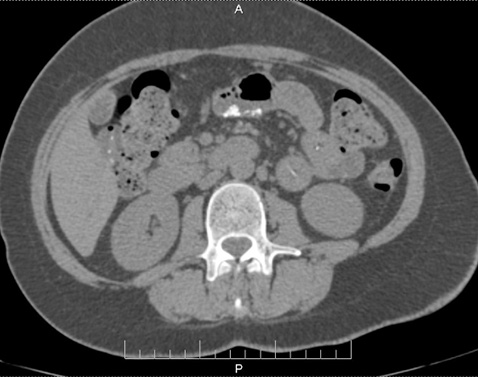
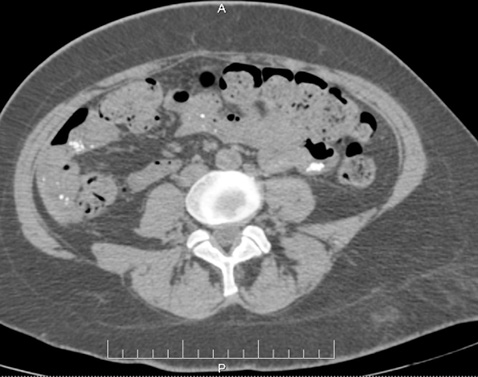
Висновок: КТ-ознаки двобічної полісегментарної пневмонії CORADS-4. Кіста печінки S5. Множинні кальцинати у стінках шлунка, тонкої, нисхідної ободової, сигмовидної кишки. Гепатомегалія. Холецистит. Характер кальцинатів за даними КТ залишився нез’ясованим, рекомендовано проведення фіброгастроскопії, колоноскопії, що пацієнтка провела після виписки.
У зв’язку з дискомфортом в епігастрії та гіпогастральній ділянці з обох боків пацієнтка проконсультована хірургом, встановлено діагноз «хронічний геморой у стадії нестійкої ремісії, звичний запор, кишкова колька», до лікування додано піколакс, меверин по 1 капсулі 2 р/добу на 15 днів.
Після отримання результатів КТ пацієнтці проведено інфузію метилпреднізолону 125 мг внутрішньовенно крапельно, № 5, з подальшим переведенням на метилпреднізолон 36 мг/добу. Незважаючи на виділення з виразки лівої кисті, відновлено прийом мофетилу мікофенолату 1 г 2 рази на добу.
На тлі терапії стан пацієнтки значно покращився: зменшилася задишка з 22–25 до 19/хв, температура тіла знизилася до максимальних цифр 37,5 °С, знизилася інтенсивність еритеми на обличчі та грудній клітці, сатурація зросла з 93 до 97%. Пацієнтці на виписку призначено метилпреднізолон 36 мг/добу з вирішенням питання про зниження дози через 1 міс, мофетилу мікофенолат 1 г 2 р/добу, огляд через 4 міс.
Враховуючи наявність кальцинатів нез’ясованої етіології, пацієнтка направлена на фіброезофагогастродуоденоскопію (ФЕГДС), колоноскопію, рекомендована консультація онколога.
Пацієнтка звернулася на повторну консультацію 04.02.2021 р. За даними обстеження: ФЕГДС — еритематозна катаральна гастропатія, уреазний тест — негативний. За даними колоноскопії — органічної патології у сигмовидній, поперечній та нисхідній ободовій кишці не виявлено. Розширення внутрішніх гемороїдальних вен ІІ ст. Застійний геморой. За даними висновку онколога онкопатології не виявлено. Етіологія кальцинатів залишилась нез’ясованою.
Клінічно у пацієнтки залишилася незначна еритема на обличчі та грудній клітці. Відмічається зменшення хворобливості підшкірних вузликів на кистях, поступове загоєння виразок на кистях, зменшення задишки, температура тіла у нормі, сатурація 97–98%. За даними загального аналізу крові від 21.01.2021 р.: лейкоцити 7,57·109/л, лімфоцити 24%, моноцити 1,1%, нейтрофіли 63,9%, еозинофіли 1,1%, базофіли 0,3%, еритроцити 4,39·1012/л, гемоглобін 134 г/л, тромбоцити 224·109/л, ШОЕ 22 мм/год.
Пацієнтці рекомендовано зниження дози метилпреднізолону на 2 мг 1 раз на тиждень до 16 мг/добу, мофетилу мікофенолат підвищено до 1 г 3 рази на добу.
Наступна консультація відбулася 23.03.2021 р. Відзначалося зникнення еритеми, загоєння ран на кистях, зменшення розмірів та хворобливості підшкірних вузликів, підвищення толерантності до фізичних навантажень. У біохімічному аналізі крові відхилення АлАТ, АсАТ, КФК були відсутні. За даними загального аналізу крові 18.03.2021 р.: лейкоцити 5,93·109/л, лімфоцити 26,3%, моноцити 12,6%, нейтрофіли 58,7%, еозинофіли 1,9%, базофіли 0,5%, еритроцити 4,6·1012/л, гемоглобін 139 г/л, тромбоцити 218·109/л, ШОЕ 11 мм/год.
Пацієнтці рекомендовано зниження дози метилпреднізолону на 1 мг 1 раз на 2 тиж до 12 мг/добу, мофетилу мікофенолат 3 г/добу.
Остання консультація проведена 25.05.2021 р. Пацієнтка самостійно зробила спробу різкого зниження дози гормонів з 12 мг до 8 мг на добу, що викликало незначне посилення загальної слабкості, що не дозволило своєчасно перейти до подальшого поступового зниження дози глюкокортикоїдів. Пацієнтці повернуто 12 мг метилпреднізолону на добу. Однак загалом стан пацієнтки зберігався стабільним. За даними загального аналізу крові від 20.05.2021 р.: лейкоцити 5,49·109/л, лімфоцити 19,1%, моноцити 14%, нейтрофіли 63,9%, еозинофіли 2,2%, базофіли 0,5%, еритроцити 4,0·1012/л, гемоглобін 134 г/л, тромбоцити 287·109/л, ШОЕ 15 мм/год. АлАТ, АсАТ, КФК у нормі.
Для оцінки динаміки змін у легенях, кальцинатів у кишечнику проведено повторну МСКТ органів грудної клітки та черевної порожнини (25.05.2021). Зберігаються фіброзні зміни у нижніх частках обох легень, локалізовані переважно S6, S9, S10, що визначалося за даними попередніх МСКТ-обстежень. Не виявлено залишкових ознак перенесеного 18.12.2021 р. загострення із ураженням легень. Ознак лімфаденопатії, кістково-деструктивних змін, об’ємних утворень не виявлено. У шлунково-кишковому тракті при повторному обстеженні відсутні кальцинати у стінках шлунка, тонкого кишечнику, дванадцятипалої, клубової кишки, описані в попередньому КТ-дослідженні від 18.12.2020 р., що залишається недостатньо з’ясованим у цьому клінічному випадку.
Висновки
1. У деяких пацієнтів з ДМ існує генетична схильність до перебігу захворювання з переважним ураженням легень, що може не супроводжуватися підвищенням лабораторних маркерів ураження м’язів і становити суттєві труднощі у діагностиці основного захворювання.
2. Виключення COVID-19 інфекції у пацієнтів з ДМ може ускладнювати його діагностику та своєчасне надання кваліфікованої медичної допомоги.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- 1. Bradley B., Bradley H.M., Egan J.J. et al. (2008) Interstitial lung disease guideline: the British Thoracic Society in collaboration with the Thoracic Society of Australia and New Zealand and the Irish Thoracic Society. Thorax, 63. doi: 10.1136/thx.2008.101691.
- 2. Vaz de Paula C.B., Viola de Azevedo M.L., Nagashima S. et al. (2020) IL-4/IL-13 remodeling pathway of COVID-19 lung injury. Nature research, 10: 18689. doi: 10.1038/s41598-020-75659-5.
- 3. Kim D.S., Collard H.R., Talmadge E.K.J. (2006) The European Respiratory Society distinguishes the following histological patterns of interstitial pneumonia. ATS Journals, 3(4): 285–292. doi: 10.1513/pats.200601-005TK.
- 4. Chen I.J., Jan W.Y.J., Lin C.W. et al. (2009) Interstitial lung disease in polymyositis and dermatomyositis. Clin. Rheumatol., 28(6): 639–46. doi: 10.1007/s10067-009-1110-6.
- 5. Hayashi S., Tanaka M., Kobayashi H. et al. (2008) High-resolution computed tomography characterization of interstitial lung diseases in polymyositis/dermatomyositis. J. Rheumatol., 35: 260–269.
- 6. Marie I., Hatron P.Y., Hachulla E. et al. (1998) Pulmonary involvement in polymyositis and in dermatomyositis. J. Rheumatol., 25: 1336–1343. PMID: 9676766.
- 7. Miro O., Laguno M., Grau J.M. et al. (1999) Survival of patients with polymyositis/dermatomyositis and pulmonary involvement. J. Rheumatol., 26: 1852–1854. PMID: 10451094.
- 8. Peravali R., Acharya S., Raza S.H. et al. (2020) Dermatomyositis Developed After Exposure to Epstein-Barr Virus Infection and Antibiotics Use. Am. J. Med. Sci., 360(4): 402–405. doi: 10.1016/j.amjms.2020.05.011.
- 9. Сіренко Ю.М., Проценко Г.О., Бойчук Н.С. (2014) Антисинтетазний синдром: особливості діагностики та лікування. Укр. ревматол. журн., 56(2): 85–88.
- 10. Ikezoe J., Takeuchi N., Kato H. (1996) Dynamic range control processing of digital chest images: a clinical evaluation. Acta Radiologica, 37: 107–115. doi: 10.1177/02841851960371P121.
- 11. William D.T., Costabel U., Hansell D.M. et al. (2013) An official American Thoracic Society/European Respiratory Society statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. Am. J. Respir. Crit. Care Med., 15; 188(6): 733–48. doi: 10.1164/rccm.201308-1483ST.
- 12. Allenbach Y., Benveniste O., Stenzel W. et al. (2020) Immune-mediated necrotizing myopathy: clinical features and pathogenesis. Nature Reviews Rheumatology, 16: 689–701. doi: 10.1038/s41584-020-00515-9.
- 13. Chen Z., Wang Y., Kuwana M. et al. (2017) HLA-DRB1 Alleles as Genetic Risk Factors for the Development of Anti-MDA5 Antibodies in Patients with Dermatomyositis. The Journal of Rheumatology, 44(9): 1389–93. doi: 10.3899/jrheum.170165.
- 14. Gonzales-Moreno J., Raya-Cruz M., Losada-Lopez I. et al. (2018) Rapidly progressive interstitial lung disease due to anti-MDA5 antibodies without skin involvement: a case report and literature review. Rheumatol. Int., 38(7): 1293–1296. doi: 10.1007/s00296-018-3991-7.
- 15. Tavakolpour S., Rakhshandehroo T., Wei E.X. et al. (2020) Lymphopenia during the COVID-19 infection: What it shows and can be learned. Immunology Letters, 225: 31–32. doi: 10.1016/j.imlet.2020.06.013.
- 16. Zheng M., Gao Y., Wang G. et al. (2020) Functional exhaustion of antiviral lymphocytes in COVID-19 patients. Cell Mol. Immunol.,17: 533–535. doi: 10.1038/s41423-020-0402-2.
- 17. Li D., Chen Y., Liu H. et al. (2020) Immune dysfunction leads to mortality and organ injury in patients with COVID-19 in China: Insights from ERS-COVID-19 study. Signal. Transduct. Target. Ther., 5:62. doi: 10.1038/s41392-020-0163-5.
- 18. Wang F., Nie J., Wang H. et al. (2020) Characteristics of Peripheral Lymphocyte Subset Alteration in COVID-19 Pneumonia. J.Infect.Dis., 221: 1762–1769. doi: org/10.1093/infdis/jiaa150.
Адреса для листування:
ДУ ННЦ «Інститут кардіології,
клінічної та регенеративної медицини»
НАМН України
E-mail: k300b600@gmail.com

Leave a comment