КИСНЕВЕ ЗАБЕЗПЕЧЕННЯ ТКАНИН У ХВОРИХ НА СИСТЕМНИЙ ЧЕРВОНИЙ ВОВЧАК
Яременко О.Б., Джус М.Б., Карасевська Т.А.
Резюме. Однією з головних причин невизначеності показань та критеріїв ефективності неспецифічних методів лікування системного червоного вовчака (СЧВ) є відсутність спільного для всіх хворих знаменника, який відображав би вплив неспецифічних реакцій організму на патологічний процес. На цю роль могли б претендувати параметри кисневого забезпечення організму, механізми формування гіпоксії чи нормоксії тканин. Мета. Вивчити стан кисневого забезпечення організму хворих на СЧВ та асоціацію його змін з активністю захворювання, залученням нирок, лікуванням глюкокортикоїдами (ГК). Матеріали та методи. Обстежено 108 хворих на СЧВ з низькою, згідно з Індексом активності захворювання на системний червоний вовчак (Systemic Lupus Erythematosus Disease Activity Index — SLEDAI)-2K (n=30), помірною (n=38) та високою активністю захворювання (n=40). Вивчали легеневий газообмін методами мас-спектрометрії та спірографії, параметри оксигенації артеріальної та венозної крові (стегнові судини), величину Р50, кровотік в гомілці, напругу кисню в підшкірній клітковині гомілки та кінетичні параметри його доставки та утилізації методом полярографії. Результати. У хворих на СЧВ виявлено порушення транспорту кисню на всіх етапах, однак визначальними детермінантами кисневого режиму тканин (КРТ) були швидкість капілярно-тканинної дифузії кисню (ШКТДК), активність тканинного дихання (АТД) та стан мікрогемодинаміки. Спільною закономірністю для категорій тяжчих хворих (які ще не приймають ГК, високий ступінь активності) є нормальні чи підвищені АТД та ШКТДК, активація артеріовенозного шунтування крові. Низька активність захворювання, прийом ГК асоціюються зі зниженням АТД та ШКТДК. Особливістю хворих з нефритом є лише більше недонасичення артеріальної крові киснем за рахунок вираженішої анемії, що компенсується зростанням периферичного кровотоку. Висновки. Параметри КРТ можуть бути імунонезалежними критеріями оцінки системних змін в тканинах, індикатором активації адаптивних механізмів.
DOI: 10.32471/rheumatology.2707-6970.92.18022
УДК 616.5-002.52-036.1-085:612.26]:615.27
ВСТУП
Системний червоний вовчак (СЧВ) — клінічно та патогенетично гетерогенне захворювання, в основі якого лежать аутоімунні механізми на тлі порушень клітинного імунітету. Якщо заходи планової фармакотерапії переважно імуносупресивного спрямування є стратегічно і тактично досить детально відпрацьованими, то показання до призначення і результати застосування непротокольних методів лікування, наприклад, еферентних чи спрямованих на покращання капілярно-тканинного обміну, залишаються предметом дискусій. Одними з головних причин такої ситуації є надзвичайна строкатість клінічних проявів, відсутність прямого паралелізму між динамікою перебігу захворювання та змінами імунологічних показників, тобто відсутність спільного для всіх хворих знаменника, який відображав би стан певних універсальних, неспецифічних реакцій організму на патологічний процес. На цю роль з кількох причин могли б претендувати параметри кисневого забезпечення організму, механізми формування гіпоксії чи нормоксії тканин. По-перше, цей чинник наявний на всіх етапах захворювання, починаючи з преморбідного стану і закінчуючи одужанням, і є ключовою ланкою як альтеративних, так і саногенних механізмів запалення [1, 8, 9]. По-друге, є достатньо підстав вважати гіпоксію не тільки наслідком, а й повноправним учасником імунопатологічного процесу, який реалізує свою дію шляхом впливу на центральні органи імунорегуляції і систему вторинних посередників [11–13, 19, 22, 23]. По-третє, кисневе забезпечення тканин (КЗТ) належить до обмеженого переліку регуляційних функцій організму, відносна сталість яких забезпечується широким діапазоном змін конформних функцій [4, 5, 18, 21, 24]. Тобто стан КЗТ слід розглядати як інтегральний показник, кінцевий результат інтерференції пошкоджувальних чинників та компенсаторних реакцій. Однак дослідження, спрямовані на вивчення змін КЗТ та їх клінічне значення у хворих на СЧВ, практично не проводилися.
МЕТА ДОСЛІДЖЕННЯ
Вивчити стан основних ланок системи кисневого забезпечення організму хворих на СЧВ та асоціацію його змін з активністю захворювання, залученням нирок, лікуванням глюкокортикоїдами (ГК).
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
Обстежено 108 хворих, які відповідали класифікаційним критеріям СЧВ Європейського альянсу ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR)/Американського коледжу ревматологів (American College of Rheumatology — ACR) (2019) [2]. Серед них було 95 жінок і 13 чоловіків віком в середньому 35 (18–64) років із тривалістю хвороби в середньому 6 років (від 1 міс до 22 років). На час обстеження низьку активність СЧВ (індекс активності захворювання на СЧВ (Systemic Lupus Erythematosus Disease Activity Index — SLEDAI)-2K ≤4 балів [7]) виявлено у 30 хворих (27,8%), помірну (SLEDAI-2K 5–10 балів) — у 38 (35,2%), високу (SLEDAI-2K >10 балів) — у 40 (37%). У переважної більшості пацієнтів виявлена полісиндромна симптоматика, зокрема, ураження шкіри та слизових оболонок — у 84 хворих (77,8%), поліартрит чи поліартралгії — у 90 (83,3%), ураження нирок — у 59 (54,6%), кардит — у 60 (55,6%), серозит — у 47 (43,5%), ураження системи мононуклеарних фагоцитів — у 43 (39,8%), центральної нервової системи — у 29 (26,9%), пневмоніт — у 15 (13,9%), синдром Рейно — у 15 (13,9%); рідше відмічали органічні ураження інших органів і систем. Люпус-нефрит діагностували за результатами біопсії нирки та/або відповідно до критеріїв ниркового домену SLEDAI-2K; хворих з гострим пошкодженням нирок і хронічною хворобою нирок вище І стадії в дослідження не включали. У дослідження також не включали хворих з набряками будь-якого походження, клінічно значущою патологією інших органів і системи еритрону, яка не була проявом ревматичного захворювання. На час обстеження 14 хворих не отримували будь-якого лікування, включаючи ГК, у решти хворих фармакотерапія (ГК, нестероїдні протизапальні препарати (НПЗП), гідроксихлорохін, азатіоприн, циклофосфамід та ін.) відповідала існуючим рекомендаціям, тяжкості ураження певних органів і систем.
Усі хворі надали добровільну інформовану згоду на участь у дослідженні. У контрольну групу включили 38 практично здорових осіб, зіставних за демографічними характеристиками з хворими на СЧВ (28 жінок та 10 чоловіків віком 19–62 років, у середньому 39 років).
Дослідження системи кисневого забезпечення організму включало оцінку стану основних її ланок: легеневого газообміну, оксигенації артеріальної крові, кисневотранспортної функції еритроцитів, периферичної гемодинаміки, кисневого режиму тканин, оксигенації венозної крові.
Легеневий газообмін вивчали з використанням методів мас-спектрометрії (мас-спектрометр МХ 6202, Україна) синхронно зі спірографією (спірограф СПІРО 2-25, Україна) з визначенням величини альвеолярного парціального тиску кисню (РАО2, мм рт. ст.) та поглинутого організмом кисню за одиницю часу (ПО2, мл/хв·м2) шляхом множення різниці вмісту кисню в повітрі та змішаного видихнутого газу на хвилинний об’єм дихання. Артеріальну та венозну кров отримували шляхом пункції стегнових артерії та вени на рівні пахвинної зв’язки. Парціальну напругу кисню в цих пробах крові (відповідно РаО2 та РvО2, мм рт. ст.) вимірювали електродом Кларка (апарат AVL-OMNI («AVL», Австрія)). Для оцінки порушень вентиляційно-перфузійних відношень та дифузії кисню в легенях вираховували альвеоло-артеріальний градієнт напруги кисню — Р(А-а)О2 (мм рт. ст.). Насичення киснем гемоглобіну в артеріальній та венозній крові (SaO2, SvO2) визначали на оксиметрах OSM-1 («Radiometer», Данія) і BGA 178 («Corning», Великобританія). Вміст кисню в обох пробах крові (СаО2, СvO2, мл/100 мл) вимірювали на апараті Ван-Слайка типу АГК-2 (у 39 хворих) або розраховували за відомими формулами [10] з подальшим обчисленням артеріовенозної різниці вмісту кисню (Са-vO2, мл/100 мл) та коефіцієнту його екстракції тканинами (КЕO2,%). Спорідненість гемоглобіну до кисню оцінювали за положенням кривої дисоціації оксигемоглобіну, яке характеризували величиною істинного Р50 (мм рт. ст.) [16].
Питомий пульсовий кровотік в кінцівці (ПКк, мл/хв·100 г) на рівні гомілки досліджували методом імпедансної реоплетизмографії (апарат РПГ2-02, Україна) [26]. Використовуючи величину ПКк, обчислювали індекс транспорту кисню до тканин кінцівки (ІТО2к, мл/хв·100 г) шляхом множення ПКк на СаО2 та його питоме поглинання (ПО2к, мл/хв·100 г) за формулою Фіка.
У підшкірній клітковині макроскопічно не змінених ділянок зовнішнього боку гомілки на межі середньої та нижньої її третини прямим полярографічним методом (полярограф LP 7е (Чехія), відкритий платиновий електрод) визначали тканинну напругу кисню (РтО2, мм рт. ст.) та кінетичні параметри доставки та утилізації кисню на тканинному рівні за результатами проби з 5-хвилинною регіонарною ішемією та реактивною гіперемією [27]: латентний період зниження РтО2 після припинення артеріального кровотоку (Тл↓, с) та константа швидкості утилізації кисню за першу хвилину ішемії (КШУ1, 1/хв), які характеризують інтенсивність тканинного дихання; латентний період підвищення РтО2 (Тл↑, с) та час досягнення 75% приросту РтО2 після відновлення кровообігу в кінцівці (Т75, с), які визначаються швидкістю капілярно-тканинної дифузії кисню та станом мікроциркуляції. Крім того, реєстрували ступінь тимчасового зниження РтО2 внаслідок вазоконстрикторної реакції на введення полярографічного електрода та час, протягом якого РтО2 поверталася до стабільного рівня, які розцінювали як показники вираженості та тривалості спастичної реакції мікросудин (відповідно Вср,%, та Тср, с).
Відбір крові на газоаналітичні дослідження здійснювали із судин тієї ж кінцівки, яка була об’єктом полярографічних та реоплетизмографічних досліджень.
Статистичну обробку результатів здійснювали з використанням пакету ліцензійних програм. У разі нормального розподілу кількісних показників використовували критерій Стьюдента та представляли їх у вигляді М±m. Частоту певних подій чи ознак в різних групах порівнювали за критерієм c2, за необхідності — з поправкою Йєйтса. Для оцінки зв’язку між кількісними показниками розраховували коефіцієнт кореляції Пірсона.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
У загальної когорти хворих на СЧВ порівняно зі здоровими особами виявлено погіршення альвеолярно-артеріальної дифузії кисню в легенях (підвищення Р(А-а)О2 на 21,8%), зниження показників оксигенації артеріальної крові (РаО2 на 8%, SaO2 на 2,3%) та додатково внаслідок анемії — суттєве зниження вмісту в ній кисню (CaO2 на 20%) (табл. 1). Очікувано при цьому зростала активність екстракції кисню тканинами (збільшення КЕО2 на 16,6%) та знижувався SvO2 (на 9,6%). Хоча об’ємні показники доставки кисню до тканин кінцівки (ПКк та ІТО2к) не були суттєво зміненими, реєструвалася гіпоксія тканин (зниження РтО2 на 17,8%) на тлі пригнічення активності тканинного дихання (підвищення Тл↓ на 40,1% та зниження КШУ1 на 39,4%) та погіршення капілярно-тканинної дифузії кисню (підвищення Тл↑ майже вдвічі та Т75 на 20,3%). Про можливий внесок судинно-мікроциркуляторних порушень в погіршення умов доставки кисню до периферичних тканин може свідчити достовірне підвищення Тср (на 34%).
Таблиця 1. Показники кисневого забезпечення тканин у хворих з різним ступенем активності СЧВ (М±m)
| Показник | Норма
n=38 |
Усі хворі
n=108 |
Ступінь активності | ||
|---|---|---|---|---|---|
| Низький
n=30 |
Помірний
n=38 |
Високий
n=40 |
|||
| ПО2 | 118,2±4,8 | 120,8±2,9 | 123,9±4,7 | 129,4±3,4 | 110,6±4,9 |
| Р(А-а)О2 | 17,4±0,9 | 21,2±0,8* | 17,3±1,0 | 23,3±1,3*,1 | 22,1±1,4*,1 |
| Нв | 133,7±2,1 | 108,8±2,2* | 122,8±4,6* | 109,3±3,3*,1 | 97,5±2,7*1,2 |
| РаО2 | 77,9±1,3 | 71,7±1,1* | 76,8±2,1 | 67,8±1,8*,1 | 72,0±1,5* |
| SaO2 | 92,1±0,4 | 90,0±0,4* | 92,0±0,4 | 89,7±0,7*,1 | 88,8±0,6*1 |
| CaO2 | 16,72±0,21 | 13,36±0,29* | 15,32±0,62* | 13,46±0,44*,1 | 11,82±0,33*1,2 |
| PvO2 | 35,6±1,0 | 31,3±0,6 | 34,1±1,6 | 28,6±1,0*,1 | 32,1±0,8*,2 |
| SvO2 | 62,7±1,2 | 56,7±1,0* | 61,1±1,8 | 53,9±1,8*,1 | 56,0±1,6*,1 |
| P50 | 28,8±0,4 | 28,0±0,4 | 28,2±0,7 | 26,5±0,7* | 29,1±0,62 |
| Ca-vO2 | 5,39±0,25 | 5,02±0,16 | 5,34±0,29 | 5,58±0,30 | 4,35±0,23*1,2 |
| КЕО2 | 32,5±1,5 | 37,9±1,1* | 33,9±1,9 | 41,7±1,9*,1 | 37,2±1,8* |
| ПКк | 3,32±0,17 | 3,61±0,20 | 3,45±0,32 | 3,78±0,33 | 3,64±0,40 |
| ІТО2к | 0,53±0,04 | 0,48±0,03 | 0,53±0,05 | 0,50±0,05 | 0,46±0,05 |
| ПО2к | 0,173±0,009 | 0,175±0,013 | 0,187±0,017 | 0,212±0,025 | 0,133±0,016*,1,2 |
| РтО2 | 42,8±1,8 | 35,2±1,1* | 39,9±2,3 | 36,0±1,7* | 30,7±1,6*1 |
| Тл↓ | 13,7±1,3 | 19,2±2,1* | 24,8±4,7* | 20,4±3,8 | 14,2±2,41 |
| КШУ1 | 0,213±0,017 | 0,129±0,010* | 0,101±0,014* | 0,115±0,012* | 0,166±0,0181,2 |
| Тл↑ | 14,9±1,3 | 27,1±2,7* | 20,9±3,9 | 25,3±3,7* | 21,2±3,2 |
| Т75 | 117,7±9,1 | 141,6±6,5* | 158,8±10,5* | 140,5±10,1 | 129,2±9,31 |
| Тср | 511±47 | 685±33* | 645±58 | 734±70* | 676±50* |
| Вср | 26,0±1,7 | 24,0±1,7 | 20,9±2,7 | 22,8±2,7 | 26,7±3,2 |
Примітки: *достовірність відмінності (р<0,05–р<0,001) порівняно з нормою; 1порівняно з низьким ступенем активності; 2порівняно з помірним ступенем активності.
За мінімального ступеня активності СЧВ виявляли незначні порушення КЗТ: помірну анемію з відповідним зниженням СаО2 (на 8,4%), зниження майже вдвічі інтенсивності тканинного дихання (Тл↓ більший, ніж в нормі, в 1,8 раза, КШУ1 менший в 2,1 раза) та погіршення транспорту кисню в мікроциркуляторному басейні (збільшення Т75 на 34,9%). Погіршення умов доставки кисню до тканин на мікросудинному рівні компенсувалося зниженням активності аеробного метаболізму, внаслідок чого рівень тканинної оксигенації (РтО2) залишався суттєво не зміненим. Зростання активності хвороби супроводжувалося прогресивним зниженням рівня гемоглобіну та СаО2, вірогідним (порівняно з нормою та хворими з низькою активністю СЧВ) погіршенням альвеолоартеріального транспорту кисню й оксигенації артеріальної крові, що могло бути пов’язано з частішим клінічним чи субклінічним залученням легеневої тканини в імунозапальний процес. Недооксигенація артеріальної крові, однак, компенсувалася деяким збільшенням кровотоку, тому ІТО2 суттєво не змінювався. Відсутня кореляційна залежність між РаО2, СаО2, ІТО2 та РтО2 (r не перевищував 0,214), що підкреслювало високий ступінь незалежності формування кисневого режиму периферичних тканин від змін оксигенації артеріальної крові. Незважаючи на стабільність ІТО2, величини РтО2 при помірній та високій активності СЧВ були на 9,8 та 23,1% відповідно нижчими порівняно з такими у хворих з низькою активністю захворювання. Головною причиною цього можна вважати відносне підвищення активності дихальних ферментів (КШУ1 за високої активності СЧВ була на 64,1% вищою порівняно з низьким і на 44,3% порівняно з помірним ступенем активності і не відрізнялася від нормальних значень), оскільки швидкість капілярно-тканинної дифузії кисню (Тл↑) суттєво не змінювалася, а умови його транспорту в мікроциркуляторному руслі навіть покращувалися (Т75 був на 18,6% нижчим, ніж у хворих з низькою активністю СЧВ, і не відрізнявся від значень контрольної групи). Іншою причиною поглиблення гіпоксії тканин при високій активності СЧВ могла бути активізація артеріовенозного шунтування крові, на що вказує достовірне зниження Ca-vO2 (на 18,5–22% відносно норми та хворих низьким та помірним ступенем активності) та ПО2к (на 23,1–37,3%) на тлі незмінених показників доставки кисню (ПКк, ІТО2к, Тл↑, Т75, Р50) та активності дихальних ферментів (КШУ1). За помірного ступеня активності СЧВ реєстрували зсув кривої дисоціації оксигемоглобіну ліворуч (зниження P50 на 8%). Разом з більш вираженою анемією це свідчить про значне пошкодження гемічного компоненту кисневотранспортної системи.
Враховуючи дані про суттєві патогенетичні відмінності СЧВ з нефритом та без нього [3, 15], проаналізовано стан КЗТ у цих категорій хворих (табл. 2). Виявилося, що у пацієнтів з нефритом очікувано виявлено значно нижчий рівень гемоглобіну і, як наслідок, знижений СаО2 (на 9,9% порівняно з альтернативною групою). Однак сумарний масопотік кисню до тканин (ІТО2) не був зменшеним і навіть дещо перевищував такий у хворих без нефриту (у останніх він виявився на 20,8% нижчим за норму, і на 19,2% — порівняно з хворими з нефритом) внаслідок зростання кровотоку (на 31,6%).
Таблиця 2. Показники кисневого забезпечення тканин у хворих на СЧВ залежно від наявності нефриту та приймання ГК (М±m)
| Показник | Норма
n = 38 |
Наявність нефриту | Прийом ГК | ||
|---|---|---|---|---|---|
| так
n = 59 |
ні
n = 49 |
так
n = 94 |
ні
n = 14 |
||
| ПО2 | 118,2±4,8 | 121,9±3,3 | 119,7±2,9 | 121,6±3,1 | 118,3±5,4 |
| Р(А-а)О2 | 17,4±0,9 | 21,2±1,1* | 20,8±1,0* | 21,1±0,9* | 20,3±1,6 |
| Нв | 133,7±2,1 | 103,9±2,8* | 114,6±3,3*,1 | 109,4±2,4* | 103,5±4,3* |
| РаО2 | 77,9±1,3 | 72,1±1,6* | 71,3±1,4* | 71,7±1,1* | 72,5±4,2 |
| SaO2 | 92,1±0,4 | 90,2±0,5* | 89,8±0,5* | 90,1±0,4* | 89,4±1,1* |
| CaO2 | 16,72±0,21 | 12,77±0,38* | 14,03±0,43*,1 | 13,44±0,32* | 12,61±0,52* |
| PvO2 | 35,6±1,0 | 30,8±0,8* | 32,0±1,0* | 30,5±0,6* | 35,3±2,5 |
| SvO2 | 62,7±1,2 | 56,4±1,4* | 57,0±1,5* | 56,0±1,1* | 59,3±2,7 |
| P50 | 28,8±0,4 | 28,1±0,5 | 28,0±0,6 | 27,6±0,4* | 31,7±1,2*,2 |
| Ca-vO2 | 5,39±0,25 | 4,84±0,22 | 5,25±0,24 | 5,16±0,17 | 4,45±0,32* |
| КЕО2 | 32,5±1,5 | 38,5±1,6* | 37,1±1,5* | 38,7±1,2* | 33,8±2,4 |
| ПКк | 3,32±0,17 | 4,04±0,33 | 3,07±0,211 | 3,67±0,22 | 3,07±0,24 |
| ІТО2к | 0,53±0,04 | 0,52±0,04 | 0,42±0,03* | 0,49±0,03 | 0,40±0,06 |
| ПО2к | 0,173±0,009 | 0,190±0,021 | 0,156±0,012 | 0,181±0,013 | 0,134±0,022 |
| РтО2 | 42,8±1,8 | 35,7±1,5* | 34,7±1,6* | 34,9±1,2* | 37,9±2,9 |
| Тл↓ | 13,7±1,3 | 16,2±2,3 | 21,9±3,4* | 20,9±2,3* | 7,8±2,2*,2 |
| КШУ1 | 0,213±0,017 | 0,132±0,018* | 0,106±0,011* | 0,111±0,011* | 0,177±0,0292 |
| Тл↑ | 14,9±1,3 | 30,9±4,4* | 23,8±3,4* | 31,2±3,0* | 10,1±3,12 |
| Т75 | 117,7±9,1 | 158,1±9,2* | 137,8±9,0 | 152,4±6,9* | 107,7±13,32 |
| Тср | 511±47 | 724±50* | 641±43* | 680±38* | 719±36* |
| Вср | 26,0±1,7 | 27,0±2,6 | 20,7±2,2 | 23,2±1,8 | 29,1±6,3 |
Примітки: *достовірність відмінності (р<0,05-р<0,001) порівняно з нормою; 1порівняно з хворими з нефритом; 2порівняно з хворими, що приймали ГК.
Інших вірогідних відмінностей між групами не виявлено. Нижчий рівень гемоглобіну у пацієнтів з люпус-нефритом, очевидно, відображав переважання серед них хворих з високою активністю хвороби. Дійсно, у цієї категорії обстежених високий ступінь активності реєстрували у 40 осіб, тоді як у хворих без нефриту — у 25 (c2=5,14, р<0,05), помірна активність — відповідно у 33 і 24 (c2=1,85; р>0,05), низька — у 10 і 32 хворих (c2=16,22; р<0,001). Ймовірно, певне значення мала і депресія еритропоетинсинтетичної функції нирок при їх дифузному ураженні.
Найпоказовішими для СЧВ, вільними від медикаментозного впливу, були зміни КЗТ у хворих, які на момент обстеження не приймали ГК (див. табл. 2). Слід зауважити, що за ступенем активності та органними ураженнями, включаючи нефрит, групи хворих, які приймали та не приймали ГК, статистично не відрізнялися. У пацієнтів, які не приймали ГК, кінетичні параметри КЗТ — швидкість дифузії та утилізації кисню — не відрізнялися від показників контрольної групи і навіть мали тенденцію до зростання. Незважаючи на відсутність суттєвих змін РтО2 та ПО2к, такий рівень оксигенації тканин та поглинання кисню був, очевидно, недостатнім для активованого запальним процесом тканинного метаболізму, про що свідчили наявність метаболічного ацидозу (рН венозної крові — 7,321±0,010, р<0,05, ВЕ — /-/5,88±0,76 ммоль/л, р<0,05 порівняно з нормою) та напруження кисневотранспортної функції еритроцитів (збільшення Р50 на 10,1% порівняно з контролем). Зменшення утилізації кисню тканинами (Ca-vO2) за умов, коли його доставка, дифузія, активність дихальних ферментів не змінені, а спорідненість гемоглобіну до кисню знижена, може бути результатом активізації шунтування крові на периферії. Прийом ГК супроводжується сповільненням капілярно-тканинного та мікроциркуляторного транспорту кисню (підвищення, порівняно з альтернативною групою, Тл↑ в 3,1 раза, а Т75 — на 41,5%), пригніченням інтенсивності тканинного дихання (зниження КШУ1 на 37,3% та зростання Тл↓ в 2,7 раза), зменшенням РтО2. Нормалізація утилізації кисню (Ca-vO2) з відповідним зниженням PvO2 та SvO2 може свідчити про усунення або зменшення артеріовенозного шунтування крові. Зростання спорідненості гемоглобіну до кисню (зменшення Р50 на 12,9% порівняно з хворими, що не лікувалися ГК, та на 4,2% відносно норми) дає підстави вважати призначення ГК фактором, який негативно впливає на модуляційний тип регуляції кисневотранспортної функції крові. Реалізація цієї дії ГК може бути пов’язана зі стабілізацією (з погіршенням проникності) мембрани еритроцитів та переключенням метаболізму глюкози в еритроциті на синтез АТФ з одночасним пригніченням активності шунта Ембдена — Мейєргофа, в якому синтезується 2,3-діфосфогліцерат — ключовий регулятор положення кривої дисоціації оксигемоглобіну [17, 20].
Отже, аналіз стану системи транспорту кисню у хворих на СЧВ з різним ступенем активності запалення та осіб, які не приймали ГК, свідчить про те, що для категорії найтяжчих хворих (високий ступінь активності та пацієнти без адекватного лікування) характерні високі (близькі до нормальних) величини інтенсивності тканинного дихання та швидкості капілярно-тканинної дифузії кисню, активізація артеріовенозного шунтування крові. Кращий клінічний стан хворих (нижчий ступінь активності, в тому числі за рахунок лікування ГК) асоціюється з пригніченням кінетичних параметрів транспорту кисню в тканинах, покращанням екстракції кисню на периферії за рахунок зменшення шунтування крові. Слід зазначити, що зниження інтенсивності метаболізму, в тому числі аеробного, розцінюється як компенсаторна, захисна реакція, що сприяє виживанню тканин в умовах дії екстремальних пошкоджувальних факторів та хронічних патологічних станів [6, 14, 25].
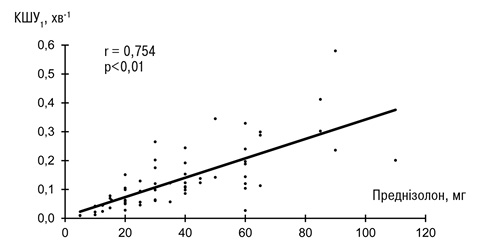
З метою підтвердження такої залежності та з’ясування, який з параметрів КЗТ найчутливіше відображає активність хвороби, було розраховано коефіцієнти кореляції між зазначеними показниками та ефективною добовою дозою ГК (в перерахунку на преднізолон перорально) — такою, яка забезпечувала позитивну клінічну динаміку із контрольованим зниженням ступеня активності щонайменше на одну градацію. Розрахунки, проведені у 62 хворих, які були обстежені до призначення або до підвищення дози ГК, показали, що найтісніша залежність існує між дозою ГК та КШУ1 (рисунок). Для цих параметрів r=0,754 (р<0,01), тоді як для інших показників КЗТ величини r знаходилися в межах /–/0,221 — /+/0,383.
Підсумовуючи отримані результати, можна стверджувати, що у хворих на СЧВ з різною активністю захворювання та фоновою протизапальною терапією кисневий режим тканин регулюється значною мірою автономно. Він детермінується переважно локальними змінами мікроциркуляторного басейну, активності аеробного метаболізму (тканинного дихання) та швидкості дифузії кисню через капілярно-тканинний бар’єр, акумулюючи наслідки реалізації багатьох механізмів розвитку запального процесу. Відповідно, можна припускати, що саме стан КЗТ відображає індивідуальні, актуальні на поточний час риси системного імунозалежного захворювання та може бути імунонезалежним знаменником для оцінки системних морфофункціональних змін в тканинах, індикатором активації адаптивних механізмів і критерієм для призначення та оцінки ефективності неспецифічних методів лікування.
ВИСНОВКИ
1. У хворих на СЧВ виявляють порушення транспорту кисню в організмі на всіх етапах, починаючи з оксигенації крові в легенях і закінчуючи інтенсивністю тканинного дихання, однак визначальними детермінантами кисневого режиму тканин є швидкість капілярно-тканинної дифузії, активність дихальних ферментів та стан мікрогемодинаміки.
2. Характер порушень кисневого режиму тканин тісно пов’язаний з клінічними особливостями СЧВ: у міру підвищення активності захворювання погіршується оксигенація артеріальної крові, і хоча масопотік кисню до тканин не знижується за рахунок гемодинамічної складової, зростає гіпоксія тканин переважно за рахунок відносного підвищення інтенсивності тканинного дихання та активізації артеріовенозного шунтування крові. Особливістю системи КЗТ у хворих з нефритом є лише більше недонасичення артеріальної крові киснем за рахунок вираженішої анемії, що компенсується зростанням периферичного кровотоку.
3. Спільною закономірністю для категорій тяжчих хворих на СЧВ (які ще не приймають ГК, високий ступінь активності) є нормальні чи підвищені активність тканинного дихання та швидкість капілярно-тканинної дифузії кисню, а також активація артеріовенозного шунтування крові, тоді як низька активність захворювання, прийом ГК асоціюються зі зниженням швидкості утилізації кисню тканинами, сповільненням його капілярно-тканинної дифузії.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- 1. Ain Q.T., Haq S.H., Alshammari A. et al. (2019) The systemic effect of PEG-nGO-induced oxidative stress in vivo in a rodent model. Beilstein J. Nanotechnol., 10: 901–911. doi: 10.3762/bjnano.10.91.
- 2. Aringer M. (2019) EULAR/ACR classification criteria for SLE. Semin. Arthritis Rheum., 49(3S): S14–S17. doi: 10.1016/j.semarthrit.2019.09.009.
- 3. Aw Y.T., Whiley P.J., Lorenzo A.M. et al. (2022) Immunophenotyping identifies distinct cellular signatures for systemic lupus erythematosus and lupus nephritis. Rheumatol & Autoimmun, 3: 15–25. doi: 10.1002/rai2.12060.
- 4. Baek J.H., Buehler P.W. (2019) Can molecular markers of oxygen homeostasis and the measurement of tissue oxygen be leveraged to optimize red blood cell transfusions? Curr. Opin. Hematol., 26(6): 453–460. doi: 10.1097/MOH.0000000000000533.
- 5. Corrado C., Fontana S. (2020) Hypoxia and HIF Signaling: One Axis with Divergent Effects. Int. J. Mol. Sci., 21(16): 5611. doi: 10.3390/ijms21165611.
- 6. Dengler F. (2020) Activation of AMPK under Hypoxia: Many Roads Leading to Rome. Int. J. Mol. Sci., 21(7): 2428. doi: 10.3390/ijms21072428.
- 7. Franklyn K., Lau C.S., Navarra S.V. et al. (2016) Definition and initial validation of a Lupus Low Disease Activity State (LLDAS). Ann. Rheum. Dis., 75(9): 1615–21. doi: 10.1136/annrheumdis-2015-207726.
- 8. Goulev Y., Morlot S., Matifas A. et al. (2017) Nonlinear feedback drives homeostatic plasticity in H2O2 stress response. Elife, 6: e23971. doi: 10.7554/eLife.23971.
- 9. Halliwell B., Gutteridge J.M.C. (2015) Free radicals in biology and medicine. 5th edn, Oxford University Press, 905 p. doi:10.1107/S2059798317004533.
- 10. Heyland D.K., Cook D.J., King D., et al. (1996) Maximizing oxygen delivery in critically ill patients: a methodologic appraisal of the evidence. Crit. Care Med., 24(3): 517–24. doi: 10.1097/00003246-199603000-00025.
- 11. Hussain M.S., Tripathi V. (2018) Smoking under hypoxic conditions: a potent environmental risk factor for inflammatory and autoimmune diseases. Mil. Med. Res., 30; 5(1): 11. doi: 10.1186/s40779-018-0158-5.
- 12. Kardol-Hoefnagel T., Michielsen L.A., Ehlers A.M. et al. (2023) Complement component C3 and C5b-9 deposition on hypoxia reperfused endothelial cells by non-HLA antibodies against RhoGDI2: A player involved in graft failure? HLA, 101(2): 103–114. doi: 10.1111/tan.14858.
- 13. Khan M.A., Shamma T., Kazmi S. et al. (2020) Hypoxia-induced complement dysregulation is associated with microvascular impairments in mouse tracheal transplants. J. Transl. Med., 18(1): 147. doi: 10.1186/s12967-020-02305-z.
- 14. Kondo Y., Sueyoshi K., Zhang J. et al. (2020) Adenosine 5’-Monophosphate Protects from Hypoxia by Lowering Mitochondrial Metabolism and Oxygen Demand. Shock, 54(2): 237–244. doi: 10.1097/SHK.0000000000001440.
- 15. Lech M., Anders H.J. (2013) The pathogenesis of lupus nephritis. J. Am. Soc. Nephrol., 24(9): 1357–66. doi: 10.1681/ASN.2013010026.
- 16. Lichtman M.A., Murphy M., Pogal M. (1976) The use of a single venous blood sample to assess oxygen binding in haemoglobin. Br. J. Haematol., 32(1): 89–98. doi: 10.1111/j.1365-2141.1976.tb01878.x.
- 17. Misiti F., Carelli-Alinovi C., Rodio A. (2022) ATP release from erythrocytes: A role of adenosine1. Clin. Hemorheol. Microcirc., 80(2): 61–71. doi: 10.3233/CH-221379.
- 18. Mori M.P., Penjweini R., Knutson J.R. et al. (2022) Mitochondria and oxygen homeostasis. FEBS J., 289(22): 6959–6968. doi: 10.1111/febs.16115.
- 19. Pastwińska J., Walczak-Drzewiecka A., Kozłowska E. et al. (2022) Hypoxia modulates human mast cell adhesion to hyaluronic acid. Immunol. Res., 70(2): 152–160. doi: 10.1007/s12026-021-09228-x.
- 20. Płoszczyca K., Czuba M., Chalimoniuk M. et al. (2021) Red Blood Cell 2,3-Diphosphoglycerate Decreases in Response to a 30 km Time Trial Under Hypoxia in Cyclists. Front Physiol., 12: 670977. doi: 10.3389/fphys.2021.670977.
- 21. Rivers R.J., Meininger C.J. (2023) The Tissue Response to Hypoxia: How Therapeutic Carbon Dioxide Moves the Response toward Homeostasis and Away from Instability. Int. J. Mol. Sci., 24(6): 5181. doi: 10.3390/ijms24065181.
- 22. Tang Y.Y., Wang D.C., Wang Y.Q. et al. (2023) Emerging role of hypoxia-inducible factor-1α in inflammatory autoimmune diseases: A comprehensive review. Front Immunol., 13: 1073971. doi: 10.3389/fimmu.2022.1073971.
- 23. Troise D., Infante B., Mercuri S. et al. (2023) Hypoxic State of Cells and Immunosenescence: A Focus on the Role of the HIF Signaling Pathway. Biomedicines, 11(8): 2163. doi: 10.3390/biomedicines11082163.
- 24. Valerio A., Nisoli E. (2015) Nitric oxide, interorganelle communication, and energy flow: a novel route to slow aging. Front Cell Dev. Biol., 3: 6. doi: 10.3389/fcell.2015.00006.
- 25. Webb K.L., Joyner M.J., Wiggins C.C. et al. (2023) The dependence of maximum oxygen uptake and utilization (VO2 max) on hemoglobin-oxygen affinity and altitude. Physiol. Rep., 11(17): e15806. doi: 10.14814/phy2.15806.
- 26. Гуревич М.И., Соловьев А.И., Литовченко Л.П. и др. (1982) Импедансная реоплетизмография. Наукова думка, Київ, 176 с.
- 27. Коркушко О.В., Иванов Л.А. (1980) Гипоксия и старение. Наукова думка, Київ, 276 с.
Адреса для листування:
Яременко Олег Борисович, доктор медичних наук, професор, завідувач кафедри внутрішньої медицини № 3
Національний медичний університет
імені О.О. Богомольця
01601, Київ, бульвар Т. Шевченка, 13, Київ
E-mail: o.b.iaremenko@gmail.com.

Leave a comment