ТРОМБОТИЧНІ ПОДІЇ, ПОВ’ЯЗАНІ З АНТИФОСФОЛІПІДНИМ СИНДРОМОМ
Резюме. Антифосфоліпідний синдром (АФС) являє собою аутоімунну тромбофілію, викликану циркулюючими антифосфоліпідними антитілами (аФЛ), причетну до розвитку тромботичних подій. Крім гострого тромбозу, у пацієнтів з АФС також може розвинутися оклюзійна васкулопатія. Довгострокові наслідки АФС характеризуються клітинною проліферацією та інфільтрацією, яка поступово посилюється та призводить до пошкодження органів. Метою було оцінити тромботичні події, пов’язані з АФС, проаналізувати патогенетичні механізми їх виникнення на основі аналізу літературних даних. Матеріали та методи: проведено аналіз даних літератури на основі проведеного пошуку англомовних статей у базах Medline та PubMed, які були опубліковані з січня 2020 до червня 2023 р. У статті представлено аналіз основних діагностичних маркерів АФС з огляду на їхню роль у патогенезі, а також перспективи використання нових, виявлених у недавніх рандомізованих дослідженнях.
DOI: 10.32471/rheumatology.2707-6970.93.18057
ВСТУП
Антифосфоліпідний синдром (АФС) являє собою аутоімунну тромбофілію, викликану циркулюючими антифосфоліпідними антитілами (аФЛ), причетну до розвитку тромботичних подій. аФЛ розпізнають фосфоліпіди та фосфоліпідзв’язувальні білки і стають не тільки маркерами хвороби. Крім гострого тромбозу, у пацієнтів з АФС також може розвинутися оклюзійна васкулопатія. Довгострокові наслідки АФС характеризуються клітинною проліферацією та інфільтрацією, яка поступово посилюється та призводить до пошкодження органів. Модель АФС співпадає з тромбофільною васкулопатією при COVІD-19 за відомими патогенними факторами.
На сьогодні встановлені нові шляхи, що зумовлюють прогресування тромбозапалення при АФС, а саме:
- активація тромбоцитів, моноцитів;
- активація ендотеліальних клітин;
- прозапальна продукція цитокінів та хемокінів;
- активація комплементу;
- вивільнення позаклітинної пастки нейтрофілів;
- експресія генів інтерферону І типу;
- ідентифікація критеріїв та некритеріальних клінічних фенотипів;
- ідентифікація профілів aФЛ та їх зв’язків з клінічними результатами [1, 2].
Мета: оцінити тромботичні події, пов’язані з АФС, проаналізувати патогенетичні механізми їх виникнення на основі аналізу літературних даних.
Матеріали та методи. У цій роботі представлено аналіз даних літератури на основі проведеного пошуку англомовних статей у базах Medline та PubMed, які опубліковані з січня 2020 до червня 2023 р.
РЕЗУЛЬТАТИ
Вища специфічність оновлених критеріїв для класифікації АФС (2023) включає набагато ширший спектр ознак і симптомів захворювання, таких як хвороби нирок, і більше змінних для вагітності [1].
З огляду на тромбофілічні наслідки слід розглядати включений до класифікаційних критеріїв макросудинний тромбоз. Згідно з оновленими сучасними класифікаційними критеріями АФС Американського коледжу ревматології (American College of Rheumatology — ACR)/Європейського альянсу ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR) 2023 р., макроваскулярна венозна тромбоемболія (домен-1) включає (але не обмежується цим) тромбоемболію легеневої артерії, тромбоз глибоких вен нижніх/верхніх кінцівок, тромбоз ниркових вен, вен головного мозку та сітківки. При АФС домінує (≈2/3 випадків) венозний тромбоз, головним чином нижніх кінцівок, набагато рідше — шийних, вісцеральних вен, вен верхніх кінцівок. Останній являє собою венозну тромбоемболію з високим профілем ризику та венозний тромбоз, пов’язаний з наявністю гіпертригліцеридемії, спадкової тромбофілії або антитіл до кардіоліпіну (aКЛ IgG >40 МО) [1, 2].
Наступний критерій (домен-2) — макроваскулярний (артеріальний тромбоз, підтверджений відповідним тестуванням) — включає (але не обмежується цим) інфаркт міокарда (тромбоз коронарних артерій), тромбози периферичної/спланхнічної/артерії сітківки, інсульт на основі міжнародних визначень та інші інфаркти органів (наприклад нирок, печінки або селезінки) за відсутності візуалізованого тромбу. Артеріальний тромбоз з високим профілем ризику розвитку серцево-судинних захворювань зазвичай стосується і судин головного мозку. При АФС часті рецидиви тромбозу, характерною рисою яких є виникнення в тому ж самому руслі, в якому виник перший епізод. До факторів ризику, особливо артеріального тромбозу, належать артеріальна гіпертензія, гіпергомоцистеїнемія, застосування гормонозамісної терапії або контрацептивів [1, 2].
2023 ACR/EULAR (домен 3) — мікросудинні порушення. При підозрі на мікросудинний кровообіг: підтвердження або виключення Livedo racemosa за відомими характеристиками, а також васкулопатії (при фізикальному обстеженні): папули та еритематозно-віолярні пурпурові бляшки, які можуть швидко еволюціонувати в геморагічні везикули або були (сітчасті, зливні, виразки і т.ін.) [1, 3].
Нефропатія, пов’язана з aФЛ (при фізикальному обстеженні або лабораторних дослідженнях):
- персистуюча:
а) вперше виявлена артеріальна гіпертензія або збільшення вираженості раніше добре контрольованої артеріальної гіпертензії;
б) протеїнурія ≥0,5 мг/24 год у зразку сечі або співвідношення альбумін/креатинін ≥0,5 мг/г (50 мг/ммоль);
в) гостра ниркова недостатність (підвищення рівня креатиніну в сироватці крові вище норми);
г) клубочкова мікроскопічна гематурія [1].
Легенева кровотеча (за клінічними симптомами та візуалізацією):
а) респіраторні симптоми (наприклад, задишка, кашель, кровохаркання);
б) легеневі інфільтрати при візуалізації, що свідчать про легеневу кровотечу [1, 2].
У домені-3 (2023 ACR/EULAR) також вказані васкулопатія (тромбоз дрібних шкірних судин та/або ендотеліальна проліферація); aФЛ нефропатія: гострі ураження ниркових судин або клубочків, тромботична мікроангіопатія, включаючи тромби фібрину в артеріолах або клубочках без запальних клітин або імунних комплексів, і хронічні ниркові судинні або клубочкові ураження, описані як артеріальні або артеріолярно організовані мікротромби з або без реканалізації, фіброзні та фіброзно-клітинні (артеріальні) оклюзії, вогнищева кортикальна атрофія з/без тиреоїдизації, фіброзна гіперплазія інтими або хронічні/організовані клубочкові тромби.
До речі, у пацієнтів із системним червоним вовчаком aФЛ-нефропатія виникає незалежно від уражень, пов’язаних з вовчаковим нефритом [1, 4].
Захворювання міокарда: інфаркт міокарда з елевацією сегмента ST при нормальній коронарній ангіограмі (інфаркт міокарда з необструктивними коронарними артеріями, або MINOCA) [1].
Крововилив у надниркові залози або мікротромбоз: демонстрація крововиливу за допомогою комп’ютерної (КТ) та магнітно-резонансної томографії (МРТ), або гістологічно тромбоз надниркових (мікро)судин, наприклад, надниркове сплетення, вен надниркових залоз. Мікросудинні порушення при підозрі або встановленому АФС зумовлюють розвиток симптоматичного тромбозу артерій нирок або вен та інфаркту нирки (3%). У третини пацієнтів виявляють внутрішньониркову тромботичну мікроангіопатію з артеріальною гіпертензією, протеїнемією різного ступеня, еритроцитурією та незначно підвищеною концентрацією креатиніну в сироватці крові. У легеневому руслі формується легенева гіпертензія внаслідок тромбозу глибоких вен кінцівок, дрібних судин [1, 5].
Велику загрозу при АФС несе акушерська патологія (відсутність або наявність прееклампсії, передчасних пологів з або без внутрішньоутробної загибелі плода). Розвиток цієї патології зумовлений реактивністю ендотеліальних структур, порушенням балансу утворення простагландину Е2/тромбоксану, взаємодією з фосфоліпідами мембран тромбоцитів з подальшим підвищенням їх агрегації, порушенням регуляції активації комплементу. Взаємодія aФЛ з фосфатидилсерином, що виділяється під час утворення трофобластного синцитію, підвищує можливість більш прямого впливу аутоантитіл на структури плаценти. Важливою складовою у визначенні АФС є запропонований тест на аФЛ, відомий як функціональний аналіз на основі коагуляції, що дає більшу вагу стійким, ніж одноразовим, позитивним результатам тесту. Відомо, що антитіла корелюють з негативними наслідками (асоціація з тромбозами). Вагомий внесок aФЛ у зміни профібринолітичної активності щодо розвитку ускладнень [6, 7, 8].
Домен-4 (2023 ACR/EULAR) — префетальна загибель (преембріональна або ембріональна втрата): втрата вагітності до 10 тиж 0 днів вагітності. Фетальна загибель: період 10 тиж 0 днів — 15 тиж 6 днів вагітності (рання загибель плода), або 16 тиж 0 днів — 34 тиж 0 днів вагітності. Якщо детальний аналіз морфології або генетичної конституції плода не проводиться або недоступний, слід використовувати обґрунтоване клінічне судження, що базується на ретельному анамнезі та огляді наявних медичних записів. Гестоз із тяжкими ознаками: прееклампсія, підвищення артеріального тиску. Плацентарна недостатність з тяжкими проявами: внутрішньоутробне обмеження росту плода, визначене як біометрія, що вказує на розрахункову масу плода менше 10-го процентиля для гестаційного віку або маси тіла після народження менше 10-го процентиля для гестаційного віку за відсутності фетально-неонатальних синдромів або генетичних станів, пов’язаних з обмеженням росту однією або декількома з наступних «тяжких ознак»: аномальний або незаспокійливий тест(и) спостереження плода, що вказує на гіпоксемію плода; аномальний аналіз форми хвилі допплерівської швидкості потоку, що вказує на гіпоксемію плода, наприклад, відсутність кінцево-діастолічного потоку в пупковій артерії; тяжке внутрішньоутробне обмеження росту плода, про яке свідчить біометрія плода, що вказує на розрахункову масу тіла плода або постнатального народження [1, 9].
Дисфункція центральної нервової системи: вперше виявлений головний біль не реагує на медикаментозне лікування, порушення зору, набряк легень, порушення функції печінки: аномально підвищена концентрація печінкових ферментів у крові (більш ніж удвічі перевищує верхню межу норми) або сильний постійний біль у правому верхньому квадранті або епігастральній ділянці, який не відповідає на ліки. Ниркова дисфункція: концентрація креатиніну в сироватці крові >1,1 мг/дл або подвоєння концентрації креатиніну в сироватці крові за відсутності інших захворювань нирок [1].
Домен-5 — морфологічні зміни (потовщення стулок) стосуються, головним чином, мітрального, рідше — аортального клапана. Дрібні вегетації на клапанах (неінфекційний ендокардит) є фактором ризику серцево-мозкових подій. Привертає увагу клініцистів питання розвитку тромбозу коронарних артерій. Потовщення клапана на основі ехокардіографічних критеріїв Всесвітньої федерації серця, потовщення мітрального клапана визначається як >4 мм у віці 20–39 років і >5 мм для пацієнтів віком старше 40 років, а також >3 мм для інших клапанів для будь-якого віку (потовщення клапана може бути пов’язане з дисфункцією клапанів (регургітація або стеноз)). Клапанна вегетація на основі рекомендацій Американського товариства ехокардіографії визначається як часточкові або округлі маси, розташовані на передсердному боці атріовентрикулярних клапанів (мітральний клапан і трикуспідальний клапан) або шлуночковому боці аортального клапана, але можуть бути розташовані на будь-якому боці будь-якого клапана [1].
Домен-6 — включає гематологічні зміни, а саме тромбоцитопенію.
Лабораторна діагностика АФС пройшла довгий шлях розвитку (рис. 1). аКЛ та антитіла до бета-2-глікопротеїну (β2-GPІ, Ig G або M) визначаються за допомогою імуноферментного аналізу (ІФА). Основними компонентами твердофазного ІФА є імуносорбент — адсорбовані на твердій фазі антигени або антитіла (залежно від цілей аналізу), імуноферментний кон’югат — ковалентно «зшиті» з ферментом специфічні антитіла або антигени, досліджуваний матеріал — біологічні рідини організму [10].
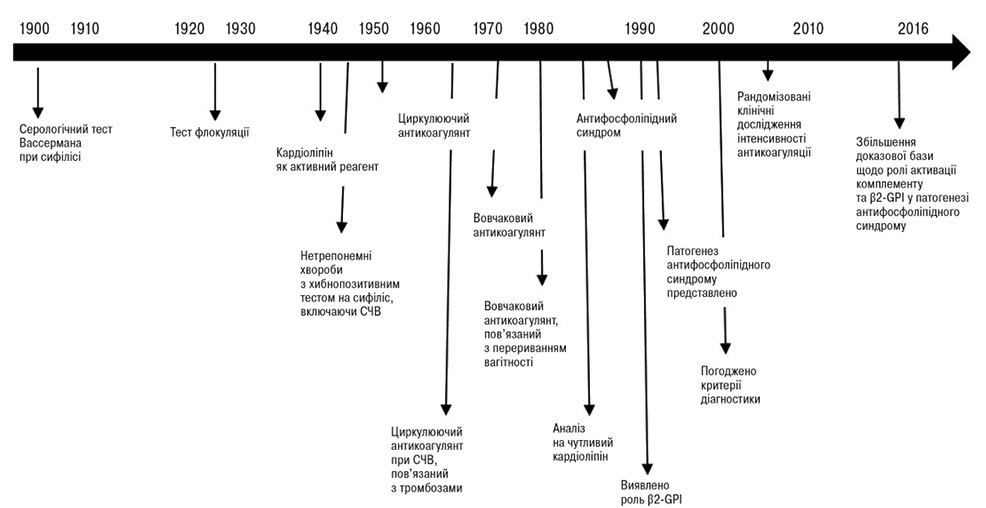
Домен-7 — aФЛ-тест, виконаний за допомогою функціонального аналізу на основі коагуляції, визначення вовчакового антикоагулянту (тест слід вважати позитивним, якщо принаймні 1 із 2 тест-систем дає позитивний результат після виконання всіх 3 кроків). Результати тестування слід інтерпретувати з обережністю, оскільки хибнопозитивні та негативні результати можуть виникати під час антикоагулянтної терапії як гострофазна відповідь (наприклад гострий тромбоз) через гострофазні реагенти, у період вагітності — через підвищення факторів згортання крові [1, 10].
Домен-8 — стандартизований ІФА для визначення аКЛ, анти-β2-GPI антитіл [1].
Стан гемостазу певною мірою залежить від кількісно оціненої одинарної, подвійної та потрійної позитивності aФЛ на основі «різних доменів та ваги». Низький рівень тромбоцитів, так звана тромбоцитопенія (20–130·109/л), має беспосередній зв’язок з тромбоцитарним фактором (ТФ) 4, останній виступає антигенною мішенню при АФС. ТФ 4 є членом сімейства хемокінів, секретується активованими тромбоцитами, має численні протромботичні ефекти: пригнічення інактивації тромбіну антитромбіном, потенціювання агрегації тромбоцитів, прискорення розщеплення активованого білка С. Антитіла ТФ 4 беруть участь у гепарин-індукованій тромбоцитопенії, але також виявлені у пацієнтів з AФС без гепарин-індукованої тромбоцитопенії в анамнезі. Рівні антитіл до ТФ 4 корелюють з рівнем аФЛ, антитіл до β2-GPI ІgM [11, 12].
На думку багатьох дослідників, один тільки синтез аФЛ у людини може спровокувати клінічно значимі порушення гемостазу, тому визначати лише одну групу антитіл малоінформативно [13].
Перший поштовх реалізації АФС здійснюється завдяки циркулюючим aФЛ і латентній ендотеліальній дисфункції [2].
Другий поштовх супроводжує підвищену регуляцію рецепторів (β2-GPI) на ендотеліальних клітинах, викликану запаленням (інфекцією або іншим). Вагому роль відіграє β2-GPІ — модулятор системи комплементу, ангіогенезу і гемостазу, який складається з 5 доменів (I–V) з двома дисульфідними зв’язками в кожному з них і додатковим дисульфідним зв’язком в домені V. Фосфоліпідне зв’язування з доменом V і деякими ділянками білка призводить до зміни конфігурації, яка сприяє експозиції та зв’язуванню аутоантитіл амінокислотами (лізин, аргінін, цистеїн) [14].
Фізіологічна роль β2-GPI окреслена декількома функціями. Він може діяти як опсонін, що веде до кліренсу аніонних фосфоліпідів, а також як поглинач LPS. Ці два ефекти зменшують вираженість запальної реакції. З іншого боку, β2-GPI є модулятором системи комплементу, ангіогенезу і гемостазу (рис. 2) [15].
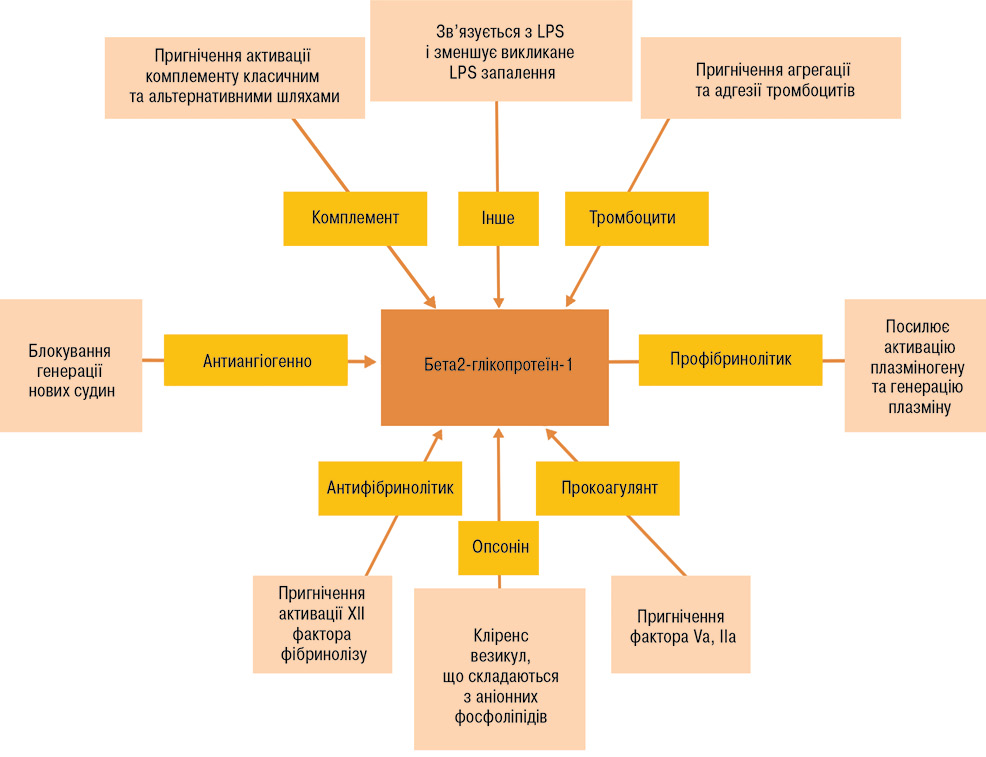
Ідентифікація β2-GPI, який опосередковує зв’язування аФЛ з клітинами-мішенями, включаючи ендотеліальні клітини, моноцити, тромбоцити та трофобласти, що призводить до протромботичних та прозапальних змін, які викликають тромбоз, є поштовхом до розуміння механізмів ребалансування гемостазу. Наявність стійко позитивних аФЛ, включаючи вовчаковий антикоагулянт, IgG/IgM, aКЛ, антитіла β2-GPI є складовою ризику АФС. aФЛ — гетерогенна група аутоантитіл, які реагують на фосфоліпіди, фосфоліпідзв’язувальні білки і фосфоліпідбілкові комплекси. аФЛ в основному спрямовані на антиген β2-GPI і поряд з антитілами, що діють проти протромбіну, становлять понад 90% антитілазв’язувальної активності у пацієнтів з AФС. У той час як багато aФЛ виявляють специфічність для одного антигену, очищені аФЛ у деяких пацієнтів зв’язують кілька білків, що беруть участь у згортанні крові, припускаючи, що один клон aФЛ може викликати множинні зміни коагуляції та активності клітин, що призводить до тромбозу або втрати плода. Наявність aФЛ сама по собі не гарантує, що у пацієнта розвинеться AФС, оскільки лише у 8,1% пацієнтів з aФЛ без клінічного тромбозу в анамнезі розвинувся тромбоз протягом 5-річного періоду спостереження, що свідчить про те, що пацієнт потребує додаткового ураження для розвитку клінічного захворювання. Підтримуючи гіпотезу «двох ударів», супутні захворювання, які були визначені як фактори ризику тромбозу при AФС, включають артеріальну гіпертензію, наявність аутоімунного захворювання, гіперхолестеринемію, наявність анти-ДНК-антитіл або середнього та високого титру aКЛ [16, 17, 18].
АФС викликає значну захворюваність при позитивних результатах aКЛ та/або aФЛ, що забезпечує підвищений ризик тромбозу зі співвідношенням шансів 3,1–9,4. Ризик рецидивного тромбозу при АФС понад 5 років становить 16,6%, незважаючи на застосування антикоагулянтів та/або ацетилсаліцилової кислоти. AФС також пов’язаний з 5-річною смертністю 5,3%, причому більшість випадків смерті відмічають протягом першого року після встановлення діагнозу, а основними причинами смерті є бактеріальні інфекції, інфаркт міокарда, інсульт та крововилив у головний мозок. Катастрофічний AФС — множинні одночасні артеріальні або венозні тромбози за наявності aФЛ — є дуже небезпечним, рідкісним ускладненням (0,9% пацієнтів) АФС. Незважаючи на агресивне лікування, смертність все ще коливається у діапазоні 44–55,6% [19].
Ці дані підкреслюють необхідність розробки більш ефективних методів лікування, спрямованих на патологічні процеси, пов’язані з АФС, без токсичності, викликаної хронічною антикоагулянтною терапією. Дослідження структури β2-GPI показали, що окремі домени важливі для взаємодії з aФЛ, а також молекулами клітинної поверхні, що пояснює деякі патологічні особливості AФС. Продемонстровано, що анти-β2-GPI антитіла, пов’язані з тромбозом, легко зв’язуються з доменом I рекомбінантного β2-GPI, але взаємодіють тільки з плазмовим β2-GPI, приєднаним до аніонної поверхні, тобто для зв’язування β2-GPI необхідна конформаційна зміна. Вплив аніонної поверхні призводить до відкриття структури через взаємодію між аніонною поверхнею і доменом V. Ця конформаційна зміна полегшує зв’язування анти-β2-GPI з β2-GPI шляхом оголення епітопу в домені I, прихованого в круговій конформації. Фрагменти легкого ланцюга анти-β2-GPI антитіл несуть антигенспецифічність, встановлюючи, що взаємодія відбувається з самим β2-GPI, а не імуноглобуліном в цілому. Поліморфізми β2-GPI також виявляють в AФС із заміщенням лейцину валіном у положенні 247, що частіше відмічають у пацієнтів з АФС у певних популяціях. Описаний поліморфізм, особливо в гомозиготному стані, пов’язаний з наявністю валіну на цій ділянці, викликає підвищення антигенності β2-GPI. Наявність специфічного для домену I анти-β2-GPI антитіл була пов’язана з підвищеним ризиком тромбозу. Останні дослідження встановили, що домен V є основним місцем взаємодії між β2-GPI і різними молекулами клітинної поверхні, з якими він взаємодіє. β2-GPI зв’язується з тромбіном, що запобігає інактивації тромбіну кофактором гепарин/гепарин II. Зв’язування анти-β2-GPI антитіл потенціює цю взаємодію, що призводить до підвищення активності тромбіну [16, 17, 18].
β2-GPI також зв’язується з ApoER2’, зрощувальним варіантом рецептора ApoE 2 (ApoER2), виявленим на тромбоцитах, і ця взаємодія залежить від домену V. Зв’язування з ApoER2’ димеризованим β2-GPI індукує активацію і агрегацію тромбоцитів. Цей ефект був відтворений за допомогою анти-β2-GPI антитіл, але не плазмового β2-GPI, що вказує на те, що анти-β2-GPI антитіла надають деякі свої ефекти шляхом димеризації β2-GPI та взаємодії димеризованого β2-GPI з рецепторами клітинної поверхні [20].
Адоданин А5 є членом сімейства анексинів і експресується плацентарними синцитіотрофобластами і ендотеліальними клітинами судин. Він виявляє антикоагулянтну активність, блокуючи активацію факторів IX, VIIa, Xa, Va. Важливо відзначити роль активації моноцитів у aФЛ-опосередкованому тромбогенезі у пацієнтів з АФС. Дослідження продемонстрували в моноцитах пацієнтів з тромбозом при АФС диференційну експресію Ann I і Ann II, а також сімейства гомологічних генів Ras, члена A (RhoA) і нейронних клітин-попередників, білків, що беруть участь у клітинній сигналізації та білку теплового шоку 60 (Hsp60), при порівнянні з хворими на АФС без тромбозу і з тромбозами, не пов’язаними з АФС. Титри aКЛ корелювали зі ступенем дисрегуляції, а вплив моноцитів викликав трансформацію профілю експресії білка до профілю експресії білка у пацієнта з АФС. Активація цих лейкоцитів відбувається в результаті аутоімунних процесів і призводить до індукції прокоагулянтного стану. Кілька груп виявили, що aКЛ індукують підвищену експресію ТФ моноцитами через активацію шляху p38 MAPK, що призводить до активації ядерного фактора-kB (NF-kB), шляху ERK1/2. Моноцити у пацієнтів з АФС, особливо з тромбозом в анамнезі, демонструють підвищену експресію мРНК ТФ, що може бути пов’язано зі стимуляцією рецептора тирозинкінази Flt-1 VEGF, оскільки підвищення плазмових рівнів VEGF та поверхневої експресії VEGF та Flt-1 на моноцитах виявлено у пацієнтів з АФС порівняно з контрольною групою. Експресія рецепторів, активованих протеазою (PAR)1 і PAR2, також підвищується в моноцитах у пацієнтів з АФС. Це має особливе значення, оскільки PAR1 опосередковує багато прозапальних ефектів тромбіну, включаючи індукцію інтерлейкінів-6 та -8, хемотаксичного білка моноцитів-1, P-селектину та VEGF через фосфорилювання [17, 21, 22].
Тромбоцити займають центральне місце у формуванні артеріального тромбу in vivo, і не дивно, що у пацієнтів з AФС відмічають підвищену активацію тромбоцитів, особливо у пацієнтів з клінічною тромботичною подією в анамнезі. aФЛ підсилюють експресію глікопротеїну IIb/IIIa, основного фібриногенового рецептора на тромбоцитах, в результаті активації p38 MAPK і синтезу тромбоксану-В2. Продемонстровано захисний ефект дефіциту або інгібування цього рецептора на aФЛ-опосередковане утворення тромбів. Цікаво також, що поліморфізм тромбоцитів GPIa/IIa і GPIIb/IIIa пов’язаний з підвищеним ризиком артеріального тромбозу, а також атеросклерозу у пацієнтів з АФС. ТФ 4 сприяє димеризації β2-GPI і подальшому зв’язуванню з анти-β2-GPI антитілами і рецепторами поверхні клітин тромбоцитів, включаючи активацію шляху p38 MAPK і утворення NF-kB. Це представляє не тільки привабливу механістичну модель активації тромбоцитів при АФС, але й активації ендотеліальних клітин і моноцитів, оскільки ТФ 4 також експресується в цих та інших імунних клітинах, хоча і в більш низьких концентраціях, ніж у тромбоцитах. ТФ 4, як і β2-GPI, виявляє безліч імуномодулюючих ефектів. Не виключено, що ТФ 4/β2-GPI комплекси можуть відігравати координуючу роль в активації багатьох імунопов’язаних клітин при АФС [12, 18, 22].
Ендотеліальні клітини відіграють ключову роль у тромбозі шляхом експресії інтегринів та ТФ після активації, а також були залучені у AФС. У пацієнтів з АФС виявляються ознаки підвищеної активності ендотеліальних клітин з порушенням ендотелійзалежної вазодилатації та підвищеною експресією фактора фон Віллебранда, фактора росту плаценти та розчинного ICAM-1. Анти-β2-GPI антитіла індукують протромботичне середовище в ендотеліальних клітинах за рахунок збільшення продукції фактора VIIa, а також зниження рівня фактора XIIa і активного активатора плазміногену урокіназного типу [18]. Узагальнена інформація щодо варіантів антитіл та пов’язаних з ними тромбозів подана у табл. 1.
Таблиця 1. Клінічні асоціації, пов’язані з тромбозом, залежно від варіантів некритеріальних антитіл при АФС
| Некритеріальні aФЛ | Клінічні асоціації |
|---|---|
| Анти-β2-GPI-DI | Асоціація анти-β2-GPI-DI з тромбозом та/або ускладненнями вагітності (більше, ніж антитіла, спрямовані в інші домени). |
| IgA анти-β2-GPI | Кореляція з тромбозом, викиднями, легеневою гіпертензією, судомами, тромбоцитопенією та livedo reticularis. |
| Анти-PT/PS | Сильна кореляція з тромбозами і акушерськими проявами. |
| Анти-віментин/CL | Кореляція з тромбогенними ситуаціями та ускладненнями вагітності. |
| Anti-AnnA5 | Клінічна кореляція з захворюваністю, пов’язаною з вагітністю, залишається суперечливою. |
| Anti-AnnA2 | Зміни профібринолітичної активності; корелюють з тромботичними подіями. |
Потенційно хворобливі прояви при АФС — це тромбоцитопенія, гемолітична анемія, захворювання серцевого клапана, livedo reticularis/racemosa, aФЛ-асоційована нефропатія, судоми (в тому числі ураження білої речовини головного мозку), визначені за допомогою МРТ) та когнітивна дисфункція. Існує небагато, якщо такі взагалі є, біомаркерів для прогнозування того, які aФЛ-позитивні пацієнти піддаються ризику за цими додатковими критеріями ознак, які зазвичай не реагують на антикоагулянтні препарати. Хоча патофізіологія АФС залишається неповністю вивченою, потенційні aФЛ-опосередковані механізми, які були описані, включають активацію ендотеліальних клітин, моноцитів, тромбоцитів, факторів згортання та білків комплементу (табл. 2) [1, 2].
Таблиця 2. aФЛ-опосередковані механізми формування АФС
| Клітини або шляхи | In vitro, aФЛ |
|---|---|
| Ендотеліальні клітини | Підвищення експресії фактора некрозу тканин і молекул адгезії |
| Тромбоцити | Активація під час зсувного стресу |
| Моноцити | Тригерна експресія фактора некрозу тканин та прозапальних цитокінів |
| Нейтрофіли | Вивільнення протромботичних нейтрофільних пасток |
| Доповнення від інших шляхів | Тригерний лізис клітин |
| Коагуляція | Перешкоджання інгібіторам згортання (білка С і антитромбіну) |
| Фібриноліз | Перешкоджання впливу активатора тканини плазміногену |
Нейтрофільні позаклітинні пастки (NET) — протромботичні та прозапальні мережі ядерної ДНК, білків гістонів, витіснених активованими нейтрофілами, — останнім часом отримують все більшу увагу як чинники тромбозапалення при AФС. Схоже, що aФЛ, особливо β2-GPI, можуть задіяти поверхню нейтрофілів, оминути стандартні гомеостатичні механізми, щоб запустити вивільнення NET. Цікаво, що у невеликому одноцентровому дослідженні виявили, що у деяких пацієнтів з АФС утворюються анти-NET антитіла (anti-NET Abs). Без уваги сьогодні залишаються антигенні специфічні риси anti-NET Abs та їх можливості як потенційних біомаркерів, які додадуть цінності традиційним критеріям АФС.
AntiPhospholipid Syndrome Alliance For Clinical Trials and InternatiOnal Networking (APS ACTION) — це міжнародний дослідницький консорціум, який підтримує великомасштабні багатоцентрові клінічні дослідження в осіб, які постійно є aФЛ-позитивними. З’ясування наявності, клінічного зв’язку та антигенних особливостей anti-NET Abs завжди хвилювало науковців. У Мічиганському університеті проведено дослідження за участю осіб, які не мали системних аутоімунних захворювань. 175 зразків були з європейської, 129 — з північноамериканської та 85 — з південноамериканської лабораторій. Ключовим у дослідженні було вимірювання антитіл anti-NET IgG та IgM у 389 aФЛ-позитивних пацієнтів. На відміну від здорових, підвищені рівні anti-NET IgG та IgM виявлені у пацієнтів як з тромботичним, так і з акушерським АФС, а також у aФЛ-позитивних пацієнтів без будь-яких проявів АФС. У 61 пацієнта (16%) відмічено високу активність anti-NET IgG, тоді як у 155 (40%) — високу активність anti-NET IgM; у 41 пацієнта (11%) отримано позитивний результат тестування як на anti-NET IgG, так і на IgM. У цілому принаймні один із цих тестів був позитивним у 175 пацієнтів (45%). Виявлено сильний позитивний кореляційний зв’язок між anti-NET IgG та anti-NET IgM (r=0,52; p<0,05). Наявність anti-NET IgG або IgM можна додати до традиційного оцінювання та стратифікації ризику aФЛ-позитивних пацієнтів, особливо якщо це стосується проявів поза критеріями. Позитивне тестування на anti-NET IgG було значно пов’язане з ураженням білої речовини головного мозку, оціненим за допомогою МРТ після поправки на вік, стать, етнічну приналежність та профілі aФЛ. Однією з функцій anti-NET Abs у пацієнтів із системним червоним вовчаком, АФС та COVID-19 є погіршення деградації NET, що може призводити до активації комплементу [2, 23, 24].
Пошук відповіді, чи пов’язаний anti-NET Abs з активацією комплементу, низкою авторів проводився через вимір циркулюючих C3 та C4 серед aФЛ-позитивних пацієнтів. У нескоригованій моделі як anti-NET IgG, так і IgM обернено корелювали з комплементами C3 (IgG: r=–0,12, p=0,02; IgM: r=–0,18, p=0,0005) і C4 (IgG: r=–0,18, p=0,0003; IgM: r=–0,25, p=0,01). Майже у половини пацієнтів визначено високий рівень anti-NET IgG та/або IgM, хоча у жодному випадку не діагностовано іншого системного аутоімунного захворювання (такого як системний червоний вовчак). Клінічно позитивний тест на anti-NET IgG зміг виявити пацієнтів з ураженнями білої речовини головного мозку. Тим часом anti-NET IgM наявний у хворих з низьким рівнем комплементу C3 і C4. Представлені дані були свідченням того, що активність anti-NET IgG у aФЛ-позитивних пацієнтів зумовлена взаємодією з гістонами, а активність anti-NET IgM — з проліферуючим клітинним ядерним антигеном. У наведеному дослідженні підтверджена наявність anti-NET Abs у пацієнтів з AФС та у aФЛ-позитивних пацієнтів, які не мають класифікованих ознак AФС. Такий anti-NET Abs може допомогти виявити пацієнтів з ризиком певних проявів екстра-критеріїв, таких як ураження білої речовини головного мозку. Хоча висловлено припущення, що активація комплементу відіграє важливу роль у патофізіології тромботичних та акушерських ускладнень АФС, механізми, за допомогою яких система комплементу активується при АФС, неповністю вивчені. Існуючі дослідження, зазвичай зосереджені на анти-β2-GPI IgG, припустили, що aФЛ може зв’язуватися з C1q, активуючи класичний шлях комплементу [9, 10, 25].
Однак переважаючим підкласом aнти-β2-GPI у пацієнтів з AФС є IgG2, який має відносно слабку здатність активувати комплемент порівняно з IgG1 та IgG3. NET вже давно визнається платформою для активації комплементу. Більш того, NET-асоційовані білки, такі як мієлопероксидаза і катепсин G, можуть безпосередньо зв’язуватися і активувати пропердин, тим самим викликаючи активацію комплементу. Також стало відомо, що ізотип IgM anti-NET Abs найбільш сильно пов’язаний з активацією каскаду комплементу. Одне недавнє дослідження показало, що IgM може безпосередньо взаємодіяти з C1q і C4b, утворюючи комплекс на ліпосомальних мембранах, а потім зумовлювати запальні реакції, опосередковані комплементом. Цілком можливо, що anti-NET IgM може взаємодіяти з NET-зв’язаним C1q та іншими факторами комплементу і надалі викликати активацію комплементу.
Роль aФЛ в активації ендотеліальних клітин була продемонстрована як in vitro, так і in vivo, більшість цих досліджень були зосереджені на активації ендотелію традиційними aФЛ, такими як aнти-β2-GPI. Припускається, що anti-NET Ab-опосередкована ендотеліальна дисфункція може порушити цілісність гематоенцефалічного бар’єру, тим самим призводячи до припливу запальних білків у паренхіму головного мозку та провокуючи ураження білої речовини головного мозку. 8-річне когортне випробування за участю 128 пацієнтів з первинним АФС показало, що у 13% розвинувся системний червоний вовчак або подібне аутоімунне захворювання. До сьогодні відсутній клінічно значущий біомаркер для ідентифікації цієї підгрупи пацієнтів. Цікаво, що останні досягнення в розумінні патогенезу системного червоного вовчака припустили, що надмірне вивільнення NET зумовлює утворення вовчакспецифічних аутоантитіл і пошкодження органів (у відповідь на інтерферон I типу). Основні диференційні ознаки АФС та системного червоного вовчака зображені на рис. 3 [8, 26, 27].
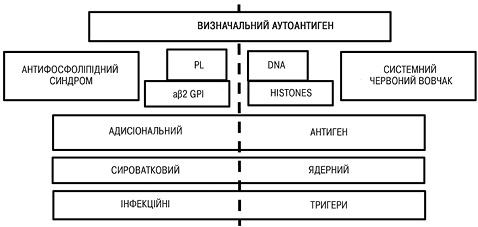
Автори наголошують, що багато первинних пацієнтів з АФС або носіїв aФЛ мають NET-стабілізуючі antі-NET Abs, які пов’язані з декількома серологічними маркерами вовчака, такими як анти-dsДНК та антинуклеосомні антитіла. На наш погляд, не виключена скринінгова цінність anti-NET Abs для виявлення схильних до розвитку вовчака первинних пацієнтів з АФС. Функціональні anti-NET Abs IgG/IgM можуть відігравати певну роль в еволюції деяких первинних пацієнтів з АФС до розвитку повної картини вовчака або Шарпа. Функція та клінічне значення цих специфічних аутоантитіл потребують подальшого вивчення. Зокрема, важливо буде порівняти функціональну роль anti-NET Abs, орієнтованих на ДНК, з тими, які розпізнають не-ДНК-антигени.
Підсумовуючи результати останніх досліджень, слід зауважити, що визначено новий клас аутоантитіл серед aФЛ-позитивних пацієнтів, які можуть зумовлювати активацію комплементу та виявляти певні позакритеріальні прояви АФС. Антикоагуляція антагоністами вітаміну К залишається основою терапії АФС. Хоча антикоагуляція є досить ефективною у запобіганні aФЛ-асоційованого тромбозу, вона часто не має ніякого відношення до позакритеріальних проявів АФС, таких як серцеві, ниркові та неврологічні ускладнення [26, 27].
Майбутні дослідження ролі anti-NET Abs як клінічно значущих біомаркерів, які можуть призвести до попереджувальної імуномодулюючої терапії у деяких пацієнтів, є обґрунтованими.
У рекомендаціях 2023 ACR/EULAR наголошено на визначенні профілів венозної тромбоемболії високого ризику та серцево-судинних захворювань на основі сучасних загальних рекомендацій щодо популяції:
1. Щоб визначити, чи сталася тромботична подія у пацієнта з венозною тромбоемболією високого ризику або профілем серцево-судинних захворювань високого ризику, клініцисту слід докласти всіх зусиль для збору та перегляду факторів ризику на основі анамнезу пацієнта або огляду медичної карти.
2. Профіль ВТЕ високого ризику визначається на основі 1/2 або більше факторів ризику ВТЕ, якщо хронологія/тяжкість пов’язані з подією на основі думки дослідника.
а) Основні фактори ризику ВТЕ (будь-який з наступних на момент події):
- активні злоякісні новоутворення з або без лікування, постійна гормональна терапія, або рецидив/прогресування, незважаючи на лікування на момент події;
- госпіталізація з гострим захворюванням не менше 3 днів протягом останніх 3 міс до події;
- серйозна травма з переломами або пошкодженням спинного мозку протягом 1 міс до події;
- хірургічне втручання із загальною/спінальною/епідуральною анестезією >30 хв протягом 3 міс до розвитку події.
б) Додаткові фактори ризику ВТЕ (2 або більше з наступних на момент події):
- активне системне аутоімунне захворювання або активне запальне захворювання кишечнику;
- гостра/активна тяжка інфекція відповідно до рекомендацій, наприклад, сепсис, пневмонія, SARS-CoV-2;
- центральний венозний катетер;
- замісна гормональна терапія контрацептивами, що містять естрогени;
- міжміські подорожі (≥8 год);
- ожиріння (індекс маси тіла ≥30 кг/м²);
- вагітність або післяпологовий період протягом 6 тиж після пологів;
- тривала іммобілізація, не врахована вище, наприклад, травма ноги, пов’язана з обмеженою рухливістю, або прикута до ліжка поза лікарнею протягом принаймні 3 днів.
3. Профіль ризику серцево-судинних захворювань визначається 1 або більше основними факторами ризику, 3 або більше помірними:
a) Основні фактори ризику серцево-судинних захворювань (будь-який з наступних на момент події):
- артеріальна гіпертензія з систолічним артеріальним тиском ≥180 мм рт. ст. або діастолічним ≥110 мм рт. ст.;
- хронічні захворювання нирок з розрахунковою швидкістю клубочкової фільтрації ≤60 мл/хв більше 3 міс;
- цукровий діабет з ураженням органів або тривалістю захворювання ≥20 років для типу 1 та ≥10 років для типу 2;
- гіперліпідемія із загальним холестерином ≥310 мг/дл (8 ммоль/л) або ліпопротеїдами низької щільності >190 мг/дл (4,9 ммоль/л).
б) Помірні фактори ризику серцево-судинних захворювань (3 або більше з наступних на момент події):
- артеріальна гіпертензія на фоні лікування, або персистуючий систолічний артеріальний тиск ≥140 мм рт. ст., або діастолічний ≥90 мм рт. ст.;
- тютюнопаління;
- цукровий діабет без ураження органів та коротка тривалість захворювання (тип 1-й <20 років; тип 2-й <10 років);
- гіперліпідемія на фоні лікування, загальний холестерин вище норми або >310 мг/дл (8 ммоль/л) або ліпопротеїди низької щільності в межах норми <190 мг/дл (4,9 ммоль/л);
- ожиріння (індекс маси тіла ≥30 кг/м²).
ВИСНОВКИ
Основні патогенетичні механізми розвитку тромботичних ускладнень при АФС характеризуються складним та послідовним каскадом реакцій організму у відповідь на порушення. Відкриття нових біомаркерів та механізмів розвитку АФС відкриває широкий спектр можливостей для діагностики, лікування та оновлення класифікаційних критеріїв АФС.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- 1. Barbhaiya М., Zuily S., Naden R. et al. (2023) 2023 ACR/EULAR Antiphospholipid Syndrome Classification Criteria. Arthritis Rheumatol. doi: 10.1002/art.42624.
- 2. Sciascia S., Radin M. (2018) Thrombotic antiphospholipid syndrome. Lupus. 27(Suppl. 1): 21–27. doi: 10.1177/0961203318801686.
- 3. Sayar Z., Moll R., Isenberg D. et al. (2021) Thrombotic antiphospholipid syndrome: A practical guide to diagnosis and management. Thromb. Res., 198: 213–221. doi: 10.1016/j.thromres.2020.10.010.
- 4. Aibar J., Schulman S. (2021) Arterial Thrombosis in Patients with Antiphospholipid Syndrome: A Review and Meta-Analysis. Semin. Thromb. Hemost., 47(6): 709–723. doi: 10.1055/s-0041-1725057.
- 5. Salet D.M., Bekkering S., Middeldorp S. et al. (2023) Targeting thromboinflammation in antiphospholipid syndrome. J. Thromb. Haemos., 21(4): 744–757. doi: 10.1016/j.jtha.2022.12.002.
- 6. Arantes F.T., Mazetto B.M., Saraiva S.S. et al. (2020) Inflammatory markers in thrombosis associated with primary antiphospholipid syndrome. J. Thromb. Thrombolysis., 50(4): 772–781. doi: 10.1007/s11239-020-02155-y.
- 7. Walter I.J., Haneveld M.J.K., Lely A.T. et al. (2021) Pregnancy outcome predictors in antiphospholipid syndrome: A systematic review and meta-analysis. Autoimmun. Rev., 20(10): 102901. doi: 10.1016/j.autrev.2021.102901.
- 8. D’Ippolito S., Barbaro G., Paciullo C. et al. (2023) Antiphospholipid Syndrome in Pregnancy: New and Old Pathogenetic Mechanisms. Int. J. Mol. Sci., 24(4): 3195. doi: 10.3390/ijms24043195.
- 9. Álvarez D., Morales-Prieto D.M., Cadavid A.P. (2023) Interaction between endothelial cell-derived extracellular vesicles and monocytes: A potential link between vascular thrombosis and pregnancy-related morbidity in antiphospholipid syndrome. Autoimmun. Rev., 22(4): 103274. doi: 10.1016/j.autrev.2023.103274.
- 10. Arachchillage D.R.J., Pericleous C. (2023) Evolution of Antiphospholipid Syndrome. Semin. Thromb. Hemost., 49(3): 295–304. doi: 10.1055/s-0042-1760333.
- 11. Knight J.S., Branch D.W., Ortel T.L. (2023) Antiphospholipid syndrome: advances in diagnosis, pathogenesis, and management. BMJ, 380: e069717. doi: 10.1136/bmj-2021-069717.
- 12. Mezhov V., Segan J.D., Tran H. et al. (2019) Antiphospholipid syndrome: a clinical review. Med. J. Aust. 211(4): 184–188. doi: 10.5694/mja2.50262.
- 13. Tektonidou M.G., Andreoli L., Limper M. et al. (2019) EULAR recommendations for the management of antiphospholipid syndrome in adults. Ann. Rheum. Dis., 78(10): 1296–1304. doi: 10.1136/annrheumdis-2019-215213.
- 14. Willis R., McDonnell T.C.R., Pericleous C. et al. (2022) PEGylated Domain I of Beta-2-Glycoprotein I Inhibits Thrombosis in a Chronic Mouse Model of the Antiphospholipid Syndrome. Front. Immunol., 13: 842923. doi: 10.3389/fimmu.2022.842923.
- 15. Krilis M., Qi M., Ioannou Y. et al. (2021) Clinical relevance of nitrated beta 2-glycoprotein I in antiphospholipid syndrome: Implications for thrombosis risk. J. Autoimmun., 122: 102675. doi: 10.1016/j.jaut.2021.102675.
- 16. Tanimura K., Saito S., Nakatsuka M. et al. (2020) The β 2-Glycoprotein I/HLA-DR Complex As a Major Autoantibody Target in Obstetric Antiphospholipid Syndrome. Arthritis Rheumatol., 72(11): 1882–1891. doi: 10.1002/art.41410.
- 17. Kmeťová K., Lonina E., Yalavarthi S. et al. (2023) Interaction of the antiphospholipid syndrome autoantigen beta-2 glycoprotein I with DNA and neutrophil extracellular traps. Clin. Immunol., 255: 109714. doi: 10.1016/j.clim.2023.109714.
- 18. Qi M., Weaver J.C., Krilis S.A. et al. (2019) Quantitation of Total and Free Thiol β2-Glycoprotein I Levels for Diagnostic and Prognostic Purposes in the Antiphospholipid Syndrome. Methods Mol. Biol., 1967: 275–283. doi: 10.1007/978-1-4939-9187-7_17.
- 19. Mittal P., Quattrocchi G., Tohidi-Esfahani I. et al. (2023) Antiphospholipid syndrome, antiphospholipid antibodies, and stroke. Int. J. Stroke., 18(4): 383–391. doi: 10.1177/17474930221150349.
- 20. Chaturvedi S., Braunstein E.M., Brodsky R.A. (2021) Antiphospholipid syndrome: Complement activation, complement gene mutations, and therapeutic implications. J. Thromb. Haemost., 19(3): 607–616. doi: 10.1111/jth.15082.
- 21. Knight J.S., Kanthi Y. (2022) Mechanisms of immunothrombosis and vasculopathy in antiphospholipid syndrome. Semin. Immunopathol., 44(3): 347–362. doi: 10.1007/s00281-022-00916-w.
- 22. Ortiz-Fernández L., Sawalha A.H. (2019) Genetics of Antiphospholipid Syndrome. Curr. Rheumatol. Rep., 21(12): 65. doi: 10.1007/s11926-019-0869-y.
- 23. Zuo Yu, Yalavarthi S., Gockman K. et al. (2020) Anti-Neutrophil Extracellular Trap Antibodies and Impaired Neutrophil Extracellular Trap Degradation in Antiphospholipid Syndrome. Arthritis Rheumatol., 72(12): 2130–2135. doi: 10.1002/art.41460.
- 24. Zuo Yu, Navaz S., Tsodikov A. et al. (2023) Anti-Neutrophil Extracellular Trap Antibodies in Antiphospholipid Antibody-Positive Patients: Results From the Antiphospholipid Syndrome Alliance for Clinical Trials and InternatiOnal Networking Clinical Database and Repository. Arthritis Rheumatol., 75(8): 1407–1414. doi: 10.1002/art.42489.
- 25. Fousert E., Toes R., Desai J. (2020) Neutrophil Extracellular Traps (NETs) Take the Central Stage in Driving Autoimmune Responses. Cells, 9(4): 915. doi: 10.3390/cells9040915.
- 26. Sadeghi M., Dehnavi S., Jamialahmadi T. et al. (2023) Neutrophil extracellular trap: A key player in the pathogenesis of autoimmune diseases. Int. Immunopharmacol., 116: 109843. doi: 10.1016/j.intimp.2023.109843.
- 27. Mazetto B.M., Hounkpe B.W., Saraiva S.S. et al. (2022) Association between neutrophil extracellular traps (NETs) and thrombosis in antiphospholipid syndrome. Thromb. Res., 214: 132–137. doi: 10.1016/j.thromres.2022.05.001.
Адреса для листування:
Дніпровський державний медичний університет
49044, м. Дніпро, вул. Володимира Вернадського, 9
E-mail: revmatologymedd@gmail.com

Leave a comment