Глюкокортикоїди у ревматології — nemo sine vitiis est
Рекалов Д.Г.1, Доценко C.Я., Кулинич Р.Л.2, Данюк І.О.2, Бринер І.А.3, Тарасенко Т.М.4, Нікітіна Д.Р.3, Мосьпан В.С.3, Крупко В.В.3
- 1Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска НАМН України»
- 2Запорізький державний медичний та фармацевтичний університет
- 3Клініка ревматології професора Рекалова, Запоріжжя
- 4Клініка ревматології професора Рекалова, Дніпро
Резюме. Глюкокортикоїди (ГК) є найважливішою опорою практикуючих ревматологів з моменту вручення Нобелівської премії за відкриття кортизону у 1950 р. Доведено, що ГК мають високоефективні протизапальні та імуносупресивні властивості. Основою для імплементації у рутинну ревматологічну терапію ГК слугувало виявлення геномних та негеномних ефектів, які впливають безпосередньо на більшість патогенетичних процесів у перебігу ревматичних хвороб. Подальше широке впровадження ГК у ревматологічну практику зумовлено низькою вартістю, високою доступністю, швидким початком дії, активністю, спрямованою на запобігання органному ураженню. Оптимальний вибір застосування ГК при терапії ревматичних захворювань — це специфічний та індивідуальний підхід у дозуванні та рутинний моніторинг, але їх застосування обмежене побоюваннями щодо виникнення побічних явищ. На сьогодні немає надійних інструментів визначення токсичності ГК, що пов’язано з поганим комплаєнсом, гострим початком або хронічним перебігом побічних явищ, варіабельністю тривалості застосування ГК, потрібності в різних дозуваннях для контролю захворювань.
DOI: 10.32471/rheumatology.2707-6970.94.18360
Вступ
 Гормони надниркових залоз відрізняються своєю відносною глюкокортикоїдною (регулює вуглеводний обмін) та мінералокортикоїдною (регулює електролітний баланс) активністю, і тому їх історично диференціювали відповідно до відносної ефективності щодо затримки натрію, впливу на метаболізм вуглеводів (відкладення глікогену, глюкогенез у печінці) та протизапальної дії [21]. З цих причин терміни «глюкокортикоїди» (ГК) або «глюкокортикостероїди» (ГКС) є науково правильними та відповідними для опису застосування цих препаратів для лікування ревматичних захворювань (РЗ) та інших станів, де бажані протизапальні та імуномодулюючі ефекти [8]. Однак термін «ГКС» використовується не дуже часто порівняно з терміном «ГК», який є більш поширеним у професійному середовищі [17].
Гормони надниркових залоз відрізняються своєю відносною глюкокортикоїдною (регулює вуглеводний обмін) та мінералокортикоїдною (регулює електролітний баланс) активністю, і тому їх історично диференціювали відповідно до відносної ефективності щодо затримки натрію, впливу на метаболізм вуглеводів (відкладення глікогену, глюкогенез у печінці) та протизапальної дії [21]. З цих причин терміни «глюкокортикоїди» (ГК) або «глюкокортикостероїди» (ГКС) є науково правильними та відповідними для опису застосування цих препаратів для лікування ревматичних захворювань (РЗ) та інших станів, де бажані протизапальні та імуномодулюючі ефекти [8]. Однак термін «ГКС» використовується не дуже часто порівняно з терміном «ГК», який є більш поширеним у професійному середовищі [17].
ГК є найважливішою опорою практикуючих ревматологів з моменту вручення Нобелівської премії за відкриття кортизону у 1950 р. E. Kendall, P. Hench та T. Reichstein [3].
Жоден препарат не отримував такої уваги при лікуванні запальних РЗ, як ГК. Близько кожного третього пацієнта із запальними РЗ лікується ГК протягом короткого або більш тривалого періоду [3]. Дискусія щодо прийнятного балансу між ефективністю та безпекою (часто низьких доз) ГК у лікуванні запальних РЗ така ж стара, як і саме лікування [8].
Кортизол (гідрокортизон) є основним людським ендогенним ГК. Цей стероїдний гормон виробляється в циркадному ритмі (високий рівень вранці перед пробудженням і дуже низьким близько опівночі). Синтез значно посилюється під час стресових станів [8, 37].
Синтетичні ГК, що найбільш часто застосовуються для лікування системного запалення, за структурою дуже схожі на кортизол з відносно скромними модифікаціями, що впливає на здатність стероїду зв’язуватися з глюкокортикоїдним рецептором і зменшувати вираженість або усувати внутрішню мінералокортикоїдну активність [12].
Механізм дії. ГК регулюють близько 20% усього геному. Синтез цитокінів, хемокінів, молекул адгезії, рецепторів, багатьох ензимів, медіаторів та інших білків регулюється ГК за рахунок або стимуляції, або депресії. Крім того, існують інші механізми дії, за якими розрізняють геномні та негеномні ефекти [9].
Геномні ефекти ГК пов’язані з цитозольним ГК-рецептором, який функціонує як фактор транскрипції, і таким чином більшість взаємодій забезпечується взаємодією ГК — ГК-рецептор, що дозволяє отримувати прямий зв’язок з ДНК та індукувати транскрипцію генів (NF-kB), зв’язаних з імунною системою, нейтралізуючи активацію фактора некрозу пухлин (TNF), інтерлейкіну (IL)-1, IL-6 [34].
Для негеномних ефектів ГК властивий швидкий розвиток, опосередкований фізичною та біомеханічною взаємодією, що зумовлено активацією мембранних ГК-рецепторів (які у фізіологічних умовах не залучаються) та за умови призначення високих та дуже високих доз (у перерахунку на преднізоновий еквівалент, більше 30 мг на добу) зв’язують всі існуючі ГК-рецептори та активують при цьому внутрішньоклітинні зміни метаболізму [26].
Слід зазначити, що клінічне та терапевтичне значення цих швидких ефектів ГК наразі залишаються нез’ясованими, хоча поточні результати фундаментальних досліджень щодо їх існування дуже переконливі [8].
Дія ліків зазвичай описується еквівалентними дозами, як показано на рис. 1. Ліва частина рисунку демонструє добре відомі відносні властивості важливих ГК для створення класичних геномних ефектів. Ці значення використовуються десятиліттями, хоча експериментальні та клінічні докази їх точності слабкі. Проте ці співвідношення можна використовувати для повсякденної клінічної роботи з точки зору загальних терапевтичних рекомендацій, але слід уникати їх догматичного використання [30].
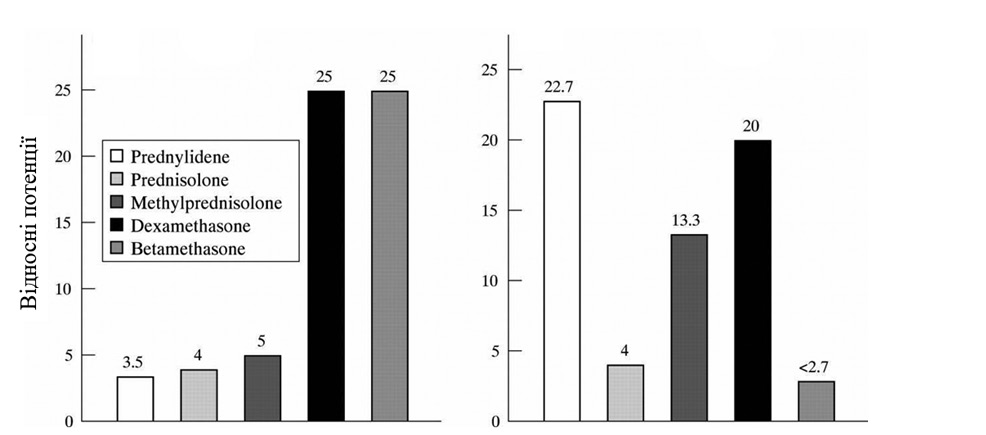
Крім того, існують інші механізми дії, за якими розрізняють геномні та негеномні ефекти.
Фермент 11β-гідроксистероїддегідрогеназа типу 1 (11β-HSD1) відіграє ключову регуляторну роль у печінковій активації структурно неактивних ГК (таких як кортизон і преднізон), перетворюючи їх на їхні активні аналоги (такі як гідрокортизон і преднізолон) [17].
Використовуючи мишачі in vivo моделі хронічного поліартриту, вони продемонстрували фундаментальну роль периферичної реактивації ГК в опосередкуванні їх протизапальних властивостей: видалення 11β-HSD1 у мишей призвело до глибокої стійкості до ГК у тварин, які отримували кортикостерон. Ця резистентність характеризувалася стійким синовітом, руйнуванням суглобів і запальною лейкоцитарною інфільтрацією [15].
Доза, час та шлях введення
Для уніфікації подання відомостей про дозу різних препаратів Європейський симпозіум з глюкокортикоїдної терапії [4] рекомендував подавати її в мг «преднізонового еквіваленту», використовуючи відомості про відносну силу класичної геномної дії. Ці відомості приблизно відповідають прийнятим величинам терапевтично еквівалентних доз: преднізолон — 5 мг, метилпреднізолон — 4 мг, тріамцинолон — 4 мг, дексаметазон — 0,75 мг, бетаметазон — 0,75 мг.
Сила дії преднізолону та преднізону однакова, проте перевагу надано терміну «преднізоновий еквівалент» з історичних причин: преднізон був першим синтетичним ГК, впровадженим в клінічну медицину.
Отже, на сьогодні ми можемо виділити наступні дози в еквіваленті за преднізоном:
- низька доза <7,5 мг еквівалента преднізону на добу.
При призначенні низької дози: зв’язано менше 50% рецепторів, доволі часто діапазон доз часто використовується для хронічної терапії, відносно небагато очікуваних побічних ефектів.
- Середня доза >7,5 мг, але <30 мг еквівалента преднізону на добу.
ГК у середніх дозах призначають для терапії помірної активності захворювання або на початкових етапах лікування аутоімунної патології.
- Висока доза >30 мг, але <100 мг еквівалента преднізону на добу.
Високі дози ГК використовують у якості початкового лікування тяжкої системної патології у хворих з високою активністю та потребують оптимальної корекції при досягненні клініко-лабораторної відповіді.
- Дуже висока доза >100 мг еквівалента преднізону на добу.
Останнім часом використовують дуже рідко з метою менеджменту тяжких проявів системних захворювань сполучної тканини, системних васкулітів, в якості лікування хворих без відповіді на стандартну терапію, при загрозі для життя або несприятливому прогнозі.
- Пульс-терапія >250 мг еквівалента преднізону на добу один або декілька днів.
Використовується при гострому чи небезпечному для життя перебігу системних захворювань сполучної тканини, системних васкулітів з ураженням нирок, головного мозку тощо.
Доза визначає силу дії і побічних ефектів. Це пов’язано з насиченням ГК-рецепторів (чим більше рецепторів зв’язано, тим сильніший ефект виявляється) і дуже ймовірно з появою додаткових негеномних ефектів при більш високих дозах (рис. 2) [8].
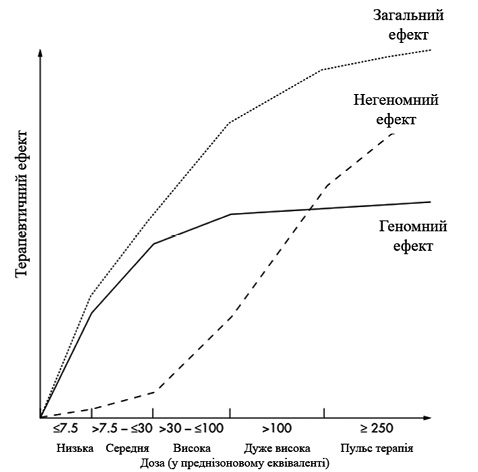
Необхідним для прогнозування ефективності ГК терапії є саме шлях введення: перорально, внутрішньовенно, внутрішньом’язово або внутрішньосуглобово. Слід зазначити, що внутрішньосуглобове призначення є більш ефективним, тому що за умови досягнення локальних терапевтичних концентрацій ГК можуть здійснювати як найважливіші геномні, так і негеномні ефекти. Діапазон ГК, доступних для внутрішньосуглобового введення, більший, ніж діапазон для системного застосування. Крім того, ці внутрішньосуглобові ГК суттєво відрізняються за структурою з важливими наслідками для їх терапевтичних ефектів [8].
Час призначення ГК має особливе значення, враховуючи циркадний ритм продукції ендогенного кортизолу, який може змінюватися при різних РЗ, а також з огляду на добову зміну симптоматики, зокрема ранкової скутості, притаманної, зокрема, ревматоїдному артриту (РА). Тому менеджмент аутоімунної запальної патології повинен базуватися на максимально ранньому призначенні ГК, наприклад одноразово у період з 6:00 до 8:00.
Доза, час та шлях введення
Терапія ГК із середніми/високими дозами викликає негеномні та геномні ефекти, які виникають уже при нижчих дозах, що вказує на те, що профіль ризику та користі для цих вищих доз може відрізнятися від низьких доз [8]. Загальні рекомендації щодо ГК-терапії розроблені робочою групою Європейського альянсу ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR) з ГК-терапії [24], але вони в основному базувалися на доказах і досвіді низькодозової терапії ГК. Належних порад щодо збалансування переваг і недоліків терапії середніми/високими дозами ГК бракує. Для вирішення зазначених науково-практичних питань у 2013 р. були сформовані Рекомендації EULAR з системної ГК-терапії РЗ (табл. 1).
Таблиця 3. Побічні ефекти терапії ГК (адаптовано за McDonough AK et al., 2021) [32]
| Симптом на початку терапії, по суті, неминучий | |
|---|---|
|
|
| Посилюється у пацієнтів із основними факторами ризику або супутнім прийомом інших препаратів | |
|
|
| Розвивається при тривалій терапії | |
|
|
| Сповільнений і підступний, ймовірно, залежить від кумулятивної дози | |
|
|
| Рідкісний і непередбачуваний | |
|
|
Ці рекомендації як настанова для щоденної практики є спробою сприяти більш безпечному застосуванню ГК при РЗ. Важливими аспектами рекомендацій є широка участь експертів і пацієнтів, використання даних досліджень, хоч і обмежених, і використання формату, що ґрунтується на доказах. Значна маса підручників та оглядових робіт зосереджена на застосуванні ГК, що базується на традиційній клінічній практиці та загальних переконаннях, які склалися до того, як належну увагу було приділено якості доказової бази. Це відображає зміни в підході до науково-обґрунтованої ревматологічної практики. Слід зазначити, що систематичні огляди та рандомізовані клінічні дослідження (РКД) вважаються найякіснішими доказами, але ці дослідження часто зосереджені на ефективності лікування [34]. У всіх обсерваційних (тобто нерандомізованих) дослідженнях проблема упередженості/змішування за показаннями серйозно погіршує або виключає можливість зробити висновки. Отже, чим вища активність запалення, тим вищий шанс почати ГК; однак через дизайн неможливо зробити висновок щодо причинно-наслідкового зв’язку між терапією та негативними ефектами або подіями. Крім того, досить різнорідні дослідження (наприклад різні захворювання, вік, схеми ГК та поєднане лікування) були об’єднані, щоб отримати принаймні загальне враження про виникнення побічних явищ. У цих дослідженнях майже всі пацієнти із більшістю запальних РЗ отримували декілька препаратів, що, вочевидь, заважає окремому вивченню співвідношення ризику та користі ГК. Представлені рекомендації стосуються питань терапії ГК із загальної точки зору, тобто не конкретного захворювання чи пацієнта. Однак відповідне лікування значно відрізняється для різних показань до такого лікування, як обговорювалося для початкових доз у рекомендації [4]. Зрозуміло, що індивідуальні характеристики пацієнта можуть потребувати адаптації режиму дозування або більш частого та тривалого моніторингу для побічних ефектів [4, 12].
Клінічне застосування
ГК виявляють багато терапевтичних ефектів, які варіюють від знеболення до хворобомодифікуючих властивостей, залежно від основного захворювання та бажаної терапевтичної цілі (табл. 2), шляху застосування, типу ГК, дози та тривалості обраної терапії. Все перелічене визначає величину клінічного ефекту та швидкості дії, але також ризик розвитку побічних явищ.
Таблиця 2. Загальне застосування ГК у ревматології. Початкові дози* (адаптовано за Bijlsma J.W. et al., 2015) [5]
| Пероральний прийом | Внутрішньовенне введення | |||
|---|---|---|---|---|
| Низькі дози | Середні дози | Високі дози | Дуже високі дози/пульс | |
|
Артрити Подагричний артрит Гострий ювенільний ідіопатичний артрит Остеоартрит Гострий КПФ* кристалічний артрит Псоріатичний артрит Реактивний артрит Гостра ревматична лихоманка Ревматоїдний артрит |
–
– – – – – – 2 |
2
1 – – 1 – 1 2 |
2
1 – – – – 1 1 |
–
– – – – – – 1 |
|
Захворювання сполучної тканини Дерматоміозит, поліміозит Змішане захворювання сполучної тканини Ревматична поліміалгія Синдром Шегрена, первинний Системний червоний вовчак Системна склеродермія |
–
– – – – – |
–
1 3 – 2 1 |
3
– – 1 1 – |
1
1 1 – 1 – |
|
Системні васкуліти Загалом |
– | – | 3 | 1 |
*Початкова доза: часто доза на початку лікування буде знижуватися з часом залежно від активності захворювання; дози в еквівалентах преднізону на добу: низькі ≤7,5 мг; середні >7,5, але ≤30 мг; високі >30 мг, але ≤100 мг; дуже високі >100 мг;
– вказує на рідкісне використання; 1 — нечасте використання для резистентних до лікування захворювань, ускладнень, тяжкого перебігу, тяжкого загострення і для бридж-терапії нещодавно розпочатого лікування; 2 — часто додається до/використовується як основна терапевтична стратегія; 3 — основна частина терапевтичної стратегії.
*КПФ — кальцію пірофосфат.
Згідно з існуючими практично-орієнтованими рекомендаціями, лише декілька нозологій потребують короткострокового призначення ГК у середній або навіть високій дозі. Серед найпоширеніших — гострий подагричний артрит, при якому доцільно призначення перорального ГК (30–35 мг/добу еквівалента преднізолону протягом 3–5 днів), згідно з рекомендаціями EULAR 2016 р. [36]. Сучасний менеджмент ревматологічної патології передбачає також можливість внутрішньосуглобового введення ГК. Такі підходи є доцільними при подагрі [49], остеоартриті [7], псоріатичному артриті [11], реактивному артриті [27], аксіальному спондилоартриті [35]. Слід зауважити, що менеджмент системних захворювань сполучної тканини (СЗСТ) зазнав неабияких змін. У рекомендаціях EULAR 2023 р. стосовно лікування системного червоного вовчака вперше зазначено, що ГК, якщо необхідно, дозують залежно від типу та тяжкості ураження органу, їх дозу слід знизити до підтримувальної ≤5 мг/добу (еквівалент преднізону) і, якщо можливо, відмінити; у пацієнтів із захворюванням середнього та тяжкого ступеня можна розглянути можливість пульсового внутрішньовенного введення метилпреднізолону (125–1000 мг/добу протягом 1–3 днів) [14, 43]. Призначення ГК при системній склеродермії також слід проводити дуже обережно, контролюючи артеріальний тиск, функцію нирок та ретельно аналізуючи необхідну дозу, оскільки існує ряд даних, що ГК пов’язані з вищим ризиком ренальної кризи. На відміну від інших СЗСТ, при поліміозиті, дерматоміозиті, антисинтетазному синдромі зазвичай преднізолон призначають перорально в дозі 0,5–1,0 мг/кг маси тіла на добу, а в особливо гострих та тяжких випадках терапію розпочинають з внутрішньовенного введення високої дози ГК (250–1000 мг) [38].
Терапія РА традиційно асоціюється із призначенням ГК. Імплементованим стандартом на сьогодні вважається «міст-терапія» при верифікації діагнозу, при загостренні та необхідності зміни лікування [2, 39]. Можливості раціональної ГК-терапії були підтверджені у цілій низці РКД. Так, у CAPRA-2 зафіксовано зниження активності РА (низькі дози преднізону із додаванням синтетичних хворобомодифікуючих антиревматичних препаратів (cХМАРП)) протягом 12 тиж порівняно з плацебо [10].
У іншій роботі — CareRA, пацієнти з раннім РА були рандомізовані в 2 групи: в одній групі пацієнти приймали ГК з метотрексатом (MTX) з поступовим зниженням ГК до 5 мг/добу, в той час як в іншій групі MTX застосовували без ГК. За даними через 1 та 2 роки, показники тих, хто досягнув ремісії, були вищими в групі MTX з ГК, ніж тільки MTX [44].
Безумовно, неможливо не згадати десятирічні дані спостереження BeSt. Дослідниками 508 пацієнтів з раннім РА були рандомізовані в 4 групи: монотерапія MTX, монотерапія MTX та сульфасалазин, MTX та ГК спочатку 60 мг/добу з прогресивним зниженням до 7,5 мг/добу протягом 6 тиж та група МТХ та інфліксимаб. При сумації даних вищу ефективність продемонстровано у групі ГК [18].
Однак останні оновлення європейських рекомендацій щодо терапії РА акцентують увагу на ще більшій необхідності зосередження на перевагах та ризиках терапії ГК порівняно з попередніми версіями. Наприклад, в оновленій версії рекомендацій EULAR 2022 р. [40] наголошено на тому, що короткострокова терапія низькими дозами ГК повинна розглядатися як частина при старті або при заміні традиційних сХМАРП у різних дозах та шляхах введення, проте корекція у бік зниження дози або відміни повинна бути проведена так швидко, як це клінічно можливо.
Проте, на наше велике переконання, ГК були, є і будуть частиною сучасного менеджменту РА, тому що оптимізоване застосування ГК при РА дозволило б домогтися значної економії, особливо за рахунок відстрочки або виключення необхідності в дорогих біологічних препаратах. Найсучасніша фундаментальна робота, яка дозволяє нам так вважати, присвячена вивченню шкоди, користі та супутнім проблемам, пов’язаним з прийомом низькодозових ГК — дослідження GLORIA, була представлена у 2022 р. Мета GLORIA — довести, що тривале застосування низької дози ГК на додаток до поточної антиревматичної терапії є високоекономічним та безпечним для пацієнтів літнього віку з РА. І цієї мети була досягнуто, оскільки результати свідчать, що пацієнти похилого віку з РА могли б отримати користь від 2-річного прийому низьких доз ГК на додаток до існуючого лікування, що модифікує захворювання, зі сприятливим балансом користі та шкоди. Отримані дані, які були представлені в двох презентаціях на конгресі EULAR 2022, також показують, що дози ГК можна успішно знизити через 2 роки, лише з помірним підвищенням активності захворювання, ризиком загострення та відсутністю ознак наднирникової недостатності [6].
Побічна дія системної ГК терапії у ревматології
Токсичність ГК є однією з найпоширеніших причин ятрогенного захворювання, пов’язаного з хронічними РЗ. Побічні ефекти ГК відомі десятиліттями. Але точне співвідношення ризику та користі є неповним та/або суперечливим, оскільки зазвичай важко відрізнити ефекти ГК від ефектів основних супутніх захворювань, інших супутніх захворювань або інших ліків. Побічні ефекти, пов’язані з ГК, залежать як від середньої дози, так і від тривалості терапії. Загалом можна сказати, що тривале застосування є фактором високого ризику, тоді як загальна доза має другорядне значення. Навіть при терапії низькими дозами ГК можуть призвести до розвитку серйозних побічних ефектів. Ступінь тяжкості коливається від більш косметичних аспектів (наприклад телеангіоектазія, гіпертрихоз) до серйозних ситуацій, що призводять до інвалідності та навіть становлять загрозу для життя (наприклад шлункова кровотеча). Можуть виникнути один або кілька побічних ефектів [19, 26]. Побічні ефекти ГК є основним обмежувальним фактором для застосування цих лікарських засобів. Огляд найбільш поширених і серйозних побічних ефектів ГК наведено в табл. 3.
Таблиця 1. Рекомендації EULAR щодо лікування середніми і високими дозами ГК терапії при ревматичних захворюваннях, що ґрунтуються на доказах і консенсусі (адаптовано за Duru N. et al., 2013)
| Освіта та профілактика | ||
|---|---|---|
| Рекомендації | A+B%, частка членів робочої групи, які настійно або повністю рекомендували цю пропозицію на основі порядкової шкали A–E (A — повністю рекомендовано, B — настійно рекомендовано) | Рівень доказовості (РД) |
| Поясніть пацієнтам (та їх родині та/або особам, що здійснюють догляд, у тому числі середньому медичному персоналу) мету лікування ГК у середній/високій дозі та потенційні ризики, пов’язані з такою терапією. | 100 | III |
| Обговоріть заходи щодо зниження таких ризиків, включаючи дієту, регулярні фізичні вправи та належний догляд за ранами. | 75 | III/IV |
| Пацієнти з остеопорозом, викликаним ГК, або які мають ризик цього захворювання, повинні отримати відповідні профілактичні/терапевтичні втручання. | 100 | I–A |
| Пацієнти та групи лікування пацієнтів повинні отримати відповідні практичні поради про те, як справлятися з ГК-індукованим пригніченням гіпоталамо-гіпофізарно-наднирникової осі. | 92 | IV |
| Надати доступний ресурс для просування передової практики у веденні пацієнтів, що застосовують ГК в середніх/високих дозах. | 75 | IV |
| Доза/ризик-користь | ||
| Перед початком лікування ГК у середніх/високих дозах розгляньте супутні захворювання, з можливими побічними явищами. До них належать цукровий діабет, непереносимість глюкози, серцево-судинні захворювання, виразкова хвороба, рецидивуючі інфекції, імуносупресія, глаукома та остеопороз. Пацієнти з такими супутніми захворюваннями потребують жорсткого контролю для управління співвідношенням ризик/користь. | 83 | IV |
| Оберіть адекватну початкову дозу для досягнення терапевтичної відповіді з урахуванням ризику недостатнього лікування. | 92 | I–A/IV |
| Постійно переглядайте вимоги до продовження лікування ГК та обирайте дозу залежно від терапевтичної відповіді, ризику недостатнього лікування та розвитку побічних явищ. | 92 | IV |
| Якщо очікується, що довгострокова середня/висока доза ГК-терапії буде необхідна, активно подумайте про ГК-щадну терапію. | ВІДХИЛЕНО | |
| Моніторинг | ||
| Усім пацієнтам повинні проводити відповідний моніторинг клінічно значущих побічних явищ. Лікуючий лікар повинен знати про можливе виникнення цукрового діабету, гіпертензії, збільшення маси тіла, інфекцій, остеопоротичних переломів, остеонекрозу, міопатії, проблем з очима, проблем зі шкірою та нейропсихологічних розладів. | 75 | IV |
| Рекомендації можна класифікувати за основними питаннями освіти та профілактики, дозування та співвідношення користі та ризику, а також моніторингу | ||
ГК-індукований остеопороз
Остеопороз, індукований ГК, є найпоширенішим типом ятрогенного остеопорозу та частою причиною вторинного остеопорозу [46]. У близько 50% пацієнтів, які приймають ГК довше 6 міс, розвивається вторинний остеопороз [20]. Ключовим моментом в патогенезі ГК-індукованого остеопорозу є пряма пригнічувальна дія ГК на остеобласти, що призводить до зменшення кісткоутворення. При цьому ГК знижують абсорбцію кальцію в кишечнику та реабсорбцію кальцію в ниркових канальцях. Це призводить до негативного балансу кальцію в організмі та транзиторної гіпокальціємії, що, своєю чергою, стимулює секрецію паратиреоїдного гормону та підвищує резорбцію кісткової тканини [28].
Досить часто більш тривале застосування ГК супроводжується застосуванням інгібітора протонної помпи (ІПП). Одночасне застосування пероральних ГК та ІПП пов’язане з підвищенням ризику розвитку остеопорозних переломів. При цьому статистично відрізняються ризики остеопорозних переломів, пов’язаних з пероральним ГК або тільки із застосуванням ІПП. Тому наголошується на підвищенні ризику остеопорозного перелому при одночасному застосуванні пероральних ГК та ІПП [4].
Однак доволі «важко знайти» безпечну для кісток дозу ГК при ревматичних захворюваннях та патології опорно-рухового апарату. Так, у дослідженні Адамі та співавторів [1] у хворих, яким було призначено тривалу ГК-терапію (дози ГК стратифіковані за середніми рівнями дозування 0–2,5 мг на добу, 2,5–5 мг на добу і ≥5 мг на добу) без антиостеопоротичних препаратів, виявлено зниження мінеральної щільності кісткової тканини (МЩКТ). Втрата МЩКТ на 4% була пов’язана з підвищенням ризику переломів на 30–40%. Існують припущення, що у пацієнтів із дозою ≤5 мг/добу у перерахунку на преднізон будуть відсутні зміни МЩКТ. Однак у рекомендаціях Американського коледжу ревматології (American College of Rheumatology — ACR) зазначено про необхідність прийому пероральних бісфосфонатів у пацієнток, які довго приймають ГК [25].
ГК-асоційовані інфекційні ускладнення
Як відомо, високі дози ГК підвищують ризик інфекційних ускладнень. У проспективному когортному дослідженні за участю 2108 пацієнтів із запальним поліартритом із реєстру клініки Мейо, США, частота госпіталізації через інфекцію була більш ніж у 2,5 раза вищою, ніж у загальній популяції. Застосування ГК було визначено як незалежний фактор ризику госпіталізації [16].
Використовуючи національний банк даних щодо ревматичних захворювань у США, понад 16 000 пацієнтів спостерігали протягом 3,5 року з приводу госпіталізованої пневмонії. У пацієнтів, які отримували терапію ГК, частота госпіталізованих пневмоній була у 1,7 раза вищою. Дослідження навіть визначає ризик при дозах, нижчих за 5 мг/добу і навіть вищий ризик при 10–15 мг/добу. Зростання частоти серйозних інфекцій було більш вираженим протягом перших 90 днів після початку лікування ГК [42].
У дослідженні L.J. Herrinton та співавторів [23] повідомлено про ризик серйозної інфекції для пацієнтів із системним червоним вовчаком, які починають прийом ГК. Отримані дані щодо 4-кратного підвищення ризику серйозних інфекцій для хворих, які приймають ГК, але не приймають протималярійних препаратів.
Масив даних, який охоплює взаємозв’язок застосування ГК та підвищення частоти інфекцій, став особливо актуальним під час пандемії COVID-19, що відобразилося у спеціально розроблених рекомендаціях EULAR [29]. Для реальної клінічної практики слід акцентувати рекомендацію про важливість призупинення або припинення прийому ГК, пов’язаного із загостренням захворювання, оскільки це може зумовлювати несприятливий результат COVID-19.
ГК та серцево-судинний ризик
Попередні дослідження показали, що терапія високими дозами ГК пов’язана з більш ніж у 2,5 раза підвищеним ризиком серцево-судинних подій [49]. Більше того, лише 30 днів прийому ГК при РА підвищують серцево-судинний ризик на 15% протягом 6 міс. Такі дані отримали B. Wallace та співавтори [47]. Зокрема, показано, що зв’язок між прийомом ГК та виникненням гострого інфаркту міокарда, інсульту, транзиторної ішемічної атаки, зупинки серця або коронарної реваскуляризації не залежить від початкового рівня ризику, а також показників активності захворювання та застосування біологічних препаратів, МТХ. У одному з найбільших аналізів короткострокового ризику серцево-судинних подій, залежних від дози та тривалості дії ГК, у пацієнтів з РА, які раніше не отримували ГК, включених в реєстр РА CorEvitas (раніше Corrona), представлені переконливі дані щодо відсутності жодного зв’язку з ризиком серцево-судинних подій із щоденним застосуванням преднізолону ≤4 мг або нижчими кумулятивними дозами та тривалістю, на відміну від дозування ≥ 5 мг на добу [33].
Подібні дані отримані також H. So та співавторами [41] при аналізі даних 12 233 пацієнтів з РА без серцево-судинних подій з 2006 до 2018 р. та середньою тривалістю спостереження 8,7 року — у 7% розвинулися серцево-судинні події, а у хворих, які отримували щоденно преднізолон ≥5 мг, ризик виникнення серцево-судинних подій підвищувався на 7% на місяць. Отже, призначення ГК пов’язане із тривалістю та залежним від дози підвищеним ризиком серцево-судинних подій, наприклад дуже низькі дози преднізолону (<5 мг на добу) не спричиняють надмірного ризику.
Зниження дози та відміна ГК
Терапія ГК, незважаючи на важливу роль в успішному лікуванні РЗ, може спричинити значну захворюваність у пацієнтів, які приймають їх довгостроково, і при застосуванні високих доз. Лікарі повинні постійно намагатися нівелювати дію надмірної дози ГК шляхом впровадження ГК-щадної терапії та поступового зниження дози до мінімальної ефективної [32]. Таким чином, як частину стратегії лікування до цільової слід розглянути скорочення лікування ГК, як тільки буде досягнуто ремісії або принаймні низької активності захворювання. Наразі відсутні дані щодо частки пацієнтів, у яких зберігається ремісія або низька активність після повного припинення прийому ГК. Більше того, коли терапію ГК поновлюють через загострення, незрозуміло, чи буде успішною друга спроба зниження та припинення терапії ГК, а також не з’ясовано, чи існують предиктори для успішного припинення лікування. У дослідженні J.M. Maassen та співавторів проведено вивчення успішного припинення застосування ГК (пероральний преднізон) з першої або другої спроби та оцінка характеристик пацієнтів, пов’язаних з успішним припиненням у двох дослідженнях лікування до цілі [31]. У дослідженні BeSt у 40% пацієнтів після первинної відміни преднізону відмічали загострення, а з інших 60% у 38% довелося поновити лікування пізніше [18]. З тих, хто перезапустив ГК-терапію (вторинне припинення), у 47% знову відмічено загострення. У дослідженні IMPROVED після первинного припинення зафіксовано 39% випадків загострення, а у 40% із 61% довелося відновити прийом пізніше. Після вторинного припинення виявлено 49% випадків загострення РА [22]. Отже, стандартні базові характеристики є недостатніми для персоналізації тривалості ГК «брідж-терапії».
Враховуючи, що хворі на системний червоний вовчак зазвичай лікуються ГК навіть у періоди ремісії, практичною необхідністю є оцінка частоти загострень та прогресування органних пошкоджень у пацієнтів, які поступово знижували дозу ГК. Серед 204 пацієнтів з системним червоним вовчаком, які брали участь у дослідженні K. Tselios та співавторів, частота загострень була нижчою в групі відміни як через 12, так і через 24 міс. Помірні та тяжкі загострення не відрізнялися через 12 міс, але були менш частими через 24 міс. Зроблено висновок, що поступова відміна ГК є безпечною при клінічно неактивному системному червоному вовчаку і пов’язана з меншою кількістю загострень і меншим органним пошкодженням через 24 міс [45].
У цікавій роботі повідомлялося про пацієнтів з РА, які розпочали терапію ГК і супутню терапію сХМАРП. Отримані результати щодо зміни доз ГК та активності захворювання, частоти припинення ГК, а також частоти загострень протягом 6 міс після припинення ГК [50].
Серед висновків слід зазначити, що у пацієнтів із РА, які починають приймати ГК, окрім сХМАРП, можливе припинення їх застосування за умови сприятливого контролю активності хвороби в реальному житті, переважно без короткочасного загострення. Але час та тривалість до відміни ГК далекі від рекомендованого, що вказує на розрив між реальною практикою та поточними рекомендаціями.
Висновки
1. ГК є високоефективними протизапальними та імуносупресивними препаратами, але їх застосування обмежене побоюваннями щодо виникнення побічних явищ.
2. Багато побічних явищ можна уникнути або успішно лікувати за умови адекватного та завбачливого підходу.
3. Оптимальний вибір застосування ГК при терапії ревматичних захворювань — це специфічний та індивідуальний підхід у дозуванні та рутинному моніторингу.
4. Уроки, які слід засвоїти для щоденної клінічної практики: при запальних ревматичних захворюваннях ГК все ще відіграють важливу роль у лікуванні.
5. Переваги та недоліки необхідно оцінювати окремо для кожного пацієнта.
6. Еквівалент преднізолону 5 мг є ефективним і безпечним протягом більш тривалого періоду, за винятком пацієнтів із високими факторами серцево-судинного ризику.
7. При застосуванні протокольної схеми зниження дози ГК можна припинити у 90% пацієнтів.
Список використаної літератури
- 1. Adami G. Abstract L01. (2022) Presented at: ACR Convergence 2022; Nov. 11-14. Philadelphia (hybrid meeting.
- 2. Bakker M.F., Jacobs J.W., Welsing P.M., et al. (2012) Low-dose prednisone inclusion in a methotrexate-based, tight control strategy for early rheumatoid arthritis: a randomized trial. Ann. Intern. Med.; 156: 329–39.
- 3. Banting F.G. (1992) Nobel Prize Laureates: Encyclopedia: A-L: Trans. from English M.: Progress. P. 55–58.
- 4. Bijlsma J.W.J. (2024) Annals of the Rheumatic Diseases collection on glucocorticoids (2020–2023): novel insights and advances in therapy Annals of the Rheumatic Diseases; 83: 4–8.
- 5. Bijlsma J.W.J., Hachulla É., Pereira da Silva J.A. et al. (2015) Textbook 0n Rheumatic diseases. BMJ Publishing Group BMJ. P. 1437.
- 6. Boers M., Hartman L., Opris-Belinski D. et al. (2022) GLORIA Trial consortium. Low dose, add-on prednisolone in patients with rheumatoid arthritis aged 65+: the pragmatic randomised, double-blind placebo-controlled GLORIA trial. Ann. Rheum. Dis. Jul; 81(7): 925–936. doi: 10.1136/annrheumdis-2021-221957. Epub 2022 May 31. PMID: 35641125; PMCID: PMC9209692.
- 7. Bruyère O., Honvo G., Veronese N. et al. (2019) An updated algorithm recommendation for the management of knee osteoarthritis from the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Semin Arthritis Rheum. Dec; 49(3): 337–350. doi: 10.1016/j.semarthrit.2019.04.008. Epub 2019 Apr 30. PMID: 31126594.
- 8. Buttgereit F., da Silva J.A., Boers M. et al. (2002) Standardised nomenclature for glucocorticoid dosages and glucocorticoid treatment regimens: current questions and tentative answers in rheumatology. Ann. Rheum. Dis.; 61(8): 718–722. doi:10.1136/ard.61.8.718.
- 9. Buttgereit F., Scheffold A. (2002) Rapid glucocorticoid effects on immune cells. Steroids; 67: 529–34.
- 10. Buttgereit F., Mehta D., Kirwan J. et al. (2013) Low-Dose prednisone chronotherapy for rheumatoid arthritis: a randomised clinical trial (CAPRA-2). Ann. Rheum. Dis.; 72: 204–10.
- 11. Coates L., Gossec L. (2023) The updated GRAPPA and EULAR recommendations for the management of psoriatic arthritis: Similarities and differences. Joint Bone Spine. Jan; 90(1): 105469. doi: 10.1016/j.jbspin.2022.105469. Epub 2022 Sep 29. PMID: 36184036.
- 12. Cooper M.S., Stewart P.M. (2003) Corticosteroid insufficiency in acutely ill patients. N. Engl. J. Med., 348: 727–734.
- 13. Duru N., van der Goes M.C., Jacobs J.W.G. et al. (2013) EULAR evidence-based and consensus-based recommendations on the management of medium to high-dose glucocorticoid therapy in rheumatic diseasesAnnals of the Rheumatic Diseases; 72: 1905–1913.
- 14. Fanouriakis A., Kostopoulou M., Andersen J. et al. (2024) EULAR recommendations for the management of systemic lupus erythematosus: 2023 update Annals of the Rheumatic Diseases; 83: 15–29.
- 15. Fenton C., Martin C., Jones R. et al. (2021) Local steroid activation is a critical mediator of the anti-inflammatory actions of therapeutic glucocorticoids. Ann. Rheum. Dis. Feb; 80(2): 250–260. doi: 10.1136/annrheumdis-2020-218493. Epub 2020 Nov 8. PMID: 33162397; PMCID: PMC7815637.
- 16. Franklin J., Lunt M., Bunn D. et al. (2007) Risk and predictors of infection leading to hospitalisation in a large primary-care-derived cohort of patients with inflammatory polyarthritis. Ann. Rheum. Dis.; 66: 308–312. This prospective cohort study of patients with inflammatory polyarthritis determined that use of glucocorticoids was identified as an independent risk factor for hospitalization for infection.
- 17. Fuller P.J., Lim-Tio S.S., Brennan F.E. (2000) Specificity in mineralocorticoid versus glucocorticoid action. Kidney Int., 57: 1256–1264.
- 18. Goekoop-Ruiterman Y.P.M., de Vries-Bouwstra J.K., Allaart C.F. et al. (2005) Clinical and radiographic outcomes of four different treatment strategies in patients with early rheumatoid arthritis (the best study): a randomized, controlled trial. Arthritis Rheum.; 52: 3381–90. doi:10.1002/art.21405.
- 19. Goodwin J.S. (1994) Antiinflammatory drugs. In: Stites DP, Terr AI, Parslow TG, editors. Basic and Clinical Immunology. 8th ed. East Norwalk: Appleton and Lange. Р. 786–795.
- 20. Gudbjornsson B., Juliusson U.I., Gudjonsson F.V. (2002) Prevalence of long term steroid treatment and the frequency of decision making to prevent steroid induced osteoporosis in daily clinical practice. Ann. Rheum. Dis.; 61: 32–36.
- 21. Hardman J.G., Limbird L.E. eds. (1998) Goodman and Gilman’s the pharmacological basis of therapeutics. 9th ed. New York: Mc Graw-Hill.
- 22. Heimans L., Wevers-de Boer K.V.C., Visser K. et al. (2014) A two-step treatment strategy trial in patients with early arthritis aimed at achieving remission: the improved study. Ann. Rheum. Dis.; 73: 1356–61. doi:10.1136/annrheumdis-2013-203243.
- 23. Herrinton L.J., Liu L., Goldfien R. et al. (2016) Risk of Serious Infection for Patients with Systemic Lupus Erythematosus Starting Glucocorticoids with or without Antimalarials. J. Rheumatol. Aug; 43(8): 1503–9. doi: 10.3899/jrheum.150671. Epub 2016 Jul 1. PMID: 27370880.
- 24. Hoes J.N., Jacobs J.W., Boers M. et al. (2007) EULAR evidence-based recommendations on the management of systemic glucocorticoid therapy in rheumatic diseases. Ann. Rheum. Dis.; 66: 1560–7.
- 25. Humphrey M. et al. (2022) American College of Rheumatology Guideline for the Prevention and Treatment of Glucocorticoid‐Induced Osteoporosis. Arthritis Care & Research, 75. 10.1002/acr.25240.
- 26. Huscher D., Thiele K., Gromnica-Ihle E. et al. (2009) Dose-related patterns of glucocorticoid-induced side effects. Annals of the Rheumatic Diseases. Jul; 68(7): 1119–1124.
- 27. Jubber A., Moorthy A. (2021) Reactive arthritis: a clinical review. J. R. Coll. Physicians Edinb. Sep; 51(3): 288–297. doi: 10.4997/JRCPE.2021.319. PMID: 34528623.
- 28. Kanis J.A., Cooper C., Rizzoli R. et al. (2019) Scientific Advisory Board of the European Society for Clinical and Economic Aspects of Osteoporosis (ESCEO) and the Committees of Scientific Advisors and National Societies of the International Osteoporosis Foundation (IOF). European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int. Jan; 30(1): 3–44. doi: 10.1007/s00198-018-4704-5. Epub 2018 Oct 15. Erratum in: Osteoporos Int. 2020 Jan;31(1):209. Erratum in: Osteoporos Int. 2020 Apr; 31(4): 801. PMID: 30324412; PMCID: PMC7026233.
- 29. Landewé R.B.M., Kroon F.P.B., Alunno A. et al. (2022) EULAR recommendations for the management and vaccination of people with rheumatic and musculoskeletal diseases in the context of SARS-Cov-2. Ann. Rheum. Dis.; 81: 1628–39.
- 30. Lipworth B.J. (2000) Therapeutic implications of non-genomic glucocorticoid activity. Lancet; 356: 87–9.
- 31. Maassen J.M., Dos Santos Sobrín R., Bergstra S.A. et al. (2021) Glucocorticoid discontinuation in patients with early rheumatoid and undifferentiated arthritis: a post-hoc analysis of the BeSt and IMPROVED studiesAnnals of the Rheumatic Diseases; 80: 1124–1129.
- 32. McDonough A.K., Curtis J.R., Saag K.G. (2008) The epidemiology of glucocorticoid-associated adverse events. Curr. Opin. Rheumatol. Mar; 20(2): 131–7. doi: 10.1097/BOR.0b013e3282f51031. PMID: 18349741.
- 33. Ocon A.J., Reed G., Pappas D.A. et al. (2021) Short-term dose and duration-dependent glucocorticoid risk for cardiovascular events in glucocorticoid-naive patients with rheumatoid arthritis. Ann. Rheum. Dis. Dec; 80(12): 1522–1529. doi: 10.1136/annrheumdis-2021-220577. Epub 2021 Jul 2. PMID: 34215644.
- 34. Panettieri R., Schaafsma D., Amrani et al. (2018) Non-genomic Effects of Glucocorticoids: An Updated View. Trends in Pharmacological Sciences. 40. 10.1016/j.tips.2018.11.002.
- 35. Ramiro S., Nikiphorou E., Sepriano A. et al. (2023) ASAS-EULAR recommendations for the management of axial spondyloarthritis: 2022 update. Ann. Rheum. Dis. Jan; 82(1): 19–34. doi: 10.1136/ard-2022-223296. Epub 2022 Oct 21. PMID: 36270658.
- 36. Richette P., Doherty M., Pascual E. et al. (2017) 2016 updated EULAR evidence-based recommendations for the management of gout. Ann. Rheum. Dis. Jan; 76(1): 29–42. doi: 10.1136/annrheumdis-2016-209707. Epub 2016 Jul 25. PMID: 27457514.
- 37. Schmid D., Burmester G.R., Tripmacher R. et al. (2000) Bioenergetics of human peripheral blood mononuclear cell metabolism inquiescent, activated, and glucocorticoid-treated states. Bioscience Rep.; 20: 289–302.
- 38. Schmidt J. (2018) Current Classification and Management of Inflammatory Myopathies. J. Neuromuscul. Dis.; 5(2): 109–129. doi: 10.3233/JND-180308. PMID: 29865091; PMCID: PMC6004913.
- 39. Smith G.C., Pell J.P. (2003) Parachute use to prevent death and major trauma related to gravitational challenge: systematic review of randomised controlled trials. BMJ; 327: 1459–61.
- 40. Smolen J.S., Landewé R.B.M., Bijlsma J.W.J. et al. (2020) EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2019 update Annals of the Rheumatic Diseases Published Online First: 22 January. doi: 10.1136/annrheumdis-2019-216655.
- 41. Smolen J.S., Landewé R.B.M., Bergstra S.A. et al. (2023) EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2022 update. Ann. Rheum. Dis. Jan; 82(1): 3–18. doi: 10.1136/ard-2022-223356. Epub 2022 Nov 10. Erratum in: Ann. Rheum. Dis. 2023 Mar; 82(3): e76. PMID: 36357155.
- 42. So H., Lam T.O., Meng H. et al. (2023) Time and dose-dependent effect of systemic glucocorticoids on major adverse cardiovascular event in patients with rheumatoid arthritis: a population-based study. Ann. Rheum. Dis. Nov; 82(11): 1387–1393. doi: 10.1136/ard-2023-224185. Epub 2023 Jul 24. PMID: 37487608.
- 43. Steinbuch M., Youket T.E., Cohen S. (2004) Oral glucocorticoid use is associated with an increased risk of fracture. Osteoporos Int.; 15: 323–328.
- 44. Stojan G., Petri M. (2017) The risk benefit ratio of glucocorticoids in SLE: have things changed over the past 40 years? Curr. Treatm. Opt. Rheumatol. Sep; 3(3): 164–172. doi: 10.1007/s40674-017-0069-8. Epub 2017 Jul 27. PMID: 28840094; PMCID: PMC5565217.
- 45. Stouten V., Joly J., De Cock D. et al. (2017) Sustained Effectivenessafter Remission Induction with Methotrexate and Step-Down Glucocorticoids in Patients with Early Rheumatoid Arthritis Following a Treat-to-Target Strategy after 2 Years [abstract]. Arthritis Rheumatol.; 69(Suppl. 10).
- 46. Tselios K., Gladman D.D., Su J. et al. (2021) Gradual Glucocorticosteroid Withdrawal Is Safe in Clinically Quiescent Systemic Lupus Erythematosus. ACR Open Rheumatol. Aug; 3(8): 550–557. doi: 10.1002/acr2.11267. Epub 2021 Jul 10. PMID: 34245233; PMCID: PMC8363847.
- 47. van Staa T.P., Leufkens H.G., Cooper C. (2002) The epidemiology of corticosteroidinduced osteoporosis: a meta-analysis. Osteoporos Int.; 13: 777–787.
- 48. Wallace B. (2021) Abstract 1428. Presented at: ACR Convergence; November 5–9, 2021 (virtual meeting).
- 49. Wechalekar M.D., Vinik O., Schlesinger N. et al. (2013) Intra-articular glucocorticoids for acute gout. Cochrane Database Syst. Rev.; (4): CD009920. doi:10.1002/14651858.CD009920.pub2).
- 50. Wei L., MacDonald T.M., Walker B.R. (2004) Taking glucocorticoids by prescription is associated with subsequent cardiovascular disease. Ann. Intern. Med.; 141: 764–770.
- 51. Xie W., Huang H., Li G. et al. (2021) Dynamical trajectory of glucocorticoids tapering and discontinuation in patients with rheumatoid arthritis commencing glucocorticoids with csDMARDs: a real-world data from 2009 to 2020Annals of the Rheumatic Diseases; 80: 997–1003.
Адреса для листування:
Рекалов Д.Г.
Клініка ревматології професора Рекалова,
Запоріжжя, Дніпро
Запорізький державний
медико-фармацевтичний університет
E-mail: dmitryrekalov@gmail.com

Leave a comment