Загальні риси та відмінності серцево-судинних ускладнень при ревматоїдному артриті та ішемічній хворобі серця: аналіз патогенетичних механізмів та можливостей диференційної оцінки
Узун К.С.1, Гнилорибов А.М.2, Узун Д.Ю.1, Севастьянова Н.Є.3, Кузеванова М.В.4, Потапов Ю.О.5
- 1КНП «Обласна лікарня інтенсивного лікування м. Маріуполь», м. Київ, Україна
- 2Національний інститут серцево-судинної хірургії імені М.М. Амосова НАМН України, м. Київ, Україна
- 3Клініко-діагностичний центр Державної наукової установи «Центр інноваційних технологій охорони здоров’я» Державного управління справами, Київ, Україна
- 4Національний університет охорони здоров’я України ім. П.Л. Шупика, Київ, Україна
- 5Донецький національний медичний університет, м. Лиман, Україна
Резюме. У статті представлено огляд літератури, що аналізує зв’язок між ревматоїдним артритом (РА) та серцево-судинними захворюваннями (ССЗ). РА визнаний незалежним фактором ризику розвитку ішемічної хвороби серця (ІХС) через хронічне запалення, яке є основною причиною цієї патології. ССЗ відмічають у близько 30% пацієнтів із РА віком старше 40 років, вони є основною причиною передчасної смерті. Надмірна кількість серцево-судинних подій у пацієнтів із РА є результатом комбінації традиційних факторів ризику та специфічних для РА запальних процесів. На сьогодні немає затвердженого алгоритму для оцінки ризику ССЗ у пацієнтів із РА. Інструмент SCORE, що використовується для оцінки ризику ССЗ у загальній популяції, має певні обмеження в контексті РА. Європейський альянс ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR) пропонує використовувати коефіцієнт 1,5 до результату SCORE для таких пацієнтів. Сучасні рекомендації EULAR підкреслюють важливу роль ревматологів у моніторингу та стандартизації управління ризиками ССЗ у пацієнтів із РА, акцентуючи на необхідності пригнічення хронічного запалення. Також EULAR наголошує на важливості ретельного контролю традиційних факторів ризику для зниження ймовірності серцево-судинних ускладнень. Отже, у статті представлено аналіз літератури, що підтверджує значний вплив РА на розвиток серцево-судинних ускладнень. Ці ураження зумовлені не лише специфічними для ІХС проявами, але й специфічними для РА механізмами, які потребують подальшої конкретизації. Відсутність точного розуміння патогенетичних причин підвищення ризиків ССЗ при РА ускладнює проведення ефективної індивідуальної профілактики та лікування ускладнень ССЗ, а також потребує розробки нових методів їх візуалізації та лікування.
DOI:10.32471/rheumatology.2707-6970.97.19014
УДК 616.72-002.77-06:616.12-005.4-02]-079.4
Ревматоїдний артрит (РА) — це хронічне запальне захворювання, яке було підтверджене як незалежний фактор ризику для серцево-судинних захворювань (ССЗ) згідно з рекомендаціями Європейського товариства кардіологів (European Society of Cardiology — ESC) [1]. Європейський альянс ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR) рекомендує множити на 1,5 показники ризику ССЗ для осіб із РА. Окрім того, чинні рекомендації EULAR наголошують, що ревматологи відповідають за оцінку та управління ризиком ССЗ у пацієнтів із РА [2]. Дослідження свідчать, що поширеність серцевих захворювань у пацієнтів із РА вища, ніж у загальній популяції, і порівняна з такою у пацієнтів із цукровим діабетом 2-го типу [3, 4]. У пацієнтів із РА частота ССЗ становить 30–60%, включаючи серцеву недостатність, ішемічну хворобу серця (ІХС), перикардит, міокардит та кардіоміопатію. Ризик інфаркту міокарда зростає на 68%, а інсульту — на 41%, що значно перевищує показники у загальній популяції [5].
Дослідження Трансатлантичного консорціуму з серцево-судинних захворювань при РА (TransAtlantic Cardiovascular risk Calculator for Rheumatoid Arthritis — ATACC-RA) виявило, що близько 49% серцево-судинних подій у пацієнтів із РА спричинені традиційними факторами ризику (зокрема курінням та артеріальною гіпертензією), а 30% — аспектами, пов’язаними з РА, такими як підвищений індекс активності захворювання (DAS28), позитивний ревматоїдний фактор та/або антитіла до цитрулінових білків (ACPA), підвищена швидкість осідання еритроцитів (ШОЕ) та рівень С-реактивного білка (СРБ) [6].
Окрім цього, серцево-судинні події є причиною 42% загальної смертності, пов’язаної з РА (що робить їх основною причиною смерті при РА) [7], і виникають на ранніх етапах захворювання, що зменшує тривалість життя пацієнтів із РА на 5–15 років [8]. Вони залишаються головною причиною смертності при РА.
Існує два основних аспекти серцево-судинного ураження при РА: ІХС та неішемічна хвороба серця (не-ІХС), як показано на рисунку [9].
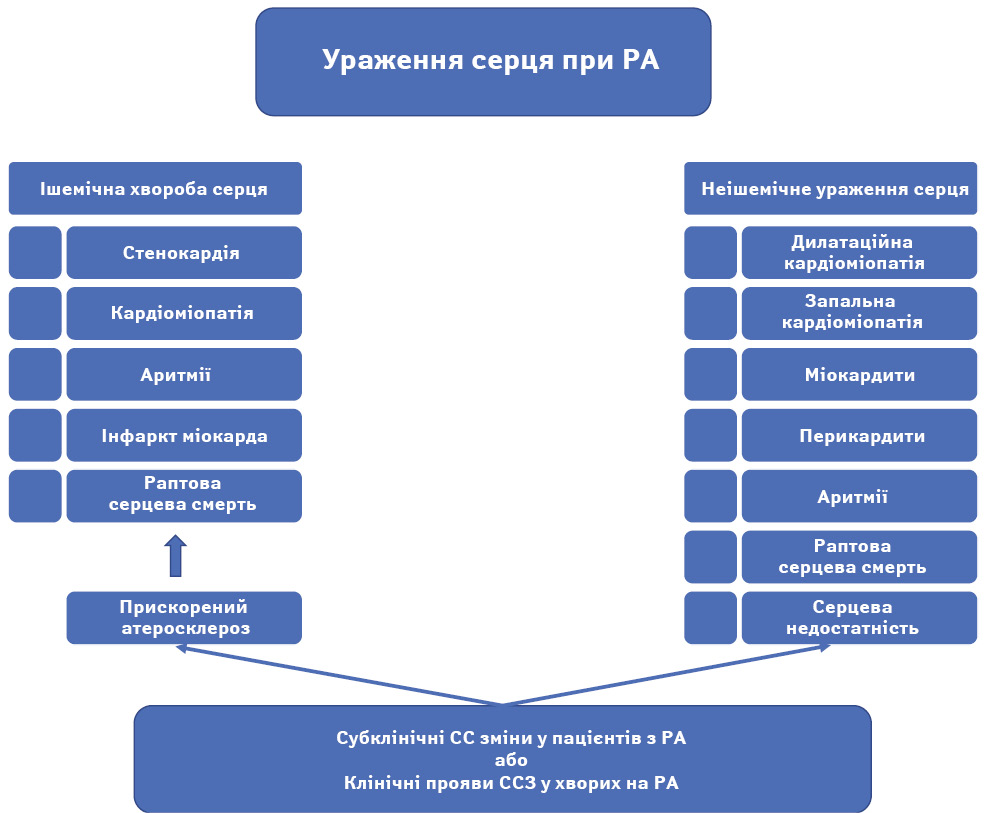
Ішемічна хвороба серця
ІХС є важливою причиною серцево-судинної смертності у пацієнтів із РА. Встановлено, що ризик інфаркту міокарда у таких пацієнтів порівняний із ризиком у хворих на цукровий діабет [10]. Особи з РА мають удвічі вищий ризик раптової серцевої смерті (РСС) [11].
У пацієнтів із РА хронічне запалення є ключовим фактором дисліпідемії, що характеризується низьким рівнем холестерину ліпопротеїнів високої щільності (ЛПВЩ) та високим рівнем холестерину ліпопротеїнів низької щільності (ЛПНЩ).
Неішемічна хвороба серця
Зазвичай не-ІХС розвивається поступово та пов’язана зі змінами клітинного складу та структури серцевого м’яза [11].
Найпоширенішим типом не-ІХС є кардіоміопатія — стан, що характеризується розширеними та жорсткими шлуночками. Часто відмічається бівентрикулярна дилатація із систолічною дисфункцією та іншими проблемами, включаючи ураження клапанів, емболії та аритмії, які спричиняють серцеву недостатність. Хронічні запальні процеси в міокарді (міокардит) є основною причиною цього захворювання. Міокардит може бути дифузним некротичним або гранулематозним. За даними [12], частота кардіоміопатії у пацієнтів із РА становить 3–30% і виявляється під час аутопсії.
Точний етіопатогенез цього захворювання повністю не з’ясований, але деякі запальні цитокіни, такі як інтерлейкін-1α (IL-1α), та інші медіатори виділяються із дегенеруючого міокарда, активуючи запальні процеси в сусідніх клітинах. Токсичність антиревматичних препаратів також може спричинити порушення функції міокарда [13].
Перикардит може бути ускладненням раннього РА або передувати проявам ревматологічного захворювання. Інше ураження серця у пацієнтів із РА — це аритмії, які спричиняються проблемами з провідністю через локальну ішемію, ревматоїдні вузлики, амілоїдоз або серцеву недостатність.
Пацієнти з РА мають підвищений ризик розвитку серцевої недостатності [14]. Припускається, що частота цієї ускладненої патології у пацієнтів із РА вдвічі вища, ніж у загальній популяції, і переважає у жінок [15]. Дослідження Девіса та його колег свідчать, що прояви та розвиток серцевої недостатності у пацієнтів із РА відрізняються від таких у хворих без РА чи інших ревматичних запальних захворювань. У пацієнтів із РА відмічають менше характерних симптомів серцевої недостатності, фракція викиду часто зберігається, а відповідь на лікування погана, що загалом призводить до несприятливого прогнозу з удвічі вищим ризиком смертності порівняно з пацієнтами без РА [16].
У перебігу РА у пацієнтів спочатку виявляють діастолічну серцеву дисфункцію [17]; з часом розвивається порушення діастолічної функції лівого шлуночка, що асоціюється зі специфічними змінами на електрокардіографії (ЕКГ). Діастолічна дисфункція тісно пов’язана із хронічним системним запаленням при РА, зокрема з підвищеними рівнями СРБ і ШОЕ, а також позитивним ревматоїдним фактором та антитілами до ACPA [18].
Частота не-ІХС при РА щонайменше така ж висока, як і ІХС [11]. У 50% пацієнтів із РА без історії ССЗ виявляються ознаки фіброзу або запалення серця на зображеннях або знижена функція лівого шлуночка [19]. Близько 30% таких пацієнтів мають порушення мікроциркуляції серця [20].
Магнітно-резонансна томографія серця (МРТ) та позитронно-емісійна томографія з комп’ютерною томографією (ПЕТ-КТ), проведені пацієнтам із РА без попереднього діагнозу ССЗ, показали, що близько половини з них мають ознаки запалення або фіброзу серця [21]. Одній третині пацієнтів із РА без клінічних проявів ССЗ також властиві субклінічні зміни у мікроциркуляції коронарних артерій, що визначається за показниками резерву міокардіального кровотоку [22].
Отже, важливо виявляти, запобігати та лікувати всі ці субклінічні зміни міокарда та коронарної системи у пацієнтів із РА через ускладнення, як ішемічні, так і неішемічні, які можуть бути серйозними або навіть смертельними [11]. Два дослідження, опубліковані Мясоєдовою та Артсом, дійшли висновку, що активність РА значно впливає на ризик ССЗ: кожен період загострення активності захворювання підвищує цей ризик на 7%, тоді як зниження активності знижує його [23, 24].
Різні прозапальні цитокіни беруть участь в етіопатогенезі ураження серця при РА: фактор некрозу пухлин (TNF)-α, IL-1β, IL-6 та IL-17 [11]. Специфічні механізми, що беруть участь у розвитку не-ІХС, ще не повністю відомі порівняно з ішемічними [20].
Встановлено, що підвищений артеріальний тиск у пацієнтів із РА є незалежним предиктором ССЗ. Дослідження COMORA показало, що гіпертензія у пацієнтів із РА відзначається у близько 40% випадків [25, 26]; крім того, у цих пацієнтів високий артеріальний тиск призводить до дворазового зростання відносного ризику ССЗ [27, 28]. Підвищення систолічного тиску на 20 мм рт. ст. підвищує ризик ендотеліальної дисфункції та ССЗ.
Дисліпідемія є важливим традиційним фактором ризику ССЗ у пацієнтів із РА; вважається, що близько 55–65% пацієнтів із РА мають порушення ліпідного обміну [29]. Існує так званий ліпідний парадокс, коли низькі рівні ЛПНЩ супроводжуються підвищеним ризиком ССЗ порівняно з високими рівнями [30, 31]. Більше того, дослідження свідчать, що у пацієнтів із РА загальні показники холестерину та ЛПНЩ знижені порівняно з популяцією без РА, хоча РА є незалежним фактором ризику для ССЗ [32].
При РА також виявляють «парадокс ожиріння», що демонструє зворотну кореляцію між індексом маси тіла (ІМТ) і смертністю. Загальновідомо, що у загальній популяції підвищений ІМТ асоціюється з важливим ризиком ССЗ; проте у пацієнтів із РА з надмірною масою тіла або ожирінням відзначають нижчий відносний ризик смертності від серцево-судинних причин порівняно з пацієнтами з нормальною масою тіла [33].
Запальні процеси впливають на ендотеліальну дисфункцію та появу атеросклеротичних бляшок. Доведено, що процеси, які відбуваються в синовіальній оболонці при РА та в атеросклеротичних бляшках, є подібними [34]. Дослідження вказують на підвищену частоту інсулінорезистентності та метаболічного синдрому у пацієнтів із РА (40%), що безпосередньо впливає на ендотеліальну дисфункцію [35].
Взаємозв’язок між запаленням, імунними порушеннями та традиційними факторами ризику ССЗ є ключовим фактором мікросудинної ендотеліальної дисфункції у пацієнтів із РА [36]. Галаррага та інші вказали, що системне запалення (оцінене за рівнями СРБ) є незалежним фактором ризику мікросудинної дисфункції у пацієнтів із РА [37]. Інше дослідження Аросіо та співавторів продемонструвало, що пацієнти з РА мають порушену реактивність мікроциркуляції, ендотеліальну дисфункцію та підвищену жорсткість артерій, що безпосередньо пов’язано з підвищеними рівнями СРБ та індуцибельної NO-синтази [38].
Вплив лікарських засобів на розвиток ІХС при РА
Підтверджено, що тривале застосування нестероїдних протизапальних препаратів (НПЗП) підвищує ризик ССЗ. Вони беруть участь в інгібуванні ізоформ циклооксигенази (ЦОГ) [39, 40].
Наслідком ЦОГ-2-опосередкованої супресії простацикліну є вазоконстрикція, мобілізація тромбоцитів, атерогенез і підвищений ризик гіпертензії, яка вважається основним фактором ризику ССЗ при РА [41].
У метааналізі 26 досліджень встановлено, що НПЗП є причиною 46% випадків смерті, спричинених серцево-судинними подіями, що підкреслює серйозність цього ризику. Серед 7 досліджених НПЗП напроксен мав найнижчий серцево-судинний ризик, тоді як ібупрофен, диклофенак, люміракоксиб, целекоксиб, еторикоксиб і рофекоксиб мали подібний підвищений профіль ризику. Примітно, що найвищий ризик смерті від застосування НПЗП виникає на початку курсу лікування [15]. EULAR рекомендують напроксен як найбезпечніший варіант НПЗП для зниження ризику ІХС у пацієнтів з РА [10].
Кортикостероїди
Кортикостероїди (КС) зазвичай призначають для короткочасного застосування для контролю активності захворювання у пацієнтів з РА. Однак їх тривалий прийом може спричинити або посилити традиційні фактори ризику ССЗ. Відомо, що КС збільшують вираженість гіпертензії, порушують метаболізм ліпідів, викликають резистентність до інсуліну та викликають абдомінальне ожиріння, що зумовлює розвиток ССЗ [42]. Вони здатні індукувати або посилювати добре відомі традиційні фактори серцево-судинного ризику [43], викликаючи або збільшуючи вираженість гіпертензії, впливаючи на рівень ліпідів у крові та резистентність до інсуліну, а також посилюючи абдомінальне ожиріння, таким чином зумовлюючи виникнення та розвиток ССЗ [42].
Звичайні синтетичні хворобомодифікуючі препарати (Disease-modifying antirheumatic drugs — DMARDs)
Метотрексат асоціюється зі зниженим серцево-судинним ризиком. Метааналіз Micha та співавторів свідчить про зниження серцево-судинних подій на 21% у пацієнтів, які приймали метотрексат [44]. В іншому дослідженні Чой та співавтори повідомили про 60% зниження смертності від усіх причин і 70% зниження смертності, пов’язаної з ССЗ, у пацієнтів з РА, які отримували метотрексат [45].
Метотрексат позитивно впливає на метаболізм ліпідів, зменшуючи утворення пінистих клітин і молекул адгезії, а також інгібує прозапальні та проатерогенні цитокіни, такі як TNFα, IL-6 та IL-1 [46, 47]. Дослідження також показують, що метотрексат уповільнює прогресування атеросклерозу [48].
Гідроксихлорохін сприятливо впливає на ліпідний профіль шляхом зниження рівня ЛПНЩ і тригліцеридів. Він також чинить антитромботичну дію на агрегацію тромбоцитів і становить мінімальний ризик розвитку цукрового діабету [49]. Метааналіз Mathieu та співавторів показав, що пацієнти з РА, які отримували гідроксихлорохін, мали менше серцево-судинних проблем порівняно з тими, хто не отримував його [50].
Показано, що сульфасалазин знижує ризик ССЗ у пацієнтів з РА. Під час дослідження випадок-контроль, проведеного van Halm та співавторами, виявлено, що терапія сульфасалазином була пов’язана з нижчим ризиком серцево-судинних проблем, ніж відсутність лікування синтетичними DMARD [51].
Лефлуномід асоціюється з підвищенням артеріального тиску, погіршуючи гіпертензію у деяких пацієнтів. Однак було також показано, що він знижує ризик інфаркту міокарда порівняно з іншими синтетичними DMARD [52].
Біологічні DMARDs (bDMARDs)
Показано, що анти-TNF-терапія покращує антиатерогенні властивості холестерину ЛПВЩ. Хоча він підвищує рівень загального холестерину, тригліцеридів і холестерину ЛПВЩ, немає істотного впливу на холестерин ЛПНЩ або індекс атерогенності, що свідчить про захисну роль у метаболізмі ліпідів [54]. Проте антагоністи TNF-α також пов’язані з підвищеним ризиком гіпертензії у пацієнтів з РА [55].
Тоцилізумаб, антагоніст рецептора IL-6, здається, не підвищує ризику ССЗ порівняно з анти-TNF-терапією, як продемонстровано в дослідженні ENTRACTE, у якому порівнювали тоцилізумаб з етанерцептом у пацієнтів з РА з факторами ризику ССЗ [56, 57]. Крім того, запропоновано, що тоцилізумаб забезпечує захисну роль проти РСС шляхом пом’якшення ризику подовження інтервалу Q–Tc, відомої проблеми у пацієнтів з РА [58]. Дослідження Кіма та співавторів і Singh та співавторів припускають, що серцево-судинний ризик, пов’язаний із тоцилізумабом, можна порівняти з ризиком інгібіторів TNF [56, 59].
У дослідженні Gottenberg та співавторів виявлено, що ритуксимаб — засіб, що виснажує B-клітини, має подібний до тоцилізумабу ризик серйозних серцево-судинних подій. Однак необхідні додаткові дослідження, щоб остаточно зрозуміти вплив ритуксимабу на ІХС [60].
Тофацитиніб, інгібітор янус-кінази (JAK), пов’язаний із підвищенням рівня холестерину ЛПВЩ і зниженням загального співвідношення холестерину до холестерину ЛПВЩ, що вказує на знижений ризик серйозних несприятливих серцевих подій. Однак підвищення рівня загального холестерину та холестерину ЛПНЩ не давало такого самого захисного ефекту [61].
Таким чином, у пацієнтів з РА вплив різних ліків на серцево-судинний ризик є комплексним, причому деякі методи лікування становлять значні ризики, а інші пропонують потенційний захисний ефект. НПЗП, особливо ті, що не містять напроксену, пов’язані з високим серцево-судинним ризиком, особливо на початку лікування. Навпаки, csDMARDs, такі як метотрексат і гідроксихлорохін, пропонують переваги щодо ССЗ, тоді як біологічні агенти, такі як тоцилізумаб і анти-TNF-терапія, мають нюансові ефекти, потребуючи ретельного розгляду профілю серцево-судинних ризиків кожного пацієнта при визначенні лікування.
Оцінка ризику ССЗ при РА
Існує чимало недоліків при використанні оцінки ризику SCORE для пацієнтів з РА. EULAR рекомендує множити результат SCORE на 1,5 у пацієнтів із РА для більш точної оцінки їхнього серцево-судинного ризику в клінічній практиці. Однак дослідження, проведене Кроусоном та співавторами, показало, що це множення не обов’язково є кращим або точнішим предиктором ризику серцево-судинних подій у пацієнтів із РА [62]. За рекомендаціями EULAR, оцінку ризику слід проводити кожні 5 років у випадку низького або помірного ризику, або частіше (щороку), якщо ризик є середнім чи високим [63]. У разі перевищення ризику серцево-судинних ускладнень на 10 років на понад 5%, необхідно змінювати спосіб життя та розпочинати терапію, спрямовану на зниження рівня ліпідів.
Візуалізаційні методи
Оцінка субклінічної серцево-судинної патології у пацієнтів із РА може проводитися за допомогою КТ (для виявлення кальцифікації коронарних артерій) [64], ультразвукового дослідження каротидних артерій (для вимірювання товщини комплексу інтима-медіа [65], а також вимірювання швидкості пульсової хвилі в аорті, індексу артеріальної ригідності та щиколотково-плечового індексу (для оцінки артеріальної жорсткості) [66]. Ехокардіографія та МРТ відіграють важливу роль у виявленні структурних та функціональних порушень, які можуть призвести до серцевої недостатності [67].
Ультразвукові методи є неінвазивними і дозволяють отримати детальну картину змін у судинах, які можуть виникнути ще на ранніх етапах розвитку РА. Це дослідження є важливим інструментом для стратифікації ризику ССЗ та допомагає у виборі оптимального лікування [68, 69].
Висновки
РА визнаний незалежним фактором ризику розвитку ІХС через хронічне запалення, яке лежить в основі цього захворювання. ССЗ відзначають у близько 30% пацієнтів із РА віком старше 40 років, і вони є основною причиною передчасної смерті. Надмірна кількість серцево-судинних подій у пацієнтів із РА є результатом поєднання традиційних факторів ризику та специфічних для РА запальних процесів.
На сьогодні немає затвердженого алгоритму для оцінки ризику ССЗ у пацієнтів із РА. Інструмент SCORE використовується для оцінки ризику ССЗ у загальній популяції, але має певні обмеження щодо застосування у хворих на РА. EULAR пропонує використовувати коефіцієнт 1,5 до результату SCORE для таких пацієнтів.
Сучасні рекомендації EULAR наголошують на ключовій ролі ревматологів у моніторингу та стандартизації управління серцево-судинними ризиками у пацієнтів із РА, акцентуючи на важливості пригнічення хронічного запалення. Крім того, EULAR підкреслює необхідність ретельного контролю традиційних факторів ризику для мінімізації можливих ускладнень з боку серцево-судинної системи.
РА робить дуже значний додатковий внесок у розвиток серцево-судинних ускладнень. На жаль, жоден із наведених у статті методів не дозволяє оцінити диференційовано серцево-судинні ризики, зумовлені РА. Немає також точного розуміння патогенетичних причин підвищення серцево-судинних ризиків при цьому захворюванні, що не дозволяє своєчасно та ефективно проводити індивідуальну профілактику та лікування серцево-судинних ускладнень.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів.
Фінансова підтримка. Автори стверджують про відсутність фінансової підтримки при написанні.
Інформація про внесок кожного автора в підготовку статті — автори стверджують про рівний внесок кожного автора при написанні статті.
Список використаної літератури
- 1. Visseren F.L.J., Mach F., Smulders Y.M. et al.; ESC Scientific Document Group (2021) 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. European heart journal, 42(34): 3227–3337. doi.org/10.1093/eurheartj/ehab484.
- 2. DeMizio D.J., Geraldino-Pardilla L.B. (2020) Autoimmunity and Inflammation Link to Cardiovascular Disease Risk in Rheumatoid Arthritis. Rheumatology and therapy, 7(1): 19–33. doi.org/10.1007/s40744-019-00189-0
- 3. Peters M.J., van Halm V.P., Voskuyl A.E. et al. (2009) Does rheumatoid arthritis equal diabetes mellitus as an independent risk factor for cardiovascular disease? A prospective study. Arthritis and rheumatism, 61(11): 1571–1579. doi.org/10.1002/art.24836.
- 4. van Halm V.P., Peters M.J., Voskuyl A.E. et al. (2009) Rheumatoid arthritis versus diabetes as a risk factor for cardiovascular disease: a cross-sectional study, the CARRE Investigation. Annals of the rheumatic diseases, 68(9): 1395–1400. doi.org/10.1136/ard.2008.094151.
- 5. Avina-Zubieta J.A., Thomas J., Sadatsafavi M. et al. (2012) Risk of incident cardiovascular events in patients with rheumatoid arthritis: a meta-analysis of observational studies. Annals of the rheumatic diseases, 71(9): 1524–1529. doi.org/10.1136/annrheumdis-2011-200726.
- 6. Crowson C.S., Rollefstad S., Ikdahl E. et al.; A Trans-Atlantic Cardiovascular Consortium for Rheumatoid Arthritis (ATACC-RA) (2018) Impact of risk factors associated with cardiovascular outcomes in patients with rheumatoid arthritis. Annals of the rheumatic diseases, 77(1): 48–54. doi.org/10.1136/annrheumdis-2017-211735.
- 7. van den Hoek J., Boshuizen H.C., Roorda L.D. et al. (2017) Mortality in patients with rheumatoid arthritis: a 15-year prospective cohort study. Rheumatology international, 37(4): 487–493. doi.org/10.1007/s00296-016-3638-5.
- 8. Bacon P.A., Stevens R.J., Carruthers D.M. et al. (2002) Accelerated atherogenesis in autoimmune rheumatic diseases. Autoimmunity reviews, 1(6): 338–347. doi.org/10.1016/s1568-9972(02)00100-3.
- 9. Rezuș E., Macovei L.A., Burlui A.M. et al. (2021) Ischemic Heart Disease and Rheumatoid Arthritis-Two Conditions, the Same Background. Life (Basel, Switzerland), 11(10): 1042. doi.org/10.3390/life11101042.
- 10. Agca R., Heslinga S.C., Rollefstad S. et al. (2017) EULAR recommendations for cardiovascular disease risk management in patients with rheumatoid arthritis and other forms of inflammatory joint disorders: 2015/2016 update. Annals of the rheumatic diseases, 76(1): 17–28. doi.org/10.1136/annrheumdis-2016-209775.
- 11. Błyszczuk P., Szekanecz Z. (2020) Pathogenesis of ischaemic and non-ischaemic heart diseases in rheumatoid arthritis. RMD open, 6(1): e001032. doi.org/10.1136/rmdopen-2019-001032.
- 12. Theander L., Nyhäll-Wåhlin B.M., Nilsson J.Å. et al. (2017) Severe Extraarticular Manifestations in a Community-based Cohort of Patients with Rheumatoid Arthritis: Risk Factors and Incidence in Relation to Treatment with Tumor Necrosis Factor Inhibitors. The Journal of rheumatology, 44(7): 981–987. doi.org/10.3899/jrheum.161103.
- 13. Kobayashi Y., Giles J.T., Hirano M. et al. (2010) Assessment of myocardial abnormalities in rheumatoid arthritis using a comprehensive cardiac magnetic resonance approach: a pilot study. Arthritis research & therapy, 12(5): R171. doi.org/10.1186/ar3131.
- 14. Crowson C.S., Nicola P.J., Kremers H.M. et al. (2005) How much of the increased incidence of heart failure in rheumatoid arthritis is attributable to traditional cardiovascular risk factors and ischemic heart disease?. Arthritis and rheumatism, 52(10): 3039–3044. doi.org/10.1002/art.21349.
- 15. Trelle S., Reichenbach S., Wandel S. et al. (2011) Cardiovascular safety of non-steroidal anti-inflammatory drugs: network meta-analysis. BMJ (Clinical research ed.), 342: c7086. doi.org/10.1136/bmj.c7086.
- 16. Davis J.M., 3rd, Roger V.L., Crowson C.S. et al. (2008) The presentation and outcome of heart failure in patients with rheumatoid arthritis differs from that in the general population. Arthritis and rheumatism, 58(9): 2603–2611. doi.org/10.1002/art.23798.
- 17. Del Buono M., Abbate A., Toldo S. (2018) Interplay of inflammation, oxidative stress and cardiovascular disease in rheumatoid arthritis. Heart (British Cardiac Society), 104(24): 1991–1992. doi.org/10.1136/heartjnl-2018-313313.
- 18. Maradit-Kremers H., Crowson C.S., Nicola P.J. et al. (2005) Increased unrecognized coronary heart disease and sudden deaths in rheumatoid arthritis: a population-based cohort study. Arthritis and rheumatism, 52(2): 402–411. doi.org/10.1002/art.20853.
- 19. Amigues I., Tugcu A., Russo C. et al. (2019) Myocardial Inflammation, Measured Using 18-Fluorodeoxyglucose Positron Emission Tomography With Computed Tomography, Is Associated With Disease Activity in Rheumatoid Arthritis. Arthritis & rheumatology (Hoboken, N.J.), 71(4): 496–506. doi.org/10.1002/art.40771.
- 20. Amigues I., Russo C., Giles J.T. et al. (2019) Myocardial Microvascular Dysfunction in Rheumatoid ArthritisQuantitation by 13N-Ammonia Positron Emission Tomography/Computed Tomography. Circulation. Cardiovascular imaging, 12(1): e007495. doi.org/10.1161/CIRCIMAGING.117.007495.
- 21. Corrao S., Messina S., Pistone G. et al. (2013) Heart involvement in rheumatoid arthritis: systematic review and meta-analysis. International journal of cardiology, 167(5): 2031–2038. doi.org/10.1016/j.ijcard.2012.05.057.
- 22. Mantel Ä., Holmqvist M., Andersson D.C. et al. (2017) Association Between Rheumatoid Arthritis and Risk of Ischemic and Nonischemic Heart Failure. Journal of the American College of Cardiology, 69(10): 1275–1285. doi.org/10.1016/j.jacc.2016.12.033.
- 23. Myasoedova E., Chandran A., Ilhan B. et al. (2016) The role of rheumatoid arthritis (RA) flare and cumulative burden of RA severity in the risk of cardiovascular disease. Annals of the rheumatic diseases, 75(3): 560–565. doi.org/10.1136/annrheumdis-2014-206411.
- 24. Arts E.E., Fransen J., Den Broeder A.A. et al. (2017) Low disease activity (DAS28 ≤3.2) reduces the risk of first cardiovascular event in rheumatoid arthritis: a time-dependent Cox regression analysis in a large cohort study. Annals of the rheumatic diseases, 76(10): 1693–1699. doi.org/10.1136/annrheumdis-2016-210997.
- 25. Dougados M., Soubrier M., Antunez A. et al. (2014) Prevalence of comorbidities in rheumatoid arthritis and evaluation of their monitoring: results of an international, cross-sectional study (COMORA). Annals of the rheumatic diseases, 73(1): 62–68. doi.org/10.1136/annrheumdis-2013-204223.
- 26. Gullick N.J., Scott D.L. (2011) Co-morbidities in established rheumatoid arthritis. Best practice & research. Clinical rheumatology, 25(4): 469–483. doi.org/10.1016/j.berh.2011.10.009.
- 27. Baghdadi L.R., Woodman R.J., Shanahan E.M. et al. (2015) The impact of traditional cardiovascular risk factors on cardiovascular outcomes in patients with rheumatoid arthritis: a systematic review and meta-analysis. PloS one, 10(2): e0117952. doi.org/10.1371/journal.pone.0117952.
- 28. Bergström U., Jacobsson L.T., Nilsson J.Å. et al. (2011) Pulmonary dysfunction, smoking, socioeconomic status and the risk of developing rheumatoid arthritis. Rheumatology (Oxford, England), 50(11): 2005–2013. doi.org/10.1093/rheumatology/ker258.
- 29. Toms T.E., Symmons D.P., Kitas G.D. (2010) Dyslipidaemia in rheumatoid arthritis: the role of inflammation, drugs, lifestyle and genetic factors. Current vascular pharmacology, 8(3): 301–326. doi.org/10.2174/157016110791112269.
- 30. Giles J.T., Wasko M.C.M., Chung C.P. et al. (2019) Exploring the Lipid Paradox Theory in Rheumatoid Arthritis: Associations of Low Circulating Low-Density Lipoprotein Concentration With Subclinical Coronary Atherosclerosis. Arthritis & rheumatology (Hoboken, N.J.), 71(9): 1426–1436. doi.org/10.1002/art.40889.
- 31. Liu N., Zhang Z., Wu H. et al. (2015) Recognition of H3K9 methylation by GLP is required for efficient establishment of H3K9 methylation, rapid target gene repression, and mouse viability. Genes & development, 29(4): 379–393. doi.org/10.1101/gad.254425.114.
- 32. Robertson J., Peters M.J., McInnes I.B. et al. (2013) Changes in lipid levels with inflammation and therapy in RA: a maturing paradigm. Nature reviews. Rheumatology, 9(9): 513–523. doi.org/10.1038/nrrheum.2013.91.
- 33. Wolfe F., Michaud K. (2012) Effect of body mass index on mortality and clinical status in rheumatoid arthritis. Arthritis care & research, 64(10): 1471–1479. doi.org/10.1002/acr.21627.
- 34. Ferguson L.D., Sattar N., McInnes I.B. (2021) Managing Cardiovascular Risk in Patients with Rheumatic Disease. The Medical clinics of North America, 105(2): 247–262. doi.org/10.1016/j.mcna.2020.09.010.
- 35. Zegkos T., Kitas G., Dimitroulas T. (2016). Cardiovascular risk in rheumatoid arthritis: assessment, management and next steps. Therapeutic advances in musculoskeletal disease, 8(3): 86–101. doi.org/10.1177/1759720X16643340.
- 36. Erre G.L., Piga M., Fedele A.L. et al. (2018) Prevalence and Determinants of Peripheral Microvascular Endothelial Dysfunction in Rheumatoid Arthritis Patients: A Multicenter Cross-Sectional Study. Mediators of inflammation, 2018: 6548715. doi.org/10.1155/2018/6548715.
- 37. Galarraga B., Khan F., Kumar P. et al. (2008) C-reactive protein: the underlying cause of microvascular dysfunction in rheumatoid arthritis. Rheumatology (Oxford, England), 47(12): 1780–1784. doi.org/10.1093/rheumatology/ken386.
- 38. Mäki-Petäjä K.M., Cheriyan J., Booth A.D. et al. (2008) Inducible nitric oxide synthase activity is increased in patients with rheumatoid arthritis and contributes to endothelial dysfunction. International journal of cardiology, 129(3): 399–405. doi.org/10.1016/j.ijcard.2008.02.011.
- 39. McGettigan P., Henry D. (2006) Cardiovascular risk and inhibition of cyclooxygenase: a systematic review of the observational studies of selective and nonselective inhibitors of cyclooxygenase 2. JAMA, 296(13): 1633–1644. doi.org/10.1001/jama.296.13.jrv60011.
- 40. Varas-Lorenzo C., Riera-Guardia N., Calingaert B. et al. (2011) Stroke risk and NSAIDs: a systematic review of observational studies. Pharmacoepidemiology and drug safety, 20(12): 1225–1236. doi.org/10.1002/pds.2227.
- 41. Grosser T., Fries S., FitzGerald G.A. (2006) Biological basis for the cardiovascular consequences of COX-2 inhibition: therapeutic challenges and opportunities. The Journal of clinical investigation, 116(1): 4–15. doi.org/10.1172/JCI27291.
- 42. Zhang M., Wang M., Tai Y. et al. (2022) Triggers of Cardiovascular Diseases in Rheumatoid Arthritis. Current problems in cardiology, 47(6): 100853. doi.org/10.1016/j.cpcardiol.2021.100853.
- 43. Panoulas V.F., Douglas K.M., Stavropoulos-Kalinoglou A. et al. (2008) Long-term exposure to medium-dose glucocorticoid therapy associates with hypertension in patients with rheumatoid arthritis. Rheumatology (Oxford, England), 47(1): 72–75. doi.org/10.1093/rheumatology/kem311.
- 44. Micha R., Imamura F., Wyler von Ballmoos M. et al. (2011) Systematic review and meta-analysis of methotrexate use and risk of cardiovascular disease. The American journal of cardiology, 108(9): 1362–1370. doi.org/10.1016/j.amjcard.2011.06.054.
- 45. Choi H.K., Hernán M.A., Seeger J.D. et al. (2002) Methotrexate and mortality in patients with rheumatoid arthritis: a prospective study. Lancet (London, England), 359(9313): 1173–1177. doi.org/10.1016/S0140-6736(02)08213-2.
- 46. Ronda N., Greco D., Adorni M.P. et al. (2015) Newly identified antiatherosclerotic activity of methotrexate and adalimumab: complementary effects on lipoprotein function and macrophage cholesterol metabolism. Arthritis & rheumatology (Hoboken, N.J.), 67(5): 1155–1164. doi.org/10.1002/art.39039.
- 47. Kerekes G., Nurmohamed M.T., González-Gay M.A. et al. (2014) Rheumatoid arthritis and metabolic syndrome. Nature reviews. Rheumatology, 10(11): 691–696. doi.org/10.1038/nrrheum.2014.121.
- 48. Kim H.J., Kim M.J., Lee C.K. et al. (2015) Effects of Methotrexate on Carotid Intima-media Thickness in Patients with Rheumatoid Arthritis. Journal of Korean medical science, 30(11): 1589–1596. doi.org/10.3346/jkms.2015.30.11.1589.
- 49. Solomon D.H., Massarotti E., Garg R. et al. (2011) Association between disease-modifying antirheumatic drugs and diabetes risk in patients with rheumatoid arthritis and psoriasis. JAMA, 305(24): 2525–2531. doi.org/10.1001/jama.2011.878.
- 50. Mathieu S., Pereira B., Tournadre A. et al. (2018) Cardiovascular effects of hydroxychloroquine: a systematic review and meta-analysis. Annals of the rheumatic diseases, 77(11): e80. doi.org/10.1136/annrheumdis-2017-212668.
- 51. van Halm V.P., Nurmohamed M.T., Twisk J.W. et al. (2006) Disease-modifying antirheumatic drugs are associated with a reduced risk for cardiovascular disease in patients with rheumatoid arthritis: a case control study. Arthritis research & therapy, 8(5): R151. doi.org/10.1186/ar2045.
- 52. Suissa S., Bernatsky S., Hudson M. (2006). Antirheumatic drug use and the risk of acute myocardial infarction. Arthritis and rheumatism, 55(4): 531–536. doi.org/10.1002/art.22094.
- 53. Daïen C.I., Duny Y., Barnetche T. et al. (2012) Effect of TNF inhibitors on lipid profile in rheumatoid arthritis: a systematic review with meta-analysis. Annals of the rheumatic diseases, 71(6): 862–868. doi.org/10.1136/annrheumdis-2011-201148.
- 54. England B.R., Thiele G.M., Anderson D.R. et al. (2018) Increased cardiovascular risk in rheumatoid arthritis: mechanisms and implications. BMJ (Clinical research ed.), 361: k1036. doi.org/10.1136/bmj.k1036.
- 55. Zhao Q., Hong D., Zhang Y. et al. (2015) Association between anti-TNF therapy for rheumatoid arthritis and hypertension: a meta-analysis of randomized controlled trials. Medicine, 94(14): e731. doi.org/10.1097/MD.0000000000000731.
- 56. Singh S., Fumery M., Singh A.G. et al. (2020) Comparative Risk of Cardiovascular Events With Biologic and Synthetic Disease-Modifying Antirheumatic Drugs in Patients With Rheumatoid Arthritis: A Systematic Review and Meta-Analysis. Arthritis care & research, 72(4): 561–576. doi.org/10.1002/acr.23875.
- 57. Giles J.T., Sattar N., Gabriel S. et al. (2020) Cardiovascular Safety of Tocilizumab Versus Etanercept in Rheumatoid Arthritis: A Randomized Controlled Trial. Arthritis & rheumatology (Hoboken, N.J.), 72(1): 31–40. doi.org/10.1002/art.41095.
- 58. Kobayashi H., Kobayashi Y., Yokoe I. et al. (2018) Heart Rate-corrected QT Interval Duration in Rheumatoid Arthritis and Its Reduction with Treatment with the Interleukin 6 Inhibitor Tocilizumab. The Journal of rheumatology, 45(12): 1620–1627. doi.org/10.3899/jrheum.180065.
- 59. Kim S.C., Solomon D.H., Rogers J.R. et al. (2017) Cardiovascular Safety of Tocilizumab Versus Tumor Necrosis Factor Inhibitors in Patients With Rheumatoid Arthritis: A Multi-Database Cohort Study. Arthritis & rheumatology (Hoboken, N.J.), 69(6): 1154–1164. doi.org/10.1002/art.40084.
- 60. Gottenberg J.E., Morel J., Perrodeau E. et al.; French Society of Rheumatology and the investigators participating in AIR, ORA, and REGATE registries (2019) Comparative effectiveness of rituximab, abatacept, and tocilizumab in adults with rheumatoid arthritis and inadequate response to TNF inhibitors: prospective cohort study. BMJ (Clinical research ed.), 364: l67. doi.org/10.1136/bmj.l67.
- 61. Charles-Schoeman C., DeMasi R., Valdez H. et al. (2019) Risk Factors for Major Adverse Cardiovascular Events in Phase III and Long-Term Extension Studies of Tofacitinib in Patients With Rheumatoid Arthritis. Arthritis & rheumatology (Hoboken, N.J.), 71(9): 1450–1459. doi.org/10.1002/art.40911.
- 62. Ray K.K., Kastelein J.J., Boekholdt S.M. et al. (2014) The ACC/AHA 2013 guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular disease risk in adults: the good the bad and the uncertain: a comparison with ESC/EAS guidelines for the management of dyslipidaemias 2011. European heart journal, 35(15): 960–968. doi.org/10.1093/eurheartj/ehu107.
- 63. Okano T., Inui K., Tada M. et al. (2017) Loss of lean body mass affects low bone mineral density in patients with rheumatoid arthritis — results from the TOMORROW study. Modern rheumatology, 27(6): 946–952. doi.org/10.1080/14397595.2017.1289645.
- 64. Karpouzas G.A., Malpeso J., Choi T.Y. et al. (2014) Prevalence, extent and composition of coronary plaque in patients with rheumatoid arthritis without symptoms or prior diagnosis of coronary artery disease. Annals of the rheumatic diseases, 73(10): 1797–1804. doi.org/10.1136/annrheumdis-2013-203617.
- 65. van Sijl A.M., Peters M.J., Knol D.K. et al. (2011) Carotid intima media thickness in rheumatoid arthritis as compared to control subjects: a meta-analysis. Seminars in arthritis and rheumatism, 40(5): 389–397. doi.org/10.1016/j.semarthrit.2010.06.006.
- 66. Corrales A., González-Juanatey C., Peiró M.E. et al. (2014) Carotid ultrasound is useful for the cardiovascular risk stratification of patients with rheumatoid arthritis: results of a population-based study. Annals of the rheumatic diseases, 73(4): 722–727. doi.org/10.1136/annrheumdis-2012-203101.
- 67. Ikdahl E., Rollefstad S., Wibetoe G. et al. (2016) Predictive Value of Arterial Stiffness and Subclinical Carotid Atherosclerosis for Cardiovascular Disease in Patients with Rheumatoid Arthritis. The Journal of rheumatology, 43(9): 1622–1630. doi.org/10.3899/jrheum.160053.
- 68. Rudominer R.L., Roman M.J., Devereux R.B. et al. (2009) Independent association of rheumatoid arthritis with increased left ventricular mass but not with reduced ejection fraction. Arthritis and rheumatism, 60(1): 22–29. doi.org/10.1002/art.24148.
- 69. Rezuş E., Floria M., Grigoriu A. et al. (2015) Cardiovascular Risk Factors in Chronic Inflammatory Rheumatic Diseases: Modern Assessment and Diagnosis. Current vascular pharmacology, 13(6): 716–724. doi.org/10.2174/1570161113666150105112820.
Відомості про авторів:
Узун К.С. — завідувачка відділення невідкладної та інтервенційної кардіології, КНП «Обласна лікарня інтенсивного лікування м. Маріуполь», Київ, Україна.
E-mail: katerinauzun1991@gmail.com
ORCID ID: 0000-0001-6179-4324
Гнилорибов А.М. — доктор медичних наук, професор науково-навчального відділу Національного інституту серцево-судинної хірургії імені М.М. Амосова НАМН України, Київ, Україна.
ORCID ID: 0000-0001-5989-5548
Узун Д.Ю. — керівник Обласного центру кардіо- та рентгенендоваскулярної хірургії, м. Краматорськ, Україна.
ORCID ID: 0000-0002-9167-6430
Севастьянова Н.Є. — відділ променевої та функціональної діагностики з ультразвуковими дослідженнями клініко-діагностичного центру Державної наукової установи «Центр інноваційних технологій охорони здоров’я» Державного управління справами.
ORCID ID: 0000-0002-4946-8582
Кузеванова М.В. — кандидатка медичних наук, доцентка Національного університету охорони здоров’я України ім. П.Л. Шупика.
ORCID ID: 0000-0002-1383-5555
Потапов Ю.О. — кандидат медичних наук, доцент, Донецький національний медичний університет, м. Лиман, Україна.
ORCID ID: 0000 0003 1519 8374

Leave a comment