Тези Науково-практичної конференції «ВСЕУКРАЇНСЬКИЙ РЕВМАТОЛОГІЧНИЙ ФОРУМ–2024 З МІЖНАРОДНОЮ УЧАСТЮ», 23–25 жовтня 2024 р.
1. PECULARITIES Of DRUG THERAPY Of CORONARY ARTERY DISEASE In COMBINATIOn WITH POSTMENOPAUSAL OSTEOPOROSIS
N.S. Mykhailovska1, I.O. Stetsiuk2
1Department of general practice — family medicine and internal diseases
2Zaporizhzhia State Medical Pharmaceutical University Zaporizhzhia, Ukraine
Aim of the study. To evaluate the clinical effectiveness of the supplementary inclusion of a combination of sodium alendronate and L-arginine hydrochloride to a basic treatment in women with coronary artery disease (CAD) comorbid with postmenopausal osteoporosis (PMOP).
Investigation methods. The sub-sectional open, transverse, monocentric clinical study in parallel groups included 58 postmenopausal women with a diagnosis of CAD: stable angina pectoris of II-III functional class, and PMOP (mean age 71 (65; 77) years). Using the method of randomization, the patients were divided into two groups: 1 group consisted of 27 women who received standard basic therapy; group 2 included 31 women, who, in addition to basic therapy, were prescribed a combination of sodium alendronate and L-arginine hydrochloride according to the scheme. In all patients (before treatment and after 3 months of therapy), the level of biomarkers of bone (osteoprotegerin, osteocalcin) and vessel remodeling (homocysteine, VEGF-A) was assessed, additional ECG monitoring and heart echocardiography were performed.
Results. When compared the indicators of the structural and functional state of the heart and blood vessels, in patients of the 2nd group, after 3 months of treatment, a significant change in the size of the IMC of the right CCA was revealed by 7.95%, a change in the size of the LA by 16.83% if compared to the initial data (p<0.05). The dynamic study in two groups after 3 months of treatment revealed a significantly greater change in the size of the IMC of the right CCA in group 2 — by 5.68% (p<0.05), in LA size — by 6.22% (p<0.05).
After 3 months of monitoring the results of preliminary ECG monitoring in patients of group 2, there was a significant change in the number of tachycardia episodes per day (1.8 times; p<0.05), an increase in RMSSD (by 74.36%; p<0.05), decrease in LF (by 54.69%; p<0.05), increase in HF (by 73.71%; p<0.05). In both groups of patients there was a significant change in the number of episodes of supraventricular extrasystole per day (by 11.54% and by 34.52% respectively; p<0.05) and the correlation between LF/HF in active and passive period. Patients of the 2nd group if compared to those of the 1st group, after 3 months of treatment there showed fewer episodes of ventricular and supraventricular extrasystoles, a greater decrease in LF, and also a significantly greater increase in HF.
When assessing the level of bone and vascular biomarkers under the treatment in patients with CAD and PMOP, which received basic therapy, a significant decrease in the level of VEGF-A was observed (by 20.09%; p<0.05). In patients who received the combination therapy, there was a decrease in the level of VEGF-A (by 25.41%; p<0.05), as well as homocysteine (by 10.72%; p<0.05), osteoprotegerin (by 2 times; p<0.05). After 3 months of therapy, in patients of the 2nd group, if compared to the patients of the 1st group, osteocalcin, VEGF-A and osteoprotegerin levels were significantly lower.
Conclusions. In postmenopausal women who have a combined course of CAD and PMOP, the use of a combined treatment regimen has a positive effect on the condition of the endothelium and indicators of structural remodeling of the heart, on the processes of autonomic regulation of cardiac activity, and reduces the imbalance of bone and vascular biomarkers. Therefore, it is advisable to use the indicated treatment scheme in order to reduce the risk of developing cardiovascular complications and osteoporotic fractures in postmenopausal women.
2. STATE Of ENDOTHELIAL FUNCTIOn AND ITS CORRECTIOn In PATIENTS WITH RHEUMATOID ARTHRITIS
O.I. Palamarchuk, S.L. Podsevahina, I.M. Fushtey
Zaporizhzhia State Medical and Pharmaceutical University, Faculty of Postgraduate Education Department of internal diseases, Zaporizhzhia
Systemic inflammation and dysfunction of the immune system are among the leading factors in the development of cardiovascular pathology in rheumatoid arthritis (RA), and the endothelium is the primary target of inflammation mediators. The positive effectі of omega-3 polyunsaturated fatty acids (omega-3 PUFA) has been proven in many multicenter clinical studies, which have revealed a clear relationship between the level of intake of these acids in the human body and a decrease in morbidity and mortality from cardiovascular pathology, primarily from acute coronary syndrome and stroke. At present, it is of interest to assess their impact on such pathogenetic aspects as immune-inflammatory reactions and endothelial dysfunction in patients with systemic inflammatory diseases, in particular RA. There are data in the literature that ω-3 PUFAs participate in the metabolism of eicosanoids and effectively compete with ω-6 PUFAs for cyclooxygenase, and the ω-3 prostacyclin formed in this way is an active vasodilator, and ω-3 thromboxane practically does not activate platelet aggregation, which reduces the gene expression of adhesive molecules.
The goal of the present study was to investigate the effect of lipid-lowering therapy with additional use of omega-3 polyunsaturated fatty acids on endothelial function in patients with rheumatoid arthritis.
Material and methods. A total of 60 patients (25 men (41,7%) and 35 women (58,3%) aged (51,7 ± 2,9) years with seropositive RA were examined. The duration of RA disease was (8,8±1,2 years). Patients received methotrexate at a dose of (10,5 ± 2,5) mg/week in combination with folic acid as basic therapy. Subjects were divided into two groups. Group 1 included 30 patients who received a combination of Rosuvastatin (Crestor, AstraZeneca UK Limited, UK) 10 mg per day and ω-3 PUFA (Omacor, Abbott Laboratories GmbH, Germany) at a dose of 2.0 g/day in two doses as lipid-lowering therapy; Group 2 included 30 patients who received Rosuvastatin at a dose of 20 mg. Laboratory research methods included determination of total cholesterol (TC), low-density lipoproteins (LDL), high-density lipoproteins (HDL) and triglycerides (TG) using the enzymatic method with the use of reagent kits «HUMAN» (Germany). The level of endothelin (ET) — 1 in plasma was analyzed by the enzyme immunoassay method using the test systems of the company «Biomedica» (Austria). To study the function of the endothelium, Dopplerography of the brachial artery (BA) in the middle third was used according to the D.S. Celermajer method before and after occlusion with a tonometer cuff and sublingual administration of 500 mg of nitroglycerin with an assessment of the indices of endothelium-dependent (EDVD) and endothelium-independent (ENDVD) vasodilation. The presence of endothelial dysfunction was verified by a decrease in the indices of EDVD brachial artery less than 10% of the initial level. Statistical analysis of the obtained data was performed using parametric and non-parametric statistics on a personal electronic computer using Microsoft Excel software and «STATISTICA Version 6.0».
Results. Initially, type IIa dyslipidemia was diagnosed in 43,3% of patients, type IIb dyslipidemia was detected in 26,7%, and type IV dyslipidemia was detected in 30, 0%. Mono- and combined lipid-lowering therapy allowed achieving the recommended level of LDL-C (<2.5 mmol/l) in 83, 3% and 70% of patients in groups 1 and 2, respectively, after 12 weeks of treatment. A more significant reliable decrease in the content of TG in the blood serum of patients taking combined lipid-lowering therapy was noted after 12 weeks of treatment, and a significant increase in HDL in 53,3% of the 1st and in (40%) of the 2nd groups. An increase in the brachial artery diameter growth in response to a reactive hyperemia test in the dynamics of observation was noted in both study groups, but it was significantly (p<0,02) higher in patients of group 1 with combined lipid-lowering therapy than in those in group 2 with rosuvastatin monotherapy. Similar trends were noted in the dynamics of the brachial artery EDVD and PA ENDVD indices. The effect of rosuvastatin on the ET-1 level in group 1 was significant (22.6%, p < 0.01), but in group 2, with the use of low-dose combination therapy with the addition of ω-3 PUFA, the ET-1 indices decreased even more significantly and differed from the initial data with a high degree of reliability (34,8%, p < 0.001).
Conclusions. The use of combined hypolipidemic therapy with rosuvastatin and omega-3 polyunsaturated fatty acids (the drug «Omacor») allows to normalize the lipid profile in patients with RA, and more significantly (p<0,01) leads to a reliable decrease in the concentration of TG. A more pronounced re significant positive effect of such therapy on the function of the endothelium was revealed, which was manifested in a significantly increased vasodilatation and decreasing in vasoconstrictor function.
3. OSTEOPOROSIS IN PATIENT WITH SYSTEMIC SCLEROSIS: CROSS-SECTIONAL PILOT STUDY
C.Prassel1, T. Karasevska1, K. Mulyk1, O. Ivashkivskyi2, H. Novytska2, R. Potomka2, T. Tkachuk2, M. Dzhus1,2
1Bogomolets National Medical University, Kyiv, Ukraine
2Communal non-commercial enterprise «Svyato-Mikhailivska Clinical Hospital of Kyiv»
Introduction. Despite extensive studies on reduced bone mineral density (BMD) in patients with systemic sclerosis (SSc) in various international cohorts, the prevalence of osteoporosis (OP) among Ukrainian patients with SSc remains under investigation.
Objective. Our study aims to determine the prevalence of OP among patients with SSc, investigate potential risk factors associated with low BMD, and compare BMD in different parts of the skeleton to rheumatoid arthritis (RA) patients, well known as subjects with a high risk of bone loss.
Material and methods. A retrospective review of medical records from 2019 to 2024 was performed including 12 female patients with determined SSc and 30 age-matched female patients with RA who did not systemically use glucocorticoids. We evaluated the influence of age, BMI, and disease-related characteristics on developing of OP. BMD was measured of the total body (TB), femur neck (FN), lumbar spine (LS), and total radius (TR) by dual x-ray absorptiometry.
Results. The average age of the patients with SSc and RA did not differ (53,8±13,1 years and 56,2±15,8 respectively). The average disease duration was7,9±5,1 years in the SSc group and 7,3±4,8 years in patients with RA. BMI was 24,5±3,5 in the SSc patients and 25,6±5,2 in RA subjects. In the SSc group OP was identified on LS in 42,7% (5/12), FN — 50% (6/12). A negative statistically significant correlation was identified between BMD of FN and age (r = -0,67; p<0,005) but not with BMI for the SSc group. The BMD of FN in SSc does not differ statistically from RA (0,721±0,267 g/cm2 vs 0,733±0,176 g/cm2, p=0,142). Patients with RA have significantly lower BMD in TR (0,480±0,126 g/cm2 vs 0,630±0,265 g/cm2, p<0,005) while significantly lower BMD in SSc patients was in TB (0,830±0,181 g/cm2 vs 1,065±0,125 g/cm2, p<0,005) and LS (0,728±0,151 g/cm2 vs 1,066±0,195 g/cm2, p<0,005). No association was detected between BMD and SSc-related characteristics like disease duration, cutaneous subset (limited or diffuse), modified Rodnan skin score, presence of interstitial lung disease, or digital ulcers. The significantly lower BMD on FN was estimated in SSc patients with calcinosis in comparison with those who have not (0,478±0,178 g/cm2 vs 0,678±0,119 g/cm2, p<0,005).
Conclusion. High rates of OP were observed among patients with SSc, underscoring the importance of early screening and intervention. Age and the presence of calcinosis may serve as indicators of OP in SSc. However, the small sample size limits the generalizability of the findings. This suggests the necessity for larger, prospective studies to provide further validation of these results and to establish standardized guidelines for the screening of OP in patients with SSc in Ukraine.
4. КАРДІОРЕНАЛЬНІ ВІДНОСИНИ У ПІДЛІТКІВ З ЮВЕНІЛЬНИМ ІДІОПАТИЧНИМ АРТРИТОМ ТА ЗНИЖЕНОЮ ШВИДКІСТЮ КЛУБОЧКОВОЇ ФІЛЬТРАЦІЇ
Т.О. Головко1,2, Л.Ф. Богмат1, Н.С. Шевченко1,2, В.В. Ніконова1
1ДУ «Інститут охорони здоров’я дітей та підлітків НАМН України», Харків, Україна 2Харківський національний університет імені В.Н. Каразіна, Харків, Україна
Вступ. При ювенільному ідіопатичному артриті (ЮІА) на тлі генералізованого імунокомплексного запалення вже на перших етапах розвитку захворювання відбувається залучення різних органів і систем в патологічний процес з подальшим формуванням коморбідних станів. Доведено, що при тривалості захворювання понад 3 роки від початку відмічається зниження функції нирок та зміни з боку серцево-судинної системи. У 2004 р. робочою групою Інституту серця запропоновано термін «кардіоренальний синдром» (КРС), а в 2008 р. — його класифікацію, що включає 5 типів. П’ятий тип описує вторинний КРС і є характерним для системних захворювань інфекційного (сепсис) та неінфекційного (аутозапальні хвороби) походження.
Мета дослідження: встановити особливості співвідношення основних морфофункціональних показників серцево-судинної системи і нирок у дітей, хворих на ЮІА, зі зниженою функцією нирок.
Матеріали та методи: обстежено 41 дитину віком 10–18 (13,42±0,22) років з ЮІА та швидкістю клубочкової фільтрації (ШКФ) <90 мл/хв/1,73 м2, з них — 18 хлопців і 23 дівчини. Тривалість хвороби становила 60,91±8,69 міс. Поліартикулярний варіант діагностовано у 29 хворих, олігоартикулярний — у 22 осіб. Усі пацієнти отримували терапію метотрексатом (МТХ), середня доза якого становила 11,73±0,39 мг/м2 на тиждень, а також фолієву кислоту в половинній дозі від дози МТХ. Групу контролю склали 38 практично здорових дітей (9 хлопців, 29 дівчат) віком 14,72±0,28 року.
За допомогою кінетичного методу та використання біохімічного фотометра загального призначення «Cormey Multi» (Польща) встановлювали концентрацію креатиніну (за методом Яффе), а також розрахункову ШКФ за оригінальною формулою Schwartz для оцінки ШКФ у дітей з використанням сироваткового креатиніну.
Для визначення морфофункціональних параметрів серця проведено ультразвукове дослідження в М- та В-режимі (апарат LOGIO V2 General Electric (США), датчиком 3Sc-RS) за стандартною методикою. Визначалися наступні структурні параметри лівого (ЛШ) та правого (ПШ) шлуночків: кінцево-систолічний розмір (КСР ЛШ та КСР ПШ), кінцево-систолічний об’єм (КСО ЛШ та КСО ПШ), кінцево-діастолічний розмір (КДР ЛШ та КДР ПШ), кінцево-діастолічний об’єм (КДО ЛШ та КДО ПШ). Також визначалися функціональні показники обох шлуночків: фракція викиду (ФВ ЛШ та ФВ ПШ), ударний об’єм (УО ЛШ та УО ПШ), хвилинний об’єм крові (ХО ЛШ та ХО ПШ) з урахуванням частоти серцевих скорочень (ЧСС). Статистична обробка отриманих даних проводилася за допомогою пакету прикладних програм SPSS17 (ліцензія 4а180844250981ae3dae-s/nSPSS17). Розраховували середню арифметичну величину і стандартну до неї помилку. Порівняння показників проводили з аналогічними показниками підлітків групи контролю. Визначали також наявність кореляційних зв’язків (за допомогою парної кореляції Пірсона) між окремими показниками діяльності серця і нирок.
Результати: у пацієнтів з ЮІА рівень креатиніну був зіставним з аналогічним показником здорових підлітків (0,083±0,003 проти 0,084±0,021 ммоль/л, р<0,4), а рівень ШКФ — достовірно нижчим (79,63±1,90 проти 103,94±2,29 мл/хв/1,73 м2, р<0,001). При порівнянні структурних показників ЛШ серця встановлено достовірне збільшення КДР (4,05±0,11 проти 4,28±0,07 см, р<0,04) та КДО (73,42±4,61 проти 84,60±3,40 мл, р<0,02). Це супроводжувалося нижчими показниками функціональної здатності цієї порожнини (ФВ 66,84±0,98 проти 68,14±0,91%, р<0,04; УО 49,57±2,70 проти 57,86±2,64 мл, р<0,02).
При порівнянні морфофункціональних показників ПШ хворих на ЮІА з аналогічними показниками здорових підлітків виявлено більш значимі зміни, а саме: достовірне збільшення КСР (2,05±0,16 проти 1,57±0,05 см, р<0,001) та КСО (19,69±1,82 проти 10,18±1,14 мл, р<0,001), збільшення КДО (37,31±2,95 проти 22,45±2,10 мл, р<0,001). Це призвело до збільшення УО (17,62±1,35 проти 12,21±1,05 мл, р<0,001) з паралельним підвищенням ХО (1,40±0,11 проти 0,88±0,09 л/хв, р<0,001), що супроводжувалося зниженням ФВ (47,70±1,64 проти 56,06±1,59%, р<0,001). При проведенні кореляційного аналізу функції нирок та морфофункціональних показників у пацієнтів з ЮІА та зниженням ШКФ встановлено негативні кореляційні зв’язки високого ступеня між КРС ПШ та рівнем креатиніну (r=–0,81, p=0,03) та КСР ПШ і рівнем ШКФ (r=–0,89, p=0,02), а також позитивний зв’язок високого ступеня між ХО ПШ та ШКФ (r=0,91, p=0,03).
Висновки: у підлітків, хворих на ЮІА зі зниженою функцією нирок, встановлено ознаки дисфункції міокарда ПШ на тлі збільшення його об’ємів. Це може призводити до зниження кровозабезпечення нирок та формування у них вторинного кардіоренального синдрому.
5. ВИПАДОК ЕФЕКТИВНОГО РАННЬОГО КОМБІНОВАНОГО ЛІКУВАННЯ ГЛЮКОКОРТИКОЇДАМИ ТА МІКОФЕНОЛАТу МоФЕТИЛОМ ПАЦІЄНТА З АНТИСИНТЕТАЗНИМ СИНДРОМОМ
М.Б. Джус1,2, Т.А. Карасевська1, О.І. Івашківський2, Г.Л. Новицька2
1Національний медичний університет імені О.О. Богомольця, Київ, Україна 2Комунальне некомерційне підприємство «Свято-Михайлівська клінічна лікарня м. Києва», Україна
Вступ. Антисинтетазний синдром — це рідкісне захворювання, що характеризується інтерстиціальним захворюванням легень (ІЗЛ), неерозивним артритом, міозитом, феноменом Рейно та/або «рукою механіка», асоційоване з позитивними аутоантитілами, спрямованими проти аміноацил-тРНК синтетаз. Наявність ІЗЛ у пацієнтів з міозитом корелює з підвищеною смертністю, тому рання діагностика та призначення адекватного лікування вкрай важливі.
Мета роботи: продемонструвати випадок ефективного раннього комбінованого лікування глюкокортикоїдами та мікофенолату мофетилом пацієнта з антисинтетазним синдромом.
Опис клінічного випадку. Жінка віком 47 років поступила в лікарню в жовтні 2022 р. зі скаргами на сухий кашель, задишку, лихоманку та значне обмеження виконання повсякденної діяльності через м’язову слабкість. Стан хворої погіршувався протягом 4 тиж до госпіталізації, амбулаторно була призначена двічі антибіотикотерапія без ефекту. При клінічному огляді пацієнтка повільно рухається, не може самостійно встати з ліжка, піднятися сходами, не може утримувати верхні кінцівки у піднятому положенні; значна симетрична слабкість проксимальних м’язів; біль у м’язах при пальпації. При аускультації легень — двобічна крепітація та хрипи. SaO2 в межах 89–91%. При лабораторному обстеженні: швидкість осідання еритроцитів (ШОЕ) — 45 мм/год, С-реактивний білок (СРБ) — 43 мг/л, креатинфосфокіназа (КФК) — 1800 МО/л, аспартатамінотрансфераза (АсАТ) — 175 МО/мл, аланінамінотрансфераза (АсАТ) — 181 МО/мл, лактатдегідрогеназа (ЛДГ) — 570 МО/л; позитивні антитіла класу IgG до SS-A/Ro52 та антитіла класу IgG до гістидил-тРНК-синтетази (Jo-1). Детальне інструментальне обстеження виключило можливе онкологічне захворювання. На комп’ютерній томографії (КТ) органів грудної клітки (ОГК) виявлені ознаки двобічного ІЗЛ (рис. 1). Враховуючи наявність ІЗЛ, підтвердженого на КТ ОГК, міозиту та артриту, позитивність анти-SS-A/Ro52, Jo-1, був встановлений діагноз: антисинтетазний синдром.
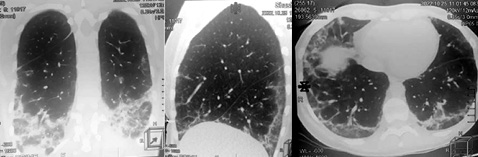
Призначене лікування: метилпреднізолон 1000 мг внутрішньовенно протягом 3 днів, з переходом на пероральний прийом метилпреднізолону 48 мг/добу та мікофенолату мофетил (ММФ) 2000 мг/добу. Через 4 тиж лікування було досягнуто клінічне та лабораторне покращення: нормалізація температури тіла, зменшення м’язової слабкості, задишки та кашлю, рівень СРБ знизився до норми, а рівень КФК — до 230 МО/л. Дозу метилпреднізолону протягом наступних 4 міс поступово знижували до 4 мг/добу. Через 6 міс лікування на КТ ОГК практично повна реституція легеневої паренхіми (рис. 2). Лікування триває підтримувальною дозою метилпреднізолону та ММФ.
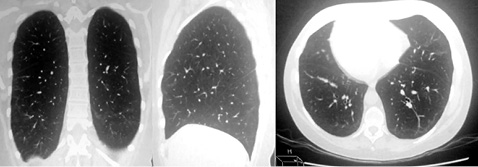
Висновок. Клініко-лабораторна ремісія, повне відновлення м’язової сили та дихальної функції при антисинтетазному синдромі досягнуті завдяки ранньому призначенню комбінованої терапії.
6. ШВИДКО ПРОГРЕСУЮЧА ТА МЕТОТРЕКСАТРЕЗИСТЕНТНА ВОГНИЩЕВА СКЛЕРОДЕРМІЯ (МОРФЕА): КЛІНІЧНИЙ ВИПАДОК
Л.В. Журавльова1, Ю.К. Сікало1, Т.І. Ховрат2, В.О. Федоров1, М.О. Олійник1
1Харківський національний медичний університет, Харків, Україна
2КНП «Обласна клінічна лікарня», Харків, Україна
Вогнищева склеродермія, або морфеа (Morphoea), є аутоімунним хронічним запальним захворюванням, яке характеризується фіброзом шкіри та прилеглих до неї тканин, що потенційно може призвести до функціональної інвалідності та косметичних проблем. Характеризується відсутністю проявів системного ураження внутрішніх органів, склеродактилії, феномену Рейно, змін капілярів нігтьового ложа, телеангіектазій. У рідкісних випадках склеродермічні ураження можуть швидко прогресувати, поширюватися на інші ділянки тіла і бути резистентними до стандартної терапії, що є прогностично несприятливою ознакою і потребує пошуку ефективних методів контролю над захворюванням.
Мета роботи — вивчення рідкісного кейсу вогнищевої склеродермії (морфеа).
Опис випадку. Пацієнтка І., віком 51 рік, звернулася зі скаргами на швидке прогресування змін шкіри (ущільнення, відчуття стягування та почервоніння) на верхніх та нижніх кінцівках впродовж останніх 2 років. Анамнез. Хвороба почалася восени 2022 р. з появи обмежених плям гіперемії, ущільнення та стягування шкіри нижніх кінцівок, набряку та болю в ділянці нижньої половини гомілок, стоп. За місцем проживання діагностовано системну склеродермію та призначено лікування метотрексатом (15 мг/тиж) та метилпреднізолоном (8 мг/добу). Протягом всього часу лікування і дотепер (1,5 року) відзначено збільшення площі ураження та розвиток нових вогнищ на верхніх кінцівках. В анамнезі вірусний гепатит В (1994). Менопауза з віку 41 рік.
При об’єктивному обстеженні — виражена поширена індурація та гіперпігментація шкіри передпліч, стегон, гомілок, стоп, почервоніння шкіри тилу стоп без вираженого свербежу чи болю (4 із 7 зон). Візуально кисті не змінені, артралгії при пальпації у ділянці дрібних суглобів кистей, функція в повному обсязі. Об’єктивних ознак системного ураження внутрішніх органів не виявлено.
Лабораторні дослідження: виявлено анемію легкого ступеня (Hb 118 г/л). Решта загальноклінічних та біохімічних показників функції внутрішніх органів та маркери запалення в межах норми. ANA-скринінг — негативний. НBsAg, Anti HCV — негативні. Тиреотропний гормон (ТТГ), вітамін D, показники Са/Р обміну, сечова кислота — в межах норми.
КТ ОГК, рентгенографія стравоходу, ультразвукове дослідження (УЗД) внутрішніх органів — без органічних змін. Спірометрія — помірні вентиляційні порушення за рестриктивним типом. Електрокардіографія (ЕКГ) — ознаки перевантаження правого передсердя. Капіляроскопія: змін капілярної архітектоніки, характерних для синдрому Рейно та системного захворювання сполучної тканини, не виявлено. Дерматологічна біопсія підтвердила діагноз вогнищевої склеродермії.
Встановлено клінічний діагноз: генералізована форма вогнищевої склеродермії, активна фаза, стадія ІІ (MRSS — 18 балів), з ураженням шкіри передпліч, стегон, гомілок, стоп (індурація, гіперпігментація).
Лікування. У зв’язку з неефективністю базисної терапії метотрексатом 15 мг/тиж у вигляді швидкопрогресуючого поширеного склеродермічного ураження шкіри нижніх та верхніх кінцівок, з метою контролю над захворюванням вирішено перейти на альтернативну терапію мофетилу мікофенолатом — 500 мг двічі на добу, та підтримувальну терапію метилпреднізолоном 4 мг/добу.
Висновок. В описаному кейсі у пацієнтки виключено системність ураження та шляхом біопсії підтверджено вогнищеву форму склеродермії. Встановлено, що швидке прогресування уражень шкіри асоційовано із неефективністю початкової 1,5-річної терапії метотрексатом. Вогнищева склеродермія, особливо у випадках швидкого прогресування та резистентності до традиційних методів лікування, потребує індивідуального підходу та ретельного спостереження. Застосування мофетилу мікофенолату може забезпечити позитивний ефект у контролі симптомів, проте важливо постійно оцінювати стан пацієнта й адаптувати терапію відповідно до змін у клінічному перебігу захворювання.
7. УРАЖЕННЯ НИРОК У ХВОРИХ З ГІПЕРУРИКЕМІЄЮ З РІЗНИМИ ТИПАМИ ЕКСКРЕЦІЇ
Я.О. Кармазін, О.М. Кармазіна
Навчально-науковий центр «Інститут біології та медицини» Київського національного університету імені Т.Г. Шевченка, КиївНаціональний медичний університет імені О.О. Богомольця, Київ
Вступ. Гіперурикемія — підвищення рівня сечової кислоти у крові понад 360 мкмоль/л у чоловіків та понад 320 мкмоль/л у жінок. До 5–12% осіб у світовій популяції мають підвишений рівень сечової кислоти в крові. Загальноприйнятим є виділення трьох форм гіперурикемії: метаболічної (внаслідок підвищення утворення сечової кислоти), ниркової (при порушенні виведення сечової кислоти із сечею) та змішаної. Причиною 90% серед усіх випадків гіперурикемії є зниження ниркової екскреції сечової кислоти.
Мета дослідження — оцінити характер та частоту ураження нирок (швидкість клубочкової фільтрації (ШКФ), наявність мікроальбумінурії та добової протеїнурії, сечокам’яної хвороби) залежно від рівня добової ниркової екскреції сечової кислоти.
Матеріали і методи. Обстежено 85 хворих з гіперурикемією (середній вік 54±7,7 року, чоловіків — 74%, жінок — 26%). Залежно від величини добової ниркової екскреції сечової кислоти хворі були розподілені на 2 групи. І група — 43 хворих з нормальною добовою екскрецією сечової кислоти (2981,16±556,22 мкмоль), ІІ група — 42 хворих зі зниженою екскрецією сечової кислоти (1381,27±380,5 мкмоль). Хворі І та ІІ груп були зіставні за віком, статтю, рівнем систолічного та діастолічного артеріального тиску, сечової кислоти у крові. В обох групах оцінювали характер та частоту ураження нирок (за ШКФ, наявністю мікроальбумінурії та рівнем добової протеїнурії, сечокам’яної хвороби). Статистична обробка — використовували параметричний критерій Ст’юдента, кореляційний аналіз (критерій Спірмена), різницю показників вважали достовірною при р<0,05.
Результати. При оцінці ШКФ (за формулою CKD-EPI) виявлено, що у хворих І групи вона становила 135,72±31,45 мл/хв, ІІ групи — 87,69±30,51 мл/хв, що на 35% менше порівняно з І групою (р>0,1), гіперфільтрація (ШКФ 168±7,9 мл/хв) виявлена у 8 (19%) хворих І групи. Мікроальбумінурія визначалася у 28 (65%) хворих ІІ групи та у 16 (38%) пацієнтів І групи. Добова протеїнурія в межах незначної (0,4–0,6 г) також частіше відмічалася у хворих ІІ групи (р<0,05).
Висновки. Отримані дані свідчать про тубулоінтерстиціальні ураження нирок, частота яких в ІІ групі була достовірно вищою (р<0,05). У хворих І групи частіше на 6% (p>0,05) виявляли сечокам’яну хворобу, що пов’язано з вищою вірогідністю кристалізації уратів у більш концентрованому розчині.
8. Клінічний випадок лікування хронічного рецидивуючого мультифокального (небактеріального) остеомієліту
С.О. Коваленко
ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини ім. акад. М.Д. Стражеска НАМН України», Київ, Україна
Вступ. Хронічний небактеріальний остеомієліт — це аутозапальне захворювання кісток, що переважно уражує дітей та підлітків, однак може виникати у всіх вікових групах. До його найтяжчої форми належить хронічний рецидивуючий мультифокальний остеомієліт, який за відсутності лікування може призводити до патологічних переломів, переважно тіл хребців.
Мета: презентувати клінічний випадок діагностики та успішного лікування хронічного рецидивуючого мультифокального остеомієліту.
Методи дослідження: з метою верифікації діагнозу та виключення інших хвороб використовувалися методи з визначення лабораторних маркерів запалення (С-реактивний білок (СРБ); швидкість осідання еритроцитів (ШОЕ)) та інструментальні дослідження (рентгенограми та магнітно-резонансна томографія (МРТ) в динаміці).
Результати: хронічний рецидивуючий мультифокальний остеомієліт найчастіше уражує метафізи / діафізи довгих кісток, кістки таза, хребці та ключиці. Рівень запальних маркерів зазвичай нормальний або злегка підвищений. Методи візуалізації мають головне значення для ранньої та диференційної діагностики та можуть виявити набряк кісткового мозку до того, як розвинуться остеолітичні або остеосклеротичні зміни.
Хвора віком 53 роки. Скарги на момент звернення: тривалий (близько 2 років) та інтенсивний (7–8 балів за візуальною аналоговою шкалою (ВАШ)) біль в нижній частині спини протягом доби, що не зменшується вночі / вранці та дещо посилюється при навантаженні. Біль виник гостро та не повʼязаний з травмою. Протягом періоду обстеження приймала нестероїдні протизапальні препарати (НПЗП) з помірним ефектом на початку застосування, який майже повністю зник через 3 міс прийому. Після виявлення на МРТ сакроілеїту до терапії (за місцем проживання) було додатково призначено сульфасалазин 2 г/добу та проведено (стаціонарно) введення глюкокортикоїдів (дози та кратність невідомі), яке майже не викликало ефекту. В анамнезі (7–8 років тому) був епізод тривалого болю з припуханням у груднинно-ключичному зʼєднанні, який не відповідав на протизапальну терапію та протягом року його вираженість самостійно зменшилася. Через відсутність відповіді на попередню терапію пацієнтку було переведено на комбінацію метотрексату і преднізолону, що також не викликало ефекту. Супутні захворювання: псоріаз.
Клінічне одужання було досягнуто після застосування ібандронової кислоти 3 мг внутрішньовенно — наступного дня після введення пацієнтка відмітила покращення стану та оцінила рівень зменшення вираженості болю на 95%. На цей час пацієнтка продовжує застосування препарату кожні 3 міс та має стійку ремісію.
Висновки. Набряк кісткового мозку (на МРТ) у хребцях та тазових кістках не завжди є ознакою спондилоартриту, а стійка неефективність протизапальних препаратів (НПЗП, глюкокортикоїди) може свідчити про інші (незапальні) механізми патологічного процесу.
9. КОМПЛЕМЕНТОПОСЕРЕДКОВАНІ ТРОМБОТИЧНІ МІКРОАНГІОПАТІЇ У ПАЦІЄНТІВ іЗ АНТИФОСФОЛІПІДНИМ СИНДРОМОМ
А.П. Кузьміна
Дніпровський державний медичний університет, Дніпро, Україна
За даними Міжнародної клінічної бази даних пацієнтів з антифосфоліпідним синдромом (АФС), у близько 10% aPL-позитивних хворих розвиваються мікроваскулярні захворювання (aPL-нефропатія, дифузний альвеолярний крововилив, ліведоїдна васкулопатія та серцевий мікротромбоз). Багато з цих мікросудинних проявів може бути важко визначити клінічно, оскільки вони потребують інвазивного тестування (такого як біопсія або бронхоскопія) для підтвердження, що призводить до затримок у лікуванні.
Мета дослідження: з’ясувати особливості клінічного мікроваскулярного АФС, що базуються на ураженні органів, тяжкості клінічної картини та відповіді пацієнта на втручання.
Матеріали та методи. За даними архівних матеріалів (25-річного спостереження), у більшості зі 120 пацієнтів із встановленим АФС відмічали тромбози й акушерські ускладнення. Кумулятивна частота рецидивів залежала від віку на період першого епізоду та профілактичних заходів при нагляді за такими пацієнтами. У майже 20% хворих відмічали мікроваскулярні прояви. При лікуванні різних мікроваскулярних проявів АФС застосовували антикоагулянтні й антитромбоцитарні засоби, глюкокортикоїди, останнім часом — мікофенолат та/або ритуксимаб.
Результати. Серед майже 20% пацієнтів з АФС помітними проявами мікросудинного ураження були Livedo racemosa (обстеження), ліведна васкулопатія, гостра / хронічна aPL-нефропатія, легенева кровотеча (симптоми та візуалізація), захворювання міокарда (візуалізація або патологія), адреналовий крововилив (візуалізація або патологія). З часом в окремих пацієнтів у рамках мікроваскулярних проявів змінювалася картина рецидиву. При скринінговому обстеженні серцевих проявів у ⅓ первинних пацієнтів з АФС виявлено прояви клапанних уражень. Трансторакальна ехокардіографія, проведена всім пацієнтам з АФС як на етапі скринінгу, так і при моніторингу стану пацієнта, забезпечила своєчасне втручання. У носіїв антитіл до фосфоліпідів з клінічними мікроваскулярними проявами відзначали більш високі рівні продуктів розщеплення комплемента Bb і sC5b-9. Мікросудинний тромбоз при АФС може виявлятися у вигляді потенційно летального катастрофічного АФС (КАПС), розвивається у носіїв гена aβ2GPI і спрямований до фактора (F)V, інгібує активацію останнього активованим FX (FXa) та/або конкуренцією з FXa за фосфоліпідзв’язувальні сайти комплексами антипротромбінові антитіла-протромбіни. На основі клінічних випадків зроблена спроба щодо підозри на гаммапатії тромботичного потенціалу високого ступеня (поліклонального або моноклонального).
Висновки. Мікроваскулярне ураження у пацієнтів з АФС відмічають майже у 20% (Livedo racemosa, ліведна васкулопатія, гостра / хронічна aPL-нефропатія, легенева кровотеча, захворювання міокарда, адреналовий крововилив). Знижені рівні комплемента С3 і С4 часто виявляють і потребують раннього розгляду діагнозу, щоб можливо було розпочати відповідне і своєчасне лікування. Підтвердження може бути особливо складним у тих, у кого не було відомо про наявність АФС до їх звернення. Тому нерегульована активація комплемента під впливом тригерних факторів (інфекція, хирургічне втручання, вагітність, субтерапевтична антикоагулянтна терапія тощо) вважається поштовхом для реалізації патогенезу хвороби. Лікування мікросудинного АФС залишається складним завданням через неоднорідні клінічні прояви та ураження органів.
10. ПРОЯВИ ТА НАСЛІДКИ, ПОВ’ЯЗАНІ З АНЦА-АСОЦІЙОВАНИМИ ВАСКУЛІТАМИ ТРЬОХ ФЕНОТИПІВ
А.П. Кузьміна
Дніпровський державний медичний університет, Дніпро, Україна
Носії антитіл до протеїнази-3 (PR3-AAV) і мієлопероксидази (MPO-AAV) трьох фенотипів не мають однакового генетичного фону і мають лише деякі спільні патофізіологічні механізми. Некротизуюче гранулематозне запалення є відмінною рисою гранулематозу з поліангіїтом (ГПА) і мікроскопічного поліангіїту (МПА) з порушенням регуляції нейтрофілів як центральної рухової сили хронічного запалення й аутоімунiтету.
Мета дослідження: визначити відмінності в прогнозі довгострокового контролю стану пацієнтів у рамках доменів васкулітів, асоційованих з антинейтрофільними цитоплазматичними антитілами (АНЦА).
Матеріали та методи. За період 2011–2021 рр. (в тому числі архівні матеріали) спостерігали пацієнтів з АНЦА-асоційованим васкулітом (середній вік 45 років). Серед пацієнтів з розвиненим ГПА (21), МПА (32), ЕГПА (12) під час першої атаки померли майже 25% (патологоанатомічна верифікація діагнозу: інтерстиціальна пневмонія, крововилив у мозок, інфекції тощо). Кумулятивна частота рецидивів за 3 роки захворювання була значно вищою у носіїв АНЦА (5 пацієнтів з перебігом, ускладненим туберкульозним процесом). Обстеження останніх 5 років включало визначення рівня інтерлейкіну (IL)-16 (ГПА, МПА) і IL-5 (ЕГПА) у сироватці крові. Проводили кореляцію рівня IL-16 з клінічними ознаками, такими як активність захворювання (BVAS-версія 3), індекс VDI і носійство PR3-ANCA. Лікування проводилося згідно з рекомендаціями Європейського альянсу ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR).
Результати: специфічність АНЦА передбачає відмінності в довгостроковому прогнозі: пацієнти з PR3-АНЦА мають вищий ризик рецидиву, ніж пацієнти з MPO-ANCA. Крім цього, специфічність АНЦА передбачає відповідь на індукційну терапію: ритуксимаб більш ефективний, ніж циклофосфамід, у пацієнтів з PR3- АНЦА (навпаки, обидва методи лікування однаково ефективні у пацієнтів з MPO- АНЦА). У пацієнтів трьох феноменів виявлялися 2 основних типи АНЦА. Останні визначалися відповідно до їх аутоантигенної мішені, а саме PR3 та MPO. Пацієнти з ГПА переважно є PR3-AНЦА-позитивними, тоді як пацієнти з MПA — переважно MPO-АНЦА-позитивними, хоча специфічність АНЦА лише частково перекривається цими клінічними синдромами. Специфічність АНЦА впливає на фенотип клінічного захворювання, а також на початкову реакцію пацієнта на терапію, що викликає ремісію, ризик рецидиву та довгостроковий прогноз. Традиційні фактори ризику рецидиву, такі як PR3-ANCA-асоційоване захворювання, фенотип ГПА та відсутність ураження нирок, також повинні враховуватися при оцінці загального ризику рецидиву.
Представлено випадки з клінічної практики довготривалого ефективного лікування.
Висновок: таким чином, класифікація АНЦА-асоційованого васкуліту за специфічністю AНЦА, а не за клінічним діагнозом може дати клінічно корисну інформацію на момент встановлення діагнозу. Прогнозування рецидиву, включаючи біомаркери (наприклад ANCA, CD19, CD27, сироватковий кальпротектин), корисні для визначення ризику рецидиву. Традиційні фактори ризику рецидиву, такі як PR3-ANCA-асоційоване захворювання, фенотип ГПА або МПА та відсутність ураження окремих органів (наприклад нирок), також слід враховувати при оцінці загального ризику рецидиву. Ризик рецидиву має бути збалансований з потенційними несприятливими наслідками триваючої таргетної терапії. Кожен фенотип АНЦА-асоційованого васкуліту та відсутність ураження окремих органів також мають враховуватися при оцінці загального ризику рецидиву.
11. САРКОПЕНІЯ У МОЛОДИХ ПАЦІЄНТІВ іЗ ЗАПАЛЬНИМИ АРТРИТАМИ
М.С. Кулик¹, Р.А. Потьомка², А.Л. Новицька², О.І. Івашківський², Т.А. Карасевська¹, Г.В. Мостбауер¹, керівник проєкту М.Б. Джус¹,²
1Національний медичний університет імені О.О. Богомольця, Київ, Україна
2Комунальне некомерційне підприємство «Олександрівська клінічна лікарня», Київ, Україна
Вступ. Саркопенія — це захворювання, що характеризується зниженням м’язової маси та м’язової сили або фізичної працездатності. Поширеність саркопенії при різних ревматичних захворюваннях зараз активно досліджується. Проте досі мало даних щодо поширеності саркопенії серед пацієнтів із запальними артритами молодого віку.
Мета. Дослідження спрямоване на вивчення поширеності саркопенії у молодих дорослих із запальним артритом (ЗА) та виявлення факторів, пов’язаних із низькою м’язовою масою та силою.
Матеріали та методи. Одноцентрове перехресне дослідження, яке включало молодих пацієнтів із ЗА (ювенільним ідіопатичним артритом (ЮІА), спондилоартритом (СпА) і ревматоїдним артритом (РА)) віком 18–44 роки і тривалістю захворювання більше 2 років. Критеріями виключення були цукровий діабет, ендопротезування, системний варіант ЮІА, вагітність та будь-яка тяжка супутня патологія, яка могла б вплинути на результат дослідження. Динамометрія за допомогою кистьового динамометра Jamar використовувалася для визначення сили стискання. Порогові значення для зниження м’язової сили становили <27 кг для чоловіків і <16 кг для жінок. Для визначення індексу апендикулярної знежиреної маси (ІАЗМ) проводили двохфотонну рентгенівську абсорбціометрію (ДРA) з такими пороговими значеннями: <5,67 кг/м² у жінок і <7,0 кг/м² у чоловіків. Пацієнти зі зниженою м’язовою масою та силою вважалися саркопенічними. Логістичний регресійний аналіз проводився для виявлення факторів, пов’язаних із саркопенією. Статистичну значущість визначали як р<0,05.
Результати. У дослідження включили 138 пацієнтів, яким проведено ДРА. Середній вік пацієнтів становив 28,5 року; 76 (55%) пацієнтів — жінки, 62 (45%) — чоловіки. У дослідженні брали участь 70 пацієнтів (50,7%) з ЮІА, 51 — зі СпА (37%) і 17 (12,3%) — з РА. Поширеність саркопенії становила 47% у всіх пацієнтів із ЗА. Поширеність саркопенії суттєво відрізнялася між групами і становила 57% у пацієнтів з ЮІА, 29% — із СпА та 59% — з РА (Chi², p=0,006). При багатофакторному аналізі індекс маси тіла (ІМТ) (відношення шансів (ВШ) 0,77; 95% довірчий інтервал (ДI) 0,66–0,89, p=0,001), мінеральна щільність кісткової тканини (МЩКТ) в ділянці шийки стегнової кістки (ВШ 0,02; 95% ДI 0,001–0,741, p=0,03), 25-гідроксивітамін D (25(OH)D) (ВШ 0,96; 95% ДI 0,93–0,98, p=0,001) та функціональна здатність за опитувальником оцінки стану здоров’я (Health Assessment Questionnaire — HAQ) (ВШ 11,1; 95% ДI 3,37–36,73, p=0,0001) були незалежно пов’язані з підвищеним ризиком саркопенії.
Висновок. Результати дослідження свідчать про високу поширеність саркопенії серед пацієнтів молодого віку із ЗА, що потребує подальших досліджень. Нижчий ІМТ, нижча МЩКТ, концентрація 25(OH)D і вищий бал за HAQ пов’язані із саркопенією.
12. ВПЛИВ АНТИГІПЕРТЕНЗИВНОЇ ТЕРАПІЇ НА ЯКІСТЬ ЖИТТЯ ПАЦІЄНТІВ іЗ ПОДАГРОЮ НА ФОНІ АРТЕРІАЛЬНОЇ ГІПЕРТЕНЗІЇ
О.М. Лазаренко, А.П. Кузьміна
Дніпровський державний медичний університет, Кривий Ріг, Україна
Мета. Оцінити ефективність антигіпертензивної терапії у лікуванні пацієнтів із подагрою на фоні артеріальної гіпертензії (АГ) на показники якості життя на етапі первинної ланки.
Матеріали та методи. Виділено дві групи пацієнтів із подагрою на фоні АГ. 1-ша група, 36 пацієнтів, які отримували лозартан (50–100 мг на добу залежно від ступеня АГ), алопуринол, аторвастатин. 2-га група, 36 осіб, які отримували раміприл (2,5–10 мг на добу залежно від ступеня АГ), алопуринол, аторвастатин. Усім пацієнтам із подагрою в стадії ремісії призначали алопуринол в стартовій дозі 100 мг на добу, з подальшим титруванням дози кожні 2–4 тиж та визначенням рівня сечової кислоти (СК) у крові до досягнення цільового рівня <360,0 мкмоль/л, а також колхіцин 0,5 мг на добу протягом 6 міс з метою профілактики загострення. Аторвастатин призначали в дозі 20 мг на добу з подальшим титруванням дози до досягнення цільового рівня холестерину ліпопротеїдів низької щільності. Діагноз подагри встановлювався згідно з критеріями Американського коледжу ревматології (American College of Rheumatology — ACR) та Європейського альянсу ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR) 2015 р. Якість життя оцінювали за допомогою загальної стандартизованої анкети SF-36. Оцінка функціонального статусу пацієнта здійснювалася з використанням опитувальника стану здоров’я HAQ-DI. Статистичний аналіз проводився за допомогою Statistica 6.1.
Результати. У 1-й групі пацієнтів більшість становили чоловіки (33 (91,7%)), як і в 2-й (32 (88,9%), р>0,05). Середній вік хворих 1-ї групи 50,0 (47,0–57,5) років, 2-ї — 57,0 (47,0–62,5) років, р>0,05. Тривалість подагри в обох групах — близько 4 років, тривалість АГ — 6 років, загальна кількість уражених суглобів — 6, кількість загострень подагри на рік — 4. Тобто до початку лікування між групами не встановлено статистично значущих відмінностей за статтю, віком, рівнем артеріального тиску, стадією та ступенем АГ, клінічними характеристиками подагри, індексом маси тіла, формою артриту, ступенем тяжкості подагри. У досліджуваних групах хворих оцінено показники якості життя пацієнтів до та після лікування. Встановлено, що до призначення лікування не відмічено достовірної різниці між групами за опитувальниками SF-36, HAQ-DI. У пацієнтів обох груп були знижені показники фізичного компоненту здоров’я (ФКЗ) та психологічного компоненту здоров’я (ПКЗ) за шкалою SF-36, зареєстровано більшу частку пацієнтів з мінімальним та помірним порушенням життєдіяльності за HAQ-DI. За результатами аналізу встановлено підвищення рівня якості життя після лікування за показником ФКЗ на 27,7% у 1-й групі та на 20,4% у 2-й групі (p<0,01), за показником ПКЗ — на 18,4 та 17,5% (p<0,01) відповідно. У 1-й групі збільшується частка хворих з мінімальними порушеннями та знижується — з помірними, а в 2-й групі — зростає поширеність мінімальних та помірних порушень, що свідчить про ефективність призначеної терапії. Вірогідне статистично значиме зниження показника HAQ-DI встановлено лише у хворих, які отримували раміприл, порівняно з вихідними даними до лікування на 33,3% (р<0,05). Можливо це пов’язано з тим, що результати бальної оцінки функціонального статусу пацієнта до лікування у 1-й групі були вищі 0,750 (0,250–1,000) (тяжчі порушення), ніж у 2-й 0,500 (0,375; 0,875), а частка пацієнтів з вираженими порушеннями життєдіяльності також була більшою у групі раміприлу (8,3%), а не лозартану (2,8%), саме тому після проведеного лікування цей показник достовірно покращився набагато більшою мірою у 2-й групі хворих, а не у 1-й.
Висновки. Антигіпертензивна терапія (лозартан або раміприл) протягом 6 міс у пацієнтів із подагрою на фоні АГ супроводжується достовірним покращенням якості життя за показниками ФКЗ (25,1%, p<0,01) і ПКЗ (17,7%, p<0,01) та ступеня життєдіяльності (25,0%, p<0,01).
13. Патологія серцево-судинної системи у пацієнтів жіночої статі з ревматоїдним артритом
В.Г. Левченко
ДУ «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені акад. М.Д. Стражеска НАМН України», Київ, Україна
Мета — удосконалення діагностики патології серцево-судинної системи (ССС) у пацієнтів із ревматоїдним артритом (РА).
Матеріали і методи. Обстежено 145 пацієнтів жіночої статі віком 40–65 років. З метою вивчення особливостей розвитку факторів серцево-судинного ризику (ССР), змін магістральних судин, показників ліпідного профілю залежно від віку обстежених пацієнтів з РА розподілили на вікові групи за критеріями ВООЗ: до 40 років — 52,4%, 45–60 років — 35,2%, старше 60 років — 12,4%. З метою визначення маркерів запального процесу та зв’язків з розвитком патології ССС пацієнтів розподілили на групи залежно від тривалості захворювання: до 5 років — 39,1%, 5–10 років — 37,1%, більше 10 років — 23,8%. У дослідженні використовували наступні методики: опитування, загальноклінічне, антропометричне, об’єктивне обстеження, анкетування та обчислення за шкалами-калькуляторами, визначення показників запального процесу, ліпідного профілю. З інструментальних методів дослідження використовували ультразвукове дослідження (УЗД) брахіоцефальних та периферичних судин із визначенням товщини комплексу інтима — медіа, наявності атеросклеротичних бляшок, морфологічних властивостей судин.
Результати. У 83,3% пацієнтів виявлено позитивний ревматоїдний фактор, 53,7% — позитивний результат антитіл до циклічного цитрулінового пептиду. Частота гіперхолестеринемії становила 43,8% з переважанням у пацієнтів із тривалістю хвороби більше 5 років (р=0,05). Рівні ліпопротеїдів високої щільності (ЛПВЩ) <1,0 ммоль/л зафіксовані у кожного п’ятого з обстежених пацієнтів. За даними розрахунку ССР за шкалою SCORE, у 48,6% відмічено низький, 41,9% — помірний, 9,5% — високий та дуже високий рівень. Застосування шкали mSCORE дозволило рекласифікувати 3,8% осіб до категорії дуже високого серцево-судинного ризику, а виявлення атеросклеротичних бляшок за допомогою УЗД — рекласифікувати 20% осіб до категорії дуже високого ризику. Серед традиційних факторів ССР у пацієнтів категорії високого / дуже високого ризику порівняно з низьким / помірним ризиком вірогідно вищими були показники рівня загального холестерину, тригліцеридів, ЛПНЩ, серед нетрадиційних факторів ССР — рівень С-реактивного білка (СРБ), ступінь активності за показником DAS28, кількість болючих суглобів, кількість набряклих суглобів. УЗД екстракраніальних судин показало, що товщина комплексу інтима — медіа більше 0,9 мм виявлена у 37,3% пацієнтів. У 59,7% пацієнтів зафіксовано кальциноз великогомілкових артерій (ВГА). Виявлено кореляційні зв’язки між наявністю кальцинозу ВГА із морфологічними змінами в сонних артеріях, наявністю атеросклеротичних бляшок, товщиною комплексу інтима — медіа >0,9 мм.
Висновки. У пацієнтів жіночої статі із РА найбільшою мірою пов’язані між собою наступні групи чинників розвитку високого / дуже високого ССР: рівень ЛПНЩ (р=0,05), СРБ (р=0,05), кількість набряклих суглобів (р=0,001), показник DAS28 (р=0,01), товщина комплексу інтима — медіа більше 0,9 мм (р=0,01).
14. Оптимізація оцінки серцево-судинного ризику та атеросклеротичних уражень судин у жінок, що хворіють на ревматоїдний артрит
В.Г. Левченко
ДУ «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені акад. М.Д. Стражеска НАМН України», Київ, Україна
Мета — удосконалення діагностики серцево-судинного ризику (ССР) у жінок, що хворіють на ревматоїдний артрит (РА).
Матеріали і методи. Обстежено 135 пацієнтів жіночої статі віком 40–65 років. З метою вивчення особливостей розвитку факторів ССР, змін магістральних судин, показників ліпідного профілю залежно від віку обстежених пацієнтів із РА розподілили на вікові групи за критеріями ВООЗ: до 40 років — 52,4%, 45–60 років — 35,2%, старше 60 років — 12,4%. З метою визначення впливу маркерів запального процесу та зв’язків з розвитком ССР пацієнтів розподілили на групи залежно від тривалості захворювання: до 5 років — 39,1%, 5–10 років — 37,1%, більше 10 років — 23,8%. У дослідженні використовували наступні методики: опитування, загально-клінічне, антропометричне, об’єктивне обстеження, анкетування та обчислення за шкалами-калькуляторами, визначення показників запального процесу, показників ліпідного профілю. З інструментальних методів дослідження використовували ультразвукову діагностику (УЗД) брахіоцефальних та периферичних судин із визначенням товщини комплексу інтима — медіа, наявності атеросклеротичних бляшок, морфологічних властивостей судин.
Результати. У 81,9% пацієнтів виявлено позитивний ревматоїдний фактор, 55,2% — позитивний результат антитіл до циклічного цитрулінового пептиду. Частота гіперхолестеринемії становила 43,8% з переважанням у пацієнтів із тривалістю хвороби більше 5 років (р=0,05). Рівні ліпопротеїдів високої щільності (ЛПВЩ) <1,0 ммоль/л констатовані у кожної п’ятої з обстежених.
За даними розрахунку ССР за шкалою SCORE, у 48,6% відмічено низький рівень, 41,9% — помірний, 9,5% — високий та дуже високий рівень. Застосування шкали mSCORE дозволило рекласифікувати 3,8% осіб до категорії дуже високого ССР, тоді як виявлення атеросклеротичних бляшок за допомогою УЗД — 20%. Серед традиційних факторів ССР у пацієнтів категорії високого / дуже високого ризику порівняно з низьким / помірним ризиком вірогідно вищими були показники рівня загального холестерину, тригліцеридів, ЛПНЩ, серед нетрадиційних факторів ССР — рівень С-реактивного білка (СРБ), ступінь активності за показником DAS28, кількість болючих суглобів, кількість припухлих суглобів (КПС). УЗД екстракраніальних судин показало, що товщина комплексу інтима — медіа >0,9 мм виявлена у 36,2% пацієнтів. У 59,0% пацієнтів встановлено кальциноз великогомілкових артерій (ВГА). Виявлено кореляційні зв’язки між наявністю кальцинозу ВГА із морфологічними змінами в сонних артеріях, наявністю атеросклеротичних бляшок, товщиною комплексу інтима — медіа >0,9 мм.
Висновки. У жінок, що хворіють на РА, найбільшою мірою пов’язані між собою наступні групи чинників розвитку високого / дуже високого ССР: рівень ЛПНЩ (р=0,05), СРБ (р=0,05), КПС (р=0,001), показник DAS28 (р=0,01), товщина комплексу інтима — медіа >0,9 мм (р=0,01), дифузний фіброз ВГА (р=0,04).
15. ПОШИРЕНІСТЬ САРКОПЕНІЇ ТА ПРЕСАРКОПЕНІЇ У ХВОРИХ НА РЕВМАТОЇДНИЙ АРТРИТ
А.О. Побережець, С.В. Шевчук
Вінницький національний медичний університет ім. М.І. Пирогова, кафедра внутрішньої медицини № 2, Вінниця, Україна
Вступ. Ревматоїдний артрит (РА) — це хронічне, аутоімунне запальне захворювання, яке характеризується ураженням суглобів, призводить до швидкої інвалідизації та значного погіршення якості життя. Постійне підвищення рівня прозапальних цитокінів у хворих на РА, обмеження фізичної активності та частий прийом глюкокортикоїдів можуть викликати ураження скелетних м’язів — саркопенію. Її поширеність серед хворих на РА коливається в межах 4–45%. Супутня саркопенія погіршує перебіг основного захворювання, підвищує ризик падінь та переломів, погіршує якість життя пацієнтів.
Мета: оцінити поширеність саркопенії та пресаркопенії у хворих на РА.
Матеріали і методи. У дослідження включено 64 хворих на РА (53 жінок (82%) та 11 чоловіків (18%)), середній вік яких становив (M±SD) 55,1±12,1 року, та 28 осіб контрольної групи, репрезентативних за віком та статтю. Середня тривалість захворювання становила 13,5±9,6 року. Діагноз РА встановлено згідно з критеріями Американського коледжу ревматології (American College of Rheumatology — ACR) та Європейського альянсу ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR) 2010 р. Оцінка скелетних м’язів проводилася згідно з рекомендаціями Європейської робочої групи з питань саркопенії в осіб похилого віку — EWGSOP2, 2019 р. Пресаркопенію діагностували при зниженні сили скелетних м’язів (сила стискання кисті <27 кг для чоловіків та <16 кг для жінок або тест «встати зі стільця» >15 с). Саркопенія встановлена при зниженні як сили скелетних м’язів, так і маси, яку оцінювали за допомогою двохенергетичної рентгенівської денситометрії (апендикулярна знежирена маса (АЗМ) <20 кг для чоловіків та <15 кг для жінок) або індекс АЗМ (<7,0 кг/м2 для чоловіків та <5,5 кг/м2 для жінок).
Результати. Дослідженням встановлено, що саркопенію відмічають у 29,7% хворих на РА (4 чоловіки та 15 жінок), тоді як серед осіб контрольної групи — у 3,6%. У групі жінок з РА та саркопенією середній індекс АЗМ становив 5,43±0,36 кг/м2, тоді як у жінок із РА без саркопенії — 7,24±0,92 кг/м2. Серед чоловіків відмічена подібна тенденція. Так, середній індекс АЗМ у чоловіків з РА та саркопенією порівняно з чоловіками з РА без саркопенії становив 7,17±0,2 кг/м2 проти 8,68±0,64 кг/м2 відповідно. У групі осіб із саркопенією середня тривалість захворювання була більшою та становила 19,3±9,1 року, тоді як у групі осіб без саркопенії — 11,1±8,7 року.
Пресаркопенія реєструвалась у 56,3% хворих на РА згідно з показниками сили стискання кисті та у 40,6% хворих на РА за даними тесту «встати зі стільця». Серед осіб контрольної групи пресаркопенія відмічена у 10,7 та 7,1% відповідно. Однак у 20,3% пацієнтів взагалі не вдалося виконати вимірювання сили стискання кисті.
Висновки. Супутня саркопенія відмічається у 29,7% хворих на РА. У пацієнтів із саркопенією відмічено нижчий середній індекс АЗМ та більшу тривалість захворювання. Поширеність пресаркопенії у хворих на РА варіює залежно від методу оцінки сили скелетних м’язів. Однак у кожного п’ятого хворого на РА неможливо адекватно оцінити силу стискання кисті через виражений больовий синдром та деформацію суглобів кистей внаслідок основного захворювання.
16. ВПЛИВ ПРИЙОМУ ХОЛЕКАЛЬЦИФЕРОЛУ В РІЗНИХ ДОЗУВАННЯХ НА ПОКАЗНИКИ КАЛЬЦІЙ-ФОСФОРНОГО ОБМІНУ ТА ПОПОВНЕННЯ РІВНЯ ВІТАМІНУ D
С.Л. Подсевахіна, О.С. Чабанна, О.І. Паламарчук
Запорізький державний медико-фармацевтичний університет, Навчально-науковий інститут післядипломної освіти, Запоріжжя, Україна
Мета дослідження — оцінити ефективність прийому препаратів, які містять вітамін D, у різних дозуваннях з оцінкою рівня 25-гідроксихолекальциферолу (25(ОН)D) та його вплив на показники кальцій-фосфорного обміну.
Методи дослідження. Проведено обстеження 62 осіб із остеоартритом (ОА) у поєднанні з хронічною серцевою недостатністю (ХСН) зі збереженою фракцією викиду (ФВ >50%) I–II функціонального класу (32 жінки та 30 чоловіків), середній вік яких становив 57,1±5,4 року, яка розвинулася на тлі ішемічної хвороби серця та/або артеріальної гіпертензії. Методом імуноферментного аналізу визначали вміст у плазмі крові загального вітаміну D (25(OH)D total). Вміст 25(ОН)D у плазмі крові, згідно з Kонсенсусом українських експертів від 2023 р. розцінювався як оптимальний в межах >30–50 нг/мл, як недостатній — ≥20 нг/мл та <30 нг/л, дефіцит вітаміну D — <20 нг/мл і <10 нг/мл — як виражений дефіцит. Проводили визначення загального кальцію (Ca) та фосфору (P) у плазмі крові та в ранковій порції сечі. Крім того, розраховували співвідношення Са/Р у крові, Са/Р у сечі, Р у сечі/Р у крові, Са у сечі/Са у крові. Для оцінки ефективності поповнення дефіциту / недостатності вітаміну D за різних режимів дозування холекальциферолу пацієнти були розподілені на три групи. Пацієнтам I групи (n=21) на додаток до комплексної патогенетичної терапії ОА та ХСН рекомендовано прийом холекальциферолу в дозі 5600 МО щоденно, пацієнтам II групи (n=20) 2000 МО щоденно. III група (порівняння) (n=21) отримувала лише комплексну патогенетичну терапію основних захворювань без додаткового введення холекальциферолу. Усім пацієнтам були надані рекомендації щодо збільшення часу перебування на вулиці в денний час та вживання продуктів харчування, багатих на вітамін D.
Результати. У всіх пацієнтів рівень вітаміну D був нижчим за оптимальні значення, з них у 72% пацієнтів відзначали недостатність, а у 28% — дефіцит вітаміну D. Початково недостатність та дефіцит вітаміну D зафіксовано у 65,7 та 34,3% пацієнтів I групи (14,4 (7,4–22,1) нг/мл), 72,5 та 27,5% II групи (16,5 (9,2–23,7) нг/мл) та 75,6 та 24,4% у групі порівняння (17,1 (8,4–25,8) нг/мл). У I групі дефіцит вітаміну D виявляли частіше (р=0,04), а недостатність — рідше (р=0,03), ніж у ІІ та ІІІ групах. Після проведеного лікування в І групі через 3 міс показник 25(OH)D досяг оптимального рівня у 88,7% осіб (37,7 (29,6–45,8) нг/мл), що було більше, ніж у ІІ групі — 52,6% (29,8 (26,3–33,4) нг/мл) (р=0,04) та групі порівняння — 20,6% (25,6 (20,8–30,4) нг/мл) (р=0,0006). Динаміка 25(OH)D також була найбільшою у I групі і достовірно більшою, ніж у II групі (р=0,02) та групі порівняння (р=0,00003). На початку дослідження не виявлено статистично значущої залежності між розподілом за рівнем Са та Р у крові (гіпо, гіпер- або нормокальціємія) та після проведеної терапії. Це підтверджується і результатами порівняння показників динаміки рівня Са та Р у плазмі крові (р>0,05 у всіх варіантах порівнянь). Динаміка рівня Са у сечі при терапії холекальциферолом була негативною, тобто рівень Са у сечі після 3-місячної терапії з додаванням холекальциферолу мав тенденцію до зниження, проте всі відмінності за величиною динаміки вмісту Са у сечі між групами були недостовірними. Динаміка рівня Р у крові достовірно не відрізнялася (p>0,05). Відповідно, можна говорити про те, що рівень Р у крові, так само як і рівень Са в крові, не змінюється при різному режимі дозування вітаміну D протягом 3 міс.
Висновки. Прийом холекальциферолу протягом 3 міс в дозі 5600 МО/добу зумовлює оптимізацію рівня вітаміну D у 88,7% випадків, у дозі 2000 МО/добу — у 52,6% випадків. Корекція рівня 25(OH)D лише за рекомендації щодо збільшення часу перебування на вулиці в денний час та вживання продуктів харчування, багатих на вітамін D, у групі порівняння зумовила оптимізацію рівня вітаміну D у 20,6% хворих. Аналіз показників обміну Са та Р вказує на безпеку прийому холекальциферолу в дозі 5600 та 2000 МО/добу протягом 3 міс, а також опосередковано підтверджує відсутність передозування вітаміну D.
17. ВИБІР ЕЛЕКТИВНИХ КУРСІВ З ПИТАНЬ РЕВМАТОЛОГІЇ ІНОЗЕМНИМИ СТУДЕНТАМИ-МЕДИКАМИ КИЇВСЬКОГО МЕДИЧНОГО УНІВЕРСИТЕТУ
О.В. Поканевич, Б.Б. Івнєв, В.В. Батушкін, О.Г. Пузанова
ПВНЗ «Київський медичний університет», Київ, Україна
Необхідність удосконалення безперервного професійного розвитку лікарів на всіх етапах, починаючи з додипломного, визнано скрізь у світі. Основи ревматології є складним для опанування елементом навчальної дисципліни «Внутрішня медицина». Результати їх вивчення суттєво залежать від якості викладання, рівня мотивації майбутніх лікарів і врахування їх освітніх потреб. Зокрема, студентів залучають до формування курикулумів шляхом вибору елективних курсів (ЕК). Потребу іноземних студентів-медиків українських закладів вищої освіти в поглибленому вивченні питань ревматології дотепер не вивчено.
З метою її характеристики в Київському медичному університеті (КМУ) проведено перехресне медико-соціологічне дослідження — опитування за допомогою спеціально створеної Google-форми 158 студентів-медиків міжнародного факультету англомовної форми навчання (6-го курсу — 130, 5-го — 28), які у 2023/2024 навчальному році вивчали внутрішню медицину на кафедрі внутрішніх та професійних хвороб в одного й того самого викладача. Їх відповіді щодо вибору тем ЕК досліджено в розрізі віку, статі, курсу навчання, поточної академічної успішності з дисципліни та країни походження. Запропоновано ЕК «Основи діагностики ревматичних захворювань (РЗ)», «РЗ в літньому віці», «Основи геріатрії», «Доказовий підхід у клініці внутрішніх хвороб» і «Інше (ваша пропозиція)». Участь у дослідженні була добровільною. Запрошення одержали студенти з 20 країн трьох основних регіонів: Південної Азії (Індії, Пакистану, Шрі-Ланки), Африки (Нігерії, Гани, Танзанії, Есваті, Замбії, ПАР, Камеруну, Кенії), Західної Азії (Ізраїлю, Ірану, Іраку, Туреччини, Ємену), а також із США, Великобританії, Данії і Фінляндії.
Використано методи системного й доказового підходів, інформаційного аналізу, експертних оцінок, математичної статистики.
Результати. Коефіцієнти відгуку на анкету були високими (100; 95,4; 96,2%): відповіді надали всі 5-курсники, 124 6-курсники, загалом 152 особи. Студенти обирали від 1 до 5 ЕК. Альтернативні теми пропонували лише 6-курсники (кожен 9-й з них — 11,3%, усі з Індії і Нігерії), і вони не стосувалися РЗ. Поглиблене вивчення питань ревматології цікавило студентів незалежно від віку, статі й середнього балу поточної успішності, але частка таких відрізнялася серед респондентів із різних країн, 5- й 6-курсників. У загальній вибірці ЕК «Основи діагностики РЗ» обрали 54,6% осіб, «РЗ в літньому віці» — 44,7%. Ці теми були пріоритетними на 5-му курсі: щойно завершивши вивчення змістового модулю з ревматології і нефрології, ЕК «Основи діагностики РЗ» обрали 60,71% студентів, «РЗ в літньому віці» — 46,43%, причому більшість (72,73%) тих, хто вчився на «відмінно», обрали лише один ЕК — і саме з питань ревматології. 5-курсників з країн Південної Азії частіше цікавила діагностика РЗ, ніж їхні вікові аспекти (100,00 vs 57,14%), а студенти з Африки обирали ці теми однаково часто (загалом по 50,00%, студенти з Гани — по 70,00%). У цілому майбутні лікарі з Африки (n=72) надали перевагу ревматологічним ЕК перед «більш інтегральними» ЕК з геріатрії і доказового підходу в терапевтичній клініці. Остання тема була найпопулярнішою серед усіх 63 студентів із Індії (60,32%) і в загальній когорті (59,2%). І геронторевматологія, і геріатрія цікавили всіх студентів із Ізраїлю, але загалом хвороби літнього віку привернули увагу лише ⅓ опитаних.
Висновок. Поглиблене вивчення питань ревматології цікавить близько половини іноземних студентів-медиків старших курсів КМУ. Вибір ЕК студентами пов’язаний з їх роком навчання в університеті (змістом курикулуму в поточному навчальному семестрі, загальним рівнем компетентності тощо) і має регіональні особливості. З урахуванням старіння глобальної популяції необхідно формувати потребу майбутніх лікарів у вивченні вікасоційованих захворювань, зокрема ревматичних.
18. Оцінка поширеності серцево-судинної патології у пацієнтів із СЧВ
Г.О. Проценко, В.В. Дубас
ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини ім. акад. М.Д. Стражеска НАМН України», Київ, Україна
Мета. Оцінити поширеність та фактори ризику серцево-судинних захворювань у хворих на системний червоний вовчак (СЧВ)та порівняти отримані результати з літературними даними.
Матеріали і методи. Проведено ретроспективний аналіз медичної документації 160 хворих на СЧВ, що проходили лікування у ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені акад. М.Д. Стражеска НАМН України» у 2011–2023 рр. Порівнювали частоту клінічних проявів (методом Хі-квадрат) та кількісні характеристики (критерій Манна — Уїтні) у пацієнтів з СЧВ, у яких розвинулося чи не розвинулося певне ураження серцево-судинної системи. Різницю вважали достовірною при р<0,05.
Результати. Проаналізовано дані 160 пацієнтів, з яких 135 (84,4%) жінок та 25 чоловіків (15,6%). Середній вік пацієнтів на момент дебюту СЧВ становив 28,4±0,87 року. Середня тривалість захворювання — 8,7±0,7 року. Артеріальна гіпертензія (АГ) розвинулася у 40 пацієнтів (25%); ішемічна хвороба серця — у 2 (1,3%), інфаркт міокарда — 1 (0,6%); гостре порушення мозкового кровообігу — 6 (3,8%); гіперхолестеринемія, що потребувала медикаментозної корекції, — 12 (7,5%); серцева недостатність ІІА стадії — у 3, ІІБ — у 1; порушення серцевого ритму — 16 (10%, надшлуночкові — 13; атріовентрикулярної провідності — 1; шлуночкові — 2); ендокардит Лімбана — Сакса — 2 (1,3%). Виявлено, що у групі пацієнтів з АГ достовірно частіше виявляють люпус-нефрит (p<0,001).
Висновки. Отримані дані щодо поширеності серцево-судинних захворювань серед пацієнтів з СЧВ є зіставними з літературними даними. Серед клінічних проявів ураження нирок асоціюється з вищою частотою розвитку АГ.
19. ВИПАДОК IgG4-ЗАЛЕЖНОГО ЗАХВОРЮВАННЯ у ПАЦІЄНТА МОЛОДОГО ВІКУ З ВРОДЖЕНОЮ СУДИННОЮ МАЛЬФОРМАЦІЄЮ
О.Г. Пузанова1, Л.Г. Карпович2
1ПВНЗ «Київський медичний університет», Київ, Україна
2Національний медичний університет імені О.О. Богомольця, Київ, Україна
Особливості IgG4-залежного захворювання (IgG4-ЗЗ) в молодому віці описані мало, в разі вроджених судинних мальформацій (ВСМ) невідомі. ВСМ були причиною збільшення органу за підозри на IgG4-ЗЗ, але гострішу проблему становить відмова від біопсії за наявності ВСМ: це знижує точність діагнозу IgG4-ЗЗ до «можливого». Частка такого в деяких країнах сягає 39%. Ранні стадії IgG4-ЗЗ й зумовлені ним васкулопатії і ретроперитонеальний фіброз (РПФ) нерідко є серонегативними за IgG4 і маркерами запалення. Це підвищує діагностичну цінність методів візуалізації, зокрема позитронної емісійної томографії (ПЕТ) з 18F-фтордеоксиглюкозою (ФДГ), яка дозволяє відрізнити злоякісний РПФ від ідіопатичного, а за поєднання з комп’ютерною (КТ) чи магнітно-резонансною томографією (МРТ) виявити і запалення, і структурні зміни судин.
Мета — розвиток уявлень про ранній дебют і судинну коморбідність васкуло-IgG4-ЗЗ.
Методи. Пацієнт віком 28 років з діагнозами ВСМ лівої здухвинної ділянки й попереку, пахвової лімфаденопатії зліва, гемангіом і перицитом різної локалізації, інфільтративного утворення заочеревинного простору й підозрою на артеріїт Такаясу (АТ) з ураженням черевної аорти та її гілок обстежений за допомогою методів клінічної, лабораторної і візуалізуючої діагностики відповідно до сучасних настанов з васкулітів крупних судин, класифікаційних критеріїв АТ і IgG4-ЗЗ, діагностичних критеріїв IgG4-ЗЗ (уніфікованих і органоспецифічних для хронічного періаортиту, періартеріїту й РПФ) та протоколу клініки Мейо. Здійснено аналіз його медичної документації за 1996–2024 рр. і комплексну оцінку візуалізаційних досліджень. Пошук аналогів проведено в базі даних PubMed і пошуковій системі Google та доповнено контент-аналізом першоджерел. Для встановлення діагнозу й лікування використано доказовий та індивідуальний підходи.
Результати. Виокремлено специфічні клінічні ознаки ВСМ (полум’яний невус спини й гіпертрофія нижньої кінцівки, що з’явилася у віці 10 років, — як і пахвова лімфаденопатія) та КТ- і ПЕТ-ознаки доброякісного характеру судинної «муфти» (здатність до дифузії контрасту, гіповаскулярність, відсутність інвазії; незначно збільшене захоплення ФДГ), розціненої за виявлення у віці 22 роки як «гемангіома, перицитома» інфраренальної аорти та лівих a. iliaca communis, а. iliaca externa і а. renalis (неоднорідний МР-сигнал з чіткими нерівними контурами, підсилений в режимах Т2 і T2FatSat, ізогіперінтенсивний в Т1). Описано 5-річну динаміку скіалогічних змін за відсутності терапії і нових клінічних проявів: поширення «муфти» товщиною 4–28 мм вздовж аорти на truncus coeliacus; зникнення звуження просвітів aa. iliacae communes і аорти біля її біфуркації та пієлоектазії лівої нирки; ущільнення клітковини й зменшення лімфовузлів пахвової ділянки з 31х22 до 11х13 мм. ПЕТ/КТ довела запальний характер і лімфаденопатії (підсилений захват ФДГ: SUVmax 1,1), і утворення заочеревинного простору (патологічне накопичення ФДГ з SUVmax 1,2). У крові вміст С-реактивного білка 0,35 мг/л, IgG4 71,4 мг/дл, 25-(ОН)D 11,9 нг/мл. Обґрунтовано діагноз IgG4-ЗЗ. Припущено: вік дебюту 10–22 роки; висхідний тип уражень судин, починаючи зі здухвинних; патогенетичну роль алергії, рецидивів бешихи, дефіциту вітаміну D; залишковий тип запалення в ретроперитонеумі. Визначено доцільність монотерапії глюкокортикоїдами — за відсутності дилатації аорти й інших чинників стероїдорезистентності.
Висновок. У молодому віці можливий дебют IgG4-ЗЗ за типом серонегативного періартеріїту гілок черевної аорти, її періаортиту і РПФ. У разі ВСМ підозрілими щодо зв’язку з IgG4-ЗЗ є запальні лімфаденопатії, аортопатії та РПФ. Для їх діагностики корисною є ФДГ-ПЕТ/КТ. Описаний випадок не має прототипів і розвиває концепції васкуло-IgG4-ЗЗ і коморбідності в ревматології.
20. Постковідний артрит та асоційований з вовчаковим антикоагулянтом реактивний поствірусний артрит
А.В. Романовський
ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини ім. акад. М.Д. Стражеска НАМН України», Київ, Україна
Мета роботи. Провести аналіз випадків постковідного артриту (ПКА) та асоційованого з вовчаковим антикоагулянтом (ВА) реактивного поствірусного артриту (АВАРПА), встановити їх характерні риси та відмінності від інших ревматологічних нозологій, розробити методи профілактики та лікування цих клінічних синдромів.
Матеріали та методи. У дослідження, що проводилося з 01.2023 до 09.2024 р., включено 32 особи (середній вік — 46±14 років), серед них — 17 жінок (середній вік — 40±13 років) та 15 чоловіків (середній вік — 46±15 років) з випадками артриту, що виникли протягом 3 міс як після лабораторно підтвердженого епізоду COVID-19 — 10 епізодів (середній вік — 47±12 років) ПКА, так і 22 епізоди (середній вік — 45±19 років) АВАРПА, з типовим клінічним синдромом: виражений набряк навколосуглобових тканин, що значно поширюється за межі суглобової ділянки, з наявністю лабораторних критеріїв: лімфоцитоз, позитивність за ВА, підвищення Д-димеру (Д-Д) та RNP-70 аутоантитіл (таблиця), що має ознаки постковідного синдрому за даними міжнародних наукових публікацій.
Отримані результати. Оцінювалися випадки вищевказаних артритів за період з січня 2023 до вересня 2024 р. Виявлено чітку сезонність епізодів спостереження артриту: з червня по жовтень 2023 — жодного епізоду звернення з приводу цього синдрому.
У лікуванні у всіх пацієнтів застосовували метилпреднізолон у дозі 4 мг/добу та вітамін D у дозах 2000–6000 МО/добу, що у всіх випадках дало швидку клінічну відповідь — виражене зменшення всіх проявів артриту. Термін лікування всіх завершених епізодів тривав 1–3 міс. Необхідності у призначенні антикоагулянтної терапії не виникало. За оцінкою нових випадків, у динаміці на фоні оцінки випадків артриту у лютому–вересні 2024 р. зменшився період між епізодом гострої респіраторної вірусної інфекції (ГРВІ) та початком артриту.
Висновок. ПКА та АВАРПА виникають через 1–2 міс після епізоду вірусної інфекції, мають типові клінічні ознаки: набряк навколосуглобових тканин, що значно поширюється за межі суглобової ділянки, значне підвищення ШОЕ, СРБ, лімфоцитоз у загальному аналізі крові, підвищення Д-Д, позитивність за RNP-70 та недостатність вітаміну D, відповідає на лікування метилпреднізолоном та вітаміном D, не потребує призначення антикоагулянтів та закінчується одужанням протягом 3 міс на фоні вказаного лікування. У динаміці на фоні оцінки випадків артриту у лютому–вересні 2024 р. зменшився термін між епізодом ГРВІ та початком артриту.
21. ЧАСТОТА ПОЗАСУГЛОБОВИХ ПРОЯВІВ У ОСІБ ІЗ ЗАПАЛЬНИМ ТА МЕХАНІЧНИМ ХАРАКТЕРОМ БОЛЮ У СПИНІ
А.О. Сидорова, О.Б. Яременко, А.В. Гончар
Національний медичний університет імені О.О. Богомольця, Київ, Україна
Медичний центр «Універсальна клініка «Оберіг», Київ, Україна
Мета. Визначити поширеність позасуглобових проявів у осіб із запальним і механічним характером болю в спині. Методи. Проанкетовано 2007 дорослих осіб без раніше встановленого діагнозу спондилоатриту (СпА) за допомогою опитувальника, що включав 40 запитань щодо болю в спині, його особливостей, тривалості, наявності супутніх симптомів. Запальний характер болю в спині визначався відповідно до критеріїв ASAS (2009). Група опитаних пацієнтів включала 1234 жінки та 773 чоловіки з середнім віком 40,3±16,3 року. Для перевірки зв’язку використовували критерій хі-квадрат (різницю вважали достовірною при p<0,05).
Результати. Про проблеми зі спиною (дискомфорт, біль, скутість) будь-коли повідомили 95,4% респондентів, а хронічний біль у спині відзначили 33,5% опитаних. Відповідність ≥4 з 5 критеріїв ASAS зафіксовано у 9,4% респондентів. Пацієнти з обома видами больового синдрому в спині (механічний та запальний) з однаковою частотою зверталися до лікаря (близько 50%). Серед основних позасуглобових проявів, за якими відрізнялись ці групи пацієнтів, були біль у сідницях та реберно-м’язовій частині грудної клітки, які достовірно частіше виявляли в осіб із болем у спині (таблиця). Різниці у частоті ірадіації болю в сідницях нижче коліна (8,5% у групі запального vs 9,8% у групі механічного болю) не виявлено. Частота офтальмологічних проявів (кон’юнктивіт, склерит, увеїт, ірит) та можливих інфекційних чинників (уретрит, діарея) також не відрізнялася в обох групах. Псоріаз у власному або сімейному анамнезі, біль у п’ятах, болючий набряк усього пальця відзначали з однаковою частотою. Близько половини пацієнтів обох груп приймали нестероїдні протизапальні препарати (НПЗП) для усунення болю у спині.
| Запальний біль, % | Механічний біль, % | p | |
|---|---|---|---|
| Біль у сідницях | 31,4 | 21 | p<0,05 |
| Біль у реберно-м’язовій частині грудної клітки | 40 | 27 | p<0,05 |
| Болючий набряк всього пальця (дактиліт) | 18,6 | 16,4 | р=0,42 |
| Біль у п’ятах | 17 | 22,1 | р=0,16 |
| Псоріаз у себе або родичів | 3,2 | 3,9 | р=0,8 |
| Прийом НПЗП | 52,7 | 46 | р=0,17 |
| Склерит, ірит, увеїт відповідно | 3,2; 1,6; 0 | 1,9; 1; 0,9 | p>0,05 |
| Кон’юнктивіт | 18,6 | 22,2 | р=0,3 |
Висновки. Біль, дискомфорт та скутість у спині є поширеними симптомами, що можуть супроводжуватися широким спектром позасуглобових проявів. Серед останніх найбільшу поширеність мають біль у сідницях та реберно-м’язовій частині грудної клітки, які достовірно частіше відмічають у пацієнтів із запальним болем у спині. Враховуючи відносно високу поширеність у популяції запального болю в спині та позасуглобових проявів у осіб, що не перебували в полі зору ревматолога, необхідно покращувати обізнаність сімейних лікарів стосовно алгоритму визначення характеру болю в спині та подальшого скерування цих пацієнтів до вузькопрофільних спеціалістів.
22. Аналіз факторів ризику прогресування ішемічної хвороби серця у пацієнтів із аксіальним спондилоартритом
А.О. Ситенко
ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини ім. акад. М.Д. Стражеска НАМН України», Київ, Україна
Серцево-судинні захворювання (ССЗ) є основною причиною летальності у всьому світі, а пацієнти з ревматичними захворюваннями мають підвищений ризик розвитку ССЗ. Фактори ризику ССЗ, такі як малорухливий спосіб життя, дисліпідемія, цукровий діабет, ожиріння, паління, є факторами, що обтяжують перебіг аксіального спондилоартриту (АксСпА). Результати досліджень показали, що HLA-B27 може бути генетичним фактором ризику для різних хвороб серця. Активність захворювання та запалення при АксСпА викликають більшу поширеність гіперхолестеринемії у пацієнтів із АксСпА, а в подальшому й ішемічної хвороби серця (ІХС) у цій популяції пацієнтів.
Мета дослідження: оцінити поширеність ІХС у пацієнтів із АксСпА та взаємозвʼязок факторів ризику ІХС з перебігом АксСпА.
Методи дослідження: обсерваційне ретроспективне дослідження. Джерело даних: історії хворб стаціонарних пацієнтів відділу некоронарних захворювань серця, ревматології та терапії, ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска НАМН України». Глибина пошуку: січень 2021–січень 2023 р. Критерії відбору медичної документації: діагноз: АксСпА, в супутніх : гіпертонічна хвороба серця, ІХС, дисліпідемія, порушення толерантності до вуглеводів, цукровий діабет, лабораторні показники (швидкість осідання еритроцитів (ШОЕ), С-реактивний білок (СРБ)), ліпідограма, HLA-B 27 антиген, рівень глюкози, індекс маси тіла (ІМТ), факт паління. Досліджувана популяція: пацієнти чоловічої та жіночої статі із встановленим діагнозом АксСпА відповідно до критеріїв ASAS. Показники наслідків запалення: частка пацієнтів з ІХС, гіперліпідемією, ожирінням.Фактори ризику: оцінювали фактори ризику розвитку ІХС з урахуванням АксСпА — вік, тривалість, активність (BASDAI) захворювання, застосування факторів некрозу пухлин (анти-ФНП), паління, дисліпідемія, цукровий діабет, ожиріння. Статистичний аналіз: багатофакторний регресійний аналіз, співвідношення шансів та 95% довірчий інтервал, програма Statistica
Результати дослідження: проаналізовано історії хвороби 51 пацієнта з діагнозом АксСпА, що відповідають критеріям ASAS. Контрольну групу формували історії хвороб 140 пацієнтів без ревматологічного діагнозу. Частка ІХС була більшою у пацієнтів із АксСпА порівняно з контрольною групою (14,1 проти 6,36% відповідно, p<0,01), а пацієнти, які отримували блокатори ФНП-альфа (анти-ФНП), мали нижчий ризик ІХС порівняно з тими, хто їх не приймав (9,02 проти 16,2%, p<0,01), молодші за віком порівняно з тими, хто не отримував анти-ФНП. Частка гіпертонічної хвороби, гіперліпідемії, цукрового діабету та куріння також була більшою у пацієнтів з АксСпА. Однак у багатофакторному аналізі після коригування факторів ризику не встановлено, що АксСпА пов’язаний з ІХС, а терапія анти-ФНП не знижує ймовірності розвитку ІХС. У пацієнтів із АксСпА наявні усі фактори ризику ССЗ, тому у них відмічають вищий ризик ІХС. Ці результати підкреслюють багатофакторний процес, що призводить до збільшення частки ІХС серед пацієнтів із АксСпА і потребує модифікації традиційних факторів ризику у цих пацієнтів.
Висновки: ризик розвитку ІХС підвищується при АксСпА. Більш висока активність зумовлює зростання ризику розвитку ССЗ та їх ускладнень; пацієнти з АксСпА повинні перебувати під ретельним наглядом щодо ознак серцево-судинних подій, оскільки це необхідно для забезпечення належного лікування та підвищення обізнаності всіх пацієнтів. Зниження активності основного захворювання за допомогою раннього призначення лікування знижує ризик серцево-судинних подій.
23. ПРОАРИТМІЧНІ ЗМІНИ НА ЕЛЕКТРОКАРДІОГРАМІ У ХВОРИХ ПРИ ПОЄДНАННІ РЕВМАТОЇДНОГО АРТРИТУ З АРТЕРІАЛЬНОЮ ГІПЕРТЕНЗІЄЮ
А.П. Стахова
Національний медичний університет імені О.О. Богомольця, кафедра пропедевтики внутрішньої медицини № 2, Київ, Україна
Мета дослідження: дослідити тип та частоту змін на електрокардіограмі (ЕКГ) у хворих на ревматоїдний артрит (РА) в поєднанні з артеріальною гіпертензією (АГ), встановити залежність цих змін від маркерів клініко-лабораторної активності РА.
Методи дослідження: проаналізовано випадкову вибірку із 201 пацієнта, які були розділені на 4 групи: пацієнти із РА в поєднанні з АГ (n=101, середній вік 62,3±8,0 року; з них 83,9% жінок), пацієнти із РА (n=41, середній вік 54,1±8,55 року; з них 90,2% жінок), пацієнти із АГ (n=37, середній вік 60,6±8,61 року; з них 83,8% жінок), а також відносно здорові особи (n=22, середній вік 50,1±4,94 року; з них 72,7% жінок). Усі хворі на РА приймали метотрексат у середній дозі 15 мг на тиждень, а пацієнти із АГ отримували потрійну антигіпертензивну терапію, що включала діуретик, інгібітор ангіотензинперетворювального ферменту, блокатор кальцієвих каналів, а також розувастатин у дозі 20 мг/добу. Усім пацієнтам проводили ЕКГ у 12 відведеннях, а також визначалися рівні С-реактивного білка (СРБ), інтерлейкінів (ІЛ)-6 та -10, а також матриксної металопротеїнази 3 (MMP-3). У хворих на РА у поєднанні з АГ рівень СРБ становить 6,8 (3,2–20,8) мг/л, ІЛ-6 — 27,5 (10,2–35,7) пг/мл, ІЛ-10 — 10,4 (8,8–15,9) пг/мл, а ММР-3 — 8,9 (7,6–12,6) нг/мл. Дані наведені у вигляді Mе (25–75% перцентилі).
Результати. У пацієнтів із РА в поєднанні із АГ визначається більша тривалість скоригованого інтервалу Q–T (Q–Tс) на 13,5±2,1 мс порівняно із пацієнтами із РА, на 10,2±1,9 мс порівняно із хворими на АГ та на 25,4 ±1,8 мс порівняно із здоровими особами (р<0,05). Подовження Q–Tс пов’язано із вищим рівнем СРБ (r=0,45, p<0,05), ІЛ-6 (r=0,47, p<0,05), ІЛ-10 (r=0,55, p<0,05) та ММР-3 (r=0,39, p<0,05). У групі хворих на РА в поєднанні з АГ визначається більша тривалість комплексу QRS на 11,4±1,8 мс порівняно із пацієнтами із РА, на 8,1±1,3 мс порівняно із хворими на АГ та на 18,6±1,1 мс порівняно із здоровими особами (р<0,05), а також у 2,3 раза вища частота неповної блокади правої ніжки пучка Гіса, ніж у хворих на РА, і у 3,4 раза порівняно із хворими на АГ, p<0,05. У відносно здорових осіб порушення деполяризації шлуночків не відмічали. Подовження комплексу QRS було пов’язано із вищим рівнем ММР-3 (r=0,42, p<0,05) та ІЛ-6 (r=0,38, p<0,05). У хворих на РА в поєднанні з АГ більша тривалість інтервалу P–Q, ніж у пацієнтів із РА, на 11,7±1,7 мс порівняно із пацієнтами із РА, на 8,4±2,1 мс порівняно із хворими на АГ та на 17,5 ±1,2 мс порівняно із здоровими особами (р<0,05). Атріовентрикулярна блокада І ступеня визначається у 7 (6,9%) хворих на РА в поєднанні з АГ. Подовження інтервалу P–Q пов’язане із вищим рівнем СРБ (r=0,41, p<0,05), ІЛ-6 (r=0,43, p<0,05) та ММР-3 (r=0,48, p<0,05).
Висновки. У хворих на РА у поєднанні з АГ вищий ризик розвитку порушення реполяризації, що корелюється із високою лабораторною активністю РА, може бути передумовою раптової серцевої смерті через Torsades de pointes. Порушення деполяризації міокарда шлуночків у хворих на РА в поєднанні з АГ може бути зумовлене вищим ступенем фіброзу, маркером якого є ММР-3, у хворих із поєднанням РА та АГ. Фіброз міокарда та високий рівень запалення можуть бути причиною порушення провідності у цих коморбідних пацієнтів.
24. Тривожно-депресивні розлади у хворих на системний червоний вовчак, зв’язок з активністю захворювання
Т.В. Степанюк, С.В. Шевчук
Вінницький національний медичний університет ім. М.І. Пирогова, Вінниця, УкраїнаНауково-дослідний інститут реабілітації осіб з інвалідністю Вінницького національного медичного університету ім. М.І. Пирогова, Вінниця, Україна
Мета дослідження: оцінити поширеність порушень в психоемоційній (депресія, тривога) сфері хворих на системний червоний вовчак (СЧВ) та їх зв’язок з активністю захворювання, адже ураження нервової системи у хворих на СЧВ становлять суттєву проблему та мають різноманітні клінічні прояви, часто маніфестують тривожними та депресивними розладами, а причини та механізми цих проявів залишаються й досі не вивченими.
Методи дослідження: обстежено 96 хворих на СЧВ віком 19–55 років, 7 (7,3%) чоловіків та 89 (92,7%) жінок, середня тривалість захворювання — 6,2±0,4 року, середній вік — 37,5±0,9 року та 29 осіб групи контролю, середній вік — 39,0±1,09 року. Діагноз СЧВ встановлювали на основі критеріїв Американського коледжу ревматології (American College of Rheumatology — ACR) та Європейського альянсу ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR) 2019 р. Для оцінки неврологічного стану використані шкала депресії Зунга, шкала тривоги Спілбергера.
Результати: аналіз психоемоційної сфери хворих на СЧВ показав високу частоту тривожних (100%) та депресивних (32,3%) розладів. Особистісна та ситуативна тривожність високого рівня визначалась у 41,6 та 33,3% хворих відповідно, середнього — у 39,6 та 47,9%, низького — у 18,8% пацієнтів. У групі контролю осіб з високим рівнем тривожності не виявлено, особистісна та ситуативна тривожність середнього рівня зафіксована у 6,9 та 17,2%, низького — у 93,1 та 82,8%. Кожен третій пацієнт з СЧВ має депресивні розлади різного ступеня тяжкості. Зокрема, у 13 (13,6%) хворих визначалася легка депресія, у 15 (15,6%) — помірна і у 3 (3,1%) — тяжка. Переважна більшість (89,6%) осіб контрольної групи не мали навіть мінімальних ознак депресії, питома вага осіб з легкою та помірною депресією становила 6,9 та 3,5% відповідно. Несприятливі зміни у психоемоційній сфері асоціювалися з активністю захворювання, оціненою за шкалою SLEDAI. Так, показники особистісної та ситуативної тривожності в групі з активністю за SLEDAI ≤10 балів становили 38,8±1,6 та 39,6±1,8 бала, а при активності за SLEDAI ≥20 балів — 44,0±1,4 та 46,0±1,7 бала, або були вищими на 13–16% відповідно. Депресивні прояви також мали тісну асоціацію з активністю захворювання. У групі з активністю ≤10 балів середній показник становив 47,4±1,2 бала, що відповідає відсутності ознак депресії, а в групі з активністю за SLEDAI ≥20 балів цей показник становив 53,4±1,7 бала, що відповідає легким депресивним порушенням.
Висновки. У хворих на СЧВ з високою частотою відзначають тривожні та депресивні розлади, які більш помітні саме в осіб з високою активністю захворювання за SLEDAI.
25. Роль активованих тромбоцитів у розвитку серцевих уражень при ревматоїдному артриті
К.С. Узун
КНП «Обласна лікарня інтенсивного лікування м. Маріуполь», Київ, Україна
Дослідження Трансатлантичного консорціуму з серцево-судинних захворювань при ревматоїдному артриті (ATACC-RA) виявило, що близько 49% серцево-судинних порушень у пацієнтів із РА спричинені традиційними факторами ризику, такими як куріння та гіпертензія, тоді як 30% пов’язані з особливостями РА, включаючи високий індекс активності захворювання (DAS28), позитивний ревматоїдний фактор (RF) та/або антитіла до цитрулінованих білків (ACPA), підвищену швидкість осідання еритроцитів (ШОЕ) і рівень С-реактивного білка (СРБ) [1]. Однак відсутність чіткого розуміння патогенетичних механізмів підвищеного серцево-судинного ризику при РА ускладнює розробку ефективних методів індивідуальної профілактики та лікування, що потребує впровадження нових підходів до діагностики та терапії. Одним із найчутливіших методів виявлення ранньої доклінічної дисфункції міокарда є спекл-трекінг ехокардіографія (STE), яка у пацієнтів із РА без явних серцево-судинних проявів демонструє порушення глобальної поздовжньої деформації [2].
Останнім часом з’являються припущення про можливу роль тромбоцитів у патогенезі серцево-судинних ускладнень при РА та пошкодження міокарда лівого шлуночка [3].
Мета дослідження — вивчити ранні доклінічні прояви серцевої недостатності за даними STE та їхній зв’язок із факторами серцево-судинного ризику, активністю РА та функціональною активністю тромбоцитів (за результатами проточної цитофлуометрії).
Методи: обстежено 57 пацієнтів із РА (49 жінок та 8 чоловіків) віком 34–75 років (середній вік 56,0±11,6 року, медіана 57,5 року). Переважали пацієнти із тривалістю захворювання до 5 років (40,4%), тоді як у 29,8% тривалість хвороби перевищувала 10 років. Активність РА оцінювали за шкалою DAS28: у 31,6% пацієнтів виявлено I ступінь активності (DAS28 <3,2), 35,1% — II ступінь (помірна активність), 33,3% — III ступінь (DAS28 >5,1). Індекс серцево-судинного ризику SCORE2 розраховували згідно з рекомендаціями Європейського товариства кардіологів (European Society of Cardiology — ESC) 2021 р. У середньому SCORE2 становив 7,70±7,27%. Дуже високий ризик відмічено у 24,6% пацієнтів, низький — у 22,8%, помірний — у 52,6%.
Дослідження глобальних і регіонарних спеклів («Bull’s-eye plot») проводили за допомогою ультразвукової системи Vivid S70N, GE Vingmed Ultrasound AS (Норвегія). Розраховували глобальну поздовжню деформацію (GLS) і регіонарні стрейни: базальний (BLS), середніх відділів (INT strain) та апікальних відділів (API strain). Маркери тромбоцитів, моноцитів і нейтрофілів визначали за допомогою проточної цитофлуометрії (CD14, CD41, CD45, CD61, CD62p) на проточному цитометрі Navios EX System 3/10 (Beckman Coulter). Також у крові досліджували рівні RF, ACPA, СРБ і холестеролу (загального та ліпопротеїдів низької щільності (ЛПНЩ)). Статистичну обробку проводили за допомогою «MedCalc® version 22.030» із використанням параметричних і непараметричних методів.
Результати: аналіз STE показав значне зниження глобальної поздовжньої деформації (GLS) у 12,3% пацієнтів без клінічно значущих серцево-судинних проявів або ознак ІХС (рис. 1). Найбільш виражені порушення відмічені у базальних сегментах міокарда (40,4%), тоді як апікальні сегменти уражувалися лише у 5,3% випадків.
Статистично достовірного зв’язку між порушеннями GLS та показниками DAS28 (r=0,20, p=0,63), рівнем СРБ (r=–0,09, p=0,85), RF (r=–0,63, p=0,18), ACPA (r=0,59, p=0,29) або рівнем холестерину ЛПНЩ (r=0,19, p=0,22) не виявлено (рис. 2). Водночас рівень активованих тромбоцитів (CD41+CD62p+) був значно підвищеним (468,09±556,00, 95% довірчий інтервал 94,56–841,62) та сильно корелював з GLS (r=–0,77, p=0,02).
Висновки. Отримані результати підтверджують гіпотезу про зв’язок між підвищенням активності тромбоцитів (CD41+CD62p+) та пошкодженням міокарда у пацієнтів із РА за даними STE. STE є чутливим методом для виявлення ранніх доклінічних уражень міокарда та може бути використаний для індивідуалізації профілактики й лікування серцево-судинних ускладнень.
26. ЕПІДЕМІОЛОГІЧНІ ПОКАЗНИКИ РЕВМАТОЇДНОГО АРТРИТУ В УКРАЇНІ: 10-РІЧНА ДИНАМІКА ЗА РЕЗУЛЬТАТАМИ ДОСЛІДЖЕННЯ ГЛОБАЛЬНОГО ТЯГАРЯ ХВОРОБ
О.О. Ханюков, О.В. Смольянова
Дніпровський державний медичний університет, Дніпро, Україна
Мета. Оцінити 10-річну динаміку показників поширеності та захворюваності на ревматоїдний артрит (РА), а також втрачених років здорового життя (DALY) при цьому захворюванні в Україні.
Матеріали та методи. Дані отримані з дослідження глобального тягаря хвороб, травм та факторів ризику, що проведене Інститутом оцінки та вимірювання показників здоров’я (США). Показники поширеності, захворюваності, DALY представлені стандартизованими за віком показниками на 100 тис. населення та наведені у вигляді медіани разом з довірчими інтервалами (ДІ). Порівнювали показники 2011 та 2021 р.
Результати. За даними дослідження глобального тягаря хвороб, травм та факторів ризику станом на 2021 р. стандартизований за віком показник поширеності РА в Україні становив 94,67 (95% ДІ 78,57–111,85), для когорти хворих жіночої статі — 130,48 (95% ДІ 107,39–153,28), для когорти хворих чоловічої статі — 51,32 (95% ДІ 41,41–63,63). Цього ж року показник захворюваності на РА становив 4,60 (95% ДІ 3,93–5,31), і був більш ніж удвічі вищим у жінок (6,52 (95% ДІ 5,54–7,58)) порівняно з чоловіками (2,56 (95% ДІ 3,07–2,14)).
Таке ж саме співвідношення за статтю виявлено і для показника DALY: 24,84 (95% ДІ 18,36–32,70) — для жінок, 10,91 (95% ДІ 7,80–14,63) — для чоловіків. Для когорти хворих на РА у цілому показник DALY становив 18,62 (95% ДІ 13,87–24,29).
За результатами дослідження глобального тягаря хвороб, травм та факторів ризику, станом на 2011 р. стандартизований за віком показник поширеності РА в Україні становив 88,26 (95% ДІ 74,28–105,53), серед осіб жіночої статі — 120,57 (95% ДІ 101,07–143,40), серед осіб чоловічої статі — 47,78 (95% ДІ 39,17–58,70). Цього ж року показник захворюваності становив 4,28 (95% ДІ 3,62–4,95), і знов був більш ніж удвічі вищим у жінок (6,03 (95% ДІ 5,09–6,94)) порівняно з чоловіками (2,37 (95% ДІ 1,99–2,84)).
Для когорти хворих на РА у цілому у 2011 р. показник DALY становив 17,97 (95% ДІ 13,93–23,54), для жінок — 24,34 (95% ДІ 18,97–32,15), для чоловіків — 9,79 (95% ДІ 7,35–12,97).
При порівнянні даних 2011 та 2021 р. виявлено наступну динаміку: приріст за поширеністю РА становив 7,26% (для когорти жінок — 8,22%, для когорти чоловіків — 7,41%); приріст за захворюваністю становив 7,48% (для когорти жінок — 8,13%, для когорти чоловіків — 8,02%); приріст за показником DALY у загальній когорті хворих з РА становив 3,62% (для жінок — 2,05%, для чоловіків — 11,44%).
Висновки. При порівнянні поширеності та захворюваності на РА у 2011 та 2021 р. зафіксовано зіставний приріст цих показників у чоловіків та жінок. Проте звертає на себе увагу значно більший приріст показника DALY у чоловіків при переважаючій поширеності та захворюваності на РА у жінок. Цей феномен викликає занепокоєння та потребує подальшого дослідження.
27. МЕДИКАМЕНТОЗНО-ІНДУКОВАНА ГІПЕРУРИКЕМІЯ У ХВОРИХ іЗ ФІБРИЛЯЦІЄЮ ПЕРЕДСЕРДЬ
В.А. Хомазюк
Національний медичний університет імені О.О. Богомольця, Київ, Україна
Гіперурикемію вважають незалежним фактором ризику серцево-судинної патології, в тому числі фібриляції передсердь. Підвищення рівня сечової кислоти в крові може бути наслідком не тільки вживання алкоголю та продуктів, багатих пуринами, але і впливу певних ліків. Петльові і тіазидні діуретики підвищують рівень сечової кислоти в сироватці крові шляхом збільшення реабсорбції сечової кислоти та/або зниження її секреції. Ацетилсаліцилова кислота у низьких дозах (60–300 мг на добу) також знижує виведення сечової кислоти та може викликати вторинну гіперурикемію, тоді як більш високі дози зумовлюють урикозуричну дію.
Мета — визначити взаємозв’язок гіперурикемії з медикаментозним лікуванням у пацієнтів з пароксизмальною і персистуючою фібриляцією передсердь, оцінити можливості зменшення кардіоваскулярного ризику.
Матеріали та методи. Обстежено 69 хворих з пароксизмальною і персистуючою фібриляцією передсердь віком 41–73 років, у яких виявлено безсимптомну гіперурикемію, а рівень сечової кислоти у сироватці крові перевищував 360 мкмоль/л. Хворі були рандомізовані на 2 групи, відповідні за віком, статтю і рівнем артеріального тиску. У 37 з них проведено корекцію медикаментозного лікування з виключенням або заміною діуретиків та ацетилсаліцилової кислоти (1-ша група) і у 32 хворих — лікування не змінювали (2-га група). Проведено комплексне клінічне обстеження, вимірювання офісного артеріального тиску, електрокардіографію, трансторакальну ехокардіографію в В-, М-режимах та допплер-ехокардіографію за стандартними протоколами при поступленні в клініку, після відновлення синусового ритму і в динаміці лікування через 3 міс.
Результати. Групи обстеження на початку лікування суттєво не відрізнялися за рівнем сечової кислоти в крові й отримали аналогічні рекомендації щодо дієти. У всіх хворих виявлені артеріальна гіпертензія І–ІІІ ступеня і гіпертрофія лівого шлуночка серця. Індекс маси міокарда лівого шлуночка в 1-й і 2-й групах становив у середньому 172,4±10,7 і 168,3±11,4 г/м2 відповідно і був більшим, ніж у здорових (p<0,05). Встановлено достовірну кореляцію між гіперурикемією і збільшенням індексу маси міокарда лівого шлуночка. Індекс об’єму лівого передсердя був також збільшеним в обох групах. Через 3 міс лікування виявлено зниження рівня сечової кислоти в крові на величину стандартного відхилення від середнього значення на початку лікування у 18,9% хворих 1-ї групи проти 6,2% в 2-й групі. Встановлено зниження гіперурикемії в 1-й групі в середньому на 126 мкмоль/л (p<0,05), в 2-й групі достовірні зміни не відзначені. Позитивна динаміка гіперурикемії після корекції медикаментозного лікування не супроводжувалася суттєвими змінами клінічних та ехокардіографічних параметрів.
Висновки. Безсимптомна гіперурикемія у значної частини хворих із фібриляцією передсердь і артеріальною гіпертензією може бути медикаментозно-індукованою. Особливої уваги потребують пацієнти, які отримують петльові і тіазидні діуретики, ацетилсаліцилову кислоту у низьких дозах. Регулярний контроль рівня сечової кислоти в крові, адекватна гідратація і подальша корекція медикаментозного лікування з відміною, заміною або зниженням дози лікарських засобів, що індукують гіперурикемію, мають бути неодмінною складовою сучасної діагностики та лікування фібриляції передсердь. При безсимптомній гіперурикемії, спричиненій лікарськими засобами, рідко потребується лікування для контролю рівня сечової кислоти в сироватці крові. Однак коли розвивається подагра, рішення розпочати прийом алопуринолу або урикозуричного препарату має бути індивідуальним. Виявлені особливості дозволяють оптимізувати оцінку кардіоваскулярного ризику і розширюють перспективи профілактики у хворих із фібриляцією передсердь.
28. ПОРІВНЯЛЬНА ОЦІНКА МОДЕЛЕЙ ВИЗНАЧЕННЯ ВИСОКОЇ АКТИВНОСТІ СИСТЕМНОГО ЧЕРВОНОГО ВОВЧАКА ЗА ЗНАЧЕННЯМИ ЛАБОРАТОРНИХ МАРКЕРІВ ЗАПАЛЕННЯ
О.Б. Яременко1, Д.І. Коляденко1, К.М. Яременко2, А.М. Костюченко3
1Національний медичний університет імені О.О. Богомольця, Київ, Україна
2КНП «Олександрівська клінічна лікарня м. Києва», Київ, Україна
3КНП «Київська міська клінічна лікарня № 3», Київ, Україна
Мета. Висока активність захворювання при системному червоному вовчаку (СЧВ) суттєво впливає на життєвий прогноз та потребує вчасної інтенсифікації терапії. Хоча антитіла до двоспіральної ДНК (АТ-дсДНК) та компоненти комплементу С3 і С4 є складовими індексу активності СЧВ SLEDAI-2K, їх інформативність може бути недостатньою для визначення високої активності захворювання, особливо у пацієнтів із позанирковими проявами. Метою роботи було порівняти ефективність маркерів запалення (швидкість осідання еритроцитів (ШОЕ), С-реактивний білок (СРБ), інтерлейкін (ІЛ)-6) із традиційними біомаркерами (С3, С4 та АТ-дсДНК) для диференціювання хворих із високою активністю СЧВ.
Матеріали та методи. Обстежено 79 хворих на СЧВ віком 37 (29–48) років, з них 68 жінок (86,1%) та 11 чоловіків (13,9%). Активність СЧВ оцінювали за допомогою шкали SLEDAI-2K, високою активністю захворювання вважали величину індексу SLEDAI-2K >10 балів. У хворих визначали рівні АТ-дсДНК, С3, С4, ШОЕ, СРБ та ІЛ-6. Для порівняльної оцінки ефективності цих біомаркерів у диференціюванні хворих із високою активністю СЧВ проаналізовано криві операційних характеристик (ROC) та моделі логістичної регресії.
Результати. В обстеженій когорті більше третини хворих (39,2%) мали високу активність СЧВ, тоді як 48 осіб (60,8%) — низьку або помірну активність хвороби. Рівні ШОЕ та ІЛ-6 були достовірно вищими у хворих із високою активністю СЧВ порівняно з пацієнтами з низькою активністю захворювання (29 (17–42) мм/год проти 15 (6–33) мм/год, 6,1 (4,1–35,7) пг/мл проти 2,3 (1,2–7,2) пг/мл, відповідно, р<0,05). Статистично значущих відмінностей рівнів СРБ у хворих на СЧВ із різними ступенями активності захворювання не відмічено. Рівні комплементу С3, С4, АТ-дсДНК, ІЛ-6 та ШОЕ достовірно корелювали з індексом SLEDAI-2K, тоді як взаємозв’язку між рівнем СРБ та ступенем активності СЧВ не виявлено. Згідно із значеннями площі під кривою (AUC) ІЛ-6 та ШОЕ продемонстрували кращу здатність визначати високу активність СЧВ, ніж С3, С4 та АТ-дсДНК (AUC=0,721; 0,765; 0,689; 0,391; 0,464 відповідно). Оптимальне порогове значення ІЛ-6 становило 5,4 пг/мл із чутливістю 74,2% та специфічністю 68,1% (р=0,01), ШОЕ — 40 мм/год із чутливістю 41,4% та специфічністю 92,7% (р=0,001). Здатність СРБ визначати хворих із високою активністю СЧВ виявилась незадовільною. У багатофакторному логістичному регресійному аналізі встановлено, що при підвищенні рівня ІЛ-6 ≥5,4 пг/мл та ШОЕ ≥40 мм/год суттєво зростає ризик високої активності СЧВ (відношення шансів (ВШ) 10,1 (95% довірчий інтервал (ДІ) 2,8–35,8), р=0,0004 та 11,4 (95% ДІ 2,3–57,3), р=0,003 відповідно). AUC відповідної ROC-кривої становив 0,825 (95% ДІ 0,731–0,918), що свідчить про дуже хорошу якість побудованої моделі.
Висновки. Під час оцінки активності СЧВ, крім традиційних клініко-лабораторних даних, рекомендовано орієнтуватися також на величини ШОЕ та ІЛ-6: рівень ШОЕ ≥40 мм/год та ІЛ-6 ≥5,4 пг/мл демонструють кращу здатність визначати високу активність СЧВ, ніж такі лабораторні складові SLEDAI-2К, як С3, С4 та АТ-дсДНК.
29. IgG4-ЗАЛЕЖНИЙ СКЛЕРОЗИВНИЙ ХОЛАНГІТ ПІД МАСКОЮ ХОЛАНГІОКАРЦИНОМИ: КЛІНІЧНИЙ ВИПАДОК
О.Б. Яременко, Д.І. Коляденко
Національний медичний університет імені О.О. Богомольця, Київ, Україна
Мета. Продемонструвати складнощі діагностики IgG4-залежного склерозивного холангіту — рідкісної хвороби, яка може мімікрувати злоякісне новоутворення жовчовивідних шляхів.
Матеріали та методи. Проаналізовано літературні дані щодо спектру клінічних проявів та диференційної діагностики IgG4-залежного склерозивного холангіту, описано клінічний випадок із власної практики.
Результати. IgG4-залежне захворювання є мультидисциплінарною проблемою, інфільтративні зміни можуть виникати практично в усіх органах, найчастіше — в епітеліальних залозах, орбітах, придаткових пазухах, легенях, жовчовивідних шляхах, заочеревинному просторі. ІgG4-залежний склерозивний холангіт здебільшого розвивається в поєднанні з аутоімунним панкреатитом 1-го типу. Ізольований IgG4-залежний склерозивний холангіт є рідкісною патологією, що часто клінічно та візуалізаційно імітує холангіокарциному. Точна диференційна діагностика має вирішальне значення через принципово відмінні методи лікування та прогноз. Ми спостерігали хвору Л., 70 років, яка первинно звернулася до хірургів зі скаргами на схуднення, нудоту, блювання, біль у животі. За даними лабораторних досліджень крові: підвищення рівнів печінкових ферментів (аланінамінотрансфераза (АлАТ) — 45 Од/л, аспартатамінотрансфераза (АсАТ) — 37 Од/л, гамма-глутамілтрансфераза (ГГТ) — 379 Од/л, лужна фосфатаза (ЛФ) — 271 Од/л) та швидкості осідання еритроцитів (ШОЕ) до 35 мм/год. Онкомаркери (вуглеводний антиген 19-9, α-фетопротеїн, раково-ембріональний антиген) та імунологічні показники (антинуклеарні антитіла, антимітохондріальні антитіла, антитіла до гладких м’язів) були в нормі. За результатами комп’ютерної та магнітно-резонансної (МР) томографії онкологами встановлено діагноз перихілярної холангіокарциноми (пухлина Клацкіна). Проведення біопсії визнано технічно неможливим, тому було призначено емпіричну хімієтерапію (4 цикли гемцитабіну з цисплатином) без клінічного покращання. За даними повторної МР-холангіографії виявлено значний стеноз внутрішньопечінкової жовчної протоки (d=1,5 мм) та прогресування м’якотканинного перидуктального утворення (12х8 мм) з поширенням на міхурову протоку та її обтурацією; при цьому головна панкреатична протока не була уражена. У подальшій тактиці лікування онкологами розглядалися трансплантація печінки або поліхімієтерапія. Проте ревматологом було запідозрено IgG4-залежний склерозивний холангіт, під час дообстеження виявлено підвищений рівень IgG4 у сироватці крові (471 мг/дл; норма <201 мг/дл). Оскільки гістологічна верифікація діагнозу не була доступною, ухвалили рішення про терапію глюкокортикоїдами (ГК) ex juvantibus (20 мг/добу у преднізолоновому еквіваленті). Через 8 тиж більшість лабораторних показників повністю нормалізувалися (АлАТ — 17 Од/л, АсАТ — 21 Од/л, ГГТ — 86 Од/л, ЛФ — 96 Од/л, ШОЕ — 23 мм/год) на тлі зникнення клінічної симптоматики, що дозволило встановити остаточний діагноз ізольованого IgG4-залежного склерозивного холангіту згідно з критеріями HISORt. При спробах зниження дози ГК нижче 12,5 мг/добу відзначено повторне підвищення маркерів холестазу, тому до лікування було додано метотрексат 15 мг/тиж у якості стероїдзберігаючого агента.
Висновки. Хоча первинно на підставі візуалізаційних даних було запідозрено холангіокарциному, підвищений рівень IgG4 у сироватці крові та швидка позитивна відповідь на ГК підтвердили діагноз IgG4-залежного склерозивного холангіту, що дозволило уникнути серйозного хірургічного втручання. Клінічний випадок демонструє, що терапія ГК ex juvantibus може бути корисною у передопераційній диференційній діагностиці стриктур жовчовивідних шляхів.
30. скасування прийому глюкокортикоїдів та прогноз загострень при ревматоїдному артриті на тлі лікування традиційними синтетичними хворобомодифікувальними засобами
О.Б. Яременко, Г.М. Микитенко
Національний медичний університет імені О.О. Богомольця, Київ, Україна
Мета: вивчити предиктори загострення ревматоїдного артриту (РА) після скасування прийому глюкокортикоїдів (ГК) на тлі лікування традиційними синтетичними хворобомодифікувальними засобами в українській когорті хворих із різною тривалістю захворювання.
Матеріали та методи. У дослідження включено 126 пацієнтів з РА, вік яких становив 22–74 роки, тривалість хвороби — 42,1±5,16 міс. Переважали особи жіночої статі (84,9%). Ранній РА (≤2 років) відмічено у 56,3% хворих. 76 (60,3%) осіб були серопозитивними за ревматоїдним фактором (РФ) та 28 із 46 (60,9%) — за антитілами до циклічного цитрулінованого пептиду (АЦЦП). У всіх хворих визначали показники суглобового статусу, інтегральний показник активності хвороби DAS28 (швидкість осідання еритроцитів — ШОЕ), рівень РФ методом латекс-аглютинації, титр АЦЦП методом ELISA та рентгенологічні зміни в суглобах кистей та стоп за модифікованою шкалою Шарпа-ван дер Хейде. Хворобомодифікувальна терапія (ХМТ) полягала у призначенні таких препаратів: метотрексат (13,8±0,37 мг/тиж), лефлуномід (19,2±0,28 мг/добу), сульфасалазин (2 г/добу) або гідроксихлорохін в комбінації з іншими препаратами; комбіновану ХМТ отримували 30 (23,8%) осіб. До призначення цих базисних препаратів 64 хворих (55,7%) не отримували ХМТ, у решти хворих її (переважно метотрексат) було відмінено через розвиток побічних дій за 3 міс до включення в дослідження. Тривалість спостереження становила 3 роки. На кожному з етапів спостереження (кожні 6 міс), окрім активності хвороби, аналізували можливість відміни ГК, досягнення пацієнтом клінічної ремісії, тривалість ремісії. Критерієм незадовільного контролю РА вважали відношення часу клінічної ремісії до загальної тривалості прийому ГК менше 50%. Статистичну обробку даних виконували з використанням SPSS 29.0.
Результати. Протягом 3 років спостереження відмінити ГК без подальшого загострення захворювання вдалося у більшості (n=89) хворих в період 3–30 міс. У загальній когорті хворих тривалість прийому ГК становила в середньому 11 міс. Загострення РА після відміни ГК виявлено у близько третини (29,4%) пацієнтів. Усі хворі були розподілені на дві групи залежно від наявності (n=37) чи відсутності (n=89) загострень після скасування прийому ГК.
Згідно з отриманими результатами, пацієнти із загостренням РА приймали ГК в 1,7 раза довше порівняно з альтернативною групою (χ2=4,17, р<0,05), мали меншу тривалість ремісії (χ2=10,9, р<0,01), вищу активність хвороби через 12 міс від початку спостереження (р<0,01) та кумулятивну дозу ГК (р<0,001), частіше відповідали критерію незадовільного контролю РА (χ2=45,5, р<0,001).
За даними багатофакторного регресійного аналізу, з ризиком загострення РА після скасування прийому ГК вірогідно асоціювалися вища кумулятивна доза ГК (середній ризик (СР) 17,4; довірчий інтервал (ДІ) 2,62–116,4, р=0,003) та активність РА через 12 міс (СР 4,06; ДІ 1,36–12,0, р=0,012).
Результати ROC-аналізу виявили незалежну прогностичну значущість для підвищення активності РА таких чинників, як вища кумулятивна доза ГК (регресійний критерій >1,37), незадовільний контроль активності РА та вищий індекс DAS28 (ШОЕ) через 12 міс лікування (регресійний критерій >4,37).
Висновки. Загострення РА після скасування прийому ГК відзначають у кожного третього пацієнта з РА, незважаючи на продовження лікування традиційними синтетичними хворобомодифікувальними засобами. Показники динамічного спостереження, а не вихідні дані впливають на ризик загострення РА після скасування прийому ГК. До незалежних прогностичних чинників негативного прогнозу перебігу РА після відміни ГК за результатами ROC-аналізу належать вища кумулятивна доза ГК (>1,3 г), незадовільний контроль активності РА та вищий індекс DAS28 (ШОЕ) через 12 міс лікування (>4,3).

Leave a comment