Оптимізація імуносупресивної терапії у пацієнтів із тяжким перебігом міокардиту
Резюме. Мета: оцінка ефективності застосування імуносупресивної терапії глюкокортикоїдами у пацієнтів із тяжким перебігом міокардиту. Матеріали і методи: обстежено 72 пацієнти з гострим міокардитом та зниженою фракцією викиду (ФВ) лівого шлуночка (ЛШ), з них 32 мали інфекцію COVID-19 в анамнезі, а 40 пацієнтів — без перенесеного COVID-19. Усім пацієнтам проводили ехокардіографічні дослідження (ЕхоКГ), магнітно-резонансну томографію (МРТ) серця, холтерівське моніторування (ХМ) ЕКГ. Результати: встановлено, що пацієнти після перенесеного COVID-19 за результатами МРТ дослідження, проведеного у 1-й місяць хвороби, мали в середньому на 25% більшу кількість сегментів ЛШ з запальними та на 33,3% фібротичними змінами, що асоціювалося з вищою частотою шлуночкової екстрасистолії та епізодів шлуночкової тахікардії. Крім того, в цій когорті хворих виявлено достовірно нижчі показники поздовжньої глобальної систолічної деформації (ПГСД) і циркулярної глобальної систолічної деформації (ЦГСД) ЛШ на тлі зіставної величини ФВ ЛШ. Через 6 міс спостереження у групі хворих без COVID-19 виявлено більш значне зниження частоти шлуночкових аритмій та епізодів нестійкої шлуночкової тахікардії на фоні достовірно меншої кількості сегментів із запальними змінами при зіставному об’ємі фібротичного ураження ЛШ. При цьому відновлення систолічної функції ЛШ проходило інтенсивніше у пацієнтів, які не хворіли на COVID-19, про що свідчили більші величини ФВ ЛШ, ПГСД і ЦГСД ЛШ порівняно з такими у хворих з COVID-19 в анамнезі. Висновки. У хворих з тяжким перебігом міокардиту застосування глюкокортикоїдів рекомендовано як патогенетична терапія (згідно з алгоритмом Всеукраїнської асоціації кардіологів України) з метою зниження дилатації та поліпшення скоротливої здатності ЛШ, зниження частоти порушень ритму серця і регресії запального ураження міокарда за даними МРТ серця.
DOI: 10.32471/rheumatology.2707-6970.97.19051
Лікування міокардиту — вагома проблема сучасної кардіології, актуальна в усіх країнах світу, оскільки це захворювання нерідко призводить до інвалідизації та смерті осіб працездатного віку [1, 3, 4]. Більшістю вітчизняних і зарубіжних дослідників визнано, що реальну частоту розвитку міокардиту дуже складно встановити, оскільки хвороба нерідко має безсимптомний перебіг, відмічають випадки спонтанного розрішення, а верифікація діагнозу можлива лише при проведенні ендоміокардіальної біопсії або аутопсії [7, 13]. Розробка адекватного алгоритму патогенетично обґрунтованої імуносупресивної терапії на сьогодні є одним з найбільш актуальних і складних викликів як для дослідників, так і для практикуючих лікарів. Проведена велика кількість клінічних досліджень, в яких оцінювали ефективність застосування глюкокортикоїдів, цитостатиків, антагоністів прозапальних цитокінів, препаратів інтерферону, стовбурових клітин, імуноадсорбції тощо, однак результати цих досліджень суперечливі і, на думку більшості експертів, поки що не можуть бути імплементовані в повсякденну клінічну практику [15].
Ураження міокарда відносно часто виявляють у пацієнтів з COVID-19, що становить 7–23% випадків і пов’язано з більш високим рівнем смертності [2, 6]. Розвиток міокардиту є потенційним наслідком інфекції COVID-19 і може виявлятися дисфункцією правого і лівого шлуночків (ЛШ), фіброзом міокарда, шлуночковими і надшлуночковими аритміями, кардіогенним шоком та раптовою серцевою смертю [8, 12, 14]. Таким чином, хоча гострий міокардит рідко є причиною пошкодження міокарда, пов’язаного з COVID-19, він може залишатися недостатньо діагностованим через різноманітність клінічних проявів у хворих, що перенесли інфекцію COVID-19. Науково обґрунтованим підходом до уточнення патогенетичних механізмів розвитку, раннього прогнозування перебігу захворювання і розробки програм диференційованого лікування міокардиту є проведення динамічного спостереження із повторним обстеженням хворих.
Мета дослідження — оцінити ефективність застосування імуносупресивної терапії глюкокортикоїдами у пацієнтів із тяжким перебігом міокардиту.
Матеріали і методи: досліджено 72 пацієнти, які розділені на дві групи. До 1-ї групи було включено 32 пацієнти з гострим міокардитом, що розвинувся в середньому через 1,5 ±0,5 міс після перенесеної інфекції COVID-19 — 18 чоловіків та 14 (45,5%) жінок, середній вік 35,2±2,3 року. До 2-ї групи увійшли 40 пацієнтів з гострим міокардитом без коронавірусної хвороби в анамнезі — 27 (67,5%) чоловіків і 13 (32,5%) жінок, середній вік 42,1±3,0 року, які перебували на обстеженні та стаціонарному лікуванні у відділі некоронарних хвороб серця та ревматології ДУ ННЦ «Інститут кардіології, клінічної та регенеративної медицини ім. акад. М.Д. Стражеска» НАМН України. У всіх пацієнтів відмічено серцеву недостатність (СН) ІІ або вище функціонального класу (ФК) за класифікацією Нью-Йоркської асоціації серця (NYHA) та знижену фракцію викиду (ФВ) ЛШ, що становила ≤40% згідно із стандартами з діагностики і лікування серцево-судинних захворювань [1]. У контрольну групу включили 20 практично здорових осіб — 13 (65%) чоловіків і 7 (35%) жінок, середній вік 40,1±2,7 року.
Усі пацієнти були поінформовані про характер обстежень, що проводяться. Усі досліджувані хворі отримували стандартну терапію з приводу СН згідно із сучасними рекомендаціями, зокрема інгібіторами ангіотензинперетворювального фермента (АПФ) та блокаторами бета-адренорецепторів у зіставних дозах, сечогінними, антагоністами мінералокортикоїдних рецепторів [1, 3]. За наявності відповідних показань призначалися антикоагулянти і антиаритмічні засоби. Глюкокортикоїди (ГК) за відсутності протипоказань призначали згідно з алгоритмом, що включає попередню оцінку тяжкості міокардиту, наведеним у Стандартах з діагностики і лікування серцево-судинних захворювань Всеукраїнської асоціації кардіологів України (ВАКУ) [3]. Усі пацієнти протягом 3 міс отримували метилпреднізолон в дозі 0,25 мг/кг маси тіла на добу, далі проводили поступове зниження дози на 1 мг на тиждень до повної відміни препарату через 6 міс від початку лікування. Аналіз результатів обстежень проводили в 1-й місяць від дебюту міокардиту до призначення ГК та через 6 міс спостереження.
Для дослідження структурно-функціонального стану серця всім пацієнтам проводили трансторакальну ехокардіографію (ЕхоКГ) на ультразвуковому діагностичному апараті Aplio Artida SSH — 880 CV, Toshiba Medical System Corporation (Японія). У 2D- режимі в період систоли та діастоли обчислювали кінцево-діастолічний об’єм (КДО) і кінцево-систолічний об’єм (КСО) ЛШ, ФВ ЛШ визначали біплановим методом дисків за Сімпсоном [9, 11]. Виміряні показники КДО і КСО ЛШ співвідносили до площі поверхні тіла й отримували індексовані показники — іКДО та іКСО ЛШ. За допомогою спекл-трекінг (СТ) ЕхоКГ вимірювали величини поздовжньої глобальної систолічної деформації (ПГСД), циркулярної глобальної систолічної деформації (ЦГСД), радіальної глобальної систолічної деформації (РГСД) з трьох стандартних апікальних доступів: 4-камерної, 3-камерної та 2-камерної позиції з використанням 17-сегментарної моделі будови ЛШ за R. Lang та співавторами [11]. Магнітно-резонансну томографію (МРТ) серця проводили на апараті Toshiba Vantage Titan HSR 1,5 Тесла (Японія). Оцінювали зображення серця по короткій і довгій осі в 3 режимах: до введення контрастного препарату (режим Т2 Black blood FSat) для виявлення ділянки набряку в міокарді, протягом 3–5 хв після введення (раннє контрастування) та в режимі відстроченого контрастування через 10–15 хв після введення контрасту [5, 10]. Добове моніторування ЕКГ проводили на апараті Philips Digitrack TM-plus 3100A. Оцінювали загальну кількість надшлуночкових екстрасистол (НШЕ) і шлуночкових екстрасистол (ШЕ) за добу, наявність пароксизмів суправентрикулярної тахікардії (СВТ) та нестійкої шлуночкової тахікардії (НШТ), порушення провідності серця.
Для статистичної обробки даних була створена комп’ютерна база даних за допомогою програмного забезпечення Exсel XP (Місrosoft Office, USA) і статистичної програми Statistica for Windows v. 6.0 (Statsoft, USA). Розраховували середню величину (М), похибку середньої величини (m), критерій достовірності (t) і значення достовірності (p). Для оцінки достовірності відмінностей в різних клінічних групах використовували тест Ст’юдента. При р<0,05 відмінності вважали достовірними. Взаємозв’язок між перемінними визначали за допомогою параметричного кореляційного аналізу.
Результати дослідження
Порівняльний аналіз даних ЕхоКГ у 1-й місяць захворювання дозволив встановити, що групи пацієнтів з міокардитом, які мали в анамнезі інфекцію COVID-19 та без неї, достовірно не відрізнялися за величинами, що характеризують розміри камер серця: іКДО та іКСО ЛШ. У той же час слід зазначити, що величина ФВ ЛШ у хворих 1-ї групи була в середньому на 7,7% меншою порівняно з такою в 2-й групі, однак ця різниця не була достовірною (табл. 1).
| Показники | Величина показника (М±m) в групах | |
|---|---|---|
| 1-ша група (n=32) | 2-га група (n=40) | |
| ІКДО ЛШ, мл/м² | 102,1±8,2 | 98,6±6,3 |
| ІКСО ЛШ, мл/м² | 68,2±6,8 | 62,2±5,4 |
| ФВ ЛШ, % | 33,9±2,2 | 36,4±3,1 |
| ПГСД, % | 8,2±0,6 | 10,1±0,7* |
| ЦГСД, % | 7,5±0,6 | 9,1±0,7* |
Примітка. Різниця показників достовірна порівняно із такими в 1-й групі: *р<0,05.
При вивченні результатів СТ ЕхоКГ встановлено, що в осіб, включених у 1-шу групу, достовірно нижчими виявилися показники ПГСД та ЦГСД (див. табл. 1). Виявлено достовірні відмінності ПГСД ЛШ: в 1-й групі її величина була в середньому на 18,9% нижча за таку в 2-й групі (р<0,05). Так само у хворих 1-ї групи порівняно з 2-ю відмічалася нижча в середньому на 17,5% величина показника ЦГСД ЛШ (р<0,05).
За результатами добового моніторування ЕКГ групи відрізнялися за частотою шлуночкових та суправентрикулярних порушень серцевого ритму (табл. 2). Так, у хворих 1-ї групи загальна кількість ШЕ була більшою в середньому на 52,6% (p <0,01), НШЕ — в середньому на 25,0% (p <0,05), а епізоди НШТ виявляли в середньому на 25% частіше порівняно з пацієнтами 2-ї групи. Кількість виявлених порушень атріовентрикулярної (АВ) провідності, блокад лівої та правої ніжок пучка Гіса (БНПГ), виявлених епізодів фібриляції передсердь в обох досліджуваних групах пацієнтів була зіставною.
| Показник | Величина показника (М±m) в групах | |
|---|---|---|
| 1-ша група (n=32) | 2-га група (n=40) | |
| ШЕ, % | 6,3±0,28 | 3,82±0,23* |
| НШЕ, % | 4,69±0,21 | 3,46±0,18* |
| НШТ, % хворих | 25 | 12,5 |
| АВ-блокада, % хворих | 12,5 | 10 |
| БНПГ, % хворих | 18,7 | 15 |
Примітка: різниця показників достовірна порівняно із такими у хворих 1-ї групи: *р<0,05, **р<0,01.
Згідно з отриманими нами даними, за результатами МРТ серця у хворих після перенесеної інфекції COVID-19 відзначали більший об’єм запального і фібротичного ураження ЛШ порівняно з пацієнтами з міокардитом без коронавірусної інфекції в анамнезі (табл. 3).
| Зміни, виявлені при МРТ серця | Результати дослідження в групах | |
|---|---|---|
| 1-ша група | 2-га група | |
| Раннє контрастування на Т1-зображеннях (гіперемія), % | 86,6 | 70,0 |
| Посилення інтенсивності сигналу на Т2-зображеннях (набряк), % | 73,3 | 60,0 |
| Відстрочене контрастування на Т1-зображеннях (некроз / фіброз), % | 60,0 | 40,0 |
| Кількість сегментів із запальними змінами (набряк та/або гіперемія) | 7,2±0,68 | 5,4±0,54* |
| Кількість сегментів із фібротичними змінами | 4,2±0,42 | 2,5±0,38** |
Примітка: різниця показників достовірна порівняно із такими у хворих 1-ї групи: *р<0,05, *р<0,01.
Дослідження структурно-функціонального стану серця у хворих з міокардитом через 6 міс спостереження.
При проведенні порівняльного аналізу показників ЕхоКГ встановлено, що через 6 міс під впливом лікування відбулося суттєве зменшення проявів кардіомегалії в обох групах хворих. Проте зниження показників іКДО та іКСО у групах пацієнтів з міокардитом було нерівномірним. Так, у пацієнтів 2-ї групи іКДО за 6 міс знизився в середньому на 15,2% (р<0,01). У пацієнтів 1-ї групи зниження іКДО відбувалося повільніше і становило 12,1% (р<0,05) протягом пів року після призначення ГК. Також протягом цього періоду спостереження в обох досліджуваних групах хворих зафіксовано покращення систолічної функції ЛШ, проте середня величина ФВ у хворих 2-ї групи через 6 міс спостереження була достовірно вищою, ніж у пацієнтів 1-ї групи (відповідно на 12,5% (р<0,05) (табл. 4).
| Показники | Величина показника (М±m) | |||
|---|---|---|---|---|
| 1-ша група (n=32) | 2-га група (n=40) | |||
| 1 міс | 6 міс | 1 міс | 6 міс | |
| ІКДО ЛШ, мл/м² | 102,1±8,2 | 92,7±5,7* | 98,6±6,3 | 88,6±5,2* |
| ІКСО ЛШ, мл/м² | 68,2±6,8 | 58,0±4,8* | 62,2±5,4 | 48,3±4,4**° |
| ФВ ЛШ, % | 33,9±2,2 | 45,4±2,5* | 36,4±3,1 | 51,9±2,7**° |
| ПГСД, % | 8,2±0,6 | 10,5±0,8* | 10,1±0,7 | 13,2±1,1*° |
| ЦГСД, % | 7,5±0,6 | 8,4±0,6 | 9,1±0,7 | 10,4±0,8*° |
| РГСД, % | 16,7±1,4 | 17,9±1,6 | 18,6±1,2 | 19,7±1,5 |
Примітки. Різниця показників достовірна порівняно із такими у 1-й місяць від початку захворювання: *р<0,05, **р<0,01. Різниця показників достовірна порівняно із такими в 1-й групі: °р<0,05.
Свідченням покращення скоротливої функції ЛШ на фоні курсу терапії ГК стало зростання і показників СТ ЕхоКГ у групах хворих з міокардитом. Так, за даними 6-місячного спостереження виявлено достовірне зростання показників ПГСД ЛШ на 21,9% (р<0,05) та ЦГСД на 10,7% (р<0,05) у пацієнтів 1-ї групи, у той же час у хворих 2-ї групи ПГСД ЛШ підвищився на 23,5% (р<0,05) та ЦГСД — на 12,5% (р<0,05).
Наступним кроком стало проведення порівняльного аналізу результатів добового моніторування ЕКГ. В обох досліджуваних групах через 6 міс спостереження при холтерівському моніторуванні ЕКГ виявлено значно меншу кількість порушень серцевого ритму і провідності, однак достовірної різниці в показниках між групами не виявлено. Як в 1-й, так і в 2-й групі пацієнтів через 6 міс спостереження відмічено меншу частку ШЕ, зокрема парних ШЕ та НШЕ і нижчу частоту виявлення епізодів НШТ та ФП, АВ-блокади та БНПГ, однак достовірних відмінностей між групами, крім більшої кількості виявлених у хворих 1-ї групи епізодів шлуночкової алоритмії, не встановлено (табл. 5).
| Показники | Величина показника (М±m), відсоткова кількість хворих | |||
|---|---|---|---|---|
| 1-ша група (n=32) | 2-га група (n=40) | |||
| 1 міс | 6 міс | 1 міс | 6 міс | |
| ШЕ, % | 6,3±0,28 | 2,30±0,21** | 3,82±0,23 | 2,04±0,42** |
| НШЕ, % | 4,69±0,21 | 2,96±0,19* | 3,46±0,18 | 2,50±0,16* |
| НШТ, % хворих | 25 | 9,4 | 12,5 | 7,5 |
| АВ-блокада, % | 12,5 | 6,25 | 10 | 5 |
| БНПГ, % | 18,7 | 15,6 | 15 | 12,5 |
| Епізоди ФП та ТП, % | 9,4 | 6,25 | 10 | 5 |
Примітки. ТП — тріпотіння передсердь. Різниця показників достовірна порівняно із такими у 1-й місяць від початку захворювання: *р<0,05, **р<0,01.
Аналіз результатів МРТ серця показав, що через 6 міс лікування частота виявлення запальних змін міокарда — набряку і гіперемії (про наявність яких свідчили раннє контрастування та посилення інтенсивності Т2-сигналу), знизилася майже удвічі. При цьому частота виявлення відстроченого контрастування, що свідчить про наявність фібротичних змін міокарда, фактично не змінилася і залишилася на рівні близько 40% (рисунок).
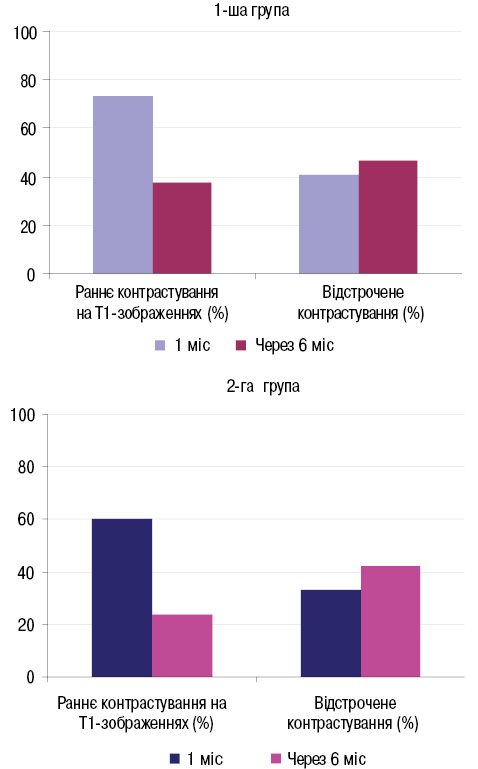
Після завершення 6-місячного курсу терапії ГК у хворих 1-ї групи кількість сегментів ЛШ, уражених запальними змінами, зменшилася з 7,2±0,8 до 2,1±0,21 сегмента (р <0,001), у пацієнтів 2-ї групи з 5,4±0,77 до 2,8±0,25 сегмента (р <0,001). У той же час кількість сегментів із наявністю фібротичних змін в обох групах хворих змінилася не так суттєво. Як і в 1-й місяць дослідження, у хворих 1-ї групи кількість сегментів з виявленими фібротичними змінами була зіставною з такими в 2-й групі і становила у середньому 4,6±0,45 та 4,2±0,41 сегмента відповідно.
Висновки
1. Пацієнти з міокардитом після перенесеної інфекції COVID-19 у 1-й місяць хвороби мали в середньому на 25% більшу кількість сегментів ЛШ із запальними та на 33,3% — з фібротичними змінами за результатами МРТ серця, що асоціювалось з вищою частотою ШЕ та епізодів ШТ. Крім цього, у вказаній когорті хворих виявлено достовірно нижчі показники ПГСД і ЦГСД ЛШ на тлі зіставної величини ФВ ЛШ.
2. Через 6 міс спостереження у хворих без інфекції COVID-19 виявлено більш значне зниження частоти шлуночкових аритмій та епізодів НШТ на фоні достовірно меншої кількості сегментів із запальними змінами при зіставному об’ємі фібротичного ураження ЛШ. Також у цих пацієнтів відбувалося інтенсивніше відновлення систолічної функції ЛШ, про що свідчили вищі показники ФВ ЛШ, ПГСД і ЦГСД ЛШ (на 12,6; 20,4 та 19,2% відповідно) порівняно з такими у пацієнтів із COVID-19 в анамнезі.
3. У пацієнтів з міокардитом, що мали в анамнезі хворобу COVID-19, застосування ГК рекомендовано як патогенетична терапія при тяжкому перебігу захворювання (згідно з алгоритмом ВАКУ) з метою зниження дилатації та поліпшення скоротливої здатності ЛШ, зниження частоти порушень ритму серця і регресії запального ураження міокарда за даними МРТ серця.
Список використаної літератури
- 1. Коваленко В.М., Лутай М.І., Сіренко Ю.М., Сичов О.С., ред. (2023) Серцево-судинні захворювання: класифікація, стандарти діагностики та лікування. 384 с.
- 2. Коваленко В.М., Несукай О.Г., Тітова Н.С. та ін. (2020) COVID-19-асоційований міокардит: власний досвід патогенетичного лікування. Український кардіологічний журнал, Т. 32(3): 9–19.
- 3. Коваленко В.М., Несукай О.Г., Чернюк С.В. та ін. (2020) Діагностика та лікування міокардиту. Рекомендації Всеукраїнської асоціації кардіологів України. Український кардіологічний журнал, Т. 32(3): 67–88.
- 4. Ammirati E., Veronese G., Bottiroli M. et al. (2020) Update on acute myocarditis. Trends in Cardiovascular Medicine, Vol. 31(6): 370–379.
- 5. Arnold J.R., McCann G.P. (2020) Cardiovascular Magnetic Resonance: Applications and Practical Considerations for the General Cardiologist. Heart, Vol. 106(3): 174–181.
- 6. Azevedo R.B., Botelho B.G., de Hollanda J.V.G. et al., (2020) Covid-19 and the cardiovascular system: a comprehensive review. J. Hum. Hypertens., Vol. 35(1): 4–11.
- 7. Caforio A.L., Pankuweit S., Arbustini E. et al. (2013) Current state of knowledge on aetiology, diagnosis, management and therapy of myocarditis: a position statement of the ESC Working group on myocardial and pericardial diseases. Eur. Heart J., Vol. 34(33): 2636–2648.
- 8. Colon C.M., Barrios J.G., Chiles J.W. et al. (2020) Atrial arrhythmias in COVID-19 patients. JACC: Clinical Electrophysiology, Vol. 6(9): 1189–1190.
- 9. González-Ruiz F.J., Lazcano-Díaz E.A., Vásquez-Ortiz Z.Y. et al. (2021) Comprehensive Left Ventricular Mechanics Analysis by Speckle Tracking Echocardiography in COVID-19. World Journal of Cardiovascular Diseases, Vol. 11: 113–125.
- 10. Hundley W.G., Bluemke D.A., Finn J.P., et al. (2010) ACCF/ACR/AHA/ NASCI/SCMR 2010 Expert consensus document on cardiovascular magnetic resonance: a report of the American college of cardiology foundation task force on the expert consensus documents. Circulation, Vol. 121: 2462—2508.
- 11. Lang R., Badano L.P., Mor-Avi V. et al. (2015) Recommendations for cardiac chamber quantification in adults: an update from the American Society of echocardiography and European Asssociation of cardiovascular imaging. J. Am. Soc. Echocardiogr., Vol. 28(1): 1–38.
- 12. Boylan M., Roddy J., Lim N. et al. (2021) Recovery of a critically ill patient with COVID-19 myocarditis. Irish Journal of Medical Science, Vol. 16: 1–5.
- 13. Peretto G., Sala S., Rizzo S. et al. (2020) Ventricular arrhythmias in myocarditis: characterization and relationships with myocardial inflammation. J. Am. Coll. Cardiol., Vol. 75(9): 1046–1057.
- 14. Szekely Y., Lichter Y., Taieb P. et al. (2020) Spectrum of Cardiac Manifestations in Coronavirus Disease 2019 (COVID-19)-a Systematic Echocardiographic Study. Circulation, Vol. 142: 342–353.
- 15. Tschöpe C., Ammirati E., Bozkurt B. et al. (2021) Myocarditis and inflammatory cardiomyopathy: current evidence and future directions. Nat. Rev. Cardiol., Vol. 18(3): 169–193.
Відомості про авторів:
Кириченко Р.М. — кандидат медичних наук, науковий співробітник відділу некоронарних хвороб серця, ревматології та терапії, Державна установа «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска НАМН України», Київ, Україна.
ORCID ID: 0000-0003-0564-8052

Leave a comment