Біохімічні маркери як основа для оптимізації хондропротекторної терапії при остеоартриті колінних суглобів (огляд літератури, власні дослідження)
Сміян С.І., Боднар Р.Я., Сверстюк А.С.
Резюме. Остеоартрит (ОА) є найпоширенішим хронічним захворюванням опорно-рухового апарату зі складними та ще не повністю відомими етіопатогенними шляхами. А пошук ефективної терапії для хворих на ОА потребує подальших досліджень. Мета. Комплексна оцінка ролі біохімічних маркерів N-кінцевого пропептиду людського проколагену II (PIINP) і C-кінцевого телопептиду колагену II типу (CTX-II) у моніторингу руйнування хрящової тканини та ефективності лікування за даними сучасної літератури та визначення терапевтичних можливостей хондропротекторної терапії на основі риб’ячого колагену пептиду, глюкозаміну гідрохлориду, кальцію глюконату, метилсульфонілметану, гіалуронової кислоти, екстракту ункарії опушеної, маточного молочка (Артікон) на симптоми та динаміку рівнів PIINP і CTX-II при ОА колінних суглобів. Методи. Здійснено науковий пошук та обстежено 52 амбулаторних та стаціонарних хворих жінок із первинним гонартрозом І–ІІ рентгенологічної стадії за Kellgren і Lawrence, які були розподілені на дві клінічні групи: I група (n=20) отримувала стандартну терапію ОА (нестероїдні протизапальні препарати (НПЗП), фізіотерапевтичне лікування); II група (n=32) в комплексі зі стандартною терапією ОА отримувала дієтичну добавку Артікон. Обстеження проводили двічі: перед початком (при госпіталізації) та після 90-го дня терапії. Результати. При порівняльному аналізі показників інтенсивності больового синдрому за ВАШ, вираженості ступеня болю за індексом WOMAC та тяжкості гонартрозу (сумарний індекс Лекена) для визначення ефективності лікування ОА стандартною терапією з додаванням дієтичної добавки Артікон виявлено статистично значиму відмінність між групами після лікування з її додаванням (ПЛТА) порівняно з групою після лікування стандартною терапією (ПЛСТ), що вказує на ефективність використання стандартної терапії з додаванням дієтичної добавки Артікон. Це підтверджує статистично значима відмінність між групами ПЛТА порівняно з групою ПЛСТ з рівнем значущості р=0,02<0,05 при порівнянні біохімічного маркера PIINP та CTX-II, при якому значення медіани у групі ПЛТА (0,302 (0,207–0,376)) на 0,164 одиниці менше порівняно з групою ПЛСТ (0,466 (0,141–0,836)), що підтверджує позитивний вплив при використанні біологічно активної добавки Артікон в комплексі зі стандартною терапією ОА. Висновки. Проведений аналіз літератури свідчить про важливість біохімічних маркерів PIINP і CTX-II у контексті оцінки хрящової тканини та ефективності терапевтичних втручань. Зміни в рівнях цих маркерів можуть бути індикаторами не лише руйнування хряща, а й стимуляції синтезу кісткової тканини. Зниження CTX-II у відповідь на терапію свідчить про позитивні зміни, тоді як підвищення PIINP демонструє активні процеси регенерації. Результати власних досліджень підтверджують, що хондропротекторна терапія на основі риб’ячого колагену пептиду, глюкозаміну гідрохлориду, кальцію глюконату, метилсульфонілметану, гіалуронової кислоти, екстракту ункарії опушеної, маточного молочка (Артікон) протягом 90 днів чинить статистично значущий позитивний вплив на симптоми ОА колінних суглобів, включаючи зменшення вираженості болю, на 37,5% порівняно з групою, в якій приймали стандартну терапію, та покращення рухливості на 50%. Встановлена позитивна динаміка рівнів PIINP (на 13,3% вище) і CTX-II (на 35,2% менше), порівняно з групою лікованих стандартною терапією, свідчить про потенціал цієї терапії в уповільненні прогресії ОА колінних суглобів.
DOI: 10.32471/rheumatology.2707-6970.97.19082
УДК: 616.728.3-002-085:616-074(048.8)
Актуальність
 Остеоартрит (ОА), який характеризується локальною дегенерацією суглобового хряща, ремоделюванням субхондральної кістки, синовіальним запаленням і утворенням остеофітів, на сьогодні уражує 6% населення світу та є найпоширенішим хронічним захворюванням опорно-рухового апарату зі складними та ще не повністю відомими етіопатогенними шляхами. Відповідно до «білої» книги Міжнародного товариства дослідження остеоартриту (Osteoarthritis Research Society International — OARSI) близько 242 млн людей живуть із симптоматичним ОА кульшового або колінного суглобів. Клінічно це проявляється суглобовим болем, скутістю, яка потім прогресує до деформацій і погіршує якість життя. На рівні тканин найбільш характерними змінами є прогресуюче руйнування та незначне запалення хряща, синовіт із запальною клітинною інфільтрацією та ремоделюванням субхондральної кістки [1].
Остеоартрит (ОА), який характеризується локальною дегенерацією суглобового хряща, ремоделюванням субхондральної кістки, синовіальним запаленням і утворенням остеофітів, на сьогодні уражує 6% населення світу та є найпоширенішим хронічним захворюванням опорно-рухового апарату зі складними та ще не повністю відомими етіопатогенними шляхами. Відповідно до «білої» книги Міжнародного товариства дослідження остеоартриту (Osteoarthritis Research Society International — OARSI) близько 242 млн людей живуть із симптоматичним ОА кульшового або колінного суглобів. Клінічно це проявляється суглобовим болем, скутістю, яка потім прогресує до деформацій і погіршує якість життя. На рівні тканин найбільш характерними змінами є прогресуюче руйнування та незначне запалення хряща, синовіт із запальною клітинною інфільтрацією та ремоделюванням субхондральної кістки [1].
Останнім часом виявлено кілька системних молекулярних механізмів, що зумовлюють розвиток захворювання. Ці механізми включають хронічне запалення, що активує прозапальні цитокіни і призводить до активації металопротеаз, порушення метаболічних шляхів та мітохондріальної дисфункції і веде до руйнування хряща. На молекулярному рівні прозапальні цитокіни, такі як фактор некрозу пухлин (TNF)-α та інтерлейкін (IL)-1β, призводять до виникнення болю. Крім того, надмірна маса тіла та ожиріння є ключовими факторами ризику та інтенсифікації болю при ОА колінних і кульшових суглобів.
Багато дослідницьких програм спрямовані на розробку медикаментозних методів лікування ОА, які змінять перебіг захворювання, але цим програмам значно заважає відсутність якісних біохімічних методів раннього виявлення та моніторингу прогресування патології. Повільний прогрес у цій галузі значною мірою пояснюється відсутністю відповідних когорт і надійних аналітичних інструментів для виявлення специфічних для ОА біомаркерів. Наявність клінічних, біомаркерних і рентгенографічних даних багатоцентрової проспективної 96-місячної когорти спостереження Ініціативи з остеоартриту Національного інституту здоров’я дає можливість ідентифікувати клінічно корисні біомаркери для ОА колінного суглоба [2].
Прозапальні цитокіни, за деякими винятками, не виявилися корисними для діагностичних або прогностичних цілей. Деякі молекули, що беруть участь у основних шляхах ОА, такі як HIF-1α або CCL3, були запропоновані як маркери гомеостазу хондроцитів і ранньої дегенерації хряща. C-кінцевий телопептид колагену (CTX) II типу (CTX-II), перехресно зшитий телопептид колагену II типу, утворюється завдяки процесингу катепсину та металопротеїнази, і є параметром обміну хряща. CTX-II пригнічується протизапальним лікуванням; його фракція в сечі значною мірою пов’язана з балами за шкалою Western Ontario and McMaster University (WOMAC). Поєднання CTX-II і олігомерного матричного білка хряща (COMP) може бути маркером ранньої діагностики, еволюції та тяжкості захворювання. Фермент матриксної металопротеїнази (MMP)-13, що руйнує хрящ, є багатообіцяючим маркером, оскільки негативно корелює з товщиною хряща та позитивно з балом K-L. Комплексні комбінації біомаркерів, серед яких були номіновані неоепітопи колагену I, II, III, співвідношення CTX-I/OC, PINP, COMP, IL-6 та інші молекули. Продукт деградації вітронектину V65 і фрагмент комплементу C3f є новими кандидатами, які демонструють підвищені спектри у пацієнтів із високими показниками K-L, наявні також у синовіальній рідині. Інгібітори Wnt, склеростин і DKK-1 і DKK-3, ймовірно, чинять захисну дію на хрящ, але через відсутність достатніх даних немає консенсусу щодо їх використання. Клінічні дослідження з відповідним дизайном, ймовірно, підтвердять нові біомаркери та нові сфери застосування в найближчому майбутньому. Кістка, хоч і представлена як пасивна тканина, перебуває під безперервним, тривожним метаболічним рівнем, і її гомеостаз залежить від гармонійної взаємодії між подіями, що утворюють кістку, і подіями, що руйнують кістку. У скелеті ссавців правильний обмін кісток забезпечує відновлення мікроархітектурних пошкоджень кісткової тканини та одночасно сприяє гомеостазу кальцію [3, 4].
Прогресуюча деструкція суглоба при ОА починається в суглобовому хрящі, переважно в несучих суглобах [5], поєднується з утворенням остеофітів і патологічними змінами синовіальної оболонки та субхондральної кістки на краю суглоба з ендохондральним відростком кістки. Поступова деградація та втрата суглобового хряща з пов’язаними структурними та функціональними змінами в цілому суглобі визначають цей складний запальний процес [6, 7]. Однак етіологія та точні патогенетичні механізми (біомеханічні, біохімічні та інші) ОА наразі не визначені, і досі не існує відомого лікування. Останнім десятиліттям ОА все частіше розглядається як процес динамічного руйнування і відновлення хряща. Як біохімічні, так і механічні зміни можуть викликати цю патологію.
Існує багато потенційних діагностичних, моніторингових і прогностичних біомаркерів, які, як повідомляється, мають зв’язок із основними патогенними процесами ОА [8]. На індивідуальному рівні ці маркери демонструють різну чутливість і специфічність. Це є причиною того, що останніми роками було докладено більше зусиль для застосування комплексних аналітичних підходів для розширення панелі відкриттів. Протеомні дослідження були розпочаті для вивчення сироватки, синовіальної рідини, хряща та секретому хондроцитів пацієнтів з ОА для кращого розуміння механізмів захворювання та визначення діагностичних і прогностичних панелей біомаркерів [9, 10].
Біохімічні маркери деградації хряща та кістки стають все більш важливими в оцінці ОА [11]. Сироваткові біомаркери кістково-суглобових захворювань були в центрі уваги сучасних тенденцій клінічних досліджень. Лабораторна перевірка визначених і потенційних біомаркерів ОА має ключове значення для майбутніх алгоритмів ухвалення рішень у діагностиці, моніторингу та прогнозу цих захворювань. Поточні рекомендації радять використовувати залишки розпаду колагену, наприклад CTX-I та CTX-II, у додатковій діагностиці. Крім маркерів деградації колагену, ферменти, які регулюють метаболізм кісток і суглобів, корисні в клінічній оцінці кістково-суглобової патології. Поряд з цим нещодавно вивчено кілька інших рекомендованих і нових номінальних молекул. Wnts і споріднені з Wnt молекули відіграють кардинальну роль у кістково-суглобовому гомеостазі, що робить їх перспективною мішенню не тільки для фармацевтичної модуляції, але й для розгляду як розчинних біомаркерів. При ОА, окрім фрагментів колагену типу II, вивчено багато молекул, пов’язаних із шляхом, і запропоновано для перевірки біомаркерів. Найбільш серйозним обмеженням є те, що значній частині досліджень бракує статистичної потужності через зменшення кількості зареєстрованих випадків. Сироваткові біомаркери обміну кісток і суглобів дають обнадійливу можливість для діагностики та прогнозу кістково-суглобових захворювань, хоча слід проводити подальші дослідження та лабораторні перевірки, щоб покладатися виключно на них.
Оцінка синтезу та деградації колагену ІІ типу вважається актуальною при дослідженні прогресування ОА. Серед продуктів розпаду колагену ІІ типу CTX-II є найбільш вивченим маркером. У пацієнтів з ОА виявлено високі рівні порівняно з безсимптомними особами або радіологічними ознаками ОА. У деяких роботах показано важливий зв’язок між ОА та рентгенографічною прогресією CTX-II [12, 13]. Дегенерація суглобового хряща включає дегенерацію матриксу, яка в основному призводить до втрати протеогліканів і колагену типу II. CTX-II виділяється в синовіальну рідину і поглинається сироваткою, коли колаген типу II розкладається [12]. Завдяки метаболізму колагенових волокон типу ІІ, ранній діагностиці ОА та ефекту клінічних прогнозів лікування динамічне визначення концентрації CTX-II може відображати тяжкість уражень суглобового хряща при ОА [14].
Рекомендації робочої групи з біомаркерів OARSI 2015 р. формулюють рекомендації, що базуються на поточних знаннях і передбачуваних перевагах, які можна використовувати.
Біомаркери можуть використовуватися як на доклінічному рівні, так і в клінічних дослідженнях. Їх основні цілі — встановлення діагнозу, визначення стадії захворювання та моніторинг, підтвердження фармакологічного механізму дії; демонстрація біологічного механізму дії, прогнозування клінічного результату захворювання [15].
Визначення рівнів СТХ I та СTX II дозволяє оцінити стан кістково-хрящової тканини при експериментальному ОА. CTX-I та CTX-II є, відповідно, маркерами деструкції кісткової та хрящової тканини, за рівнем яких можна досліджувати стан анаболічного і катаболічного процесів у суглобі. За даними літератури, маркери CTX-I та CTX-II широко використовуються в експериментальному вивченні патології суглобів [16]. M.R. Trăistaru та співавтори (2019) встановили підвищений рівень CTX-II у пацієнтів із гістологічною модифікацією хряща [17].
H. Cheng і співавтори (2020) [18] при пошуку досліджень, в яких вимірювали CTX-II у сечі у пацієнтів з ОА колінного суглоба та у здорових осіб контрольної групи, за даними PubMed, ScienceDirect і EMBASE (13 досліджень, 2856 учасників), показали, що рівні CTX-II у сечі можуть слугувати біомаркером ОА колінного суглоба.
А J.G. Convill і співавтори (2020) [19], згідно з аналізом результатів 80 досліджень за ідентифікацією 89 статистично значущих окремих молекулярних біомаркерів (бази даних MEDLINE та Embase, пошук у період із серпня 2013 до травня 2018 р.), продемонстрували, що CTX-II, визначений в сечі та сироватці крові, може прогнозувати прогресування ОА колінного суглоба. За даними 2 досліджень, концентрація фактора росту ендотелію судин синовіальної рідини є прогностичною ознакою прогресування ОА колінного суглоба. Такі дані підтверджені й в більш сучасних дослідженнях, де показано, що комбіноване визначення сироваткових концентрацій CTX-II і генерованого колагеназою карбокси-кінцевого неоепітопу колагену типу II може мати потенціал для оцінки та діагностики ОА на ранніх стадіях [20, 21].
Протягом останніх двох десятиліть для охоплення ланцюга шляху ОА біохімічні маркери всього суглоба, включаючи обмін кісток — CTX-I, PINP, OC, обмін хряща — C2M (похідна від MMP деградація колагену типу II), сироватковий N-пропептид колагену IIA (PIIANP) та COMP, запалення — hsCRP (високочутливий С-реактивний білок), IL-6 та біохімічний обмін сполучної тканини — C3M (MMP-похідна деградація колагену типу III), C1M (похідна MMP деградація колагену типу I), сироватковий перехресний зв’язок СТХ (ICTP) і MMP-9, а також пов’язані з кісткою антагоністи передачі сигналу Wnt — склеростин і DKK-1 — аналізувалися в різних дослідженнях [22].
Сильна кореляція між сироватковим CTX-ІІ та мікроструктурними змінами суглобового хряща після травми суглоба демонструє потенційне використання сироваткових біомаркерів для раннього виявлення дегенерації хряща [23].
Показано, що сечовий CTX-II мав найсильніші та послідовні асоціації з клінічними симптомами ОА, а також рентгенографічними доказами пошкодження суглобів. Відповідно, сечовий CTX-II може допомогти в ранній діагностиці ОА у симптоматичних пацієнтів без рентгенологічних ознак ОА. Протягом останніх трьох десятиліть вчені продемонстрували, що рівні біомаркерів у сироватці та сечі можуть забезпечити спосіб моніторингу ОА, і деякі з цих біомаркерів (медіатори та продукти деградації внутрішньосуглобової тканини, спроби відновлення та запалення) чітко пов’язані з біологічними та патологічними процесами при OA колінного суглоба [24, 25, 26, 27].
Але деякі автори вважають, що жоден із біомаркерів не виявився достатньо специфічним чи чутливим для ранньої діагностики та/або моніторингу окремих пацієнтів групи ризику та/або прогнозування перебігу захворювання з часом [28].
Питання оцінки ефективності лікування ОА, особливо структурно модифікуючого, на сьогодні є дуже важливим як для клінічної практики, так і для наукових досліджень. Існуючі інструменти за показниками інтенсивності болю і порушення функції не відповідають сучасним вимогам, вважаються деякою мірою суб’єктивними. Тому об’єктивізація маркерів, що підтверджують вплив різних методів лікування, видається найбільш перспективною для формування висновків.
У літературі широко дискутується питання використання хворобомодифікуючих препаратів повільної дії, що, за даними різних авторів, чинять позитивний вплив на структуру ураженого хряща.
Протягом багатьох років хондроїтину сульфат [29] та глюкозамін використовують як препарати повільної дії для лікування ОА, зменшення вираженості болю та покращення функції, а також за властивість модифікувати захворювання шляхом обмеження втрати об’єму хряща та зниження темпів прогресування звуження суглобової щілини. Однак в опублікованих дослідженнях щодо клінічної ефективності виявлено невідповідності, у яких повідомляється про відсутність значущих ефектів порівняно з плацебо. Терапевтичний ефект цих препаратів може залежати від багатьох змінних, таких як джерело походження, чистота та забруднення побічними продуктами.
A. Rabade та співавтори (2024) [30] провели оглядове дослідження, щоб оцінити ефективність та безпеку двох пероральних препаратів глюкозаміну сульфату, хондроїтину сульфату та їх комбінованого режиму лікування ОА колінного суглоба за допомогою пошуку літератури (1994–2022) з використанням різних електронних баз даних, включаючи PubMed, Embase, Cochrane Library та Google Scholar. У цей систематичний огляд включено 25 рандомізованих контрольованих досліджень (РКД) (9 РКД для глюкозаміну сульфату, 13 — для хондроїтину сульфату і 3 для їх комбінації). У всіх цих дослідженнях групи лікування порівнювали з плацебо. У метааналізі хондроїтину сульфат продемонстрував значне зниження інтенсивності болю та покращення фізичних функцій порівняно з плацебо; глюкозамін — значне зменшення звуження великогомілкової суглобової щілини. У той час як їх комбінація не показала ні зниження інтенсивності болю, ні будь-якого поліпшення фізичної функції. Поряд із тим відмічено незначне звуження суглобової щілини. Оцінка безпеки обох препаратів свідчила про сприятливий профіль безпеки та хорошу переносимість.
Хотілося б звернути увагу на те, що автори акцентують увагу на суб’єктивних симптомах і не враховують у висновку результатів небагатьох досліджень щодо комбінованого застосування хондроїтину сульфату і глюкозаміну стосовно покращення структурних змін, однак поряд із тим пояснюють відсутність широкого спектру випробувань комбінації цих препаратів.
За останнє десятиліття обговорення щодо доцільності та ефективності застосування симптоматичних препаратів сповільненої дії при ОА стали ще більш інтенсивними. Американська колегія ревматологів (American College of Rheumatology — ACR) до цього часу вважає їх використання сумнівним. У рекомендаціях Європейського альянсу ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR) пропонується включати хондроїтину сульфат у комплексне лікування хворих на ОА кистей, а в рекомендаціях Європейського товариства з клінічних і економічних аспектів остеопорозу та остеоартриту (The European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases — ESCEO) рекомендується їх застосування у пацієнтів з ОА колінних суглобів.
Вибір ефективної терапії для хворих на ОА завжди був складним завданням та оскільки результати досліджень мають різні висновки, ця проблема потребує подальших досліджень.
Мета. Комплексна оцінка ролі біохімічних маркерів PIINP і CTX-II у моніторингу руйнування хрящової тканини та ефективності лікування за даними сучасної літератури, а також визначення терапевтичних можливостей хондропротекторної терапії на основі риб’ячого колагену пептиду, глюкозаміну гідрохлориду, кальцію глюконату, метилсульфонілметану, гіалуронової кислоти, екстракту ункарії опушеної, маточного молочка (дієтична добавка Артікон) на симптоми та динаміку рівнів PIINP і CTX-II при ОА колінних суглобів.
Матеріали і методи. Здійснено науковий пошук у друкованих і електронних виданнях, наукових пошукових базах із застосуванням методів аналізу, порівняння й узагальнення інформаційних даних про взаємозв’язок ОА з маркерами дегенерації хряща і кістки. У проведеному дослідженні на базі ревматологічного відділення КНП «Тернопільська обласна клінічна лікарня» Тернопільської обласної ради кафедри внутрішньої медицини № 2 Тернопільського національного медичного університету імені І.Я. Горбачевського МОЗ України брали участь 52 амбулаторних та стаціонарних хворих жінок із первинним гонартрозом І–ІІ рентгенологічної стадії за Kellgren і Lawrence. Критеріями виключення з дослідження були цукровий діабет у стадії декомпенсації, ожиріння ІІ–ІІІ ст., вірусні та інфекційні захворювання в стадії загострення, онкологічна патологія, протезований суглоб, пацієнти із супутніми системними захворюваннями у стадії загострення, період вагітності, годування грудьми. Усі пацієнти підписали інформовану згоду на участь у дослідженні. В основну групу включено 32 жінки (середній вік (Me (IQR)) 58,0 (48,5; 65,5), середня тривалість захворювання (Me (IQR)) 10 (6,5; 12,0) років). 2-га група включала 20 жінок. Середній вік пацієнтів (Me (IQR)) становив 55,0 (52,5; 59,0) років з тривалістю недуги (Me (IQR)) 11,0 (10,0; 16,0) років. Діагноз первинного гонартрозу встановлено згідно з наказом МОЗ України від 12.10.2006 р. № 676 та діагностичними критеріями ACR 2019 р., що включали збір скарг, анамнезу, проведення клініко-лабораторних й інструментальних досліджень, визначення антропометричних показників, а саме зросту, маси тіла, індексу маси тіла (ІМТ) — ІМТ = маса тіла (кг)/зріст2 (м2), окружності стегон (ОС), окружності талії (ОТ) та співвідношення OT/OC. Використовували загальноприйняті методи клінічного дослідження суглобів (огляд, пальпація, вимірювання кінцівок та суглобів, визначення ступеня рухливості суглобів), інструментального (рентгенографія, ультразвукове дослідження (УЗД) та магнітно-резонансна томографія (МРТ) суглобів) та лабораторного методів обстеження (клінічний аналіз крові, рівні глюкози, трансаміназ, білірубіну, сечовини, креатиніну, ревматоїдного фактора, С-реактивного білка (СРБ), загального холестерину, ліпопротеїдів високої щільності (ЛПВЩ), ліпопротеїдів низької щільності (ЛПНЩ), тригліцеридів, кальцію, калію, магнію, загального білка та сечової кислоти). За допомогою імуноферментного методу визначали біомаркери ОА PIINP та CTX-II.
Визначення рівня PIINP та CTX-II проводили на імуноферментному аналізаторі «Multiskan FС-357» у Міжкафедральній навчально-дослідній лабораторії Тернопільського національного медичного університету ім. І.Я. Горбачевського МОЗ України із використанням набору для аналізу ELISA Kit згідно з методикою виробника.
Проведено аналіз інтенсивності больового синдрому за візуально-аналоговою шкалою (ВАШ), індексом тяжкості для гонартрозу (сумарного індексу Лекена), індексом WOMAC та виявлення нейропатичного болю. Для цього використовували стандартизовані опитувальники пацієнтів.
З метою вивчення ефективності запропонованого методу лікування всі пацієнти були розділені на дві групи: пацієнти 1-ї групи отримували стандартне лікування ОА (нестероїдні протизапальні препарати (НПЗП), фізіотерапевтичне лікування), а пацієнти 2-ї групи — в комплексі зі стандартною терапією ОА вживали дієтичну добавку Артікон (перорально 50 мл 1 раз на добу щодня протягом 3 міс).
Статистичний аналіз результатів досліджень проведено за допомогою комп’ютерних програм «Excel 2016» і «Statistica Version 12». Статистична обробка проводилася методами статистичного аналізу [31].
Перевірці статистичних гіпотез про відмінність до та після лікування досліджуваних даних передувала оцінка нормальності розподілу кількісних ознак із використанням критерію Колмогорова — Смірнова.
Зважаючи на обмежену кількість пацієнтів у кожній із досліджуваних груп, яка коливалася від 20 до 32, а також на результати перевірки на відповідність вибірок нормальному закону розподілу з використанням критерію Колмогорова — Смірнова, порівняння розрахованих коефіцієнтів асиметрії та ексцесу з відповідними критичними значеннями, зроблено висновок про невідповідність їх нормальному закону розподілу.
Для перевірки статистичних гіпотез про несуттєву відмінність до лікування експериментальних показників при невідповідності досліджуваних даних нормальному закону розподілу було використано непараметричний критерій Манна — Уїтні для незалежних вибірок [32].
Для порівняння залежних вибірок (до та після лікування) використано парний критерій Вілкоксона. Відмінності вважали достовірними при значенні р<0,05, що загальноприйнято для медико-біологічних досліджень.
Результати дослідження та їх обговорення
Включені в дослідження пацієнти з первинним гонартрозом були розподілені на дві клінічні групи: 1-ша група (n=20) — хворі, які отримували стандартну терапію ОА (НПЗП, хондропротектори, фізіотерапевтичне лікування, симптоматичне лікування); 2-га група (n=32) — пацієнти, які в комплексі зі стандартною терапією ОА отримували дієтичну добавку Артікон. Обстеження проводили двічі: перед початком лікування (при госпіталізації) та після 90-го дня терапії.
Клініко-лабораторну характеристику пацієнтів (n=52) з ОА до лікування наведено в табл. 1.
| Показник, одиниці вимірювання | І група (n=20)Me (IQR) | ІІ група (n=32)Me (IQR) |
|---|---|---|
| Вік, роки | 55,0 (52,5; 59,0) | 58,0 (48,5; 65,5) |
| Тривалість захворювання, роки (Me (IQR)) | 11,0 (10,0; 16,5) | 10,0 (6,5; 12,0) |
| САТ, мм рт. ст. (Me (IQR)) | 145,0 (120,0; 170,0) | 150,0 (130,0; 160,0) |
| ДАТ, мм рт. ст. (Me (IQR)) | 87,5 (80,0; 100,0) | 90,0 (80,0; 100,0) |
| ІМТ, кг/м2 (Me (IQR)) | 31,8 (25,3; 35,6) | 30,055 (26,7; 31,2) |
| ВАШ, мм (Me (IQR)) | 80,0 (70,0; 90,0) | 80,0 (75,0; 90,0) |
| Індекс WOMAC (Me (IQR)) | 68,0 (59,0; 82,0) | 68,0 (63,0; 84,0) |
| Індекс Лекена (Me (IQR)) | 9,5 (7,0; 11,0) | 10,0 (8,0; 13,5) |
| Рентгенологічна стадія | 2,0 (1,5; 2,0) | 2,0 (1,5; 2,0) |
| Глюкоза, ммоль/л (Me (IQR)) | 4,81 (4,00; 5,50) | 5,6 (5,11; 5,97) |
| Загальний ХС, ммоль/л (Me (IQR)) | 6,4 (5,7; 6,7) | 6,7 (6,2; 6,9) |
| ХС ЛПВЩ, ммоль/л (Me (IQR)) | 1,2 (1,1; 1,5) | 1,3 (1,1; 1,7) |
| ХС ЛПНЩ, ммоль/л (Me (IQR)) | 3,7 (2,5; 4,4) | 3,9 (3,4; 4,7) |
| ТГ, ммоль/л (Me (IQR)) | 1,5 (0,8; 2,3) | 1,4 (1,2; 2,1) |
| КА, ОД (Me (IQR)) | 3,3 (1,8; 7,0) | 3,2 (2,2; 4,8) |
| СК, мкмоль/л (Me (IQR)) | 283,0 (216,0; 358,0) | 303,5 (261,5; 350,0) |
| СРБ, мг/л (Me (IQR)) | 2,7 (1,1; 12,9) | 2,4 (1,3; 3,7) |
| АсАТ, Од/л (Me (IQR)) | 18,2 (11,7; 26,8) | 21,8 (16,6; 25,4) |
| АлАТ, Од/л (Me (IQR)) | 16,9 (10,40; 34,0) | 25,7 (18,3; 27,0) |
| Білірубін, мкмоль/л (Me (IQR)) | 8,5 (5,3; 23,1) | 8,7 (8,3; 10,1) |
| Ca, ммоль/л (Me (IQR)) | 2,4 (1,9; 2,7) | 2,4 (2,1; 2,6) |
| К, ммоль/л (Me (IQR)) | 4,2 (3,7; 5,0) | 4,2 (4,0; 4,7) |
| Na, ммоль/л (Me (IQR)) | 141,0 (137,0; 149,0) | 144,0 (138,5; 145,0) |
| Білок загальний, г/л (Me (IQR)) | 71,8 (62,0; 80,8) | 70,4 (69,0; 77,0) |
| Креатинін, мкмоль/л (Me (IQR)) | 77,5 (59,0; 98,0) | 75,0 (69,0; 88,0) |
| Сечовина, ммоль/л (Me (IQR)) | 4,5 (3,3; 8,8) | 4,8 (4,5; 6,4) |
| PIINP, пг/мл (Me (IQR)) | 3218,0 (1295,0; 4647,0) | 3594,5 (2399,0; 6495,0) |
| CTX-II, нг/мл (Me (IQR)) | 0,6 (0,4; 0,9) | 0,6 (0,4; 0,96) |
Примітки. Me (IQR): медіана та інтерквартильний діапазон. САТ — систолічний артеріальний тиск; ДАТ — діастолічний артеріальний тиск; ХС — холестерин; ТГ — тригліцериди; СК — сечова кислота; АсАТ — аспартатамінотрасфераза; АлАТ — аланінамінотрансфераза; КА — коефіцієнт атерогенності.
Обидві групи обстежуваних є репрезентативними за віком, статтю, клінічними та лабораторними показниками. Загалом у пацієнтів обох груп спостерігається незначне підвищення ІМТ, наявність артеріальної гіпертензії І ступеня та дисліпідемії (підвищення рівня загального холестерину та зниження ХС ЛПВЩ) та достатньо високі рівні ВАШ, індексів Лекена і WOMAC. Поряд з тим у переважної більшості пацієнтів виявлено ІІ стадію гонартрозу.
Результати порівняльного аналізу інтенсивності больового синдрому за ВАШ відповідно до рис.1 наведено в табл. 2 у групах до лікування стандартною терапією (ДЛСТ), до лікування стандартною терапією з додаванням дієтичної добавки Артікон (ДЛТА), після лікування стандартною терапією (ПЛСТ) та після лікування стандартною терапією з додаванням дієтичної добавки Артікон (ПЛТА).
| № п/п | Групи порівняння | Медіана, Me (IQR) | Рівень значущості | Наявність (+) / відсутність (-) статистично значущої відмінності |
|---|---|---|---|---|
| 1 | ДЛСТ | 80,0 (70,0; 90,0) | 0,000089 | + (***) |
| ПЛСТ | 40,0 (50,0; 52,5) | |||
| 2 | ДЛТА | 80,0 (75,0; 90,0) | 0,000001 | + (***) |
| ПЛТА | 25,0 (25,0;35,0) | |||
| 3 | ДЛСТ | 80,0(70,0; 90,0) | 0,87 | – |
| ДЛТА | 80,0 (75,0; 90,0) | |||
| 4 | ПЛСТ | 40,0(50,0; 52,5) | 0,000017 | + (***) |
| ПЛТА | 25,0 (25,0; 35,0) |
*0,01<p<0,05; **0,001<p<0,01; ***p<0,001.
За результатами порівняльного аналізу (див. табл. 2 та рис. 1), встановлено достовірну відмінність в групах пацієнтів з ОА ДЛСТ та ПЛСТ з рівнем значущості р=0,000089<0,001, а також до та після лікування стандартною терапією з додаванням дієтичної добавки Артікон з рівнем значущості р=0,000001<0,001.
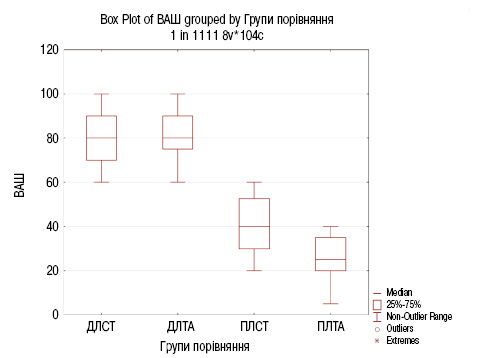
Відсутність достовірної відмінності встановлено при порівнянні двох груп ДЛСТ та ДЛТА (р=0,87), що додатково підтверджує відповідність пацієнтів обох груп критеріям відбору.
Ефективність лікування ОА стандартною терапією з додаванням дієтичної добавки Артікон при порівнянні інтенсивності больового синдрому за ВАШ підтверджує статистично значима відмінність між групами ПЛТА порівняно з групою ПЛСТ з рівнем значущості р=0,000017<0,001. Також виявлено, що значення медіани показника ВАШ у групі ПЛТА (25,0 (25,0; 35,0)) на 15 одиниць менше порівняно з групою ПЛСТ (40,0 (50,0; 52,5)), що додатково вказує на ефективність використання стандартної терапії з додаванням дієтичної добавки Артікон, завдяки глюкозамін гідрохлориду, який стимулює синтез протеогліканів, знижуючи больовий синдром, та метилсульфонілметану (МСМ), який має протизапальний ефект, що посилює зниження ВАШ.
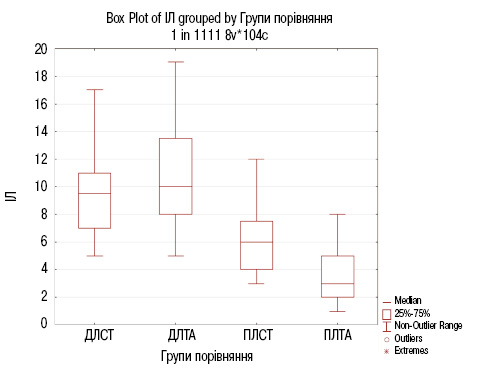
Результати порівняльного аналізу сумарного індексу Лекена (індекс тяжкості для гонартрозу) наведено на рис. 2 та в табл. 3.
| № п/п | Групи порівняння | Медіана | Рівень значущості | Наявність (+) / відсутність (-) статистично значущої відмінності |
|---|---|---|---|---|
| 1 | ДЛСТ | 9,5 (7,0; 11,0) | 0,000144 | + (***) |
| ПЛСТ | 6,0 (4,2; 7,5) | |||
| 2 | ДЛТА | 10,0 (8,0; 13,5) | 0,000001 | + (***) |
| ПЛТА | 3,0 (2,0; 5,0) | |||
| 3 | ДЛСТ | 9,5 (7,0; 11,0) | 0,25 | – |
| ДЛТА | 10,0 (8,0; 13,5) | |||
| 4 | ПЛСТ | 6,0 (4,2; 7,5) | 0,000134 | + (***) |
| ПЛТА | 3,0 (2,0; 5,0) |
*0,01<p<0,05; **0,001<p<0,01; ***p<0,001.
Відповідно до результатів порівняльного аналізу (див. табл. 3 та рис. 2), встановлено достовірну відмінність в групах пацієнтів з ОА у групах ДЛСТ та ПЛСТ з рівнем значущості р=0,000144<0,001, а також до та після лікування стандартною терапією з додаванням дієтичної добавки Артікон з рівнем значущості р=0,000001<0,001.
Відсутність достовірної відмінності встановлено при порівнянні двох груп ДЛСТ та ДЛТА (р=0,25), що додатково підтверджує відповідність пацієнтів обох груп критеріям відбору.
Ефективність лікування ОА стандартною терапією з додаванням дієтичної добавки Артікон при аналізі сумарного індексу Лекена підтверджує статистично значима відмінність між групою ПЛТА порівняно з групою ПЛСТ з рівнем значущості р=0,000134<0,001. Значення медіани індексу Лекена у групі ПЛТА (3,0 (2,0; 5,0)) на 3 одиниці менше порівняно з групою ПЛСТ (6,0 (4,2; 7,5)), що свідчить про значне покращення стану пацієнтів. Ефективність Артікону як доповнення до стандартної терапії, зумовлена дією його компонентів: риб’ячий колаген пептид та глюкозаміну гідрохлорид сприяють регенерації хряща, метилсульфонілметан та екстракт ункарії опушеної зменшують вираженість запалення, а гіалуронова кислота покращує змащення суглобів. Це пояснює зниження больового синдрому та покращення функціональності суглобів.
Результати порівняльного аналізу індексу WOMAC (Western Ontario and McMaster University)
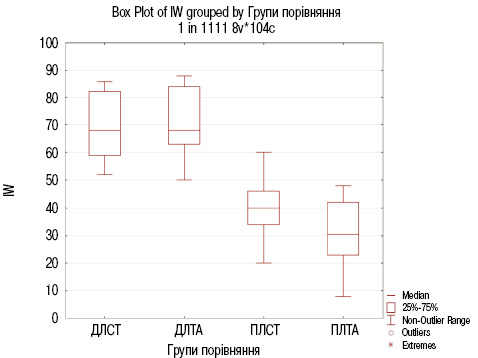
Результати порівняльного аналізу індексу WOMAC наведено в рис. 3 та табл. 4.
| № п/п | Групи порівняння | Me (IQR) | Рівень значущості | Наявність (+) / відсутність (-) статистично значущої відмінності |
|---|---|---|---|---|
| 1 | ДЛСТ | 68,0 (59,0; 82,0) | 0,000132 | + (***) |
| ПЛСТ | 40,0 (34,0; 46,0) | |||
| 2 | ДЛТА | 68,0 (63,0; 84,0) | 0,000001 | + (***) |
| ПЛТА | 30,5 (23,0; 42,0) | |||
| 3 | ДЛСТ | 68,0 (59,0;82,0) | 0,55 | – |
| ДЛТА | 68,0 (63,0;84,0) | |||
| 4 | ПЛСТ | 40,0 (34,0;46,0) | 0,027762 | + (*) |
| ПЛТА | 30,5 (23,0; 42,0) |
*0,01<p<0,05; **0,001<p<0,01; ***p<0,001.
Провівши порівняльний аналіз індексу WOMAC (див. табл. 4 та рис. 3), встановлено достовірну відмінність в досліджуваних пацієнтів з ОА в групах ДЛСТ та ПЛСТ з рівнем значущості р=0,000132<0,001, а також до та після лікування стандартною терапією з додаванням дієтичної добавки Артікон з рівнем значущості р=0,000001<0,001.
Відсутність достовірної відмінності встановлено при порівнянні двох груп ДЛСТ та ДЛТА (р=0,55), що додатково підтверджує відповідність пацієнтів обох груп критеріям відбору.
Результати порівняльного аналізу індексу WOMAC вказують на значну ефективність додавання Артікону до стандартної терапії для пацієнтів з ОА. Медіана індексу WOMAC у групі ПЛТА (30,5 (23,0; 42,0)) була на 10 одиниць нижчою порівняно з групою ПЛСТ (40,0 (34,0; 46,0)), що підтверджує покращення функціонального стану та зменшення вираженості больового синдрому. Ці результати статистично значущі з р=0,027762<0,05. Механізми дії компонентів Артікону, таких як глюкозамін для підтримки хряща, протизапальний МСМ, риб’ячий колаген для регенерації, забезпечують синергічний ефект, який підвищує ефективність стандартної терапії, зменшуючи вираженість болю і покращуючи мобільність суглобів.
Результати порівняльного аналізу біохімічного маркера ОА PIINP
Результати порівняльного аналізу біохімічного маркера ОА PIINP наведено в рис. 4 та табл. 5.
| № п/п | Групи порівняння | Медіана | Рівень значущості | Наявність (+) / відсутність (–) статистично значущої відмінності |
|---|---|---|---|---|
| 1 | ДЛСТ | 3218,0 (1295,0; 4647,0) | 0,1 | – |
| ПЛСТ | 3559,50 (1255,5; 5032,0) | |||
| 2 | ДЛТА | 3594,50 (2399,0; 6495,0) | 0,000 | + (***) |
| ПЛТА | 4105,5 (3343,0; 8293,0) | |||
| 3 | ДЛСТ | 3218,0 (1295,0; 4647,0) | 0,07 | – |
| ДЛТА | 3594,50 (2399,0; 6495,0) | |||
| 4 | ПЛСТ | 3559,50 (1255,5; 5032,0) | 0,02 | + (*) |
| ПЛТА | 4105,5 (3343,0; 8293,0) |
*0,01<p<0,05; **0,001<p<0,01; ***p<0,001.
За результатами порівняльного аналізу (див. табл. 5 та рис. 4), встановлено відсутність достовірної відмінності при порівнянні двох груп ДЛСТ та ПЛСТ (р=0,1). Натомість виявлено високу достовірну відмінність в досліджуваних пацієнтів з ОА в групах ДЛТА та ПЛТА з рівнем значущості р=0,000<0,001.
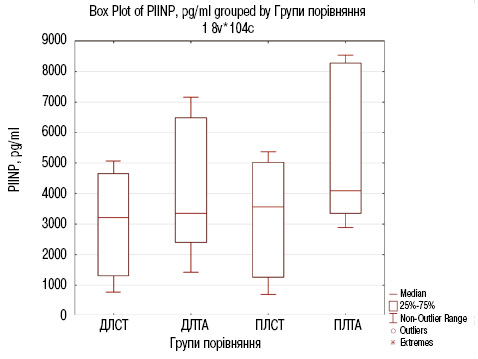
Відсутність достовірної відмінності встановлено при порівнянні двох груп ДЛСТ та ДЛТА (р=0,07), що додатково підтверджує відповідність пацієнтів обох груп критеріям відбору.
Результати порівняльного аналізу біохімічного маркера PIINP свідчать про значну ефективність додавання Артікону до стандартної терапії для пацієнтів з ОА. У групі ПЛТА значення медіани PIINP (4105,5 (3343,0; 8293,0)) було на 546 одиниць вище, ніж у групі ПЛСТ (3559,50 (1255,5; 5032,0)), з рівнем значущості р=0,02<0,05. Це зростання показника PIINP вказує на активізацію процесів регенерації хрящової тканини, що підтверджує позитивний вплив Артікону, сприяючи відновленню структури суглоба завдяки дії риб’ячого колагену, глюкозаміну та інших компонентів, які стимулюють синтез колагену і підтримують здоров’я хряща.
Результати порівняльного аналізу біохімічного маркера ОА CTX-II
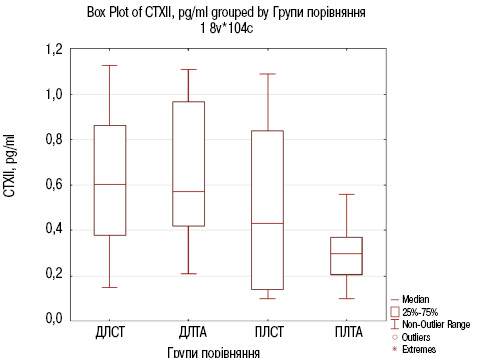
Результати порівняльного аналізу біохімічного маркера ОА CTX-II наведено в рис. 5 та табл. 6.
 /div>
/div>
| № п/п | Групи порівняння | Медіана | Рівень значущості | Наявність (+) / відсутність (-) статистично значущої відмінності |
|---|---|---|---|---|
| 1 | ДЛСТ | 0,6 (0,4; 0,9) | 0,014005 | + (*) |
| ПЛСТ | 0,5 (0,1; 0,8) | |||
| 2 | ДЛТА | 0,6 (0,4; 0,96) | 0,000004 | + (***) |
| ПЛТА | 0,3 (0,2; 0,4) | |||
| 3 | ДЛСТ | 0,6 (0,4; 0,9) | 0,449677 | – |
| ДЛТА | 0,6 (0,4; 0,96) | |||
| 4 | ПЛСТ | 0,5 (0,1; 0,8) | 0,326525 | – |
| ПЛТА | 0,3 (0,2; 0,4) |
*0,01<p<0,05; **0,001<p<0,01; ***p<0,001
Відповідно до результатів порівняльного аналізу (див. табл. 6 та рис. 5), встановлено достовірну відмінність в групах пацієнтів з ОА у групах ДЛСТ та ПЛСТ з рівнем значущості р=0,014005<0,05, а також до та після лікування стандартною терапією з додаванням дієтичної добавки Артікон з рівнем значущості р=0,000004<0,001.
Відсутність достовірної відмінності встановлено при порівнянні двох груп ДЛСТ та ДЛТА (р=0,449677), що додатково підтверджує відповідність пацієнтів обох груп критеріям відбору.
Результати порівняльного аналізу біохімічного маркера CTX-II свідчать, що додавання Артікону до стандартної терапії зумовлює суттєве зниження показників руйнування хрящової тканини. У групі ПЛТА значення медіани CTX-II (0,302 (0,207; 0,376)) було на 0,164 одиниці нижче порівняно з групою ПЛСТ (0,466 (0,141; 0,836)), що є статистично значущим при р=0,000004<0,001. Це зниження CTX-II свідчить про сповільнення деградації хряща завдяки компонентам Артікону, зокрема риб’ячому колагену та МСМ, які допомагають зменшити вираженість запальних процесів та підтримують структуру суглоба.
ВИСНОВКИ
- Проведений аналіз літератури свідчить про важливість біохімічних маркерів PIINP і CTX-II у контексті оцінки хрящової тканини та ефективності терапевтичних втручань. Зміни в рівнях цих маркерів можуть слугувати індикаторами не лише руйнування хряща, а й стимуляції синтезу кісткової тканини. Зниження CTX-II у відповідь на терапію свідчить про позитивні зміни, тоді як підвищення PIINP демонструє активні процеси регенерації.
- Результати власних досліджень підтверджують, що хондропротекторна терапія на основі риб’ячого колагену пептиду, глюкозаміну гідрохлориду, кальцію глюконату, метилсульфонілметану, гіалуронової кислоти, екстракту ункарії опушеної, маточного молочка (Артікон) протягом 90 днів чинить статистично значущий позитивний вплив на симптоми ОА колінних суглобів, включаючи зниження інтенсивності болю на 37,5% порівняно з групою, яка приймала стандартну терапію, та покращення рухливості на 50%. Встановлена позитивна динаміка рівнів PIINP і CTX-II свідчить про потенціал цієї терапії в уповільненні прогресії ОА колінних суглобів.
Список використаної літератури
- 1. Berenbaum F. (2013) Osteoarthritis as an inflammatory disease (osteoarthritis is not osteoarthrosis! Osteoarthr. Cartil.; 21(1): 16–21. doi:10.1016/j.joca.2012.11.012.
- 2. Liem Y., Judge A., Kirwan J. et al. (2020) Multivariable logistic and linear regression models for identification of clinically useful biomarkers for osteoarthritis. Sci. Rep. Jul 9; 10(1): 11328. doi: 10.1038/s41598-020-68077-0. PMID: 32647218; PMCID: PMC7347626.
- 3. Burch J., Rice S., Yang H. et al. (2014) Systematic review of the use of bone turnover markers for monitoring the response to osteoporosis treatment: the secondary prevention of fractures, and primary prevention of fractures in high-risk groups. Health Technol. Assess (Rockv); 18(11): 1–180. doi:10.3310/hta18110.
- 4. Zhou H., Lu S.S., Dempster D.W. (2010) Bone remodeling: cellular activities in bone. Osteoporosis in Men:15–24. doi:10.1016/B978-0-12-374602-3.00002-X.
- 5. Ogata T., Ideno Y., Akai M. et al. (2018) Effects of glucosamine in patients with osteoarthritis of the knee: a systematic review and meta-analysis. Clin. Rheumatol., 37(9): 2479–2487.
- 6. Duclos M.E., Roualdes O., Cararo R. et al. (2010) Significance of the serum CTX-II level in an osteoarthritis animal model: a 5-month longitudinal study. Osteoarthritis Cartilage, 18(11): 1467–1476.
- 7. Mobasheri A., Bay-Jensen A.C., van Spil W.E. et al. (2017) Osteoarthritis Year in Review 2016: biomarkers (biochemical markers). Osteoarthritis Cartilage, 25(2): 199–208.
- 8. Watt F.E. (2018) Osteoarthritis biomarkers: year in review. Osteoarthr. Cartil.; 26(3): 312–318. doi:10.1016/j.joca.2017.10.016.
- 9. Fernández-Puente P., Calamia V., González-Rodríguez L. et al. (2017) Multiplexed mass spectrometry monitoring of biomarker candidates for osteoarthritis. J. Proteomics.; 152: 216–225. doi:10.1016/j.jprot.2016.11.012.
- 10. Haraden C.A., Huebner J.L., Hsueh M.F. et al. (2019) Synovial fluid biomarkers associated with osteoarthritis severity reflect macrophage and neutrophil related inflammation. Arthritis Res. Ther.; 21(1): 1. doi:10.1186/s13075-019-1923-x).
- 11. Izaguirre A., González-Gutiérrez G., Galindo-López S.E. et al. (2021) Evaluation of biomarkers of joint damage in patients subjected to arthroscopy. Int. Orthop. Jun; 45(6): 1413–1420. doi: 10.1007/s00264-020-04829-x. Epub 2020 Oct 1. PMID: 33005990.
- 12. Duclos M.E., Roualdes O., Cararo R. et al. (2010) Significance of the serum CTX-II level in an osteoarthritis animal model: a 5-month longitudinal study. Osteoarthritis Cartilage, 18(11): 1467–1476.
- 13. Sharif M., Kirwan J., Charni N. et al. (2007) A 5-yr longitudinal study of type IIA collagen synthesis and total type II collagen degradation in patients with knee osteoarthritis — association with disease progression. Rheumatology (Oxford), 46(6): 938–943.
- 14. Jordan K.M., Syddall H.E., Garnero P. et al. (2006) Urinary CTX-II and glucosyl-galactosyl-pyridinoline are associated with the presence and severity of radiographic knee osteoarthritis in men. Ann. Rheum. Dis, 65(7): 871–877.
- 15. Nagy E.E., Nagy-Finna C., Popoviciu H. et al. (2020) Soluble Biomarkers of Osteoporosis and Osteoarthritis, from Pathway Mapping to Clinical Trials: An Update. Clin. Interv. Aging. Apr 8; 15: 501–518. doi: 10.2147/CIA.S242288. PMID: 32308378; PMCID: PMC7152733.
- 16. Sergeevich Nosivets D. (2022) Bone and cartilage condition in experimental osteoarthritis and hypothyroidism. Med. Glas. (Zenica). Feb 1; 19(1). doi: 10.17392/1429-21. Epub ahead of print. PMID: 35048626.
- 17. Trăistaru M.R., Kamal D., Maria D.T. et al. (2019) Complex evaluation in patients with knee osteoarthritis. Rom. J. Morphol. Embryol.; 60(1): 167–174. PMID: 31263841.
- 18. Cheng H., Hao B., Sun J. et al. (2020) C-Terminal Cross-Linked Telopeptides of Type II Collagen as Biomarker for Radiological Knee Osteoarthritis: A Meta-Analysis. Cartilage. Oct; 11(4): 512–520. doi: 10.1177/1947603518798884. Epub 2018 Sep 15. PMID: 30221987; PMCID: PMC7488952.
- 19. Convill J.G., Tawy G.F., Freemont A.J. et al. (2021) Clinically Relevant Molecular Biomarkers for Use in Human Knee Osteoarthritis: A Systematic Review. Cartilage. Dec; 13(Suppl. 1): 1511S–1531S. doi: 10.1177/1947603520941239. Epub 2020 Jul 17. PMID: 32680434; PMCID: PMC8808945.
- 20. Fan Y., Li R., Deng X. et al. (2024) Sensitive osteoarthritis sensing by salt-induced aggregation and dispersion of gold nanoparticles. Biotechnol. Appl. Biochem. Apr 12. doi: 10.1002/bab.2588. Epub ahead of print. PMID: 38606832.
- 21. Yu F., Bai H., Zhang Z. et al. (2023) Combined detection of serum CTX-II and C2C in a rat model of ACLT-induced osteoarthritis. FEBS Open Bio. Aug; 13(8): 1485–1494. doi: 10.1002/2211-5463.13613. Epub 2023 Jun 11. PMID: 37062041; PMCID: PMC10392046).
- 22. Bay-Jensen A.C., Hoegh-Madsen S., Dam E. et al. (2010) Which elements are involved in reversible and irreversible cartilage degradation in osteoarthritis? Rheumatol. Int.; 30(4): 435–442. doi:10.1007/s00296-009-1183-1).
- 23. Coyle C.H., Henry S.E., Haleem A.M. et al. (2012) Serum CTXii Correlates With Articular Cartilage Degeneration After Anterior Cruciate Ligament Transection or Arthrotomy Followed by Standardized Exercise. Sports Health. Nov; 4(6): 510–7. doi: 10.1177/1941738112451425. PMID: 24179591; PMCID: PMC3497947.
- 24. Davis C.R., Karl J., Granell R. et al. (2007) Can biochemical markers serve as surrogates for imaging in knee osteoarthritis? Arthritis Rheum.; 56(12): 4038–4047.
- 25. Petersson I.F., Boegard T., Svensson B. et al. (1998) Changes in cartilage and bone metabolism identified by serum markers in early osteoarthritis of the knee joint. Rheumatology; 37(1): 46–50.
- 26. Sharif M., Kirwan J., Charni N. et al. (2007) A 5-yr longitudinal study of type IIA collagen synthesis and total type II collagen degradation in patients with knee osteoarthritis—association with disease progression. Rheumatology; 46(6): 938–943.
- 27. Van Spil W.E., Szilagyi I.A. (2019) Osteoarthritis year in review 2019: Biomarkers (biochemical markers) Osteoarthr. Cartil.; 27: 412–423.
- 28. Lotz M., Martel-Pelletier J., Christiansen C. et al. (2013) Value of biomarkers in osteoarthritis: Current status and perspectives. Ann. Rheum. Dis.; 72(11): 1756–1763.
- 29. Brito R., Costa D., Dias C. et al. (2023) Chondroitin Sulfate Supplements for Osteoarthritis: A Critical Review. Cureus. Jun 9; 15(6): e40192. doi: 10.7759/cureus.40192. PMID: 37431333; PMCID: PMC10329866.
- 30. Rabade A., Viswanatha G.L., Nandakumar K. et al. (2024) Evaluation of efficacy and safety of glucosamine sulfate, chondroitin sulfate, and their combination regimen in the management of knee osteoarthritis: a systematic review and meta-analysis. Inflammopharmacology. Jun; 32(3): 1759–1775. doi: 10.1007/s10787-024-01460-9. Epub 2024 Apr 6. PMID: 38581640.
- 31. Eman Atef, Somnath Singh (2024) Chapter 1 — Introduction: Terminology, Basic Mathematical Skills, and Calculations. Editor(s): Alekha K. Dash, Somnath Singh, Pharmaceutics (Second Edition), Academic Press. P. 3–21. ISBN 9780323997966. doi.org/10.1016/B978-0-323-99796-6.00010-2.
- 32. Chunrong Ai, Lukang Huang, Zheng Zhang (2020) A Mann–Whitney test of distributional effects in a multivalued treatment. Journal of Statistical Planning and Inference, Volume 209: 85–100. doi.org/10.1016/j.jspi.2020.03.002.
Відомості про авторів:
Сміян Світлана Іванівна — професорка, докторка медичних наук, завідувачка кафедри внутрішньої медицини № 2, Тернопільський національний медичний університет імені І.Я. Горбачевського МОЗ України, Тернопіль, Україна.
ORCID ID: 0000-0001-5543-9895
Боднар Роксолана Ярославівна — доцентка, кандидатка медичних наук, доцентка кафедри внутрішньої медицини № 2, Тернопільський національний медичний університет імені І.Я. Горбачевського МОЗ України, Тернопіль, Україна.
E-mail: bodnar_ry@tdmu.edu.ua
ORCID ID: 0000-0003-3621-8995
Сверстюк Андрій Степанович — професор, доктор технічних наук, професор кафедри медичної інформатики, Тернопільський національний медичний університет імені І.Я. Горбачевського МОЗ України, Тернопіль, Україна.
ORCID ID: 0000-0001-8644-0776

Leave a comment