Аналіз рівня лептину у пацієнтів з аксіальним спондилоартритом, які мають порушення мінеральної щільності кісткової тканини
Ситенко А.О.1, Борткевич О.П. 2
- 1ДУ «ННЦ «Інститут кардіології, клінічної та регенеративної медицини ім. акад. М.Д. Стражеска» НАМН України, Київ
- 2ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска» НАМН України, Київ
Резюме. Аксіальний спондилоартрит (АксСпА), що обмежує фізичну активність пацієнтів, розглядається як чинник ризику збільшення маси тіла. Своєю чергою, жирова тканина є метаболічним органом, що продукує адипокіни, які пов’язані з розвитком порушень мінеральної щільності кісткової тканини (МЩКТ) та надмірною масою тіла. Лептин — пептидний гормон жирової тканини (адипокін), що регулює харчову поведінку та метаболізм у кістковій тканині при остеопорозі у пацієнтів з АксСпА порівняно з контрольною групою та групою пацієнтів з іншими ревматологічними захворюваннями (псоріатичний артрит (ПсА), ревматоїдний артрит (РА)). Методи. У дослідженні взяли участь 56 пацієнтів, серед яких 16 жінок, 40 чоловіків. Кількість пацієнтів з АксСпА становила 26, з псоріатичним артритом — 6, з ревматоїдним артритом — 12, у групу контролю включили 6 пацієнтів без ревматологічного захворювання. Проведено аналіз індексу маси тіла (ІМТ), маси тіла, лабораторних показників активності — швидкості осідання еритроцитів (ШОЕ), С-реактивного білка (СРБ) та лептину. Для оцінювання МЩКТ використали результати проведених двохенергетичних рентгенівських абсорбціометрій (ДРA). Проаналізовано зв’язок між рівнем лептину, клінічними та лабораторними даними, а також результатами ДРA. Для порівняння груп використані непараметричні методи Крускала — Воліса, тест Манна — Уїтні. Для оцінки достовірності розбіжностей використовували критерій Пірсона (Х2). Для оцінки сили асоціації зв’язку (між рівнем лептину та масою тіла) проведено регресійний аналіз. Програмне забезпечення ST Statistica. Результати. Проведений аналіз асоціації меж рівнем лептину та масою тіла свідчить, що при АксСпА на кожен кілограм маси тіла припадає менша кількість лептину, ніж у контрольній групі. У групі з АксСпА у 10% (р=0,25) відмічено остеопороз, у групах ПсА — 0% (р=0,25) та РА — 5,9% (р=0,25), у групі контролю 3,8% (р=0,25). Усі групи достовірно не відрізняються за частотою остеопорозу; рівень лептину достовірно не пов’язаний з ризиком розвитку остеопорозу. Висновки. Пацієнти з АксСпА мають більшу медіану маси тіла та достовірно меншу медіану концентрації лептину порівняно з контрольною групою. Порівняно з контрольною групою при АксСпА змінюється сила асоціації між рівнем лептину та масою тіла. У пацієнтів з АксСпА ризик розвитку остеопорозу не асоціюється з рівнем лептину.
DOI: 10.32471/rheumatology.2707-6970.98.19276
Актуальність
Аксіальний спондилоартрит (АксСпА) — хронічне системне запальне захворювання сполучної тканини з переважним ураженням сакроіліальних з’єднань та хребта з формуванням синдесмофітів і подальшим анкілозуванням хребта, що часто поєднується з периферичним артритом, ентезитом, гострим переднім увеїтом та залученням внутрішніх органів (кишечник, серце, аорта, нирки, легені) [1]. АксСпА уражує до 1,4% дорослого працездатного населення і пов’язаний зі зниженням якості життя, підвищенням смертності та значними витратами, пов’язаними з охороною здоров’я, що накладає великий тягар на пацієнтів, осіб, які за ними доглядають, і суспільство [2]. Додатковими факторами, що обтяжують перебіг захворювання, є розвиток ожиріння як наслідок поступового зниження рухливості пацієнта та остеопорозу, що в подальшому призводить до виникнення таких ускладнень, як переломи тіл хребців та шийки стегнової кістки [3]. Слід зауважити, що жирова тканина є метаболічним органом і продукує адипокіни, які пов’язані з розвитком порушень мінеральної щільності кісткової тканини (МЩКТ) та надмірною масою тіла [4]. Лептин — пептидний гормон жирової тканини (адипокін), що регулює харчову поведінку та метаболізм у кістковій тканині [5]. Він секретується імпульсно переважно адипоцитами і, таким чином, його рівень відображає кількість жирової тканини в організмі [6]. Лептин також вважається прозапальним цитокіном, враховуючи його здатність стимулювати проліферацію Т-клітин і підвищувати активацію Т-клітин [5, 7].
Мета дослідження: дослідити асоціацію між рівнем лептину та масою тіла з ризиком розвитку остеопорозу у пацієнтів з АксСпА порівняно з контрольною групою та групою пацієнтів з іншими ревматологічними захворюваннями (псоріатичний артрит (ПсА), ревматоїдний артрит).
Матеріали і методи дослідження
Дизайн дослідження. Відкрите проспективне порівняльне дослідження. Пацієнти розподілені на 4 групи — основна група — пацієнти з АксСпА (відповідно до критеріїв оцінки Міжнародного товариства спондилоартриту (Assessment of SpondyloArthritis International Society — ASAS)), група порівняння — ПсА (критерії Класифікації ПсА (Classification Criteria for Psoriatic Arthritis — CASPAR)); ревматоїдний артрит (Американського коледжу ревматологів (American College of Rheumatology — ACR) / Європейського альянсу ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR) 2010 р.); група контролю — пацієнти без ревматологічного захворювання. У дослідженні брали участь 56 пацієнтів, серед яких 16 жінок, 40 чоловіків. Кількість пацієнтів з АксСпА становила 26, з ПсА — 6, з ревматоїдним артритом — 12, групу контролю складали 6 пацієнтів без ревматологічного захворювання (рис. 1).
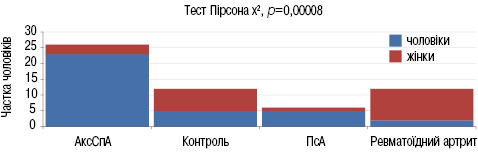
Оцінка клінічних показників захворювання
Проведене загальноклінічне обстеження пацієнтів з урахуванням віку (роки), статі (чоловіча / жіноча), тривалості захворювання (роки), індексу маси тіла (ІМТ), маси тіла (кг).
Рівень лептину. Лабораторне обстеження включало клініко-біохімічний аналіз крові з визначенням концентрації лептину в сироватці крові імуноферментним методом (Leptin Elisa, Німеччина). Референтні значення лептину для жінок становили 3,7–11,1 нг/мл, у чоловіків — 2,0–5,6 нг/мл.
Оцінка показників МЩКТ. Показники МЩКТ оцінювали за результатами двохенергетичної рентгенівської абсорбціометрії на приладі HOLOGIC Explorer (HOLOGIC, США).
Статистичний аналіз. Для порівняння груп використані непараметричні методи Крускала — Воліса, тест Манна — Уїтні. Для оцінки достовірності розбіжностей використовувався критерій Пірсона (Х2). Для оцінки сили асоціації зв’язку (між рівнем лептину та масою тіла) проведено регресійний аналіз. Програмне забезпечення — ST Statistica.
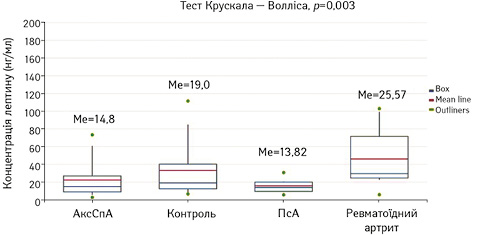
Результати. У групі пацієнтів з АксСПА медіана лептину становила МЕ 14,8 (р=0,003), у пацієнтів з ПсА — 13,82 (р=0,003), з ревматоїдним артритом — 25,57 (р=0,003), у групі контролю — 25,57 (р=0,003). Отже, найнижчі рівні лептину зафіксовано в групах з АксСпА та ПсА, найвищий — у групі пацієнтів з ревматоїдним артритом (рис. 2).
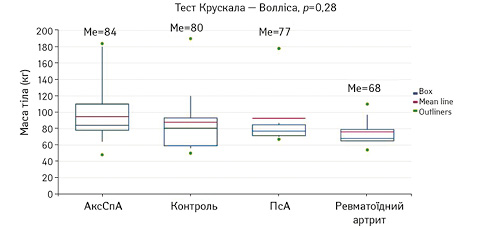
Оскільки рівень лептину має пряму залежність від маси тіла, усіх пацієнтів розподілено на групи за цим показником (рис. 3). У пацієнтів з АксСПА медіана маси тіла становила МЕ 84 кг (р=0,28), з ПсА — 77 кг (р=0,28), з ревматоїдним артритом — 68 кг (р=0,28), у групі контролю — 80 кг (р=0,28). Отже, пацієнти з АксСПА мають більшу МЕ маси тіла, але розбіжність не досягає статистичної достовірності.
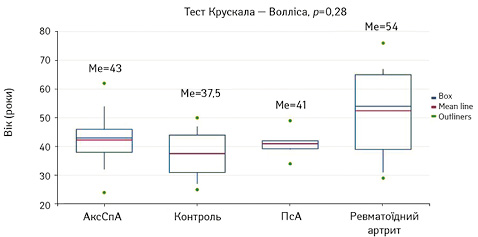
Пацієнтів також було розподілено за віком (рис. 4). У пацієнтів з АксСПА медіана віку становила МЕ 43 роки (р=0,28), з ПсА — МЕ 41 рік (р=0,28), з ревматоїдним артритом — МЕ 54 роки (р=0,28), у групі контролю — МЕ 37,5 року (р=0,28). Пацієнти з АксСпА належать до молодшої вікової групи за критеріями Всесвітньої організації охорони здоров’я (ВООЗ), розбіжність між групами за віком не досягає статистичної достовірності.
Надалі, оскільки пацієнти з АксСпА мали найбільшу медіану маси тіла, доцільно було оцінити асоціацію між рівнем лептину та масою тіла у цій групі пацієнтів і пацієнтів групи контролю. Саме група контролю відображає фізіологічний взаємозвʼязок між збільшенням маси тіла і рівнем лептину у сироватці крові. У результаті проведеного аналізу асоціації меж рівнем лептину та масою тіла встановлено, що при АксСпА на кожен кілограм маси тіла припадає менша кількість лептину, ніж у контрольній групі (рис. 5).
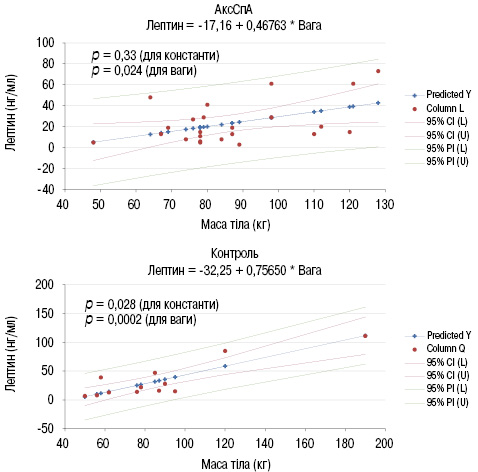
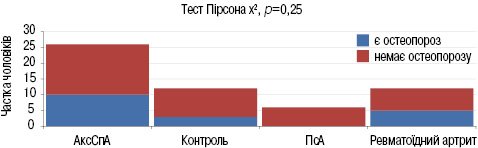
Розподіл поширеності зниження МЩКТ, зокрема остеопорозу, в досліджуваних групах проводили наступним чином. У групі пацієнтів з АксСпА 10% (р=0,25) мали остеопороз, з ПсА — 0% (р=0,25), з РА — 5,9% (р=0,25), у групі контролю — 3,8% (р=0,25). Усі групи достовірно не відрізняються за частотою остеопорозу (рис. 6).
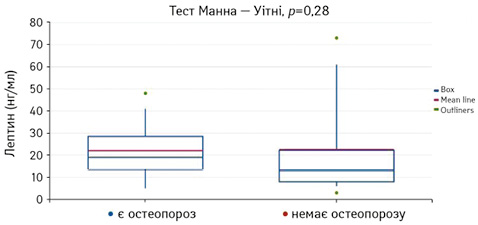
Потім проведено порівняння підгруп пацієнтів з АксСпА з наявністю та відсутністю остеопорозу за рівнем лептину. Встановлено, що рівень лептину достовірно не пов’язаний з ризиком розвитку остеопорозу (p=0,28) (рис. 7).
Обговорення
За результатами проведених численних досліджень щодо взаємозв’язку ІМТ, ожиріння та надмірної маси тіла з активністю АксСпА встановлено, що при АксСпА вищий ІМТ асоціюється з високою активністю захворювання, наявністю супутніх ускладнень та гіршою відповіддю на застосування біологічної терапії, зокрема фактора некрозу пухлин (ФНП) [8, 9]. За результатами нашого дослідження саме у групі пацієнтів з АксСпА зафіксовано найбільшу медіану маси тіла порівняно з групою контролю та групою з ревматоїдним артритом [10]. З огляду на те, що жирова тканина виконує функцію ендокринного органа завдяки виділенню біоактивних речовин (адипоцитокінів), можна припустити, що вона є додатковим фактором, що підтримує або посилює запальний процес при АксСпА. До цієї групи медіаторів входять адипокіни, цитокіни, хемокіни, фактори комплементу та гормони [11]. Адипокіни мають про- та протизапальні властивості. Адипокіни, зокрема лептин, є відомими модуляторами імунної відповіді і беруть участь у регуляції кісткового метаболізму [12]. Лептин посилює проліферацію моноцитів і індукує експресію запальних цитокінів (ФНП-α та інтерлейкін (ІЛ)-6) [13]. Лептин тісно корелює з жировою масою та ІМТ і вважається сурогатним маркером ожиріння [14]. Вироблення лептину залежить від енергетичних факторів, включаючи інсулін і статеві гормони, а також прозапальних медіаторів, таких як ФНП α, ІЛ-6 та ІЛ-1-β, які також можуть стимулювати його вивільнення [15, 16]. Синтез лептину стимулюється статевими гормонами яєчників і пригнічується тестостероном, тому рівні циркулюючого лептину більш високі у жінок, ніж у чоловіків, навіть після коригування ІМТ [17, 18]. За результатами проведеного дослідження встановлено, що найнижчі рівні лептину реєструються при серонегативних спондилоартропатіях, АксСпА та ПсА, а найвищі — при ревматоїдному артриті. Це може бути зумовлено як особливостями патогенезу цих захворювань, так і особливістю реакції самої жирової тканини на запалення [19, 20]. Не можна виключити, що ця особливість також може бути зумовлена патоморфозом, зокрема застосуванням ФНП-α в терапії АксСпА [21, 22]. За результатами досліджень встановлено, що низька концентрація лептину пов’язана з досягненням клінічних результатів у пацієнтів з АксСпА, які отримували ФНП-α [23]. Оскільки секреція лептину адипоцитами білої жирової тканини посилюється під час ожиріння та враховуючи, що ФНП-α не модулює його експресії, пацієнтів із ожирінням слід заохочувати знижувати ІМТ для досягнення успішної терапії [24, 25]. Слід зауважити, що ряд епідеміологічних досліджень демонструє широку варіабельність рівня лептину навіть серед осіб з однаковим ІМТ, що свідчить про вплив обох генетичних чинників і факторів навколишнього середовища [26].
За результатами нашого дослідження лептин не асоціювався зі зниженням МЩКТ, зокрема остеопорозом. Дані літератури є суперечливими щодо взаємозв’язку рівня лептину та порушень МЩКТ при АксСпА, через отримані дані зі зниженими рівнями лептину в деяких дослідженнях [27, 28]. Раніше лептин пов’язували з ремоделюванням кісток, таким чином, він був причетний до патофізіології остеопорозу в популяції хворих без ревматологічного захворювання [29, 30]. З іншого боку, лептин має здатність активувати остеобласти та інгібувати остеокласти. Роль лептину в рентгенологічній структурній прогресії хребта вивчали у різних дослідженнях. Деякі з них показали, що рівень лептину у сироватці крові був вищим у пацієнтів із осифікацією міжхребцевих зв’язок порівняно з пацієнтами без них [31, 32], тоді як інше дослідження повідомило про зв’язок між змінами сироваткового лептину вже через 2 роки та рентгенографічним прогресуванням (модифікований індекс рентгенологічного ураження хребта (mSASSS) [32]. І навпаки, два дослідження продемонстрували зворотний зв’язок між сироватковим лептином і рентгенографічним прогресуванням через 2 роки — в першому дослідженні mSASSS становив 1,16 [32] і через 4 роки — у другому — 0,614, тобто індекс рентгенологічного прогресування знижувався [33].
Обмеження: аналіз проводився на малих вибірках пацієнтів з метою оцінки наявності асоціації. Але отримані результати дозволили встановити відсутність прямого взаємозв’язку між рівнем лептину та масою тіла за наявності запального захворювання.
Висновки. Пацієнти з АксСпА мають більшу медіану маси тіла та достовірно меншу медіану концентрації лептину порівняно з контрольною групою. Порівняно з контрольною групою при АксСпА змінюється сила асоціації між рівнем лептину та масою тіла: при збільшенні маси тіла на 1 кг концентрація лептину підвищується менш виражено, ніж у групі контролю. У пацієнтів з АксСпА ризик розвитку остеопорозу не асоціюється з рівнем лептину. Необхідні проспективні дослідження для визначення біологічних механізмів, що лежать в основі виявлених закономірностей та їх клінічних імплементацій.
Список використаної літератури
- 1. Liu D., Xie Y., Tu L. et al. (2024) A guideline on biomarkers in the diagnosis and evaluation in axial spondyloarthritis. Front. Immunol., Oct 30; 15: 1394148. doi: 10.3389/fimmu.2024.1394148.
- 2. Rabiepour S., Saboory E., Abedi M. (2019) The relationship between stress during pregnancy with leptin and cortisol blood concentrations and complications of pregnancy in the mother. J. Turk. Ger. Gynecol. Assoc., Nov 28; 20(4): 218–223. doi: 10.4274/jtgga.galenos.2019.2019.0010.
- 3. Maffei M. et al. (1995) Leptin Levels in Human and Rodent: Measurement of Plasma Level Leptin and obRNA in Obese and Weight Reduced Subjects. Nat Med.; 1(11): 1155–61.
- 4. Recinella L., Orlando G., Ferrante C. et al. (2020) Adipokines: New Potential Therapeutic Target for Obesity and Metabolic, Rheumatic, and Cardiovascular Diseases.
- 5. Xie C., Chen Q. (2019) Adipokines: 2019 New Therapeutic Target for Osteoarthritis? Curr. Rheumatol. Rep.
- 6. Taylor E.B. (2021) The complex role of adipokines in obesity, inflammation, and autoimmunity. Clin. Sci. (Lond).
- 7. Ait Eldjoudi D., Cordero Barreal A., Gonzalez-Rodríguez M. et al. (2022) Leptin in Osteoarthritis and Rheumatoid Arthritis: Player or Bystander?
- 8. Choi H.M., Doss H.M., Kim K.S. (2020) Multifaceted Physiological Roles of Adiponectin in Inflammation and Diseases. Int. J. Mol. Sci.
- 9. Bouillon-Minois J.B., Trousselard M., Thivel D. et al. (2021) Leptin as a Biomarker of Stress: A Systematic Review and Meta-Analysis. Nutrients, Sep 24; 13(10): 3350. doi: 10.3390/nu13103350.
- 10. Liu D., Xie Y., Tu L. et al. (2024) A guideline on biomarkers in the diagnosis and evaluation in axial spondyloarthritis. Front Immunol., Oct 30; 15: 1394148. doi: 10.3389/fimmu.2024.1394148.
- 11. Neumann E., Junker S., Schett G. et al. (2016) Adipokines in bone disease. Nat. Rev. Rheumatol., 12: 296–302.
- 12. Neumann E., Hasseli R., Ohl S. et al. (2021) Frommer and Ulf Müller-Ladner Department of Rheumatology and Clinical Immunology, Campus Kerckhoff. Adipokines and Autoimmunity in Inflammatory Arthritis.
- 13. Liew J.W., Huang I.J., Louden D.N. et al. (2020) Association of body mass index on disease activity in axial spondyloarthritis: systematic review and meta-analysis. RMD Open, May; 6(1): e001225. doi: 10.1136/rmdopen-2020-001225.
- 14. Otero M., Lago R., Lago F. et al. (2005) Leptin, from fat to inflammation: Old questions and new insights. FEBS Lett., 579: 295–301.
- 15. Houseknecht K.L., Baile C.A., Matteri R.L. et al. (1998) The biology of leptin: A review. J. Anim. Sci., 76: 1405–1420.
- 16. Otero M., Lago R., Lago F. et al. (2005) Leptin, from fat to inflammation: Old questions and new insights. J. Anim. Sci., 76: 1405–1420.
- 17. Iikuni N., Lam Q.L., Lu L. et al. (2008) Leptin and Inflammation. Curr. Immunol. Rev., 4: 70–79.
- 18. Neumann E., Junker S., Schett G. et al. (2016) Adipokines in bone disease. Curr. Immunol. Rev., 4: 70–79.
- 19. Hernández-Breijo B., Novella-Navarro M., Genre F. et al. (2023) Serum leptin concentration is associated with the attainment of clinical outcomes in patients with axial spondyloarthritis treated with TNF inhibitors. Clin. Exp. Rheumatol., Mar; 41(3): 565–573.
- 20. Upadhyay J., Farr O.M., Mantzoros C.S. (2015) The role of leptin in regulating bone metabolism.Metabolism, Jan; 64(1): 105–13. doi: 10.1016/j.metabol.2014.10.02122.
- 21. Sari I., Demir T., Kozaci L.D. et al. (2007) Body composition, insulin, and leptin levels in patients with ankylosing spondylitis. Clin. Rheumatol., 26: 1427–1432.
- 22. Toussirot E., Streit G., Nguyen N.U. et al. (2007) Adipose tissue, serum adipokines, and ghrelin in patients with ankylosing spondylitis. Metabolism, 56: 1383–1389.
- 23. Kim K.J., Park J.Y., Yoon S.J. et al. (2012) Serum leptin levels are associated with the presence of syndesmophytes in male patients with ankylosing spondylitis. Clin. Rheumatol., 31: 1231–1238.
- 24. Gonzalez-Lopez L., Fajardo-Robledo N.S., Saldana-Cruz M. et al. (2017) Association of adipokines, interleukin-6, and tumor necrosis factor-alpha concentrations with clinical characteristics and presence of spinal syndesmophytes in patients with ankylosing spondylitis. J. Int. Med. Res., 45: 1024–1035.
- 25. Park J.H., Lee S.G., Jeon Y.K. et al. (2017) Relationship between serum adipokine levels and radiographic progression in patients with ankylosing spondylitis: A preliminary 2-year longitudinal study. Medicine, 96: e7854.
- 26. Hartl A., Sieper J., Syrbe U. et al. (2017) Serumlevelsofleptinandhighmolecular weight adiponectin are inversely associated with radiographic spinal progression in patients with ankylosing spondylitis: Results from the ENRADAS trial. Arthritis Res. Ther., 19: 140.
- 27. Rademacher J., Siderius M., Gellert L. et al. (2022) Baseline serum biomarkers of inflammation, bone turnover and adipokines predict spinal radiographic progression in ankylosing spondylitis patients on TNF inhibitor therapy. Semin. Arthritis Rheum., 53: 151974.
- 28. Reseland J.E., Syversen U., Bakke I. et al. (2001) Leptin is expressed in and secreted from primary cultures of human osteoblasts and promotes bone mineralization. J. Bone Miner. Res., 16: 1426–1433.
- 29. Holloway W.R., Collier F.M., Aitken C.J. et al. (2002) Leptin inhibits osteoclast generation. . J. Bone Miner. Res., 17: 200–209.
- 30. Thommesen L., Stunes A.K., Monjo M. et al. (2006) Expression and regulation of resistin in osteoblasts and osteoclasts indicate a role in bone metabolism. J. Cell. Biochem., 99: 824–834.
- 31. Xue Y., Jiang L., Cheng Q. et al. (2012) Adipokines in psoriatic arthritis patients. The correlations with osteoclast precursors and bone erosions. PLoS ONE, 7: e46740.
- 32. Eder L., Jayakar J., Pollock R. et al. (2013) Serum adipokines in patients with psoriatic arthritis and psoriasis alone and their correlation with disease activity. Ann. Rheum. Dis., 72: 1956–1961.
- 33. Hartl A., Sieper J., Syrbe U. et al. (2017) Serumlevelsofleptinandhighmolecular weight adiponectin are inversely associated with radiographic spinal progression in patients with ankylosing spondylitis: Results from the ENRADAS trial. Arthritis Res. Ther., 19: 140.
Відомості про авторів:
Борткевич О.П. — професор, провідний науковий співробітник відділу некоронарних хвороб серця, ревматології та терапії, ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска Національної академії медичних наук України.
ORCID ID: 0009-0000-0620-626Х
Ситенко А.О. — аспірантка відділу некоронарних хвороб серця, ревматології та терапії, ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска НАМН України.
ORCID ID: 0009-0002-2177-9378

Leave a comment