Оптимізація лікування саркопенії при ревматоїдному артриті та неалкогольній жировій хворобі печінки шляхом корекції метаболічних порушень
Резюме. Поширеність неалкогольної жирової хвороби печінки (НАЖХП), включаючи неалкогольний стеатогепатит (НАСГ), серед пацієнтів з ревматоїдним артритом (РА) підвищена та становить 35–50%, а поширеність саркопенії серед пацієнтів з РА варіює у межах 15–50% залежно від досліджуваної популяції та використовуваних діагностичних критеріїв. Потрійна коморбідність негативно впливає на прогноз перебігу кожної з хвороб, підвищуючи ризик смертності та інвалідизації. Метою цієї роботи є підвищення ефективності лікування хворих на РА та НАСГ, асоційованих із саркопенічним синдромом, шляхом корекції м’язового, жирового, кісткового метаболізму та синдрому хронічного запалення. Методи дослідження. Усім пацієнтам з РА проведено обстеження та встановлено діагноз згідно з діагностичними критеріями Європейського альянсу ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR) / Американського коледжу ревматологів (American College of Rheumatology — ACR) 2010 р., алгоритм діагностики НАСГ згідно з уніфікованим клінічним протоколом МОЗ України від 06.11.2014 р. № 826. Нами використано такі рекомендовані Європейською робочою групою із саркопенії (European Working. Group on Sarcopenia in Older People — EWCSOP2) методи діагностики саркопенії: опитувальник Simple Questionnaire to Rapidly Diagnose Sarcopenia (SARC-F), біоімпедансометрія, тести на фізичну працездатність, динамометрію. Результати. Обстежено 96 хворих на РА, у 44 встановлено саркопенію. У 19 пацієнтів діагностовано НАЖХП в поєднанні з саркопенією. Комплексне лікування, що включає левокарнітин, аргініну гідрохлорид, холекальциферол, дозоване фізичне навантаження та дієту з підвищеним вмістом білка, демонструє високу ефективність у лікуванні саркопенії у пацієнтів з РА та НАЖХП порівняно з базовою терапією. Висновки. Виявлення у хворих на РА саркопенії та НАЖХП є важливим, адже потрійна коморбідність впливає на частіше загострення та гірший перебіг основного захворювання.
DOI: 10.32471/rheumatology.2707-6970.19568
Саркопенія, ревматоїдний артрит (РА) та неалкогольний стеатогепатит (НАСГ) являють собою три патологічні стани, які все частіше визнаються як взаємопов’язані та взаємообтяжувальні. Хоча традиційно вони розглядались як окремі нозологічні одиниці, сучасні дослідження демонструють наявність спільних патофізіологічних механізмів та високу частоту їх коморбідності [1, 2].
Саркопенія визначається як прогресуюча та генералізована втрата м’язової маси, сили та функції, що асоціюється з підвищеним ризиком несприятливих наслідків, таких як фізична неспроможність, погіршення якості життя та смерть [3]. РА — хронічне системне аутоімунне захворювання, що характеризується запаленням синовіальної оболонки суглобів та прогресуючою деструкцією хряща та кісткової тканини [4]. НАСГ є прогресуючою формою неалкогольної жирової хвороби печінки (НАЖХП), що характеризується стеатозом, запаленням та пошкодженням гепатоцитів за відсутності значного споживання алкоголю [5].
Спільними ланками, що об’єднують ці три стани, є хронічне системне запалення, інсулінорезистентність, оксидативний стрес та метаболічна дисфункція [6]. Прозапальні цитокіни, такі як фактор некрозу пухлин альфа (TNF-α), інтерлейкін (IL)-1 бета та IL-6, які підвищені при РА, можуть зумовлювати розвиток саркопенії через активацію катаболічних шляхів у м’язах та НАСГ через індукцію інсулінорезистентності та стеатозу печінки [7, 8].
Епідеміологічні дослідження демонструють значно підвищену поширеність саркопенії та НАСГ у пацієнтів з РА порівняно із загальною популяцією [9, 10]. Крім того, наявність усіх трьох станів одночасно асоціюється з гіршим прогнозом, більш швидким прогресуванням захворювань та підвищеним ризиком розвитку ускладнень [11].
Розуміння складних взаємозв’язків між саркопенією, РА та НАСГ є критично важливим для розробки ефективних діагностичних та терапевтичних стратегій для пацієнтів з цими коморбідними станами. У пацієнтів з коморбідністю РА, саркопенії та НАСГ відзначається ціла низка несприятливих клінічних ефектів.
При РА ця комбінація пов’язана з вищою активністю запального процесу, гіршою функціональною спроможністю, підвищеним ризиком падінь та переломів, зниженою ефективністю базисної терапії та зростанням серцево-судинних ускладнень.
У випадку НАСГ відзначаються прискорене прогресування фіброзу печінки, підвищений ризик цирозу та гепатоцелюлярної карциноми, а також зниження ефективності лікування.
При саркопенії ця коморбідність призводить до швидшої втрати м’язової маси, гіршої відповіді на нутритивну підтримку, підвищеного ризику саркопенічного ожиріння та зниження якості життя. Коморбідність саркопенії, РА та НАСГ має важливе клінічне значення через взаємний обтяжувальний вплив цих станів та їх асоціацію з підвищеною захворюваністю та смертністю. Потрійна коморбідність також асоціюється з підвищеним економічним тягарем для системи охорони здоров’я через зростання частоти госпіталізацій, тривалості перебування в стаціонарі та витрат на лікування.
Мета роботи: підвищити ефективність лікування у хворих на РА та НАСГ, асоційованих із саркопенічним синдромом, шляхом корекції м’язового, жирового, кісткового метаболізму та синдрому хронічного запалення.
МАТЕРІАЛИ ТА МЕТОДИ
Усім пацієнтам з РА проведено обстеження та встановлено діагноз згідно з діагностичними критеріями Європейського альянсу ревматологічних асоціацій (European Alliance of Associations for Rheumatology — EULAR) / Американського коледжу ревматологів (American College of Rheumatology — ACR) 2010 р., алгоритм діагностики НАСГ згідно з уніфікованим клінічним протоколом МОЗ України від 06.11.2014 р. № 826. Керуючись алгоритмом «виявити — оцінити — підтвердити — тяжкість» (Find-Asess-Confirm-Severity (F-A-C-S), проведені такі методи верифікації саркопенії згідно з рекомендаціями Європейської робочої групи із саркопенії (European Working. Group on Sarcopenia in Older People — EWCSOP2): опитувальник Simple Questionnaire to Rapidly Diagnose Sarcopenia (SARC-F), біоімпедансометрія, тести на фізичну працездатність, динамометрія [3].
Критерії включення у дослідження: хворі на РА, серопозитивний варіант (ревматоїдний фактор (РФ)+, антитіла до циклічного цитрулінового пептиду (АЦЦП)+), активність ІІ–ІІІ ст., рентгенологічна (Rtg) стадія II–III, функціональна недостатність суглобів (ФНС) ІІ–ІІІ, вік 40–60 років, скарги на зниження м’язової сили, визначення зниження м’язової сили за допомогою динамометра.
Задля діагностування НАЖХП використовували ультразвукове дослідження (УЗД) та стеатометрію печінки.
Статистичні методи: систематизація даних, отриманих у ході науково-дослідної роботи (НДР), виконана за допомогою електронних таблиць Microsoft Excel; обробку та аналіз результатів досліджень здійснювали за допомогою програми IBM SPSS Statistic 26. Відмінності вважалися значущими за умови р<0,05.
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ
Першим етапом діагностики саркопенії згідно з рекомендаціями EWGSOP2 є скринінг. Для цього використали опитувальник SARC-F. Середній показник SARC-F у групі пацієнтів з РА становив 6,2±0,7 бала, що перевищує пороговий рівень для підозри на саркопенію (≥4 бали). У контрольній групі здорових осіб цей показник становив 4,0±0,5 бала (p<0,005).
Для подальшої оцінки м’язової сили та фізичної працездатності проведені тест «вставати зі стільця» та динамометрія. Результати цих тестів представлені в табл. 1.
| Показник | Досліджувана група (n=96) | Контрольна група (n=12) | p |
|---|---|---|---|
| Тест «вставати зі стільця» | 17±2,3 | 13,7±0,64 | p<0,005 |
| Динамометрія | 22,6±4,4 | 29,9±2,2 | p<0,005 |
Як показано у табл. 1, у пацієнтів з РА зафіксовано значне погіршення результатів тесту «вставати зі стільця» та зниження сили кисті за даними динамометрії порівняно з контрольною групою (p<0,005).
Наступним етапом діагностики саркопенії було проведення біоімпедансометрії для визначення складу тіла. Результати біоімпедансометрії представлені в табл. 2.
| Показники | Досліджувана група (n=96) | Контрольна група (n=12) | Р |
|---|---|---|---|
| Жирова тканина, % | 36,4±3,9 | 28,3±3,9 | p<0,005 |
| М’язова тканина, % | 19,8±2,1 | 29,3±1,6 | p<0,005 |
| Вісцеральна жирова тканина, % | 12,1±2,2 | 4,2±3,3 | p<0,005 |
За результатами комплексного обстеження діагноз саркопенії встановлено у 44 пацієнтів (45,8%) із 96 хворих на РА.
Пацієнтам з саркопенією (n=44) була проведена стеатометрія для виявлення НАЖХП. За результатами обстеження ця патологія виявлена у 19 пацієнтів.
Для оцінки взаємозв’язку між РА, саркопенією та НАЖХП проведено порівняння лабораторних показників у пацієнтів з потрійною коморбідністю з групою контролю, що складалася з пацієнтів з НАЖХП без РА та саркопенії (табл. 3).
| Показники | Досліджувана група (n=19) | Контрольна група (n=9) | Р |
|---|---|---|---|
| АлАТ, Од/л | 49,1±4,3 | 43±3,9 | p<0,12 |
| АсАТ, Од/л | 38,3±9,4 | 34,3±1,6 | p<0,12 |
| СРБ, мг/л | 6,9±1,5 | 2,5±1,1 | p<0,005 |
| КФК-ММ, Од/л | 185,5±6,9 | 157,2±3,6 | p<0,005 |
Примітки: АлАТ — аланінамінотрансфераза; АсАТ — аспартатамінотрансфераза; СРБ — С-реактивний білок; КФК-ММ — фракція ММ креатинфосфокінази.
Згідно з отриманими результатами, рівні СРБ та КФК-ММ були значно підвищені у пацієнтів із саркопенічним синдромом, РА та НАЖХП порівняно з пацієнтами, в яких виявлено лише НАЖХП (p<0,005). Водночас показники АлАТ та АсАТ суттєво не відрізнялися між групами (p<0,12). Згідно з результатами обстежень, хворих розподілено на 2 групи для подальшого призначення лікування. Група І (9 пацієнтів) — хворі на РА, асоційований з саркопенічним синдромом, та супутнім НАСГ, яким призначено лікування базисною терапією. Група ІІ (10 пацієнтів) — хворі на РА, асоційований із саркопенічним синдромом, та супутнім НАСГ, яким призначено лікування базисною терапією, а також додатково левокарнітин та аргініну гідрохлорид 100 мл внутрішньовенно крапельно протягом 10 днів, холекальциферол 4000 МО перорально протягом 1 міс та дозоване фізичне навантаження — 14 днів; надані рекомендації щодо дієтотерапії, що збагачена білком, — 1 міс.
Після лікування нами проведено повторне обстеження на виявлення саркопенії, а саме: опитувальник SARC-F, біоімпедансометрія, тести на фізичну працездатність, динамометрія та лабораторні показники. Отримані результати свідчать про достовірне покращення показників функціональних тестів у групі I порівняно з групою IІ (табл. 4).
| Показник | Група І | Група ІІ | p |
|---|---|---|---|
| Тест «вставати зі стільця» | 16,4±1,1 | 15±0,83 | p<0,005 |
| Динамометрія | 23,4±2,8 | 26,3±3,1 | p<0,005 |
Показники біоімпедансометрії після лікування також свідчать про значні відмінності між групами (табл. 5).
| Показники | Група І | Група ІІ | Р |
|---|---|---|---|
| Жирова тканина, % | 35,4±3,2 | 31,3±3,9 | p<0,005 |
| М’язова тканина, % | 20,8±2,1 | 24,3±2,6 | p<0,005 |
| Вісцеральна жирова тканина, % | 10,8±2,2 | 8,9±2,5 | p<0,005 |
Аналіз лабораторних показників після лікування виявив статистично значущі відмінності між групами, результати яких представлені в табл. 6.
| Показники | Група І | Група ІІ | Р |
|---|---|---|---|
| АлАТ, Од/л | 49,1±4,3 | 43±3,9 | p<0,12 |
| АсАТ, Од/л | 38,3±9,4 | 34,3±1,6 | p<0,12 |
| СРБ, мг/л | 3,2±1,5 | 2,3±1,1 | p<0,005 |
| КФК-ММ, Од/л | 165,5±6,9 | 155,2±3,6 | p<0,005 |
| 25-гідроксикальциферол | 58,3±10,3 | 73,5±10,9 | p<0,005 |
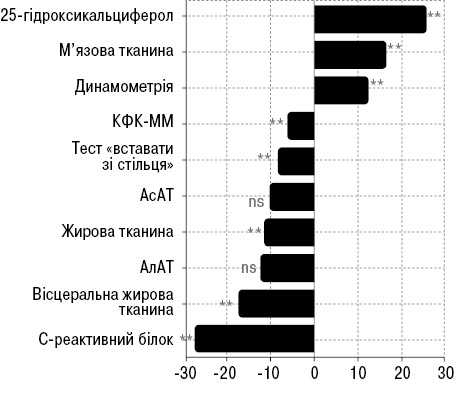
Результати статистичної значущості змін показників після лікування при порівнянні груп І (базисна терапія) з групою IІ (комплексна терапія) представлені на рисунку.
Загалом із 10 досліджуваних параметрів для 8 відмічено статистично значущі зміни (80%), що свідчить про ефективність комплексної терапії порівняно з базисною.
ОБГОВОРЕННЯ
Епідеміологічні дані щодо одночасної поширеності усіх трьох станів — саркопенії, РА та НАСГ — обмежені, однак існує значна кількість досліджень, що вивчають попарні асоціації між цими захворюваннями.
Поширеність саркопенії серед пацієнтів з РА варіює у межах 15–50% залежно від досліджуваної популяції та використовуваних діагностичних критеріїв. Метааналіз, що включав 1177 пацієнтів з РА, виявив, що ризик розвитку саркопенії у цій групі в 2,2 раза вищий порівняно із загальною популяцією відповідного віку [12].
Поширеність НАЖХП, включаючи НАСГ, серед пацієнтів з РА також підвищена та становить 35–50%, що значно перевищує показники у загальній популяції (25–30%) [13]. Дослідження Liou та співавторів, яке включало 588 пацієнтів з РА, виявило, що поширеність НАЖХП у цій групі становила 43,8%, а НАСГ — 18,9% [14].
Серед пацієнтів з НАСГ поширеність саркопенії становить 15–46% з вищими показниками серед пацієнтів з прогресуючим фіброзом та цирозом печінки [15]. У дослідженні Lee та співавторів, яке включало 309 пацієнтів з НАЖХП, підтвердженою біопсією печінки, поширеність саркопенії становила 22,7% серед пацієнтів з НАСГ [16].
Обмежені дані щодо потрійної коморбідності свідчать про її наявність у близько 10–15% пацієнтів з РА [17]. У когортному дослідженні Tada та співавторів, яке включало 300 пацієнтів з РА, потрійна коморбідність виявлена у 13,3% випадків та асоціювалася з більш тяжким перебігом РА, гіршою функціональною спроможністю та підвищеним ризиком розвитку серцево-судинних ускладнень [18].
Адекватне харчування є важливим компонентом лікування саркопенії при РА. Пацієнтам рекомендується дієта з достатнім вмістом білка (1,2–1,5 г/кг маси тіла на день) для підтримки синтезу м’язових білків. Дієтичні втручання повинні враховувати наявність запалення та метаболічних порушень у пацієнтів з РА [19].
Добавки з незамінними амінокислотами стимулюють синтез м’язових білків через активацію mTOR та можуть бути корисними для пацієнтів з РА та саркопенією [20].
Застосування левокарнітину та аргініну гідрохлориду в комплексному лікуванні пацієнтів із коморбідністю РА, НАСГ та саркопенії має патогенетичне обґрунтування [21]. Левокарнітин відіграє ключову роль у транспорті довголанцюгових жирних кислот у мітохондрії для їх подальшого β-окиснення та продукції енергії, що особливо важливо для функціонування скелетних м’язів. Крім того, левокарнітин має антиоксидантні та протизапальні властивості, що може сприяти зменшенню вираженості оксидативного стресу та системного запалення, які є спільними патогенетичними механізмами при РА, НАСГ та саркопенії. Аргініну гідрохлорид як попередник оксиду азоту покращує мікроциркуляцію в м’язовій тканині, стимулює секрецію гормону росту та інсуліноподібного фактора росту-1 (IGF-1), що сприяє анаболічним процесам у м’язах. Крім того, аргінін бере участь у синтезі креатину, який забезпечує енергією м’язові скорочення та стимулює синтез протеїнів у м’язовій тканині. Комбіноване застосування цих препаратів з холекальциферолом, який модулює запальну відповідь та покращує функцію м’язів, створює синергічний ефект, що підтверджується отриманими результатами.
Вітамін D відіграє важливу роль у регуляції м’язової функції та імунної системи. Дефіцит вітаміну D часто відзначають у пацієнтів з РА та саркопенією [22]. Добавки з вітаміном D (800–1000 МО/добу) рекомендуються для пацієнтів з низьким рівнем 25-гідроксивітаміну D (<30 нг/мл) [23].
Регулярні фізичні навантаження стимулюють синтез м’язових білків, покращують мітохондріальну функцію, зменшують вираженість запалення та оксидативного стресу, що сприяє збільшенню м’язової маси та сили [24].
Аеробні вправи, такі як ходьба, плавання, їзда на велосипеді, покращують серцево-судинну функцію, зменшують вираженість запалення та інсулінорезистентності, що може сприяти збереженню м’язової маси. Рекомендується виконувати аеробні вправи помірної інтенсивності 150 хв на тиждень [25, 26].
ВИСНОВКИ
У пацієнтів з РА відзначається висока поширеність саркопенії (45,8%), що підтверджує значний вплив хронічного запального процесу на стан м’язової тканини. Частота виявлення НАЖХП у хворих на РА у поєднанні із саркопенією також виявилася високою та становила близько 43%.
У дослідженні продемонстровано ефективність та позитивний вплив амінокислот, вітаміну D, дієтотерапії і фізичної активності в комплексному лікуванні потрійної коморбідності у вигляді РА, НАЖХП та саркопенії. Ця комбінація шляхом корекції м’язового, жирового, кісткового метаболізму дозволяє краще контролювати основне захворювання та менше призводити до інвалідизації.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці цієї статті.
Інформація про фінансування. Наукова робота виконувалася в рамках наукової тематики згідно з планом науково-дослідної роботи «Імунологічні, біохімічні та метаболічні порушення при патології внутрішніх органів: диференційовані підходи до лікування та медичної реабілітації хворих» кафедри внутрішньої медицини № 1, клінічної імунології та алергології імені академіка Є.М. Нейка Івано-Франківського національного медичного університету.
Інформація про внесок кожного автора в підготовку статті. Стойка І.В. — аналіз отриманих даних, написання та корекція тексту, відбір пацієнтів, статистична обробка, збір та обробка матеріалу, аналіз даних літературних джерел. Яцишин Р.І. — концепція та дизайн дослідження.
Список використаної літератури
- 1. Cruz-Jentoft A.J., Sayer A.A. (2019) Sarcopenia. Lancet; 393(10191): 2636–2646. DOI: 10.1016/S0140-6736(19)31138-9.
- 2. Kerekes G., Nurmohamed M.T., González-Gay M.A. et al. (2014) Rheumatoid arthritis and metabolic syndrome. Nat. Rev. Rheumatol.; 10(11): 691–696. DOI: 10.1038/nrrheum.2014.121.
- 3. Cruz-Jentoft A.J., Bahat G., Bauer J. et al. (2019) Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing; 48(1): 16–31. DOI: 10.1093/ageing/afy169.
- 4. McInnes I.B., Schett G. (2011) The pathogenesis of rheumatoid arthritis. N. Engl. J. Med.; 365(23): 2205–2219. DOI: 10.1056/NEJMra1004965.
- 5. Chalasani N., Younossi Z., Lavine J.E. et al. (2018) The diagnosis and management of nonalcoholic fatty liver disease: Practice guidance from the American Association for the Study of Liver Diseases. Hepatology; 67(1): 328–357. DOI: 10.1002/hep.29367.
- 6. Tilg H., Moschen A.R. (2010) Evolution of inflammation in nonalcoholic fatty liver disease: the multiple parallel hits hypothesis. Hepatology; 52(5): 1836–1846. DOI: 10.1002/hep.24001.
- 7. Schaap L.A., Pluijm S.M., Deeg D.J., Visser M. (2006) Inflammatory markers and loss of muscle mass (sarcopenia) and strength. Am. J. Med.; 119(6): 526.e9–17. DOI: 10.1016/j.amjmed.2005.10.049.
- 8. Cusi K. (2012) Role of obesity and lipotoxicity in the development of nonalcoholic steatohepatitis: pathophysiology and clinical implications. Gastroenterology; 142(4): 711–725.e6. DOI: 10.1053/j.gastro.2012.02.003.
- 9. Barone M., Viggiani M.T., Anelli M.G. et al. (2018) Sarcopenia in patients with rheumatic diseases: prevalence and associated risk factors. J. Clin. Med.; 7(12): 504. DOI: 10.3390/jcm7120504.
- 10. Tournadre A., Pereira B., Dutheil F. et al. (2017) Changes in body composition and metabolic profile during interleukin 6 inhibition in rheumatoid arthritis. J. Cachexia Sarcopenia Muscle; 8(4): 639–646. DOI: 10.1002/jcsm.12189.
- 11. Hong H.C., Hwang S.Y., Choi H.Y. et al. (2014) Relationship between sarcopenia and nonalcoholic fatty liver disease: the Korean Sarcopenic Obesity Study. Hepatology; 59(5): 1772–1778. DOI: 10.1002/hep.26716.
- 12. Beaudart C., Sanchez-Rodriguez D., Locquet M. et al. (2019) Malnutrition as a strong predictor of the onset of sarcopenia. Nutrients; 11(12): 2883. DOI: 10.3390/nu11122883.
- 13. Liou I., Kowdley K.V. (2006) Natural history of nonalcoholic steatohepatitis. J. Clin. Gastroenterol.; 40 (Suppl. 1): S11–S16. DOI: 10.1097/01.mcg.0000168645.86658.22.
- 14. Li H., Zuo J., Tang W. (2018) Phosphodiesterase-4 inhibitors for the treatment of inflammatory diseases. Front Pharmacol.; 9: 1048. DOI: 10.3389/fphar.2018.01048.
- 15. Poggiogalle E., Lubrano C., Sergi G. et al. (2016) Sarcopenic obesity and metabolic syndrome in adult Caucasian subjects. J. Nutr. Health Aging; 20(9): 958–963. DOI: 10.1007/s12603-015-0638-1.
- 16. Lee Y.H., Jung K.S., Kim S.U. et al. (2016) Sarcopenia is associated with significant liver fibrosis independently of obesity and insulin resistance in nonalcoholic fatty liver disease: Nationwide surveys (KNHANES 2008-2011). Hepatology; 63(3): 776–786. DOI: 10.1002/hep.28376.
- 17. Meng S.J., Yu L.J. (2010) Oxidative stress, molecular inflammation and sarcopenia. Int. J. Mol. Sci.; 11(4): 1509–1526. DOI: 10.3390/ijms11041509.
- 18. Tada M., Inui K., Sugioka Y. et al. (2016) Use of bisphosphonates and risk of incident CKD in patients with rheumatoid arthritis. J. Am. Soc. Nephrol.; 27(11): 3405–3412. DOI: 10.1681/ASN.2016030319.
- 19. Deutz N.E., Bauer J.M., Barazzoni R. et al. (2014) Protein intake and exercise for optimal muscle function with aging: recommendations from the ESPEN Expert Group. Clin. Nutr.; 33(6): 929–936. DOI: 10.1016/j.clnu.2014.04.007.
- 20. Atherton P.J., Smith K. (2012) Muscle protein synthesis in response to nutrition and exercise. J. Physiol.; 590(5): 1049–1057. DOI: 10.1113/jphysiol.2011.225003.
- 21. Wall B.T., van Loon L.J. (2013) Nutritional strategies to attenuate muscle disuse atrophy. Nutr. Rev.; 71(4): 195–208. DOI: 10.1111/nure.12019.
- 22. Hasan E., Olusi S., Al-Awadhi A. et al. (2012) Effects of rituximab treatment on the serum concentrations of vitamin D and interleukins 2, 6, 7, and 10 in patients with rheumatoid arthritis. Biologics; 6: 31–35. DOI: 10.2147/BTT.S23774.
- 23. Holick M.F., Binkley N.C., Bischoff-Ferrari H.A. et al. (2011) Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J. Clin. Endocrinol. Metab.; 96(7): 1911–1930. DOI: 10.1210/jc.2011-0385.
- 24. Landi F., Marzetti E., Martone A.M. et al. (2014) Exercise as a remedy for sarcopenia. Curr. Opin. Clin. Nutr. Metab. Care; 17(1): 25–31. DOI: 10.1097/MCO.0000000000000018.
- 25. de Jong Z., Munneke M., Zwinderman A.H. et al. (2003) Is a long-term high-intensity exercise program effective and safe in patients with rheumatoid arthritis? Results of a randomized controlled trial. Arthritis Rheum.; 48(9): 2415–2424. DOI: 10.1002/art.11216.
- 26. Hashida R., Kawaguchi T., Bekki M. et al. (2017) Aerobic vs. resistance exercise in non-alcoholic fatty liver disease: A systematic review. J. Hepatol.; 66(1): 142–152. DOI: 10.1016/j.jhep.2016.08.023.
Відомості про авторів
Стойка Іван Володимирович — асистент кафедри внутрішньої медицини № 1, клінічної імунології та алергології імені академіка Є.М. Нейка, Івано-Франківський національний медичний університет.
Е-mail: istoika@ifnmu.edu.ua
ORCID ID: 0000-0002-6221-9345
Яцишин Роман Іванович — доктор медичних наук, професор кафедри внутрішньої медицини № 1, клінічної імунології та алергології імені академіка Є.М. Нейка, Івано-Франківський національний медичний університет.
E-mail: ryatsyshyn@ifnmu.edu.ua
ORCID ID: 0000-0002-6221-9345
Надійшла до редакції/Received: 14.03.2025
Прийнято до друку/Accepted: 24.03.2025

Leave a comment