ЕФЕКТИВНІСТЬ І ПЕРЕНОСИМІСТЬ БАЗИСНОЇ ТЕРАПІЇ ПСОРІАТИЧНОГО АРТРИТУ ІЗ застосувАННЯМ ЛЕФЛУНОМІДУ
Резюме. Вивчено ефективність і переносимість лікування лефлуномідом (ЛФ) при застосуванні його як монотерапії та у складі комбінованої базисної терапії (КБТ) у 63 хворих із псоріатичним артритом (ПсА). Застосування ЛФ в дозі 20 мг/добу зумовлює виражену знеболювальну і протизапальну дію вже через 4 тиж з подальшим наростанням клініко-лабораторного ефекту до 12-го тижня лікування. Під впливом ЛФ через 12 тиж на 45% знижуються сумарні показники ураження суглобів (DAS (СРБ) та DAS (ШОЕ)), на 26,3% покращується функціональний стан хворих (за індексом HAQ), в 1,9 раза знижується інтенсивність псоріатичного ураження шкіри (за індексом PASI 50). Ефективність ЛФ у комбінації з сульфасалазином чи метотрексатом вища порівняно з монотерапією ЛФ як щодо ураження суглобів (вища частота досягнення хорошої та задовільної відповіді за DAS (СРБ)), так і щодо ураження шкіри (більша кількість хворих — «відповідачів» за PASI 50). Переносимість лікування була хорошою у 73% хворих, задовільною — у 22,2%, лікування було припинено у зв’язку з побічними явищами у 4,8% хворих. Суттєвих відмінностей у переносимості ЛФ як монотерапії та у складі КБТ немає.
ВСТУП
Псоріатичний артрит (ПсА) — досить поширене запальне захворювання суглобів, що асоціюється із псоріазом і є переважно серонегативним [19]. У різних регіонах світу на нього страждають від 0,3 до 1% населення [11], хворі на ПсА становлять близько 7% усіх хворих з артритами [4]. Наявність ПсА підвищує ризик смерті порівняно з популяційним на 59% у жінок і на 65% — у чоловіків [18]. Вже через 2 роки від початку ПсА у 47% хворих відзначають принаймні 1 кісткову ерозію [7], а через 10 років — у 55% хворих деформовано більше ніж 5 суглобів [3]. Лише своєчасна діагностика та застосування адекватної базисної терапії (БТ) здатні запобігти прогресуванню хвороби та інвалідизації пацієнтів.
Досі залишаються недостатньо вивченими ефективність і безпека окремих базисних препаратів (БП) у монотерапії та у складі комбінованої базисної терапії (КБТ) у хворих на ПсА. Одним із таких БП є лефлуномід (ЛФ). Відомо, що активація Т-клітин відіграє ключову роль в імунопатогенезі ПсА, а також псоріазу [5]. ЛФ відносять до про-ліків, основний терапевтичний ефект зумовлює його активний метаболіт — A771726 [15], який інгібує дегідрооротат-редуктазу, перешкоджаючи синтезу піримідинів [1, 9]. Гальмування синтезу піримідинів інгібує Т-клітинну активацію і проліферацію [2], тому спробу використання ЛФ як БП у хворих зі ПсА слід вважати патогенетично цілком обґрунтованою. В одному з двох невеликих пілотних досліджень виявлено здатність ЛФ після 3 міс лікування значно знижувати рівень С-реактивного білка (СРБ), кількість болючих і набряклих суглобів [14], в іншому — підтверджено клінічну ефективність препарату у 66,7% хворих протягом 2 років спостереження [10]. Пізніше в рандомізованому плацебо-контрольованому багатоцентровому дослідженні доведено, що ЛФ дійсно є ефективним БП у пацієнтів з активним ПсА як щодо суглобових проявів захворювання (за критерієм PsARC через 6 міс на лікування ЛФ відповіли 59% хворих порівняно з 30% у групі плацебо), так і стосовно уражень шкіри (відповідно 24 і 0% за критерієм PASI) [6]. При цьому профіль безпеки препарату був цілком прийнятним. Водночас ефективність і переносимість ЛФ у складі КБТ у хворих із ПсА не досліджувалися.
Мета дослідження — оцінка ефективності та переносимості ЛФ як монотерапії та у складі КБТ у хворих з активним ПсА.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
У дослідження було включено 63 хворих на ПсА із залученням периферичних суглобів, оскільки відповідно до існуючих рекомендацій з лікування ПсА GRAPPA [8] ЛФ можна застосовувати саме в лікуванні хворих з ураженням периферичних суглобів. Діагноз ПсА встановлювали відповідно до критеріїв CASPAR 2006 [16]. Критеріями включення в дослідження були кількість болючих і припухлих суглобів ≥3, стабільна доза БП або відсутність БТ протягом 3 міс, стабільна доза глюкокортикоїдів (ГК) і/або нестероїдних протизапальних препаратів (НПЗП) протягом 1 міс до першого обстеження.
Хворі були розподілені у групу монотерапії ЛФ (препарат ЛЕФНО, фірма «Kusum Healthcare») (31 пацієнт, який не менше 3 міс не отримував БП) або у групу КБТ, де ЛФ додавався до іншого БП (32 пацієнти, які до початку дослідження отримували сульфасалазин (СС) або метотрексат (МТ) у стабільній дозі). ЛФ призначався на додаток до іншого БП у зв’язку з недостатньою ефективністю лікування СС або МТ (збереження чи рецидивування клінічно очевидних синовітів, дактилітів, ентезопатій, залучення у процес нових суглобів). Тривалість безперервного прийому СС становила від 9 міс до 5 років (в середньому — 28,8±18,4 міс), МТ — від 6 міс до 7 років (в середньому — 34,8±20,5 міс). Перед початком і протягом дослідження СС отримували 13 осіб у дозі 2000 мг/добу, МТ — 19 осіб в дозі від 7,5 до 20 мг/тиж, в середньому — 12,7±3,0 мг/тиж. У групі монотерапії ЛФ інші БП раніше приймали 17 (53,1%) із 32 хворих, з них 11 (64,7%) припинили прийом БП у зв’язку з несприятливими явищами, і по 3 (по 17,6%) пацієнти — внаслідок неефективності чи інших причин (самостійне рішення хворого).
Протягом перших 3 днів хворі обох груп отримували ЛФ по 100 мг/добу, надалі — по 20 мг/добу за умови прийнятної переносимості. Тривалість курсу лікування в обох групах становила 12 тиж.
При обстеженні пацієнтів оцінювали тривалість ранкової скутості, рахунок болючих і набряклих суглобів, реєстрували оцінку пацієнтом і лікарем болю і стану здоров’я за 100-мм візуальною аналоговою шкалою (ВАШ) та шкалою Likert, визначали швидкість осідання еритроцитів (ШОЕ) і рівень у сироватці крові СРБ. Ефективність ЛФ щодо ураження суглобів оцінювали за кількістю хворих, які відповіли на лікування за критерієм ACR20, модифікованим для ПсА — PsARC [12], величинами індексів DAS (ШОЕ) та DAS (СРБ) [8, 17], змінами якості життя, яку визначали за Стенфордським опитувальником оцінки стану здоров’я HAQ [12]. Для визначення ефективності ЛФ щодо ураження шкіри оцінювали відповідь на лікування за індексом PASI 50, який базується на оцінці інтенсивності еритеми, інфільтрації та десквамації за 5-бальною шкалою з урахуванням площі ураженої шкіри [6].
Оцінку ефективності та переносимості лікування проводили на 4-му та 12-му тижні лікування.
З дослідження на ранніх етапах (до 2 тиж) вибули 3 хворих внаслідок припинення прийому ЛФ, зумовленого побічними ефектами, тому в подальший аналіз ефективності лікування було включено 60 хворих, які виконали всі 3 запланованих візити.
Демографічну, анамнестичну та клініко-лабораторну характеристику хворих, у яких аналізували ефективність лікування, наведено в табл. 1. Як свідчать дані, серед загальної когорти обстежених було дещо більше жінок, тривалість захворювання становила в середньому 8,5 року, більше половини хворих приймали НПЗП, 16,7% — ГК. Активність артриту була досить високою, про що, зокрема, свідчать середні величини тривалості ранкової скутості >2 год, кількості набряклих суглобів — 7, індексів DAS (ШОЕ) і DAS (СРБ) — >4 (відповідає високій активності захворювання). Водночас підвищення ШОЕ та рівня СРБ було незначним. Така невідповідність клінічної активності артриту рівню лабораторних маркерів запалення вважається однією з характерних рис ПсА [12].
Таблиця 1. Характеристика хворих на ПсА за основними демографічними та клініко-лабораторними показниками у групах монотерапії ЛФ та КБТ (М±σ)
| Показник | Монотерапія | КБТ | Загалом | |
|---|---|---|---|---|
| Стать | чол., n (%) | 12 (40) | 13 (43,3) | 25 (41,6) |
| жін., n (%) | 18 (60) | 17 (56,7) | 35 (58,4) | |
| Вік, років | 49,4±12,3 | 49,9±9,1 | 49,7±10,7 | |
| Тривалість ПсА, міс | 92,5±91,5 | 111,3±80,54 | 101,9±86,0 | |
| Прийом ГК, кількість хворих, n (%) |
2 (6,6) | 8 (26,7)* | 10 (16,7) | |
| Прийом НПЗП, кількість хворих, n (%) | 16 (53,3) | 16 (53,3) | 32 (53,3) | |
| Оцінка лікарем за Likert | 3,13±0,43 | 3,46±0,73** | 3,30±0,62 | |
| Оцінка пацієнтом за Likert | 3,90±0,55 | 3,77±0,73** | 3,83±0,64 | |
| Оцінка болю за ВАШ, мм | 5,98±1,43 | 5,72±1,76 | 5,85±1,59 | |
| Оцінка пацієнтом артриту за ВАШ, мм | 6,60±1,55 | 6,38±1,56 | 6,49±1,54 | |
| Болючі суглоби (із 76), балів | 43,0±31,6 | 54,3±28,4* | 48,6±30,40 | |
| Набряклі суглоби (із 74), балів | 11,2±8,38 | 17,8±13,2* | 14,5±11,5 | |
| Індекс Річі | 19,7±10,9 | 22,5±9,24 | 20,9±10,17 | |
| Набряклі суглоби (із 44), балів | 5,50±3,73 | 8,53±5,39 | 7,02±4,84 | |
| Ранкова скутість, хв | 81,7±92,6 | 192,0±216,1* | 136,9±173,9 | |
| HAQ | 1,20±0,51 | 1,08±0,48 | 1,14±0,50 | |
| ШОЕ, мм/год | 20,5±9,20 | 22,9±14,0 | 21,7±11,8 | |
| СРБ, мг/л | 9,63±4,39 | 10,0±4,32 | 9,84±4,32 | |
| DAS (ШОЕ) | 4,07±0,89 | 4,49±0,97 | 4,28±0,95 | |
| DAS (СРБ) | 3,94±0,85 | 4,36±0,90 | 4,15±0,91 | |
| PASI | 11,1±9,95 | 17,2±15,8 | 14,1±13,4 | |
р<0,05; р<0,01 порівняно з групою монотерапії.
Групи пацієнтів, які отримували монотерапію ЛФ та КБТ, за демографічними показниками, тривалістю хвороби були зіставними. Однак у групі КБТ значно більша кількість хворих приймали ГК, була більшою тривалість ранкової скутості (більше ніж у 2 рази), кількість болючих (на 26,3%) і набряклих суглобів (на 58,9%), хоча за самооцінками пацієнта (включаючи HAQ), значеннями DAS (ШОЕ) і DAS (СРБ), PASI, рівнем маркерів запалення групи суттєво не відрізнялись. Як підтвердження тенденції до вищої тяжкості артриту в цій групі можна розглядати і факт низької ефективності попереднього лікування СС і МТ.
Статистичну обробку результатів здійснювали з використанням непараметричних (тест Фрідмана, критерій знаків, тести Вілкоксона, МакНемара, метод Фішера) і параметричних методів (метод різниць, t-тест) залежно від характеру розподілу варіант у варіаційному ряду та конкретних завдань аналізу. Відмінності вважали вірогідними при p<0,05.
результати та їх обгоВорення
Із 63 хворих на ПсА, включених у дослідження, завершили 3-місячне спостереження 60 (95,2%) осіб — по 30 у групах монотерапії та КБТ. Отримані в загальній когорті хворих результати свідчать про вірогідне покращання всіх клініко-лабораторних показників через 12 тиж лікування (табл. 2), що свідчить про досить високу ефективність ЛФ у лікуванні суглобових та шкірних проявів у хворих із ПсА. Так, індекси DAS (ШОЕ) і DAS (СРБ) знизилися на >30%, рахунок набряклих і болючих суглобів — на 64,2 та 51,5% відповідно, індекс PASI — на 42%. Також покращились оцінка лікарем та пацієнтом за Likert — на 30 та 32%, оцінка пацієнтом перебігу артриту та болю — на 39 та 41% відповідно, в 2,5 раза скоротилася тривалість ранкової скутості. Слід відзначити суттєве покращання функціональної здатності пацієнтів, про що свідчить зниження величин HAQ на 32,6%. Як видно з табл. 2, подібні зміни спостерігалися вже з 4-го тижня лікування: вірогідно зменшилася кількість рахунок болючих суглобів (на 23,5%), набряклих суглобів (на 26,9%), покращились оцінки лікарем та пацієнтом за Likert (на 14,8 та 13% відповідно), оцінка пацієнтом перебігу артриту та болю (на 16,5 та 16,0% відповідно), скоротилася тривалість ранкової скутості (на 35,4%), зменшився HAQ (на 13,1%), що свідчить про достатньо швидкий розвиток ефекту від прийому ЛФ. Лише зміни ШОЕ через 4 тиж лікування виявилися невірогідними. За всіма показниками, які аналізувалися при обох повторних обстеженнях, позитивна динаміка на 12-му тижні була вірогідно суттєвішою порівняно з 4-м тижнем, що дає підстави зробити висновок про наростання клініко-лабораторного ефекту протягом 3 міс лікування і необхідність остаточно оцінювати ефективність ЛФ не раніше, ніж через 12 тиж.
Таблиця 2. Динаміка змін клініко-лабораторних показників у процесі лікування ЛФ у загальній когорті хворих із ПсА (М±σ)
| Показник | До лікування | Тиждень | |
| 4-й 12-й | |||
| Оцінка лікарем за Likert | 3,30±0,62 | 2,87±0,62* | 2,35±0,71*# |
| Оцінка пацієнтом за Likert | 3,83±0,64 | 3,33±0,57* | 2,71±0,64*# |
| Оцінка болю за ВАШ, мм | 5,85±1,59 | 4,90±1,38* | 3,65±1,59*# |
| Оцінка пацієнтом артриту за ВАШ, мм | 6,49±1,54 | 5,42±1,42* | 4,24±1,45*# |
| Болючі суглоби (із 76), балів | 48,6±30,40 | 37,2±22,0* | 23,17±17,82*# |
| Набряклі суглоби (із 74), балів | 14,5±11,5 | 10,6±9,11* | 6,2±5,82*# |
| Індекс Річі | 20,9±10,17 | – | 9,75±7,09* |
| Набряклі суглоби (із 44), балів | 7,02±4,84 | – | 3,27±2,96* |
| Ранкова скутість, хв | 136,9±173,9 | 88,5±101,6* | 54,6±69,8*# |
| HAQ | 1,14±0,50 | 0,99±0,51* | 0,84±0,54*# |
| ШОЕ, мм/год | 21,7±11,8 | 21,1±9,34 | 18,6±9,19*# |
| СРБ, мг/л | 9,84±4,32 | – | 8,48±4,07* |
| DAS (ШОЕ) | 4,28±0,95 | – | 2,98±0,86* |
| DAS (СРБ) | 4,15±0,91 | – | 2,87±0,83* |
| PASI | 14,1±13,4 | – | 7,55±8,35* |
*р<0,01 — вірогідність змін порівняно з вихідними значеннями; #р<0,01 порівняно з 4-м тижнем.
Таблиця 3. Динаміка змін клініко-лабораторних показників у процесі лікування ЛФ у групах монотерапії та КБТ (М±σ різниць абсолютних значень порівняно з початковими)
| Показник | Монотерапія | КБТ | ||
| Тиждень | ||||
| 4-й |
12-й | 4-й 12-й | ||
| Оцінка лікарем за Likert | –0,23±0,43* | –0,73±0,69**## | –0,77±0,72**§§ | –1,26±0,83**##§§ |
| Оцінка пацієнтом за Likert | –0,63±0,56** | –1,1±0,80**## | –0,53±0,73** | –1,33±0,80**## |
| Оцінка болю за ВАШ, мм | –0,92±1,33** | –2,06±2,06**## | –1,42±1,31** | –2,79±1,96**## |
| Оцінка пацієнтом артриту за ВАШ, мм | –1,32±1,50** | –2,2±1,93**## | 1,20±1,23** | –2,80±1,57**## |
| Болючі суглоби (із 76), балів | –8,93±15,1** | –21,5±25,5**## | –15,4±22,0** | –28,7±29,6**## |
| Набряклі суглоби (із 74), балів | –3,13±3,93** | –6,33±7,67**## | –6,97±7,51**§ | –12,3±11,1**##§ |
| Індекс Річі | – | –9,40±7,69** | – | –12,2±10,2**§ |
| Набряклі суглоби (із 44), балів | – | –2,67±3,34** | – | –5,70±5,36** |
| Ранкова скутість, хв | –23,1±47,6** | –46,7±79,2**## | –84,2±130,8**§ | –133,6±175,3**##§ |
| HAQ | –0,20±0,31** | –0,38±0,45**## | –0,12±0,22* | –0,26±0,34**## |
| ШОЕ, мм/год | –0,10±4,61 | –2,70±7,35## | –1,70±6,73 | –3,80±10,2* |
| СРБ, мг/л | – | –1,36±3,52* | – | –1,35±4,17 |
| DAS (ШОЕ) | – | –1,08±0,70** | – | –1,52±1,08**§ |
| DAS (СРБ) | – | –1,06±0,66** | – | –1,50±1,06**§ |
| PASI | –2,00±4,13** | –3,96±6,31**## | –6,42±8,62**§§ | –8,97±10,0**#§ |
*р<0,05; **р<0,01 — вірогідність змін порівняно з вихідними значеннями; #р<0,05; ##р<0,01 — порівняно з 4-м тижнем; §р<0,05; §§р<0,01 — порівняно з монотерапією.
При аналізі ефективності окремо монотерапії ЛФ і КБТ (табл. 3) виявлено в цілому такі ж закономірності, як і в загальній когорті хворих: в обох групах всі клінічні показники й індекси вірогідно покращувалися на обох повторних візитах з наростанням результативності лікування з 4-го по 12-й тиждень. Статистично незначущими були лише зміни ШОЕ у групі монотерапії ЛФ і рівня СРБ — у групі КБТ, що ще раз ілюструє відсутність прямого взаємозв’язку між клінічною тяжкістю ПсА і рівнем лабораторних маркерів запалення. Як видно з наведених даних (див. табл. 3), вже через 4 тиж від початку лікування ефективність КБТ була вищою порівняно з монотерапією за динамікою ряду показників: оцінка стану хворого лікарем — в 3,3 раза, рахунок набряклих суглобів (рахунок 74) — в 2,2 раза, тривалість ранкової скутості — в 3,6 раза, індекс PASI — в 3,2 раза. По завершенні курсу лікування також спостерігалася вірогідна різниця між групами на користь КБТ за оцінкою стану хворого лікарем (в 1,7 раза), кількістю набряклих суглобів (рахунок 74) (в 1,9 раза), індексами DAS (ШОЕ) і DAS (СРБ) (в 1,4 раза), тривалістю ранкової скутості (в 2,8 раза), індексом PASI (в 2,3 раза). Відзначали кількісне зменшення відмінностей між групами через 12 тиж порівняно із 4 тиж, що відбулося переважно за рахунок більш вираженої позитивної динаміки показників між 2-м і 3-м візитом у групі монотерапії. Це може свідчити про те, що у випадках, коли ЛФ призначається на фоні іншого БП (СС або МТ), виражений клінічний ефект загалом розвивається швидше, ніж у разі застосування монотерапії ЛФ.
Зміни клініко-лабораторних показників через 12 тиж у групі монотерапії були зіставними з результатами багатоцентрового дослідження [6], в якому оцінювали ефективність ЛФ у хворих зі ПсА протягом 24 тиж лікування. Так, у нашому дослідженні кількість набряклих суглобів зменшилася на 56,8% проти 40,5% у роботі J. Kaltwasser та співавторів, індекс PASI — відповідно на 36,0 і 24,1%, індекс HAQ — на 31,6 і 17,6%. Краща динаміка показників у нашому дослідженні може бути пов’язана з більш високою клінічною активністю ПсА у групі монотерапії на початку лікування порівняно з такою в рандомізованому дослідженні. Так, у наших хворих кількість болючих суглобів була 43,0 проти 28,8 у дослідженні J. Kaltwasser та співавторів, індекс PASI — 11,1 проти 8,7, HAQ — 1,20 проти 1,08 відповідно.
Основним критерієм, за яким оцінювалась ефективність ЛФ щодо уражень суглобів, була кількість хворих, які відповіли на лікування за критерієм PsARC. У загальній когорті хворих на ПсА кількість осіб, які відповіли за цим критерієм через 3 міс, становила 65,0% (табл. 4). На обох етапах обстеження спостерігалася тенденція до більшої кількості «відповідачів» за критерієм PsARC у групі КБТ. І при монотерапії, і при КБТ кількість хворих, які відповідали цьому критерію, була вірогідно більшою через 12 тиж порівняно з 4-м тижнем, що підтверджує вищезазначену закономірність про динамічне наростання клінічного результату протягом 3-місячного періоду. Досить високий кінцевий показник ефективності лікування у групі монотерапії ЛФ (60,0% «відповідачів» за PsARC) практично не відрізняється від результату, отриманого в рандомізованому контрольованому дослідженні — 59% хворих після 6 міс лікування [6].
Таблиця 4. Кількість хворих, які відповіли на лікування ЛФ за критерієм PsARC, n (%)
| Група | Монотерапія (n=30) | КБТ(n=30) | Загалом(n=60) |
|---|---|---|---|
| «Відповідачі» на 4-му тижні | 10 (33,3) | 13 (43,3) | 23 (38,3) |
| «Відповідачі» на 12-му тижні | 18 (60,0)* | 21 (70,0)* | 39 (65,0)* |
*р<0,05 — вірогідність змін порівняно з 4-м тижнем.
Крім PsARC, до інтегральних показників ефективності лікування ПсА належить індекс DAS. На час завершення дослідження кількість хворих, які мали задовільну відповідь за DAS (ШОЕ) у групах КБТ і монотерапії, була такою ж, як і при оцінці за PsARC — 70,0 і 60,0% відповідно (табл. 5). Водночас за індексом DAS (СРБ) кількість «відповідачів» у групі КБТ була вірогідно більшою порівняно з групою монотерапії (сумарно хороша і задовільна відповідь) — в 1,4 раза. Слід відзначити, що результати оцінки відповіді на лікування за обома методами (PsARC і DAS) були зіставні: серед «відповідачів» за PsARC хорошу і задовільну відповідь за динамікою DAS (ШОЕ) мали 97,4% хворих, за динамікою DAS (СРБ) — 94,9% хворих.
Таблиця 5. Характеристика відповіді за індексами DAS (ШОЕ) і DAS (СРБ) на момент завершення дослідження, кількість хворих (%)
| Відповідь | DAS (ШОЕ) | DAS (СРБ) | ||||||
|
Монотерапія
(n=30) |
КБТ
(n=30) |
Серед «відповідачів» за PsARC
(n=39) |
Загалом
(n=60) |
Монотерапія
(n=30) |
КБТ
(n=30) |
Серед «відповідачів» за PsARC
(n=39) |
Загалом
(n=60) |
|
| Хороша | 0 | 0 | 0 | 0 | 1 (3,3) | 0 | 1 (2,6) | 1 (1,7) |
| Задовільна | 18 (60,0) | 21 (70,0) | 38 (97,4)* | 39 (65,0) | 18 (60,0) | 26 (86,7)§ | 36 (92,3)* | 36 (60,0) |
| Незадовільна | 12 (40,0) | 9 (30,0) | 1 (2,6)* | 21 (35,0) | 11 (46,7) | 4 (13,3)§ | 2 (5,1)* | 23 (38,3) |
*р<0,01 порівняно з усіма хворими на ПсА; §р<0,05 порівняно з монотерапією (враховуючи пацієнта з хорошою відповіддю у групі монотерапії).
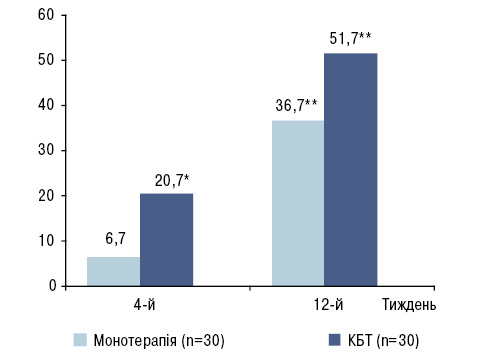
Для оцінки динаміки ураження шкіри у пацієнтів із ПсА нами використовувася показник кількості хворих, які відповіли покращанням за критерієм PASI 50. У загальній когорті хворих через 3 міс «відповідачами» були 44,0% пацієнтів. Як видно з рис. 1, на цьому етапі у групі КБТ частка хворих, у яких ураження шкіри регресувало щонайменше на 50%, була вірогідно більшою (в 1,4 раза) порівняно з групою монотерапії ЛФ. При цьому в групі монотерапії ЛФ кількість «відповідачів» за PASI 50 (36,7%) була близькою до такої в багатоцентровому дослідженні (29%) [6]. Як і щодо динаміки суглобового статусу, позитивні зміни шкірних проявів через 4 тиж реєструвалися у 2,5–5,5 раза рідше, ніж після 12-тижневого курсу лікування (p<0,05).
Відзначимо, що серед «відповідачів» за PASI 50 було вірогідно менше хворих, які отримували ГК — 11,5% порівняно з 21,2% у «невідповідачів» (p<0,05), що може бути пов’язано з розвитком ГК-індукованого псоріатичного ураження шкіри [13].
Протягом дослідження 3 хворих достроково припинили прийом ЛФ у зв’язку із побічними ефектами (по 1 хворому — дерматит, сенсорна нейропатія та підвищення рівня АлАТ більше ніж у 3 рази вище від верхньої межі норми). Ці побічні явища реєстрували протягом 2–4 тиж після припинення прийому препарату та не потребували додаткового лікування. У 14 (22,2%) пацієнтів спостерігалися несприятливі явища, які не потребували припинення прийому препарату, а саме: у 4 хворих — диспептичні явища (біль у шлунку, нудота, діарея), 3 — незначну дифузну алопецію волосистої ділянки голови, по 2 хворих — дерматит і підвищення АлАТ та/чи АсАТ у межах менше ніж у 2 рази вище верхньої межі норми, та по 1 хворому — кардіалгію, загальну слабкість та нейропатію. Отже, серед 63 хворих, включених у дослідження, хорошу переносимість мали 73,0%, задовільну — 22,2% та незадовільну — 4,8%.
Частота несприятливих явищ у групах КБТ та монотерапії вірогідно не відрізнялася: з 17 випадків несприятливих явищ 58,8% сталися у групі КБТ та 41,2% — монотерапії. Загалом переносимість ЛФ була клінічно прийнятною, і, враховуючи тривалість лікування, зіставною з переносимістю ЛФ у хворих на ПсА в рандомізованому клінічному дослідженні [6].
ВИСНОВКИ
ЛФ — ефективний щодо уражень суглобів (65% хворих) і шкіри (44% хворих) та з прийнятним профілем безпеки засіб БТ — можна застосовувати у лікуванні хворих на ПсА з ураженням периферичних суглобів.
У хворих на ПсА з недостатнім ефектом від лікування СС чи МТ слід застосовувати КБТ з використанням ЛФ. При цьому результативність лікування є вищою порівняно з монотерапією ЛФ.
Суттєвих відмінностей у переносимості ЛФ при застосуванні його як монотерапії та у складі КБТ немає.
Позитивний вплив ЛФ на ураження суглобів проявляється раніше (вже через 4 тиж) і є вираженішим порівняно з динамікою шкірних проявів.
Остаточну оцінку ефективності лікування ЛФ як щодо суглобових, так і шкірних проявів, необхідно здійснювати не раніше ніж через 12 тиж.
ЛІТЕРАТУРА
1. Davis J.P., Cain G.A., Pitts W.J. et al. (1996) The immunosuppressive metabolite of leflunomide is a potent inhibitor of human dihydroorotate dehydrogenase. Biochemistry, 35: 1270–1273.
2. Fox R.I. (1998) Mechanism of action of leflunomide in rheumatoid arthritis. J. Rheumatol., 53: 20–26.
3. Gladman D.D. (1994) The natural history of psoriatic arthritis. In: Wright V, Helliwell PS, eds. Psoriatic arthritis in Baillière’s Clinical Rheumatology. International Practice and Research. Baillière Tindall., London, 379–394.
4. Gladman D.D., Antoni C., Mease P. et al. (2005) Psoriatic arthritis: epidemiology, clinical features, course, and outcome Ann. Rheum. Dis., 64: 14–17.
5. Joachim Peter Kaltwasser (2007) Leflunomide in psoriatic arthritis. Autoimmunity Reviews, 6(8): 511–514.
6. Kaltwasser J.P., Nash P., Gladman D. et al. (2004) Treatment of Psoriatic Arthritis Study Group. Efficacy and safety of leflunomide in the treatment of psoriatic arthritis and psoriasis: a multinational, double-blind, randomized, placebo-controlled clinical trial. Arthritis Rheum., 50(6): 1939–1950.
7. Kane D., Stafford L., Bresnihan B. et al. (2003) A prospective, clinical and radiological study of early psoriatic arthritis: an early synovitis clinic experience. Rheumatology (Oxford)., 42: 1460–1468.
8. Kavanaugh A.F., Ritchlin C.T. (2006) GRAPPA Treatment Guideline Committee. Systematic review of treatments for psoriatic arthritis: an evidence based approach and basis for treatment guidelines. J. Rheumatol., 33: 1417–1421.
9. Knecht W., Bergiohann U., Kitshbaum B. et al. (1996) Functional expression of a fragment of human dihydroorotate dehydrogenase by means of the baculovirus expression vector system, and kinetic investigation of the purified recombinant enzyme. Eur. J. Biochem., 240: 292–302.
10. Liang G.C., Barr W.G. (2001) Long term followup of the use of leflunomide in recalcitrant psoriatic arthritis and psoriasis. Arthritis Rheum., 44: 121.
11. Maddison P.J., Isenberg D.A., Woo P. et al. (2004) Psoriatic arthritis. In: Maddison P.J., Isenberg D.A., Woo P., Glass D.N., Breedveld F. (Еds) Oxford textbook of rheumatology. 3rd ed. Oxford University Press, Oxford, р. 766–778.
12. Mease P.J., Antoni C.E., Gladman D.D. et al. (2005) Psoriatic arthritis assessment tools in clinical trials. Ann. Rheum. Dis., 64: 49–54.
13. Ritchlin C.T., Kavanaugh A., Gladman D.D. et al. (2009) Treatment recommendations for psoriatic arthritis. Ann. Rheum. Dis., 68: 1387–1394.
14. Scarpa R., Manguso F., Oriente P. et al. (2001) Leflunomide in psoriatic polyarthritis: an Italian pilot study. Arthritis Rheum., 44: 92.
15. Strand V., Cohen S., Schiff H.M. et al. (1999) Treatment of active rheumatoid arthritis with leflunomide compared with placebo and methotrexate. Arch. Intern. Med., 159: 2542–2550.
16. Taylor W., Gladman D., Helliwell P. et al. (2006) Classification criteria for psoriatic arthritis: development of new criteria from a large international study. Arthritis Rheum., 54: 2665–2673.
17. van der Heijde D.M., van ’t Hof M.A., van Riel P.L. et al. (1990) Judging disease activity in clinical practice in rheumatoid arthritis: first step in the development of a disease activity score. Ann. Rheum. Dis., 49: 916–920.
18. Wong D., Gladman D.D., Husted J. et al. (1997) Mortality studies in psoriatic arthritis: results from a single outpatient clinic. I. Causes and risk of death. Arthritis Rheum., 40: 1868–1872.
19. Wright V., Moll J.M.H. (1976) Psoriatic arthritis. In: Wright V., Moll J.M.H., eds. Seronegative polyarthritis. North Holland Publishing Co., Amsterdam, р. 169–223.
ЭФФЕКТИВНОСТЬ И ПЕРЕНОСИМОСТЬ БАЗИСНОЙ ТЕРАПИИ ПСОРИАТИЧЕСКОГО АРТРИТА С ПРИМЕНЕНИЕМ ЛЕФЛУНОМИДА
Резюме. Резюме. Изучена эффективность и переносимость лечения лефлуномидом (ЛФ) при применении его в качестве монотерапии и в составе комбинированной базисной терапии (КБТ) у 63 больных с псориатическим артритом (ПсА). Применение ЛФ в дозе 20 мг/сут оказывает выраженное обезболивающее и противовоспалительное действие уже через 4 нед с последующим нарастанием клинико-лабораторного эффекта к 12-й неделе лечения. Под влиянием ЛФ через 12 нед на 45% снижаются суммарные показатели поражения суставов (DAS (СРБ) и DAS (СОЭ)), на 26,3% улучшается функциональное состояние больных (по индексу HAQ), в 1,9 раза снижается интенсивность псориатического поражения кожи (по индексу PASI 50). Эффективность ЛФ в комбинации с сульфасалазином или метотрексатом выше в сравнение с монотерапией ЛФ как относительно поражения суставов (выше частота достижения хорошего и удовлетворительного ответа по DAS (СРБ)), так и относительно поражения кожи (большее количество больных — «ответчиков» по PASI 50). Переносимость лечения была хорошей у 73% больных, удовлетворительной — у 22,2%, лечение было прекращено из-за побочных явлений у 4,8% больных. Существенных различий в переносимости ЛФ как монотерапии и в составе КБТ нет.
псориатический артрит, базисное лечение, лефлуномид.
Адреса для листування:
Яременко Олег Борисович
01601, Київ, бульв. Тараса Шевченка, 13
Національний медичний університет ім. О.О. Богомольця,
кафедра внутрішніх хвороб стоматологічного факультету

Leave a comment