ТЮТЮНОПАЛІННЯ І РОЗВИТОК РЕВМАТОЇДНОГО АРТРИТУ: СКЛАДАННЯ ПАТОГЕНЕТИЧНОГО ПАЗЛА
Коваленко В.Н., Головач И.Ю., Борткевич О.П.
Резюме. В оглядовій статті представлено сучасні дані щодо вивчення взаємозв’язку між тютюнопалінням і розвитком ревматоїдного артриту (РА). Численні дослідження, проведені за останні 20 років, переконливо стверджують, що куріння сигарет пов’язане з високим ризиком розвитку РА як серед жінок, так і серед чоловіків, а також доводять взаємозв’язок між курінням, антитілами до циклічного цитрулінового пептиду (АЦЦП) і РА. У жінок, які курили більше 20 років, ризик розвитку РА був підвищений на 24–39%, а ризик виникнення серопозитивного РА — на 30–49%, залежно від кількості викурених протягом дня сигарет. Доведено достовірний взаємозв’язок між тютюнопалінням і ступенем тяжкості хвороби, кількістю ерозій, появою ревматоїдних вузликів, у тому числі при ранньому РА. Ризик розвитку РА у більшою мірою асоціюється з тривалістю тютюнопаління, ніж з інтенсивністю, але одночасно згубний вплив куріння щодо можливості розвитку артриту нівелюється лише через 10–20 років після припинення куріння. Продемонстрована чітка кореляція між наявністю HLA-DRB1 SE-генотипу і розвитком РФ- і АЦЦП-позитивного РА, при цьому ризик розвитку АЦЦП-позитивного РА серед курців із двома алелями порівняно з тими, хто ніколи не курив без SE-алелів, зростав у >20 разів. Таким чином, тютюнопаління є важливим етіологічним фактором ризику розвитку аутоімунних захворювань, зокрема РА. Отже, надзвичайно важливо інформувати пацієнтів про небезпечні наслідки куріння щодо розвитку та прогресування РА.
Курение является одним из главных факторов окружающей среды, гипотетически играющее решающую роль в развитии ряда заболеваний, прежде всего онкологических. Совсем недавно установлено, что курение участвует в патогенезе некоторых аутоиммунных заболеваний, таких как ревматоидный артрит (РА), системная красная волчанка, системная склеродермия, псориатический артрит, рассеянный склероз и болезнь Крона. Проведены глубокие многочисленные исследования, подтвердившие эту связь на патогенетическом уровне.
О существовании связи между серопозитивным РА и курением известно давно. В одной из самых ранних публикаций I.D. Mathews и соавторов (1973) [27] сообщалось о взаимосвязи между курением, выработкой аутоантител, в том числе ревматоидного фактора (РФ), частотой развития сердечно-сосудистых заболеваний и летальными исходами. Чуть позже, в 1990 г., финскими учеными также доказана ассоциация между нарушением функции легких, курением и наличием РФ [46]. В 1987 г. M.P. Vessey и соавторы [49] описали связь между частотой госпитализаций и обострением РА и курением сигарет, что было случайно выявлено при гинекологическом обследовании пациенток. С тех пор проведено несколько типа случай–контроль и когортных исследований [16]. Например, популяционные исследования случай–контроль в Норфолке (Англия) продемонстрировали, что курение связано с повышением риска развития РА [43].
Большой интерес представляет ретроспективное когортное исследование по изучению взаимосвязи курения и риска развития РА среди 377 481 женщины, работающей в области социальной медицины. Из 7697 женщин, сообщивших о диагнозе РА, у 3416 диагностирован серопозитивный РА. При мультивариабельном анализе по возрасту, национальности, образованию, началу менструального цикла, количеству беременностей, менопаузальному статусу, применению гормонов, длительности курения выявлен выраженный повышенный риск развития РА (р<0,01) и, в частности, серопозитивного РА (р<0,01). У женщин, выкуривающих свыше 25 сигарет в день в течение более чем 20 лет, риск развития РА и серопозитивного РА составлял 39 и 49% соответственно. С высоким риском развития РА у женщин ассоциировалась продолжительность, а не интенсивность курения [19].
Шведские исследователи также провели качественный анализ влияния сигаретного дыма на развитие РА. У 670 пациентов с РА и 847 человек контрольной группы проводили регистрацию наличия курения и РФ. Сопоставлялась заболеваемость cialis insomnia РА у курящих, бывших курящих, когда-либо куривших с никогда некурившими. Курящие, бывшие курящие и когда-либо курившие обоего пола имели повышенный риск развития серопозитивного РА. Для когда-либо куривших отношение шансов составляло 1,7 у женщин (95% ДИ; 1,2–2,3) и 1,9 — у мужчин (95% ДИ; 1,0–3,5). Повышенный риск был очевиден у курящих более 20 лет при курении 6–9 сигарет в день и оставался таковым в течение 10–19 лет после прекращения курения. Риск повышался с увеличением кумулятивной дозы никотина [42].
В 2008 г. на Ежегодном конгрессе Европейской лиги по борьбе с ревматизмом (EULAR), проведенном во Франции, Аннмари Уэсли из Института экологической медицины Стокгольма обнародовала заключительные результаты исследования, показывающие, что курение повышает риск развития РА. Такие данные получены в результате большого исследования EIRA, проведенного в Швеции, с участием 1899 человек с подтвержденным диагнозом РА. Курение табака — установленный фактор риска для РА, но исследователи выявили прямую связь между количеством выкуриваемых сигарет и высокой частотой развития АЦЦП-положительного (антитела к циклическому цитруллированному пептиду — АЦЦП) РА. Так, группа шведских ученых определяла взаимодействие двух факторов, специфичных для развития РА: наличия гена, кодирующего определенную белковую последовательность, называемую SE (shared epitope) и являющуюся наиболее важным известным в настоящее время генетическим фактором риска развития РА, и табакокурения. Результаты продемонстрировали, что курение существенно повышает риск развития этого заболевания у мужчин и женщин с генетической предрасположенностью. Установлено, что у некурящих людей, в геноме которых содержится кодирующий SE ген, риск развития РА в 2,8 раза выше, чем у некурящих без генетической предрасположенности. У курильщиков риск развития заболевания в 2,4 раза выше по сравнению с контрольной группой. Это подтверждает, что как наличие SE-гена, так и курение, независимо друг от друга могут способствовать развитию РА. В то же время у курильщиков с генетической предрасположенностью риск заболевания повышен в 7,5 раза. Взаимодействие этих двух факторов еще более выражено в случае наличия в геноме двух генов, кодирующих SE-последовательность, в таких случаях риск развития заболевания повышается в 15,7 раза [21, 37].
Разнообразные эффекты табакокурения и их гипотетическая роль в развитии аутоиммунных, в том числе и ревматических заболеваний, представлена в табл. 1.
Таблица 1. Эффекты курения, играющие ведущую роль в патогенезе ревматических заболеваний
(адаптировано нами по: Z. viagra effect on blood pressure Baka et al. (2007) [4])
| Эффект | Детали воздействия | Источник |
| Клетки иммунной системы | Воздействие табачного дыма приводит к депрессии фагоцитарной и антибактериальной функций альвеолярных макрофагов | Ortega E. et al. (1994) [35] |
| Хроническое курение вызывает T-клеточную анергию | de Jonge W.J. et al. (2007) [17] | |
| Вследствие курения и накопления конденсата первичный иммунный ответ снижается | Nguyen van Binh P. et al. (2004) [33] | |
| Нарушение уничтожения внутриклеточных бактерий в альвеолярных макрофагах курильщиков | King T.E. et al. (1988) [20] | |
| Никотин ослабляет функции нейтрофилов, например супероксидных радикалов | de Jonge W.J. et al. (2007) [17] | |
| Никотиновые рецепторы ацетилхолина принимают участие в угнетении антимикробной активности | Matsunaga K. et al. (2001) [28] | |
| Никотин снижает индукцию антиген-представляющих Т-клеток | de Jonge W.J. et al. (2007) [17] | |
| Продукция цитокинов | Гидрохинон подавляет секрецию интерферона (ИНФ)-γ в лимфоцитах | Choi J.M. et al. (2008) [10] |
| Ненасыщенные альдегиды вызывают высвобождение интерлейкина (ИЛ)-8 и фактора некроза опухоли (ФНО)-α в макрофагах человека | Facchinetti F. et al. (2007) [13] | |
| Никотин снижает производство ИЛ-12 в дендритных клетках | de Jonge W.J. et al. (2007) [11] | |
| Никотиновые рецепторы ацетилхолина участвуют в подавлении ИЛ-6, ИЛ-12 и ФНО-α | Matsunaga K. et al. (2001) [28] | |
| Альвеолярные макрофаги курильщиков выпускают меньше ФНО-α, ИЛ-1 и ИЛ-6 | Sauty A. et al. (1994) [41] | |
| Гидрохинон вызывает подавление продукции ИЛ-1, ФНО-α и ИНФ-γ в человеческих макрофагах | Ouyang Y. et al. (2000) [36] | |
| Окислительный стресс | Дым содержит большое количество свободных радикалов | Hasnis E. et al. (2007) [15] |
| Дым вызывает истощение внутриклеточного глутатиона в результате повреждения клеток | Hasnis E. et al. (2007) [15] | |
| У курильщиков вследствие нарушения окислительно-восстановительных процессов активируются NF-kB и активатор протеина-1 | Nguyen C. et al. (2003) [32] | |
| Агенты, действующие на сульфгидрильные группы, инактивируют пептидиларгининдеиминазу, в то время как восстановленные соединения повышают свою деятельность | Méchin M.C. et al. (2007) [29] | |
| В легких курильщиков повышается активность пептидиларгининдеиминазы | Nguyen C. et al. (2003) [32] | |
| Антиэстрогеновый эффект | Курение оказывает противовоспалительное действие за счет образования неактивных эстрогенов | Baron J.A. et al. (1990) [6] |
| Фибриноген | Курильщики имеют более высокий уровень фибриногена в сыворотке крови | Kannel W.B. et al. (1987) [18] |
Исследования, проведенные за последние 15–20 лет, установили, что многие аспекты возникновения и течения РА (серопозитивность, тяжесть течения, степень прогрессирования, появление ревматических узелков, висцеральные поражения) связаны с курением. В последние годы удалось установить патогенетические механизмы такой взаимосвязи и выдвинуть гипотезу этиопатогенеза РА.
Благодаря сообщению P.K. Gregersen и соавторов в 1987 г. об ассоциации между «общими» аллелями HLA-DRB1, гена и риском развития РА, наступил новый этап в понимании этиопатогенеза РА [14].
РА считается классическим полиэтиологичным заболеванием, при котором сочетающиеся генетические и экологические факторы обусловливают развитие заболевания. Генетический компонент РА широко исследован: установлена корреляционная связь между наличием гена HLA, в частности HLA-DRB1, и развитием РА [8, 44, 52]. Некоторые HLA-DRB1-аллели (DRB1*0401, DRB1*0404, DRB1*0405, DRB1*0408, DRB1*0101, DRB1*102, DRB1*1001 и DRB1*1402), кодирующие так называемый общий эпитоп (SE) в позициях 70 до 74 аминокислот, ассоциируются с высокой восприимчивостью к РА [8].
Другой важной ассоциацией для РА является связь с полиморфизмом PTPN22 — гена протеинтирозинфосфатазы нонрецептора 22 (protein tyrosine phosphatase nonreceptor 22). PTPN22 — это внутриклеточный белок, который устанавливает порог сигнализации Т-клеточного рецептора. Поэтому PTPN22, скорее всего, является общим фактором риска для всех аутоиммунных viagra and food заболеваний. Кроме того, в исследовании случай–контроль A.B. Begovich и соавторы (2004) установили значительное взаимодействие между PTPN22 и курением (>10 пачек сигарет в год) [7]. Активно изучается роль и других генетических факторов, например рецептор 2 ФНО-α (TNFR2), ген активатора нуклеарного фактора κB (TNFRSR11A), runt-зависимый транскрипционный фактор 1(RUNX1) и др. [8].
По генетическим маркерам РА разделяется множество подгрупп, определяющих особенности клинического течения и прогноз. АЦЦП-позитивный и АЦЦП-негативный РА также генетически существенно отличаются. Так, наличие HLA-DRB1 SE-аллелей и PTPN22 ограничивает развитие АЦЦП-позитивных артритов; ИНФ-регуляторный фактор-5 (IRF-5) и C-тип лектина обусловливают риск ACPA-отрицательного РА [8].
Курение является фактором риска развития РА у носителей общих эпитопов. По результатам шведского исследования случай–контроль связь между курением и РА строго обусловлена наличием аллелей общего эпитопа (SE) с 15-кратным повышением риска развития РФ- и АЦЦП-позитивного РА среди курильщиков с двумя аллелями, с 7,5-кратным повышением риска РФ- и АЦЦП-позитивного РА развития в сравнении с 2,5-кратным повышением риска среди курильщиков без SE-аллелей [37].
Cкрининг финского населения выявил связь между наличием РФ и курением, однако при этом не исследовалась заболеваемость РА [46]. В другом исследовании подчеркивалось, что курение обусловливает развитие только серопозитивных форм РА [47], предполагая, что два варианта болезни могут иметь различные патологические механизмы развития. Некоторые исследователи подтверждают наличие взаимосвязи между курением и РА, но только у женщин [22], однако множество других ученых противоречат этому факту. Большинство исследований указывают, что курильщики имеют повышенный риск развития серопозитивного РА, но не серонегативного.
Сделаны также многочисленные попытки выяснить, как история курения (длительность курения, возраст начала курения, интенсивность) влияют на развитие РА. Популяционное исследование случай–контроль, проведенное в США в 1994 г., показало, что женщины, выкуривающие ≥20 пачек сигарет в год, имеют значительно более высокий относительный риск развития РА по сравнению с никогда не курившими женщинами [50]. Кроме того, исследование медицинских работников-женщин показало, что курение женщиной ≥25 сигарет/день в течение >20 лет (>25 пачек сигарет в год) вызывает повышенный риск развития РА [19]. Интенсивность курения (количество сигарет/сут), однако, не связана с РА, поэтому был сделан вывод, что именно продолжительность курения, но не интенсивность, ассоциируются с повышенным риском РА.
Интересно, что повышенный риск развития РА сохраняется и после отказа от курения. Так, результаты исследования случай–контроль в Швеции свидетельствуют, что повышенный риск развития РА устанавливается после длительного курения (≥20 лет при умеренной интенсивности) и может продолжаться в течение нескольких лет (от 10 до 20 лет) после отказа от курения [42].
Таким образом, повышенный риск заболевания РА возникает при длительном курении, а снижение риска возникает только через 10 лет после прекращения курения. РА характеризуется продукцией антител, прежде всего АЦЦП и РФ [2]. Данные о взаимосвязи длительности курения с повышенным риском заболевания могут свидетельствовать о том, что длительное курение с определенной интенсивностью приводит к устойчивым изменениям иммунного ответа и последующей продукции антител клетками памяти, создавая и сохраняя, таким образом, патологическую продукцию антител. И только через определенное время (10–20 лет) иммунная система может «оправиться» от последствий курения.
Но если длительность курения существенно повышает риск развития РА, то интенсивность курения оказывает влияние на тяжесть течения заболевания. Клиническая оценка пациентов в Университете штата Айова показала, что курение сигарет (≥25 пачек/год) было в значительной степени связано с серопозитивностью, ранними эрозиями, выявляемыми при рентгенографии, и ревматоидными узелками [40]. Некоторые исследования указывают, что курение может повысить риск появления внесуставных проявлений (ревматоидные узелки, интерстициальные заболевания легких, ревматоидный васкулит) [31, 34].
Еще в 1997 г. проведено клиническое исследование K.G. Saag и соавторами [40], установившими, что курильщики, выкуривающие по крайней мере 25 пачек/год, имеют в 3,1 раза больше шансов приобрести серопозитивный РА и в 2,4 раза больше рентгенографически выявляемых эрозий костей, в сравнении с теми, кто никогда не курил. Таким образом, эти исследователи одними из первых связали тяжесть клинической симптоматики РА с курением (рис. 1).
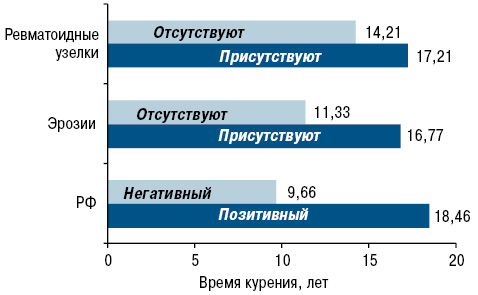
В работе V.F. Manfredsdottir и соавторов (2006) постепенное повышение активности заболевания наблюдалось от группы никогда не куривших пациентов, бросивших курить и до группы сегодняшних курильщиков с наивысшими показателями количества опухших суставов и выраженной болевой шкалой у последней группы пациентов. При этом установлено, что курение не влияло на рентгенологическую прогрессию РА [26]. В когорте греческих пациентов с ранним РА курение ассоциировалось с повышением активности заболевания и степени тяжести, несмотря на раннее начало лечения [38].
Недавние результаты исследований G. Westhoff и соавторов (2008) показали, что курение не влияет на активность заболевания и рентгенологическую прогрессию, но при этом курильщики нуждаются в более высоких дозах болезнь-модифицирующих противоревматических препаратов, что может указывать на снижение их эффективности из-за курения [51].
Несмотря на противоречивые данные, можно сделать вывод о неблагоприятном влиянии курения на течение РА, поэтому необходимо обращать внимание пациентов на позитивные эффекты отказа от курения.
Многочисленные популяционные исследования, проведенные в последние годы в разных странах, доказательно продемонстрировали, что курение связано с высокой частотой AЦЦП-положительного РА. Оценка случаев заболевания артритом (недифференцированный артрит и РА) показала, что длительное воздействие табака повышает риск продукции АЦЦП лишь у носителей в SE-аллелей [25].
Курение не только ассоциировалось с АЦЦП-позитивностью РА, но также идентифицировалось как фактор риска развития РА среди пациентов с носительством АЦЦП при раннем РА и как фактор, влияющий на тяжесть болезни, ее активность и рентгенологическое прогрессирование. Курение также может рассматриваться как фактор риска развития РА среди пациентов с АЦЦП-позитивным недифференцированным артритом.
Курение главным образом связано с АЦЦП-позитивным РА. Эта связь наблюдалась только в контексте наличия аллелей SE и отсутствовала при SE-негативном РА, что тем самым подтверждает взаимодействие генотипа и окружающей среды: HLA-SE и курения [48]. Эти данные легли в основу гипотезы, которую первым постулировал L. Klareskog и соавторы (2006) [21], предположив, что курение может выступать специфическим триггером РА-специфических иммунных реакций, связанных с цитруллированием белков, вызывая, возможно, цитруллирование поврежденных, «умирающих» клеток бронхоальвеолярного тракта. Привлекательность этой гипотезы состоит в том, что курение может влиять не только на наличие, но и на характер продукции циклических цитруллированных антител. Например, можно предположить, что HLA-аллели SE, которые патогенетически объединяют курение и АСРА-позитивный вариант РА, моделируют иммунный ответ через CD4 Т-хелперы, которые влияют на величину и/или качество цитруллирования белков, на которые, в свою очередь, направлен В-клеточный ответ [4, 48]. А это означает, что иммунный ответ и качественный состав АЦЦП-антител будет различным у курящих и некурящих пациентов (табл. 2), что, в конечном итоге, определяет гетерогенность клинического течения РА и особенности ответа на противоревматическую терапию.
Установлено, что IgA-АЦЦП статус чаще отмечается среди курящих пациентов, независимо от наличия SE. Кроме того, IgM- АЦЦП также чаще выявляют у курящих пациентов с РА, в сравнении с некурящими, независимо были ли это пациенты SE-позитивными или SE-негативными. У курильщиков наблюдается тенденция к увеличению числа различных изотипов АЦЦП, особенно у SE-позитивных [48].
| Изотипы АЦЦП | Пациенты, n (%) | Соотношение(ОР, 95% ДИ) | |
|---|---|---|---|
| некурящие (n=99) | курящие (n=117) | ||
| IgA | 50 (51) | 87 (74) | 2,8 (1,60–5,04) |
| IgM | 55 (56) | 81 (69) | 1,8 (1,03–3,15) |
| IgG 1 | 99 (100) | 116 (99) | – |
| IgG 2 | 76 (77) | 99 (85) | 1,7 (0,84–3,30) |
| IgG 3 | 50 (51) | 70 (60) | 1,5 (0,85–2,51) |
| IgG 4 | 97 (98) | 113 (97) | 0,6 (0,10–3,25) |
Табак индуцировал выработку АЦЦП преимущественно у больных с SE, но когда толерантность к цитруллированным антигенам была нарушена, воздействие табака уже не зависело от активности Т-клеток. Возможно, курение влияет непосредственно на В-клеточную реакцию. Таким образом, курящие или бросившие курить с АЦЦП-позитивным РА демонстрировали наличие более широкого спектра АЦЦП-изотипов и более высокий процент IgА и IgМ АЦЦП, чем некурящие с АЦЦП-позитивным РА [48]. На большей когорте из 858 пациентов с РФ-позитивностью и 1048 с РФ-негативностью высокий риск развития РА (ОR=2,8; 95% ДИ; 1,6–4,8) выявлен у больных с положительным РФ и SE [2].
Активированные В-клетки бронхоальвеолярного тракта являются известными продуцентами IgA (так называемая система BALT — bronchus-associated lymphoid tissue — бронхоассоциированная лимфоидная ткань). Клетки бронхоассоциированной лимфоидной ткани значительно чаще определяют у курящих пациентов по сравнению с некурящими [39]. Этот факт, а также исследования, указывающие на более высокий процент цитруллирования белков в клетках курильщиков, полученных путем бронхоальвеолярного лаважа [21], подтверждают рабочую гипотезу, что IgA-АЦЦП будут чаще и в более высоких концентрациях присутствовать у курящих пациентов с РА, чем у некурящих.
Различия в изотипах АЦЦП-антител у курящих и некурящих пациентов, возможно, определяет характер течения патологических реакций, более быстрое прогрессирование РА и более быстрый переход недифференцированного артрита в РА по критериям 2010 ACR/EULAR.
В исследовании Leiden Early Arthritis Clinic таким SE-аллелям, как HLA-DRB1*0401, HLA-DRB1*0404, HLA-DRB1*0405 или HLA-DRB1*0408 присвоен самый высокий риск развития АЦЦП-антител, а взаимодействие курения и SE было самым высоким в случае HLA-DRB1*0101 или HLA-DRB1*0102 и HLA-DRB1*1001 SE аллелей [17].
Два из трех когортных исследований, проведенных в Северной Америке, продемонстрировали ассоциацию между курением и АЦЦП (исследования NARAC — North American Rheumatoid Arthritis Consortium и National Inception Cohort of Rheumatoid указали на наличие такой связи, а SONORA — Study of New Onset Rheumatoid Arthritis — не выявила подобную взаимосвязь) [24]. У афроамериканцев молодого возраста с ранним РА не установлено никакой связи между курением, АЦЦП и рентгенологически выявляемыми эрозиями [30]. Это указывает на особенности взаимодействия экологических и генетических факторов и более сложную картину факторов риска у американцев.
Однако другие многочисленные исследования гипотезируют о наличии связи между курением, аллелями SE и АЦЦП-позитивными пациентами с РА. Обобщение последних когортных и случай–контроль исследований, посвященных изучению взаимосвязи и взаимовлияния курения и АЦЦП, представлено в табл. 3.
Среди аутоантител, которые отмечаются при РА, антифилагриновые аутоантитела (АФА) являются весьма специфическими и постепенно стали признанным лабораторным тестом для его диагностики. Открытие аутоантигенов, содержащих цитруллин, что присуще РА, стало одним из самых важных событий в ревматологии последнего времени в области серологической диагностики. Процесс цитруллирования наблюдается при естественных физиологических и патологических процессах и играет важную роль в процессах дифференциации и апоптоза. Цитруллирование не является строго специфичным для РА, многие ревматические заболевания, сопроводжающиеся синовитом (остеоартрит, реактивный артрит, недифференцированный артрит, подагра и даже травмы), характеризуются наличием цитруллированных белков.
| Исследование | Результат |
|---|---|
| Исследование случай–контроль (n=1,305) (недифференцированный артрит, n=486; РА, n=407) |
Курение повышает риск развития АЦЦП-позитивного РА только у SE (shared epitope)-позитивных пациентов [45] |
| Национальное исследование случай–контроль (515 пациентов с РА и 769 пациентов контроля) | Курение связано с повышенным риском АЦЦП-положительных РА [25] |
| Последовательное изучение сывороток крови больных РА (n=241) | Более высокие титры ЦЦП выявляли у курящих пациентов.АЦЦП-позитивность была связана с более высокой частотой рентгенологически выявляемых эрозий.Умеренная связь между АЦЦП и РФ [24] |
| Исследование случай–контроль (EIRA, 967 пациентов с РА и 1357 пациентов контроля) | Предшествующее курение в зависимости от длительности и интенсивности ассоциируется с образованием АЦЦП.Наличие двойных копий общих аллелей SE приблизительно в 20 раз повышает риск возникновения АЦЦП-позитивного РА у курильщиков [21] |
| Исследование Клиники Лейден — Leiden Early Arthritis Clinic (977 пациентов с ранним артритом) | HLA-DRB1*0401, HLA-DRB1*0404, HLA-DRB1*0405, или HLA-DRB1*0408 эпитопы общих аллелей может придать самый высокий риск развития АЦЦП-позитивного РА.Наиболее неблагоприятным является взаимодействие курения и SE в случае наличия таких общих аллелей: HLA-DRB1*0101 или HLA-DRB1*0102 и HLA-DRB1*1001 [17] |
| Исследование Клиники Лейден — Leiden Early Arthritis Clinic (n=216) | Бывшие и нынешние курильщики с АЦЦП-позитивным РА демонстрируют более широкий спектр АЦЦП изотопов по сравнению с SE-негативными пациентами [48] |
| Анализ трех Североамериканских когортных исследований РА (n=2476) (NARAC, n=1105; SONORA, n=618; Inception Cohort, n=753) | Наличие связи между курением и АЦЦП в исследовании NARAC и Inception Cohort, но не в исследовании SONORA.Только когортное исследование NARAC указывает на взаимодействие курения и SE-эпитопов у АЦЦП-позитивных пациентов [24] |
| Афроамериканцы с ранним началом РА (n=300) | Не установлено взаимодействия между курением и АЦЦП [30] |
Цитруллирование — это процесс, в котором формируются цитруллинсодержащие белки [1]. Эти реакции происходят при участии фермента пептидиларгининдеиминазы (PAD). Они сопровождают, прежде всего, процессы апоптоза и воспаления. На сегодня известно 4 типа этого фермента: PAD1 и PAD3 выявлены преимущественно в эпидермисе и волосяных фолликулах, PAD2 — в клетках мышечной, мозговой и гемопоэтической тканей, а PAD4 — в макрофагах и моноцитах. Последние два изотипа являются наиболее вероятными кандидатами для включения в цитруллирование синовиальных белков при РА. В физиологических условиях PAD2 и PAD4 неактивны. Цитруллирование синовиальных белков является активным процессом, возникающим во время воспаления. Для активации процессов цитруллирования необходимо значительное повышение уровня внутриклеточного кальция, которое также отмечают и при апоптозе.
Курение связано с рядом аутоиммунных заболеваний, таких как системная красная волчанка, первичный билиарный цирроз, рассеянный склероз, где подобная ассоциация генов с факторами окружающей среды создает особенный иммунный ответ. Изучение таких патогенетических связей поможет лучше понять этиопатогенетические взаимосвязи и при РА.
Данные свидетельствуют о том, что курение имеет подавляющий эффект на иммунную систему с помощью различных веществ, содержащихся в сигаретном дыме, среди которых никотин имеет самую существенную роль. Комплексная роль курения в развитии РА схематически представлена на рис. 2. Никотин попадает в кровь через альвеолярно-эндотелиальный барьер, а затем достигает лимфоидной ткани, где проявляет системный иммуномоделирующий эффект и действует через никотиновые рецепторы. Вследствие иммуносупрессии, вызванной дымом, риск инфекции повышается не только в дыхательных путях, но и в других областях тела.
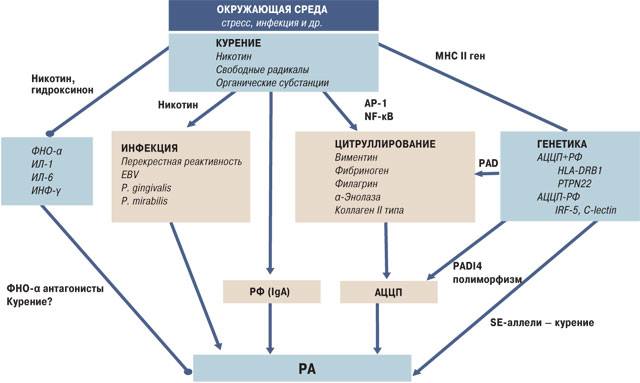
Суперантигены конкретных бактерий (Streptococcus, Staphylococcus) и вирусы (вирус Эпштейна — Барр — EBV) в обход антигенпредставляющих клеток непосредственно связываются с молекулами большого комплекса гистосовместимости, вызывая массовую активацию Т-клеток (до 20% общего числа). Кроме того, они могут использовать не только Т-клеточный рецепторный путь, но и другие пути [9]. Т-клетки могут быть активированы и цитруллированными белками, которые накапливаются в дыхательных путях вследствие хронического курения. Роль EBV в патогенезе РА поддерживается и другими данными: титр анти-EBV повышен у пациентов с РА; антигены EBV имеют общие черты с аутоантигенами синовиальной оболочки, что обусловливает возможность перекрестного реагирования; также gp110 гликопротеина в EBV содержит копию SE; клеточный ответ против белков EBV выявлен в синовиальной жидкости пациентов с РА [45].
С другой стороны, обсуждается роль Porphyromonas gingivalis в патогенезе РА. Хорошо известно, что Porphyromonas gingivalis является причиной гингивита и одновременно имеет функциональный фермент PAD, принимающий участие в цитруллировании белков [21]. Частота пародонтита повышается из-за курения, поэтому Porphyromonas gingivalis становится постоянным триггером у курящих по сравнению с некурящими [23].
Новые данные позволяют также предположить, что может быть связь между развитием РА и Proteus mirabilis. Эти сведения подтверждаются следующими наблюдениями. Существует повышенная частота инфекций мочевыводящих путей (особенно P. mirabilis) у пациентов с РА [12]. Кроме того, A. Ebringer и Т. Rashid нашли гомологическую последовательность между определенными аллелями HLA, связанными с РА, и гемолизинами P. mirabilis. Они также определили наличие еще одной гомологии между типом XI коллагена и Proteus-уреазным ферментом [12].
Итак, сочетание генетических факторов — например, HLA-DRB1, имеющее более высокое сродство к цитруллированным белкам, и, возможно, canadian pharmacy university rankings других локусов в различных популяциях, таких как население Северной Америки, — и факторов окружающей среды — курение, сопутствующие инфекции (перекрестная реактивность, молекулярная мимикрия), создается плацдарм для развития аутоиммунных заболеваний [5]. Курение, кроме того, может поддерживать постоянный незначительный стресс в организме через его наркотический характер, а в дальнейшем может привести к нейрогуморальной иммуномодуляции.
Таким образом, результаты многочисленных исследований, проведенных за последние 20 лет, убедительно подтверждают, что курение сигарет связано с высоким риском развития РА как среди женщин, так и среди мужчин, а также доказывают взаимосвязь между курением, АЦЦП и РА [2, 4, 5]. У женщин, куривших более 20 лет, риск развития РА был повышен на 24–39%, а риск возникновения серопозитивного РА — на 30–49%, в зависимости от количества выкуренных в течение дня сигарет. Доказана достоверная взаимосвязь между курением и степенью тяжести болезни, количеством эрозий, появлением ревматоидных узелков, в том числе при раннем РА. Показана четкая корреляция между наличием HLA-DRB1 SE генотипа и развитием РФ- и АЦЦП-позитивного РА, при этом риск развития АЦЦП-позитивного РА среди курящих с двумя аллелями в сравнении с никогда не курившими без SE-аллелей возрастал в >20 раз. Эти данные могут существенно влиять в перспективе на разработку превентивных оздоровительных мер в общей популяции, демонстрируя при этом серьезный риск, связанный с курением, и способствовать разработке адекватной гипотезы патогенеза РА.
Следовательно, чрезвычайно важно информировать пациентов об опасных последствиях курения в развитии и прогрессировании РА [2]. Кроме того, поскольку аутоиммунные заболевания являются общей причиной ускоренного развития атеросклероза из-за воспаления и приводят к повышению риска развития сердечно-сосудистых заболеваний, пациентам важно разъяснить, что отказ от курения также важен в комплексном лечении РА, как применение противоревматических препаратов, в том числе и биологического действия. На сегодняшний день во врачебном арсенале есть достаточно эффективные терапевтические препараты для достижения ремиссии у больных РА, что является основной парадигмой в современной стратегии ведения данного контингента пациентов [3]. Для достижения этой цели мы должны лучше понимать патогенез заболевания и взаимодействие факторов риска, что будет способствовать разработке более эффективных средств и направлений в лечении РА.
Список использованной литературы
1. Борткевич О.П., Білявська Ю.В. (2008) Клініко-діагностичне значення антитіл до циклічного цитрулінового пептиду у пацієнтів з різною тривалістю ревматоїдного артриту. Укр. ревматол. журн., 3(33): 58–64.
2. Денисов Л.Н., Насонова В.А. (2011) Курение и ревматические болезни. Часть 1. Курение — фактор риска развития ревматоидного артрита. Науч.-практ. ревматология, 2: 47–51.
3. Коваленко В.Н., Головач И.Ю., Борткевич О.П. (2011) Индивидуализация лечения ревматоидного артрита: курс на достижение оптимальных результатов. Укр. ревматол. журн., 3(45): 5–15.
4. Baka Z., Edit Buzás E., Nagy G. (2009) Rheumatoid arthritis and smoking: putting the pieces together. Arthritis Res Ther., 11(4): 238–241.
5. Bang S.Y., Lee K.H., Cho S.K. et al. (2010) Smoking increases rheumatoid arthritis susceptibility in individuals carrying the HLA-DRB1 shared epitope, regardless of rheumatoid factor or anti-cyclic citrullinated peptide antibody status. Arthritis Rheum., 62(2): 369–377.
6. Baron J.A., La Vecchia C., Levi F. (1990) The antiestrogenic effect of cigarette smoking in women. Am. J. Obstet. Gynecol., 162: 502–514.
7. Begovich A.B., Carlton V.E., Honigberg L.A. et al. (2004) A missense single-nucleotide polymorphism in a gene encoding a protein tyrosine phosphatase (PTPN22) is associated with rheumatoid arthritis. Am. J. Hum. Genet., 75: 330–337.
8. Bowes J., Barton A. (2008) Recent advances in the genetics of RA susceptibility. Rheumatology (Oxford)., 47: 399–402.
9. Bueno C., Criado G., McCormick J.K. et al. (2007) T cell signalling induced by bacterial superantigens. Chem. Immunol. Allergy., 93: 161–180.
10. Choi J.M., Cho Y.C., Cho W.J. et al.(2008) Hydroquinone, a major component in cigarette smoke, reduces IFN-γ production in antigen-primed lymphocytes. Arch. Pharm. Res., 31: 337–341.
11. de Jonge W.J., Ulloa L. (2007) The alpha7 nicotinic acetylcholine receptor as a pharmacological target for inflammation. Br. J. Pharmacol., 151: 915–929.
12. Ebringer A., Rashid T. (2006) Rheumatoid arthritis is an autoimmune disease triggered by Proteus urinary tract infection. Clin. Dev. Immunol., 13: 41–48.
13. Facchinetti F., Amadei F., Geppetti P. et al. (2007) α,β-unsaturated aldehydes in cigarette smoke release inflammatory mediators from human macrophages. Am. J. Respir. Cell. Mol. Biol., 37: 617–623.
14. Gregersen P.K., Silver J., Winchester R.J. (1987) The shared epitope hypothesis: an approach to understanding the molecular genetics of susceptibility to rheumatoid arthritis. Arthr. Rheum., 30: 1205–1213.
15. Hasnis E., Bar-Shai M., Burbea Z. et al. (2007) Cigarette smoke-induced NF-κB activation in human lymphocytes: the effect of low and high exposure to gas phase of cigarette smoke. J. Physiol. Pharmacol., 58(5): 263–274.
16. Heliovaara M., Aho K., Aromaa A. et al. (1993) Smoking and risk of rheumatoid arthritis. J. Rheumatol., 20: 1830–1835.
17. Helm-van Mil A.H. van der, Verpoort K.N., le Cessie S. et al. (2007) The HLA-DRB1 shared epitope alleles differ in the interaction with smoking and predisposition to antibodies to cyclic citrullinated peptide. Arthritis Rheum., 56: 425–432.
18. Kannel W.B., D’Agostino R.B., Belanger A.J. (1987) Fibrinogen, cigarette smoking, and risk of cardiovascular disease: insights from the Framingham Study. Am. Heart J., 113: 1006–1010.
19. Karlson E.W., Lee I.M., Cook N.R. et al. (1999) A retrospective cohort study of cigarette smoking and risk of rheumatoid arthritis in female health professionals. Arthritis Rheum., 42: 910–917.
20. King T.E. Jr, Savici D., Campbell P.A. (1988) Phagocytosis and killing of Listeria monocytogenes by alveolar macrophages: smokers versus nonsmokers. J. Infect. Dis., 158: 1309–1316.
21. Klareskog L., Stolt P., Lundberg K. et al.(2006) Epidemiological Investigation of Rheumatoid Arthritis Study Group. A new model for an etiology of rheumatoid arthritis: smoking may trigger HLA-DR (shared epitope) – restricted immune reactions to autoantigens modified by citrullination. Arthritis Rheum., 54: 38–46.
22. Krishnan E., Sokka T., Hannonen P. (2003) Smoking-gender interaction and risk for rheumatoid arthritis. Arthritis Res. Ther., 5: 158–R162.
23. Laxman V.K., Annaji S. (2008) Tobacco use and its effects on the periodontium and periodontal therapy. J. Contemp. Dent. Pract., 9: 97–107.
24. Lee H.S., Irigoyen P., Kern M. et al. (2007) Interaction between smoking, the shared epitope, and anti-cyclic citrullinated peptide: a mixed picture in three large North American rheumatoid arthritis cohorts. Arthritis Rheum., 56: 1745–1753.
25. Linn-Rasker S.P., Helm-van Mil A.H. van der, van GaalenF.A. et al. (2006) Smoking is a risk factor for anti-CCP antibodies only in rheumatoid arthritis patients who carry HLA-DRB1 shared epitope alleles. Ann. Rheum. Dis., 65: 366–371.
26. Manfredsdottir V.F., Vikingsdottir T., Jonsson T. et al. (2006) The effects of tobacco smoking and rheumatoid factor seropositivity on disease activity and joint damage in early rheumatoid arthritis. Rheumatology (Oxford), 45: 734–740.
27. Mathews I.D., Whittingham S., Hooper B.M. et al. (1973) Association of autoantibodies with smoking, cardiovascular morbidity, and death in the Busselton population. Lancet, 2: 754–758.
28. Matsunaga K., Klein T.W., Friedman H. et al.(2001) Involvement of nicotinic acetylcholine receptors in suppression of antimicrobial activity and cytokine responses of alveolar macrophages to Legionella pneumophila infection by nicotine. J. Immunol., 167: 6518–6524.
29. Méchin M.C., Sebbag M., Arnaud J. et al. (2007) Update on peptidylarginine deiminases and deimination in skin physiology and severe human diseases. Int. J. Cosmet. Sci., 29: 147–168.
30. Mikuls T.R., Hughes L.B., Westfall A.O. et al (2008) Cigarette smoking, disease severity, and autoantibody expression in African Americans with recent-onset rheumatoid arthritis. Ann. Rheum. Dis., 67: 1529–1534.
31. Nagai S., Hoshino Y., Hayashi M. et al. (2000) Smoking-related interstitial lung diseases. Curr. Opin. Pulm. Med., 6: 415–419.
32. Nguyen C., Teo J.L., Matsuda A. et al. (2003) Chemogenomic identification of Ref-1/AP-1 as a therapeutic target for asthma. Proc. Natl. Acad. Sci. USA., 100: 1169–1173.
33. Nguyen van Binh P., Zhou D., Baudouin F. et al. (2004) Modulation of the primary and the secondary antibody response by tobacco smoke condensates. Biomed. Pharmacother., 58: 527–530.
34. Nyhäll-Wåhlin B.M., Jacobsson L.T., Petersson I.F. et al. (2006) BARFOT study group Smoking is a strong risk factor for rheumatoid nodules in early rheumatoid arthritis. Ann. Rheum. Dis., 65: 601–606.
35. Ortega E., Barriga C., Rodriguez A.B. (1994) Decline in the phagocytic function of alveolar macrophages from mice exposed to cigarette smoke. Comp. Immunol. Microbiol. Infect. Dis., 17: 77–84.
36. Ouyang Y., Virasch N., Hao P. et al. (2000) Suppression of human IL-1β, IL-2, IFN-γ, and TNF-α production by cigarette smoke extracts. J. Allergy Clin. Immunol.,106: 280–287.
37. Padyukov L., Silva C., Stolt P. et al.; for the Epidemiological Investigation of Rheumatoid Arthritis Study Group (2004) A gene-environment interaction between smoking and shared epitope genes in HLA–DR provides a high risk of seropositive rheumatoid arthritis. Arthritis Rheum., 50: 3085–3092.
38. Papadopoulos N.G., Alamanos Y., Voulgari P.V. et al. (2005) Does cigarette smoking influence disease expression, activity and severity in early rheumatoid arthritis patients? Exp. Rheumatol., 23: 861–866.
39. Richmond I., Pritchard G.E., Ashcroft T. et al. (1993) Bronchus associated lymphoid tissue (BALT) in human lung: its distribution in smokers and non-smokers. Thorax., 48: 1130–1134.
40. Saag K.G., Cerhan J.R., Kolluri S. et al. (1997) Cigarette smoking and rheumatoid arthritis severity. Ann. Rheum. Dis., 56: 463–469.
41. Sauty A., Mauel J., Philippeaux M.M. et al. (1994) Cytostatic activity of alveolar macrophages from smokers and nonsmokers: role of interleukin-1 beta, interleukin-6, and tumor necrosis factor-alpha. Am. J. Respir. Cell. Mol. Biol., 11: 631–637.
42. Stolt P., Bengtsson C., Nordmark B. et al. (2003) Quantification of the influence of cigarette smoking on rheumatoid arthritis: result from a population based case-control study, using incident cases. Ann. Rheum. Dis., 62: 835–841.
43. Symmons D.P., Bankhead C.R., Harrison B.J. et al. (1997) Blood transfusion, smoking, and obesity as risk factors for the development of rheumatoid arthritis: results from a primary care-based incident case–control study in Norfolk, England. Arthritis Rheum., 40: 1955–1961.
44. The Wellcome Trust Case Control Consortium Genome-wide association study of 14,000 cases of seven common diseases and 3,000 shared controls (2007) Nature, 447: 661–678.
45. Toussirot E., Roudier J. (2007) Pathophysiological links between rheumatoid arthritis and the Epstein – Barr virus: an update. Joint. Bone. Spine., 74: 418– 426.
46. Tuomi T., Heliovaara M., Palosuo T. et al. (1990) Smoking, lung function, and rheumatoid factors. Ann. Rheum. Dis., 49: 753–756.
47. Uhlig T., Hagen K.B., Kvien T.K. (1999) Current tobacco smoking, formal education, and the risk of rheumatoid arthritis. J. Rheumatol., 26: 47–54.
48. Verpoort K.N., Papendrecht-van der Voort E.A., Helm-van Mil A.H. van der et al. (2007) Association of smoking with the constitution of the anti-cyclic citrullinated peptide response in the absence of HLA-DRB1 shared epitope alleles. Arthritis Rheum., 56: 2913–2918.
49. Vessey M.P., Villard-Mackintosh L., Yeates D. (1987) Oral contraceptives, cigarette smoking and other factors in relation to arthritis. Contraception., 35: 457–464.
50. Voigt L.F., Koepsell T.D., Nelson J.L. et al. (1994) Smoking, obesity, alcohol consumption, and the risk of rheumatoid arthritis. Epidemiology, 5: 525–532.
51. Westhoff G., Rau R., Zink A. (2008) Rheumatoid arthritis patients who smoke have a higher need for DMARDs and feel worse, but they do not have more joint damage than non-smokers of the same serological group. Rheumatology (Oxford)., 47: 849–854.
52. Yamamoto K., Yamada R. (2007) Lessons from a genome wide association study of rheumatoid arthritis. N. Engl. J. Med., 357: 1250–1251.
Адрес для переписки:
Коваленко Владимир Николаевич
03680, Киев, ул. Народного ополчения, 5
ГУ «Национальный научный центр
«Институт кардиологии им. Н.Д. Стражеско
НАМН Украины»

Leave a comment