ДОСЯГНЕННЯ ТЕРАПІЇ СИСТЕМНОГО ЧЕРВОНОГО ВОВЧАКА
Коваленко В.М., Головач І.Ю., Борткевич О.П.
Резюме. Системний червоний вовчак (СЧВ) — аутоімунне ревматичне захворювання, що характеризується нагромадженням патогенних аутоантитіл, що продукуються гіперреактивними В-клітинами, викликаючи пошкодження органів внаслідок утворення імунних комплексів. Традиційні методи лікування СЧВ коливаються в діапазоні від нестероїдних протизапальних препаратів до імуносупресивної терапії. Розуміння патогенезу захворювання привело до використання цільової терапії, зокрема біологічних агентів. Нові досягнення у вивченні патогенезу СЧВ та нещодавне затвердження FDA белімумабу — нового препарату В-клітинної дії для лікування пацієнтів із СЧВ, ознаменують нову еру в лікуванні цього захворювання. Іншими перспективними препаратами В-клітинної цільової терапії є ритуксимаб і епратузумаб, які заохочують подальші дослідження В-клітинної терапії. Встановлено також, що інтерферон-α відіграє важливу роль у патогенезі СЧВ. Останні дослідження антиінтерферон-α моноклональних антитіл — сифалізумабу і ронталізумабу — продемонстрували поліпшення клінічних результатів у пацієнтів зі шкірними проявами захворювання. Інші дослідження біологічних препаратів, таких як тоцилізумаб і абатацепт, можливо, потребують подальших клінічних досліджень. Ця стаття фокусується на нових досягненнях терапії СЧВ.
Системний червоний вовчак (СЧВ) — яскравий приклад аутоімунного захворювання, що характеризується продукцією широкого спектра аутоантитіл до компонентів клітинного ядра, цитоплазми і мембран та розвитком імунокомплексного запалення [1, 3]. Фундаментальним порушенням в імунній системі у осіб із СЧВ на сьогодні є генетично зумовлений дефект апоптозу аутореактивних клонів Т- і В-клітин, наслідком якого є В-клітинна гіперреактивність і антигенспецифічна Т-залежна стимуляція синтезу аутоантитіл [3]. Ці аутоантитіла — діагностичний серологічний біомаркер захворювання, а їх відкладання в органах-мішенях (поряд з імунними комплексами) лежить в основі системного запалення, що призводить до тяжкого, необоротного пошкодження внутрішніх органів при СЧВ [2, 44].
Прогресуюче ураження життєво важливих органів визначає життєвий і соціальний прогноз хворих на СЧВ, оскільки при «катастрофічному» плині хвороби летальність сягає 40% на рік, у зв’язку з чим принципове значення має розробка нових методів патогенетичної терапії цього захворювання [1]. В останні десятиліття сформовано головні принципи терапії СЧВ, в основі яких лежить застосування різних режимів глюкокортикоїдної (ГК)-терапії та цитотоксичних препаратів. Сучасні терапевтичні схеми з використанням пульс-терапії метилпреднізолоном та циклофосфаном (ЦФ) значно поліпшили віддалені показники виживаності пацієнтів і є високоефективними при розвитку загрозливих станів у хворих на СЧВ. Найбільш яскравим прикладом покращання якості лікування СЧВ є більше ніж п’ятикратне підвищення 5-річної виживаності у хворих із вовчаковим нефритом. Однак віддалений життєвий прогноз у цієї категорії пацієнтів залишається несприятливим [8].
Надзвичайна різноманітність клінічних проявів та імунологічних порушень, відсутність універсальних критеріїв оцінки дієвості лікування, необхідність активної стандартної терапії ГК і цитостатиками за життєвими показаннями — все це утруднює ведення пацієнтів із СЧВ та досягнення ремісії захворювання.
Сучасні цілі лікування СЧВ багатогранні й полягають у досягненні клініко-лабораторної ремісії захворювання, запобіганні ураженню життєво важливих органів (перш за все нирок і центральної нервової системи), своєчасному виявленні та контролі супутньої патології, профілактиці ускладнень лікарської терапії та поліпшенні якості життя [1, 3].
Однак обнадійливі результати останніх клінічних випробувань, подальша реєстрація нового препарату белімумабу FDA, а згодом і EMEA, дають підставу говорити, що ми живемо в захоплюючу епоху нових перспектив і нових методів лікування пацієнтів із СЧВ [43].
Різні біологічні агенти вивчаються як потенційні препарати для терапії СЧВ. Більш глибоке розуміння патогенезу СЧВ привело до створення низки нових біологічних агентів, що таргентно впливають на основні патогенетичні ланки хвороби [25]. Сучасні напрямки лікування СЧВ схематично наведені на рисунку.
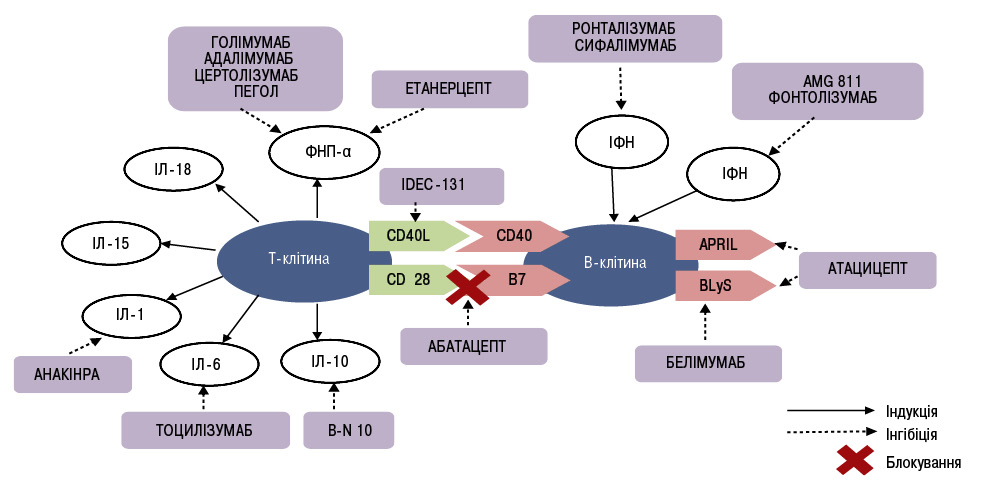
Ритуксимаб. Перспективним напрямком фармакотерії СЧВ є препарати, що блокують проліферацію В-клітин, серед яких найбільш вивченим, безумовно, є ритуксимаб [5]. Ритуксимаб є рекомбінантним химерним моноклональним антитілом до поверхневих рецепторів В-лімфоцитів — CD20. Механізм дії ритуксимабу реалізується за рахунок антитілозалежної клітинної цитотоксичності, комплементзалежної цитотоксичності, інгібування клітинної проліферації та індукції апоптозу В-лімфоцитів. Основною мішенню ритуксимабу є клітини-попередники, незрілі й наївні В-лімфоцити [6, 48].
Спочатку у листопаді 1997 р. ритуксимаб був схвалений для лікування пацієнтів із неходжкінською лімфомою, пізніше — для осіб із ревматоїдним артритом [18]. Перше повідомлення щодо застосування ритуксимабу при СЧВ датується 2001 р., коли F. Petschner та співавтори з успіхом застосували його для лікування «катастрофічного» СЧВ за життєвими показаннями. У 2002 р. отримано дані досліджень щодо ефективності ритуксимабу в лікуванні активних форм СЧВ, резистентних до стандартної імуносупресивної терапії [19].
У цілому лікування ритуксимабом асоціювалося з достовірним зниженням активності захворювання у >80% пацієнтів. Призначення ритуксимабу є високоефективним у хворих на СЧВ з активними позанирковими проявами хвороби (серозит, поліартрит, ураження шкіри, стоматит, гарячка, анемія), із прогресуючим вовчаковим нефритом (III–IV морфологічний тип за класифікацією ВООЗ). Ритуксимаб може бути препаратом вибору у хворих із «критичним» перебігом СЧВ, зумовленим тяжким ураженням центральної нервової системи (ЦНС) (коматозний стан, судоми, психоз), а також мультиорганним тромбозом, пов’язаним із катастрофічним антифосфоліпідним синдромом (АФС). Попередні результати свідчать про високу ефективність повторних курсів терапії ритуксимабом у разі розвитку загострення [7]. У багатьох дослідженнях продемонстровано ефективність, безпеку й хорошу переносимість препарату [6, 28].
У більшості досліджень продемонстровано, що ефект терапії цим препаратом при вовчаковому нефриті розвивається не відразу, зазвичай значуще зменшення протеїнурії, підвищення клубочкової фільтраціі, збільшення вмісту альбуміну в сироватці крові, спостерігається на 2–3-му місяці від початку лікування і досягає свого максимуму до 5–6 міс. Одночасно спостерігається зниження індексів активності СЧВ (BILAG, SLEDAI), антитіл до ДНК, підвищення комплементу. Навпаки, застосування ритуксимабу у хворих із високою активністю, зумовленою позанирковими проявами СЧВ — цитопенією, поліартритом, серозитом, пневмонітом і АФС, може призвести до розвитку позитивної динаміки вже через кілька днів [8].
Однак два останніх дослідження (EXPLORER і LUNAR) не підтвердили результатів попередніх досліджень і продемонстрували негативний результат: дослідження для оцінки ефективності та безпеки ритуксимабу у хворих із тяжкою формою СЧВ (EXPLORER) — рандомізоване подвійне сліпе плацебо-контрольоване дослідження ритуксимабу при СЧВ без ураження нирок [33] та дослідження з оцінки та безпеки застосування ритуксимабу у пацієнтів із ISN/RPS класом або ІІІ/IV класом нефриту (LUNAR) — рандомізоване подвійне сліпе плацебо-контрольоване дослідження ритуксимабу при нирковому люпусі [20].
Ці результати контрастують із декількома відкритими дослідженнями, в яких відзначили поліпшення при застосуванні ритуксимабу приблизно у 60% випадків, а відповідь з боку нирок — у 66% [37]. Результати досліджень EXPLORER і LUNAR призвели до суперечки і докладного аналізу методології. На думку більшості ревматологів, невдача цих досліджень пов’язана з недосконалим протоколом цих рандомізованих подвійних сліпих плацебо-контрольованих досліджень, а не з неефективністю ритуксимабу [11]. Серед причин невдалих досліджень обговорюється застосування стероїдів та імунодепресантів, які начебто могли маскувати анти-CD20-ефекти, надто короткі терміни досліджень (ритуксимаб прявляє ефективність при середньо- ідовготривалих випробуваннях), включення до дослідження пацієнтів із надтяжкими випадками СЧВ [20].
Незважаючи на негативні результати цих досліджень, значне число відкритих нерандомізованих досліджень вказують на ефективність ритуксимабу у пацієнтів із тяжким перебігом хвороби. Нещодавній систематичний огляд досліджень, що включав 188 хворих із СЧВ із 35 досліджень, репрезентував загальний показник ефективності >90% при люпус-нефриті [45]. Проспективне дослідження когорти пацієнтів із гістологічно доведеним люпус-нефритом показало, що ритуксимаб був ефективним у досягненні ремісії люпус-нефриту, що в подальшому підтримувалася низькими дозами мікофенолату мофетилу [40].
Крім того, при порівнянні ритуксимабу і циклофосфаміду як терапії індукції ремісії у пацієнтів із рефрактерним ANCA-позитивним нирковим васкулітом, обидві групи досягли ремісії у схожі темпи; ці дані підтримують думку про ефективність ритуксимабу в лікуванні активного СЧВ [27].
Отримані результати продовжують заохочувати лікарів застосовувати ритуксимаб у пацієнтів із тяжкими формами захворювання, з поліорганними ураженнями і рефрактерними до звичайної імуносупресивної терапії. Дослідження в цьому напрямку тривають.
Белімумаб. Це перший біологічний препарат, створений спеціально для лікування СЧВ, що по праву розглядається як одне з найвидатніших подій ревматології за останні 50 років [4, 31, 50].
Відкриття ключового значення В-клітин в імунопатогенезі СЧВ спонукало до вивчення не лише самих В-клітин, але й В-клітинних цитокінових лігандів як можливих мішеней для терапевтичних цілей. Особливий інтерес викликав В-лімфоцитарний стимулятор (B-lymphocytes stimulator — BlyS), відомий також як В-клітинний активуючий фактор (B cell-activating factor — BAFF), і ліганд надродини ФНП-13b, що є найважливішим компонентом цитокінової регуляції функціонування, проліферації та диференціації В-клітин [29, 36, 51]. Родина BLyS належить до надродини ФНП-α і включає 2 цитокіни: BLyS і APRIL (a proliferation-inducing ligand — ліганд, індукуючий проліферацію), які у разі імунної відповіді синтезуються різними клітинами. На мембрані В-клітин експресуються три типи рецепторів для BLyS i APRIL: BLyS-рецептор 3 (BR3), трансмембранний активатор, кальцієвий модулятор і цитофіліновий ліганд інтерактор (TACI) та В-клітинний антиген дозрівання (B cell maturation antigen — BCMА). Сигналізація, індукована взаємодією BLyS-BR3, регулює гомеостаз преімунних В-клітин, призводить до збільшення «виживаності» антитілопродукуючих В-клітин за рахунок запобігання їх селекції та апоптозу [12].
У клінічних дослідженнях продемонстровано, що у хворих на СЧВ спостерігається підвищення концентрації BLyS у сироватці крові, що корелює з концентрацією антитіл до двоспіральної ДНК і динамікою активності захворювання [41]. Ці дані послужили підставою до теоретичного обґрунтування створення цілої низки анти-BLyS-препаратів для лікування СЧВ (таблиця).
| Антагоніст BLyS, компанія-виробник | Препарат, спосіб введення | Специфічність | Початок дослідження при СЧВ | Статус |
|---|---|---|---|---|
| Белімумаб | Людські моноклональні антитіла (довенно) |
Розчинний BLyS | 2001 | Одобре-ний FDA і EMEA |
| Атацицепт | Рекомбінантний білок (Fc) (підшкірно) | BLyS+APRIL | 2005 | Фаза ІІ/ІІІ |
| Блісбімод (AMG 623; A-623) |
Рекомбінантний білковий антагоніст (Peptibody) | Розчинний і мембранний BLyS | 2005 | Фаза ІІ |
| Табалумаб (LY2127399) | Людські моноклональні антитіла (підшкірно) | Розчинний і мембранний BLyS | 2011 | Фаза ІІІ |
Белімумаб — повністю людські рекомбінантні моноклональні антитіла (IgG1), механізм дії яких пов’язаний із запобіганням взаємодії розчинних BLyS із клітинними рецепторами аутореактивних перехідних і наївних В-клітин, що, у свою чергу, призводить до пригнічення властивої СЧВ В-клітинної гіперреактивності, зокрема, синтезу аутоантитіл [24]. Окрім того, блокування BLyS призводить до зниження виживаності В-клітин у росткових ділянках лімфоїдних органів, диференціювання В-клітин пам’яті в антитілопродукуючі клітини і зниження синтезу прозапальних цитокінів: ІЛ-21, ІЛ-17 тощо, які відіграють виключну роль в імунопатогенезі СЧВ [4, 9]. Офіційними показаннями до застосування белімумабу при СЧВ є помірна/висока активність, наявність виражених серологічних порушень (позитивні результати визначення антинуклеарного фактора — АНФ — і/або антитіл до дволанцюгової ДНК) і недостатня ефективність попередньої стандартної терапії.
Клінічні випробування белімумабу охоплюють 4 рандомізованих клінічних дослідження. У дослідженні І фази белімумаб достовірно зменшував кількість периферичних В-клітин і добре переносився [21]. Дослідження ІІ фази охоплювало 449 пацієнтів із США і Канади і тривало 52 тиж. І хоча в цьому дослідженні не досягнуто жодної із запланованих кінцевих точок (зниження показника SELENA-SLEDAI — Safety of Estrogen in Lupus Erythematosus National Assesment — SLE Disease Activity Index), отримано дані про більш високу ефективність белімумабу у серопозитивних пацієнтів порівняно з плацебо, зроблено важливі висновки, що уможливило більш вірно спланувати наступні випробування [53]. На сьогодні завершено два рандомізованих плацебо-контрольованих клінічних дослідження ІІІ фази — BLISS-52 і BLISS-76 — результати яких послужили підставою для реєстрації препарату [22, 38]. Первинною кінцевою точкою цих досліджень був індекс SRI, спеціально розроблений у дослідженні ІІ фази, а вторинною точкою — зниження дози ГК. У дослідження BLISS-52 увійшли 865 пацієнтів, серопозитивних за АНФ і/або антитілами до дволанцюгової ДНК. Покращання індексу SRI через 52 тиж вірогідно частіше реєстрували у пацієнтів, які отримували белімумаб (1 мг/кг та 10 мг/кг маси тіла), ніж плацебо (51% і 58% проти 44%). У дослідження BLISS-76 було включено 819 пацієнтів. Не відзначено вірогідних відмінностей щодо ефективності белімумабу у дозі 1 мг/кг порівняно з плацебо (40,6% проти 33,8%); однак при застосуванні дози 10 мг/кг відзначено вірогідне поліпшення індексу SRI через 52 тиж (43,2% проти 33,8%). Отже, в обох дослідженнях досягнута первинна точка, що засвідчує дієвість препарату. Відмінностей щодо частоти небажаних ефектів на тлі лікування белімумабом і плацебо не відзначено.
На підставі результатів цих великих міжнародних рандомізованих плацебо-контрольованих клінічних випробувань белімумаб був вперше за 50 років схвалений FDA для лікування СЧВ. Белімумаб призначають шляхом довенних інфузій; тривалість введення становить 1 год, доза — 10 мг/кг. Перші 3 інфузії проводять кожні 3 тиж, а наступні — кожні 4 тиж. До досліджень не залучалися пацієнти з активним люпус-нефритом та з активними неврологічними проявами; роль белімумабу в лікуванні цієї когорти пацієнтів належить ще визначити. Утім на сьогодні белімумаб є новим ефективним препаратом в лікуванні СЧВ із хорошим профілем переносимості [35].
Необхідно підкреслити, що, незважаючи на помірну ефективність белімумабу при СЧВ, найперше у пацієнтів з імунологічно активним варіантом захворювання, але без тяжких і потенційно смертельних проявів (вовчаковий нефрит, ураження ЦНС), розробка і впровадження препарату в клінічну практику — це важливий крок уперед щодо вдосконалення фармакотерапії цього захворювання. На сьогодні лише на тлі лікування белімумабом отримано достовірні позитивні результати рандомізованих плацебо-контрольованих досліджень, що дозволило зареєструвати цей препарат для лікування СЧВ. Водночас місце белімумабу в реальній клінічній практиці потребує подальшого вивчення [43].
Епратузумаб. Це гуманізовані IgG1 анти-CD22 моноклональні антитіла, що орієнтовані на зрілі В-клітини і більш широко вивчалися і застосовувалися у терапії гематологічних злоякісних новоутворень. CD22 (gp135) — це глікопротеїн із молекулярною масою 130/140 кДа, поліпептидний ланцюг якого складається із 628 амінокислот. CD22 експресується на 60–80% зрілих В-лімфоцитах і на клітинах волосатоклітинного лейкозу, однак після активації В-клітин зникає з їх поверхні. Описані дві форми CD22: CD22a викликає адгезію трансфекованих кодуючим його геном клітин на моноцитах і еритроцитах, CD22β опосередковує адгезію В-клітин на CD4+ Т-клітинах [42]. CD22, мабуть, є ідеальною мішенню терапії, оскільки він відсутній на пре-В і ембріональних клітинах. Епратузумаб є єдиним анти-CD22-препаратом, що застосовується у терапії СЧВ. Також у невеликому дослідженні ІІ фази 14 пацієнтів були включені до дослідження і отримували 360 мг/м препарату [17]. У цьому відкритому дослідженні 92% пацієнтів показали поліпшення за оцінкою BILAG (British Isles Lupus Assessment Group index) та 77% продемонстрували >50% зниження загального бала BILAG на 6-й тиждень, на 71% — на 10-й тиждень і 38% — на 18-й тиждень. Загалом це дослідження підтверджує ефективність епратузумабу в лікуванні СЧВ.
Перші два рандомізовані плацебо-контрольовані дослідження ALLEVIATE A (помірний СЧВ) і ALLEVIATE B (тяжкий СЧВ) оцінювали ефективність 360мг/м та 720 мг/м поверхні тіла доз епратузумабу проти плацебо, утім дослідження були призупинені у зв’язку з відсутністю ліків [47]. Незважаючи на це, результат аналізу на момент його припинення демонстрував значне скорочення використання стероїдів, а також покращання якості життя [54]. У третьому дослідженні EMBLEM, до якого було включено 227 пацієнтів із помірним і тяжким СЧВ, за винятком люпус-нефриту ІІІ–IV стадії та тяжких неврологічних порушень, було продемонстровано статистично достовірне покращання у групі епратузумабу порівняно з плацебо (43% проти 21%) з відсутністю різниці в побічних ефектах. Ці багатообіцяючі результати привели до нових глобальних досліджень, зокрема планування проведення дослідження EMBODY, набір пацієнтів до якого здійснюється нині.
Атацицепт. Атацицепт — рекомбінантний гібридний білок, який містить розчинний рецептор ТАСІ, що блокує BLyS i APRIL В-клітин. APRIL входить до родини ФНП. Аналогічно до BLyS, APRIL використовує два рецептори ТАСІ і ВСМА для реалізації своєї активності. Атацицепт вибірково блокує зрілі В-клітини і плазматичні клітини із меншим впливом на клітини-попередники і клітини-пам’яті [49].
Початкова фаза Ib подвійного сліпого плацебо-контрольованого дослідження декількох доз атацицепту підшкірно показала зменшення кількості зрілих В-клітин і рівнів Ig та відсутність збільшення небажаних ефектів [15]. Проте дослідження II фази у пацієнтів із люпус-нефритом було зупинено у зв’язку з підвищення ризику інфікування. У протокол дослідження внесено зміни щодо виключення мофетилу мікофенолату як фонової терапії та включення пацієнтів без ураження нирок [16].
Ронталізумаб та сифалімумаб. Останнім часом збільшується кількість даних щодо ролі ІФН-α у патогенезі СЧВ [46]. Підвищені рівні ІФН-α, встановлені при СЧВ, були пов’язані з активністю захворювання, крім того, добре відомі дані щодо можливої індукції люпоїдного синдрому при лікуванні гепатиту С із застосуванням ІФН. На сьогодні створені та проходять клінічну апробацію два моноклональних антитіла до ІФН-α — сифалімумаб і ронталізумаб, що нещодавно випробувані у І фазі досліджень. Перші клінічні випробування сифалімумабу у пацієнтів із СЧВ від легкого до помірного ступеня дали обнадійливі результати щодо позитивної динаміки шкірних проявів хвороби, водночас жодних побічних ефектів не зафіксовано [34]. Нині йде набір у групу пацієнтів ІІb фази дослідження сифалімумабу.
Ронталізумаб нещодавно також було оцінено як потенційний препарат для лікування при СЧВ. На сьогодні продовжується ІІ фаза дослідження ROSE (A study to evaluate the efficacy and safety of rontalizumab in patients with moderately to severely active SLE — дослідження щодо оцінки ефективності й безпеки ронталізумабу у пацієнтів із помірним і тяжким активним СЧВ). На І етапі дослідження встановлено зниження експресії деяких імунорегулюючих генів у більшості пацієнтів після прийому ронталізумабу [30].
Абатацепт. Препарат становить розчинну гібридну білкову молекулу, що складається з двох компонентів — позаклітинного домена CTLA4 людини і модифікованого Fc (CH2– і CH3-ділянки) фрагмента IgG1. Модифікація Fc-фрагмента забезпечує низьку здатність абатацепта індукувати комплементзалежні й антитілозалежні клітинні цитотоксичні реакції. Як і нативний CTLA4, цей білок із більш високою авідністю зв’язується з CD80/86, ніж із CD28, та блокує активацію Т-клітин. Як відомо, абатацепт одобрений у США та Європі для лікування ревматоїдного артриту з 2005 р.
Водночас взаємодія CD28 на Т-клітинах і B7 на В-клітинах відіграє важливу роль у продукції високоспоріднених антитіл IgG та забезпечує другий костимулювальний сигнал для активації Т-клітин.
У ході дослідження, яке вивчало ефективність і безпеку абатацепту в пацієнтів із незагрозливими проявами СЧВ (активний поліартрит, серозит, дискоїдний вовчак) не встановлено переваг абатацепту перед плацебо, за даними досягнення первинної кінцевої точки [32]. Одночасно комбінація абатацепту із циклофосфамідом у пацієнтів із люпус-нефритом (ACCESS трайл) також не продемонструвала переваг комбінації абатацепт + циклофосфамід перед монотерапією циклофосфамідом [14]. Утім, подальший аналіз дозволив переглянути результати дослідження і вказати на недосконалий дизайн випробування, що унеможливило досягнення встановлених кінцевих точок. Зараз планується нове дослідження щодо вивчення ефективності абатацепту при СЧВ.
Тоцилізумаб. У патогенезі СЧВ важлива роль належить декільком цитокінам, одним з яких є ІЛ-6. ІЛ-6 синтезується багатьма клітинами (Т- і В-лімфоцитами, моноцитами, фібробластами, ендотеліальними клітинами та ін.), які беруть участь у розвитку запалення, і проявляє широкий спектр прозапальних біологічних ефектів. Саме цей цитокін відіграє провідну роль при люпус-нефриті. Так, екзогенне введення ІЛ-6 мишам з експериментальною моделлю СЧВ призводило до збільшення продукції аутоантитіл і прогресування гломерулонефриту. Також добре відомо, що екскреція ІЛ-6 із сечею збільшується у разі активного нефриту та знижується за умов адекватного лікування. Тоцилізумаб — гуманізовані моноклональні антитіла (IgG1), що зв’язуючись із мембранними і розчинними рецепторами ІЛ-6, інгібують обидва сигнальні шляхи ІЛ-6-залежної клітинної активації [39]. Ефективність тоцилізумабу при СЧВ була оцінена у І фазі дослідження. 16 пацієнтів із помірною активністю СЧВ (оцінка SELENA-SLEDAI від 3 до 10 або активний нефрит) отримували тоцилізумаб в одній із трьох доз (2; 4 і 8 мг/кг маси тіла) 2 рази на тиждень впродовж 12 тиж та в подальшому спостереження тривало ще 8 тиж [26]. Редукції активності прозапальних маркерів і рівня аутоантитіл не спостерігалося, однак відзначено зниження активності захворювання за оцінкою SELENA-SLEDAI та клінічне поліпшення перебігу артриту. Навпаки, у пацієнтів розвинулася дозозалежна нейтропенія, що послужило стримувальним фактором для застосування цієї терапії при СЧВ. Необхідні додаткові дослідження для встановлення оптимального режиму дозування препарату [25].
Інгібітори Toll-подібних рецепторів (TLR). Дендритні клітини — представники гетерогенної групи клітин, отриманих із кісткового мозку, що беруть участь в імунній відповіді, презентації антигенів та імунологічній толерантності. З двох підгруп дендритних клітин плазматичні дендритні клітини відіграють важливу роль у патогенезі СЧВ. Ці клітини беруть участь у передачі сигналів від вірусів і внутрішньоклітинних бактерій через TLR7 і TLR9, що зумовлює надмірну секрецію ІФН, насамперед ІФН-α [13]. Потенційна роль плазматичних дендритних клітин як терапевтичної мішені при лікуванні СЧВ цікава з огляду на можливість інгібування TLR з метою зупинки внутрішньоклітинної сигналізації і припинення секреції ІФН. На сьогодні на стадії лабораторної апробації знаходяться дві молекули — IRS 954 і ST2825, що є антагоністами TLR9 і TLR7. IRS 954 був випробуваний на мишах (NZB × NZW), показавши підвищення виживаності та зниження певних рівнів аутоантитіл, протеїнурії, тяжкість гломерулонефриту та пошкодження органів [10].
На стадії розробок знаходяться також інгібітори CD79 і CD19, здатні викликати В-клітинну деплецію [23, 35], інгібітори комплементу (екулізумаб — гуманізовані моноклональні антитіла, що блокують С5 і запобігають його розщепленню на прозапальні фрагменти С5а і С5b), інгібітори ІФН-γ (AMG 811, фонтолізумаб) тощо.
Глибокі патофізіологічні дослідження зумовили краще розуміння нами патогенезу СЧВ, привели до появи нових перспективних таргетних препаратів [4, 52]. Утім, є ще багато дискусійний питань щодо патогенезу і лікувальної тактики СЧВ, багато перспективних методів лікування знаходяться на стадії розробки, але це дає надію, що в найближчому майбутньому ми зможемо запропонувати нашим пацієнтам більш ефективні й безпечні методи лікування СЧВ.
Список використаної літератури
1. Дядик А.И., Багрий А.Э. (2003) Системная красная волчанка: Науч.-мед. издание. Регион, Донецк, 464 с.
2. Клюквина Н.Г. (2008) Системная красная волчанка. В кн.: Ревматология: Национальное руководство / Под ред. Е.Л. Насонова и В.А. Насоновой. ГЭОТАР-Медиа, Москва, с. 419–446.
3. Коваленко В.Н., Шуба Н.М., Борткевич О.П., Білявська Ю.В. (2010) Системний червоний вовчак: патогенетичні особливості клінічної симптоматики, сучасна діагностична і терапевтична тактики ведення хворих. Укр. ревматол. журн., 39(1): 13–23.
4. Насонов Е.Л., Решетняк Т.М., Денисов Л.Н. и др. (2012) Белимумаб: прогресс в лечении системной красной волжанки. Науч.-практ. ревматол., 54(5): 13–19.
5. Насонов Е.Л., Соловьев С.К. (2007) Перспективы применения моноклональных антител к В-лимфоцитам (ритуксимаб) при воспалительных ревматических заболеваниях. Науч.-практ. ревматол., 1: 4–8.
6. Проценко Г.А. (2009) Перспективы применения ритуксимаба в ревматологии. Укр. ревматол. журн., 1(35): 44–47.
7. Соловьев С.K., Торгашина А.H., Асеева Е.H. и др. (2007) Ритуксимаб. Анти-В-клеточная терапия системной красной волчанки. ГУ Институт ревматологии РАМН, Москва, 20 с.
8. Соловьев С.К. (2008) Ритуксимаб: новые перспективы лечения больных СКВ. Науч.-практ. ревматол., 1: 29–33.
9. Baker K.P., Edwards B.M., Main S.H. et al. (2003) Generation and characterization of LymphoStat-B, a human monoclonal antibody that antagonizes the bioactivities of B lymphocyte stimulator. Arthr. Rheum., 48: 3253–3265.
10. Barrat F.J., Meeker T., Chan J.H. et al. (2007) Treatment of lupusprone mice with a dual inhibitor of TLR7 and TLR9 leads to reduction of autoantibody production and amelioration of disease symptoms. Eur. J. Immunol., 37: 3582–3586.
11. Bruce I.N. (2010) Re-evalution of biologic therapy in systemic lupus erythematosus. Curr. Opin. Rheumatol., 22(3): 273–277.
12. Cancro M.P. (2006) The BLyS/BAFF family of ligands and receptors: Key targets in the therapy and understanding of autoimmunity. Ann. Rheum. Dis., 65: 34–36.
13. Christensen S.R., Shlomchik M.J. (2007) Regulation of lupus-related autoantibody production and clinical disease by Toll-like receptors. Semin Immunol.,19: 11–23.
14. ClinicalTrials.gov. Abatacept and Cyclophosphamide Combination Therapy for Lupus Nephritis (ACCESS) (NCT00774852) August 2011 (http://www.clinicaltrials.gov/ct2/show/NCT00774852?term=abatacept+sle&rank=4).
15. Dall’Era M., Chakravarty E., Wallace D.J. et al. (2007) Reduced B-lymphocyte and immunoglobulin levels after atacicept treatment in patients with SLE. Arthritis Rheum., 56: 4142–4150.
16. Dall’era M., Chakravarty E.F. (2011) Treatment of mild, moderate, and severe lupus erythematosus: focus on new therapies. Cur. Rheumatol. Rep., 13(4): 308–316.
17. Dörner T., Kaufmann J., Wegener W.A. et al. (2006) Initial clinical trial of epratuzumab (humanized anti-CD22 antibody) for immunotherapy of systemic lupus erythematosus. Arthritis Res. Ther., 8: R74.
18. Edwards J.C., Szczepanski L., Szechinski J. et al. (2004) Efficacy of B-cell-targeted therapy with rituximab in patients with rheumatoid arthritis. N. Engl. J. Med., 350: 2572–2581.
19. Favas C., Isenberg D.A. (2009) B cell therapy in SLE. What are the current prospects for its acceptance?. Nat. Rev. Rheumatol., 5: 711–716.
20. Furie R., Looney R.J., Rovin B. et al. (2009) Efficacy and safety of Rituximab in subjects with active proliferative lupus nephritis: Results from the randomized, double-blind phase III LUNAR study, Abstract 1149. Arthritis Rheum., 60(Suppl. 1): S429.
21. Furie R., Stohl W., Ginzler E.M. et al. (2008) Biologic activity and safety of belimumab, a neutralizing anti-B-lymphocyte stimulator (BLyS) monoclonal antibody: a phase I trial in patients with systemic lupus erythematosus. Arthritis Res. Ther., 10: R109.
22. Furie R., Petri M., Zamani E. et al. (2011) A phase III, randomized, placebo-controlled study of belimumab, a monoclonal antibody that inhibits B lymphocyte stimulator, in patients with systemic lupus erythematosus. Arthritis Rheum., 63: 3918–3930.
23. Giraldo W.A.S., Villanueva M.J.G., Boteanu A.L. et al. (2012) New Therapeutic Targets in Systemic Lupus. Reumatol. Clin., 8(4): 201–207.
24. Halpern W.G., Lappin P., Zanardi T. et al. (2006) Chronic administration of belimumab, a BLyS antagonist, decreases tissue and peripheral blood B-lymphocyte populations in cynomolgus monkeys:Pharmacokinetic, pharmacodynamic, and toxicologic effects. Toxicol. Sci., 91: 586–599.
25. Huertas C.M., Salvador F., Isenberg D. (2012) Recent Developments in the Treatment of Systemic Lupus Erythematosus. Eur. Musculoskeletal Rev., 7(1): 14–17.
26. Illei G.G., Shirota Y., Yarboro C.H. et al. (2010) Tocilizumab in systemic lupus erythematosus: data on safety, preliminary efficacy, and impact on circulating plasma cells from an open label phase I dose-escalation study. Arthritis Rheum., 62: 542–552.
27. Jones R.B., Ferraro A.J., Chaudhry A.N. et al. (2009) A multicenter survey of rituximab therapy for refractory antineutrophil cytoplasmic antibody-associated vasculitis. Arthritis Rheum., 60: 2156–2168.
28. Leandro M.J., Cambridge G., Edwards J.C. et al. (2005) B cell depletion in the treatment of patients with SLE: a longitudinal analysis of 24 patients. Rheumatology (Oxford)., 44: 1542–1545.
29. Lied G.A., Berstad A. (2011) Functional and clinical aspects of the Bcell-activation factor (BAFF): a narrative review. Scand. J. Immunol., 73: 1–7.
30. McBride J.M., Wallace D.J., Yao Z. et al. (2009) Dose dependent modulation of interferon regulated genes with administration of single and repeat doses of rontalizumab in a phase I, placebo controlled, double blind dose escalation study in SLE, Abstract 2072. Arthritis Rheum., 60: S 775–S776.
31. Merrill J.T.(2011) Ending the 50-year drought of FDA drug approval for SLE. Bull. NYU Hosp. Joint Dis., 69: 238–242.
32. Merrill J.T., Burgos-Vargas R., Westhovens R. et al. (2010) The efficacy and safety of abatacept in patients with non-life threatening manifestations of SLE. Arthritis Rheum., 62: 3077-3087.
33. Merrill J.T., Neuwelt C.M., Wallace D.J. et al. (2010) Efficacy and safety of Rituximab in moderately- to severely active SLE: results from the randomized, double-blind phase II/III study EXPLORER. Arthritis Rheum., 62: 222–223.
34. Merrill J.T., Wallace D.J., Petri M. et al. (2011) Safety profile and clinical activity of sifalimumab, a fully human anti-interferon {alpha} monoclonal antibody, in systemic lupus erythematosus: a phase I, multicentre, double-blind randomised study. Ann. Rheum. Dis., 70: 1905–1913.
35. Moldovan I., Katsaros E. (2012) Recent Developments in the Treatment of Lupus Disease. Eur. Musculoskeletal Rev., 7(1): 18–21.
36. Moore P.A., Belvedere O., Orr A. et al. (1999) BLyS: Member of the tumor necrosis factor family and B lymphocyte stimulator. Science., 285: 260–263.
37. Murray E., Perry M. (2009) Off-label use of rituximab in systemic lupus erythematosus: a systematic review. Clin. Rheumatol., 29: 707–716.
38. Navarra S.V., Guzman R.M., Gallacher A.E. et al. (2011) BLISS-52 Study Group.Efficacy and safety of belimumab in patients with active systemic lupus erythematosus: A randomised, placebo-controlled, phase 3 trial. Lancet, 377: 721–731.
39. Oldfield V., Dhillon S., Plosker G.L. (2009) Tocilizumab. A review of its use in the management of rheumatoid arthritis. Drugs, 69: 609–632.
40. Pepper R., Griffith M., Kirwan C. et al. (2009) Rituximab is an effective treatment for lupus nephritis and allows a reduction in maintenance steroids. Nephrol. Dial. Transplant., 24: 3717–3723.
41. Petri M., Stohl W., Chatham W. et al. (2008) Association of plasma B lymphocyte stimulator levels and disease activity in systemic lupus erythematosus. Arthr. Rheum., 58: 2453–2459.
42. Ponticelli C., Moroni G. (2010) Monoclonal antibodies for systemic lupus erythematosus. Pharmaceuticals., 3: 300–322.
43. Postal M., Costallat L.T., Appenzeller S. (2012) Biological therapy in systemic lupus erythematosus. Int. J. Rheumatol., 2012: 578641.
44. Rahman A., Isenberg D.A. (2008) Systemic lupus erythematosus. N. Engl. J. Med., 358: 929–939.
45. Ramos-Casals M., Soto M.J., Cuadrado M.J. et al. (2009) Rituximab in systemic lupus erythematosus: a systematic review of off-label use in 188 cases. Lupus, 18: 767–776.
46. Rönnblom L. (2010) Potential role of IFNα in adult lupus // Arthritis Res.Ther., 12 (Suppl 1): S3.
47. Sifuentes Giraldo W.A., García Villanueva M.J., Boteanu A.L. et al. (2012) New therapeutic targets in systemic lupus. Reumatol. Clin., 8(4): 201–207.
48. Silverman G.J. (2005) Anti-CD20 therapy in systemic lupus erythematosus: a step closer to the clinic. Arthritis Rheum., 52: 371–377.
49. Stohl W. (2010) Systemic lupus erythematosus and its ABCs (APRIL/BLyS complexes). Arthritis Res. Ther., 12(2): 111.
50. Stohl W. (2012) The discovery and development of belimumab: the anti-BlyS-lupus connection. Nature Biotechnol., 30: 69–77.
51. Treml J.F., Hao Y., Stadanlick J.E. et al. (2009) The BLyS family: Toward a molecular understanding of B cell homeostasis. Cell Biochem.Biophys., 53: 1–16.
52. Tullus K. (2012) New developments in the treatment of systemic lupus erythematosus. Pediatr. Nephrol., 27(5): 727–732.
53. Wallace D., Stohl W., Furie R.A. et al. (2009) A phase II randomized, double blinded, placebo controlled, dose-ranging study of belimumab, in patients with active systemic lupus erythematosus. Arthritis Rheum., 61: 1168–1178.
54. Wallace D.J. (2008) Epratuzumab (anti-CD22 mAb targeting B-cells) provides clinically meaningful reductions in corticosteroid (CS) use with a favorable safety profile in patients with moderate/severe flaring SLE: results from randomized controlled trials (RCTs). Arthritis Rheum., 58 (Suppl. 9): S571–572.
ДОСТИЖЕНИЯ ТЕРАПИИ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКИ
Резюме. Системная красная волчанка (СКВ) — аутоиммунное ревматическое заболевание, которое характеризуется накоплением патогенных аутоантител, продуцируемых гиперреактивными В-клетками, вызывая повреждение органов вследствие образования иммунных комплексов. Традиционные методы лечения СКВ колеблются в диапазоне от нестероидных противовоспалительных препаратов к иммуносупрессивной терапии. Понимание патогенеза заболевания привело к использованию целевой терапии, в частности биологических агентов. Новые достижения в изучении патогенеза СКВ и недавнее утверждение FDA белимумаба — нового препарата В-клеточной действия для лечения СКВ, ознаменуют новую эру в лечении этого заболевания. Другими перспективными препаратами В-клеточной целевой терапии является ритуксимаб и эпратузумаб, стимулирующие дальнейшие исследования В-клеточной терапии. Установлено также, что интерферон-α играет важную роль в патогенезе СКВ. Последние испытания антиинтерферон-α моноклональных антител — сифализумаба и ронтализумаба — продемонстрировали улучшение клинических исходов у пациентов с кожными проявлениями заболевания. Другие испытания биологических препаратов, таких как тоцилизумаб и абатацепт, возможно, требуют дальнейших клинических исследований. Данная статья фокусируется на новых достижениях терапии СКВ.
системная красная волчанка (СКВ), терапия, В-клетки, биологические препараты, перспективы лечения.
Адреса для листування:
Головач Ірина Юріївна
03680, Київ, вул. Академіка Заболотного, 21
Клінічна лікарня «Феофанія» ДУС,
ІІІ корпус, відділення ревматології, нефрології
і внутрішньої патології
E-mail: golovachirina@yandex.ru

Leave a comment