НОВА МЕТА ТАРГЕТНОЇ ТЕРАПІЇ ОСТЕОПОРОЗУ — ІНГІБІТОР RANKL ДЕНОСУМАБ
Резюме. Резюме. Проблема медикаментозної терапії остеопорозу лишається актуальною, незважаючи на великий вибір схвалених засобів. Побічні ефекти та низька прихильність до тривалої терапії — основні причини неефективності протиостеопоротичної терапії. Відкриття сигнальної системи, що складається з рецептора активатора ядерного фактора κВ (RANK), його ліганда (RANKL) і остеопротегерину (OPG), що є основним регулятором процесів диференціювання, функціонування та апоптозу остеокластів, здійснило прорив у розумінні патофізіології остеопорозу. Відомості про вирішальну роль RANKL у пришвидшенні резорбції кістки привели до створення нових лікарських препаратів, механізм дії яких заснований на інгібуванні RANKL. Представником цієї групи препаратів є деносумаб — повне людське антитіло, високоспецифічне до RANKL, яке імітує дію остеопротегерину на RANKL. Отже, патогенетична терапія при постменопаузальному остеопорозі з цільовим впливом на ключовий процес активації та виживаності остеокластів — cигнальний шлях RANKL/RANK/OPG — багатообіцяюча стратегія подолання багатьох недоліків існуючих схем лікування, котра реалізувалася винаходом інноваційної молекули деносумабу. Клінічні дослідження за участі більше ніж 10 тис. пацієнток переконливо довели ефективність деносумабу в запобіганні остеопоротичним переломам основних локалізацій порівняно з плацебо, більш потужний антирезорбтивний ефект порівняно з алендронатом, сприятливий профіль безпеки і високий рівень прихильності пацієнток до лікування. Деносумаб продемонстрував повну оборотність антирезорбтивних ефектів без накопичення в кістковому матриксі, довготривалу безпеку (>5 років) і керованість небажаними ефектами.
Проблема медикаментозной терапии остеопороза остается актуальной, несмотря на большой выбор одобренных средств. Побочные эффекты и низкая приверженность к длительной терапии — основные причины неэффективности противоостеопоротической терапии. Открытие сигнальной системы, состоящей из рецептора активатора ядерного фактора kВ (RANK), его лиганда (RANKL) и остеопротегерина, являющейся основным регулятором процессов дифференцировки, функционирования и апоптоза остеокластов, совершило прорыв в понимании патофизиологии остеопороза. Сведения о решающей роли RANKL в ускорении резорбции кости привели к созданию новых лекарственных препаратов, механизм действия которых основан на ингибировании RANKL. Представителем этой группы препаратов является деносумаб — полное человеческое антитело, высокоспецифичное к RANKL, которое имитирует действие остеопротегерина на RANKL. Таким образом, патогенетическая терапия при постменопаузальном остеопорозе с целевым воздействием на ключевой процесс активации и выживаемости остеокластов — cигнальний путь RANKL/RANK/OPG — многообещающая стратегия преодоления многих недостатков существующих схем лечения, которая реализовалась изобретением инновационной молекулы деносумаба. Клинические исследования с участием более 10 тыс. пациенток убедительно доказали эффективность деносумаба в предотвращении остеопоротических переломов основных локализаций по сравнению с плацебо, более мощный антирезорбтивный эффект по сравнению с алендронатом, благоприятный профиль безопасности и высокий уровень приверженности пациенток к лечению. Деносумаб продемонстрировал полную обратимость антирезорбтивных эффектов без накопления в костном матриксе, долгосрочную безопасность (>5 лет) и управляемость нежелательными эффектами.
Понимание молекулярных механизмов костного ремоделирования — важный шаг в развитии новых технологий лечения заболеваний, связанных с нарушениями костного обмена [3, 4]. До настоящего времени в традиционной медицине в основном применяли синтетические препараты, полученные химическим путем, которые, как правило, действовали на клеточном уровне и обладали низкой специфичностью к определенным белковым структурам. Одним из последних направлений в фармакологии является создание биофармакологических агентов, полученных в живых организмах и осуществляющих свое влияние на регулирующие системы преимущественно внеклеточно. Влияние этих агентов специфично в отношении определенных мишеней, поэтому механизм действия подобных препаратов называют «таргетным» (от англ. «target» — мишень) [3]. Процесс активации остеокластов представляет собой одно из самых важных открытий в биологии кости за последние 10 лет, открывших путь к принципиально новому пониманию механизмов костного ремоделирования и расширению терапевтического арсенала для лечения при патологии костной ткани.
Сигнальный путь, запускаемый лигандом рецептора активатора ядерного фактора kВ (RANKL), оказался краеугольным камнем в понимании патогенеза остеопороза (ОП) и отправной точкой в разработке нового класса препаратов, влияющего на костную резорбцию и ремоделирование путем таргетного воздействия на активность и выживаемость остеокластов [46]. Целенаправленное воздействие на RANKL-зависимый сигнальный путь недавно зарегистрированным в Украине иммунобиологическим препаратом деносумаб (Пролиа™, «Amgen») открывает новые перспективы в лечении при постменопаузальном ОП, позволяет надеяться на преодоление недостатков существующих видов терапии, а также на достижение лучших результатов в лечении пациенов с ОП и профилактике переломов костей.
Обзор нетаргетных препаратов для лечения при ОП
В настоящеее время одобренные к клиническому применению средства терапии при ОП включают препараты с различными механизмами действия, что определяет их различную эффективность и профиль безопасности [17]. Рутинное применение витамина D и препаратов кальция исторически рассматривается как базисная профилактика и терапия ОП у всех пациентов, однако ее недостаточно для предупреждения потерь костной массы в случаях клинически выраженного заболевания с высоким риском переломов [29, 40]. С 1995 г. во всем мире для лечения ОП активно применяют препараты класса бисфосфонатов — лекарственные средства первой линии выбора с высокой эффективностью в отношении снижения риска переломов. В клинических исследованиях показана эффективность этих препаратов при длительном использовании [1, 34].
Большинство применяемых для лечения ОП средств обладают антирезорбтивным действием, повышая прочность костей и снижая вероятность остеопоротических переломов за счет замедления процессов ремоделирования при сохранении или повышении минеральной плотности костной ткани (МПКТ). В число таких препаратов, кроме деносумаба, входят бисфосфонаты для применения внутрь или внутривенно и селективные модуляторы эстрогеновых рецепторов (SERMs). Рассматриваемые ранее в этой группе кальцитонинсодержащие препараты с 2012 г. утратили Рекомендации Европейского агентства по лекарственным препаратам (EMEA) в лечении остеопороза в связи с достоверным повышением риска развития онкологических заболеваний при их долгосрочном применении [15]. Другой класс средств для лечения при ОП, представленный рекомбинантным человеческим паратиреоидным гормоном (rHuPTH) и терипаратидом, усиливает формирование кости посредством преимущественного стимулирующего влияния на функцию остеобластов, ускоряя процессы костного ремоделирования [12, 40]. Стронция ранелат обладает и антирезорбтивными, и анаболическими свойствами в отношении костной ткани, в связи с чем позиционируется как агент с двойным механизмом действия (DABAs), который до настоящего времени не изучен окончательно [31, 32].
При наличии достаточного количества хорошо спланированных, крупных исследований, убедительно демонстрирующих эффективность каждого из рассмотренных в табл. 1 классов препаратов для лечения пациентов с ОП, остается ряд проблем и недостатков, ограничивающих их применение. В частности, бисфосфонаты, принимаемые внутрь, в целом имеют низкую биодоступность. Побочные эффекты со стороны желудочно-кишечного тракта (ЖКТ), отсутствие удобных схем приема приводят к недостаточной приверженности пациентов к длительной терапии. Средняя продолжительность лечения пероральными бисфосфонатами по данным J.A. Cramer и соавторов составила <1 года [10]. Риски нарушения режимов терапии при ежедневном дозировании per os могут быть компенсированы увеличением интервала приема препаратов парентерально, например бисфосфонатами для внутривенного введения или деносумабом — для подкожного. Стронция ранелат при длительном приеме повышает риск венозных тромбозов [14] и редких заболеваний кожи с общим названием DRESS-синдром [16], также рекомендуются ограничения его применения у иммобилизированных пациентов. Возникают сложности с правильной интерпретацией динамики МПКТ в связи с уменьшением проникающей способности рентгеновских лучей через ткани, содержащие стронций [14].
| Класс | Препарат | Клинические доказательства | Ограничения и возможные побочные эффекты | ||
|---|---|---|---|---|---|
| ↑МПКТ | ↓Риск вертебральных переломов | ↓Риск невертебральных переломов | |||
| Бисфосфонаты для приема внутрь | Алендронат | + | +++ | ++ | Расстройства со стороны ЖКТ |
| Этидронат* | + | + | – | ||
| Ризедронат | + | +++ | ++ | ||
| Внутривенные бисфосфонаты | Ибандронат | + | +/+++ | +/+++ | Гриппоподобный синдром, миалгия |
| Золедронат | + | +++ | +++ | ||
| DABAs | Стронция ранелат | + | +++ | +++ | Риск тромбозов, DRESS |
| SERMs | Ралоксифен* | + | +++ | – | Вазомоторные расстройства, тромбозы, колики |
| Лазофоксифен* | + | +++ | +++ | ||
| PTH | Терипаратид* | + | +++ | ++ | Тошнота, головокружение, судороги, применение не дольше 24 мес |
| rHuPTH* | + | +++ | – | ||
– Нет доказательств; для приема внутрь; + незначительные доказательства; для внутривенного применения; ++доказательства средней силы; *препарат не зарегистрирован в Украине; +++убедительные, системные доказательства; DRESS — сыпь с эозинофилией и системными симптомами.
Основные клинические характеристики препаратов, одобренных в Европейском Союзе для лечения ОП, суммированы — см. табл. 1.
Однако практикующие врачи часто задают вопросы о продолжительности лечения, особенно при тяжелом ОП и высоком риске новых переломов у пациентов, которые в течение нескольких лет применяли эти препараты, о возможности и необходимости перевода больного с одной терапии на другую при возниковении переломов или осложнений лечения. Немаловажное значение в организации помощи пациентам с ОП имеют и индивидуальная переносимость лекарств, а также приверженность к терапии. Хорошо известно, что низкая комплаентность (<80%) приводит к снижению эффективности противоостеопоротических препаратов в предотвращении риска переломов, а следовательно, конечный результат лечения не достигает значений, полученных в ходе клинических исследований [1]. Поэтому постоянно ведется поиск новых противоостеопоротических средств, изучается кратность их применения, что позволит улучшить профилактику и лечение ОП.
Молекулярные предпосылки создания нового класса таргетных препаратов
Костное ремоделирования — непрерывный и хорошо скоординированный процесс, который помогает устранить микроповреждения в костном матриксе, возникающие в течение жизни, сохранить костную микроархитектуру и поддерживать костную прочность. В этом тщательно регулируемом процессе количество резорбированной кости замещается адекватным количеством вновь образованной костной ткани. Резорбция кости осуществляется остеокластами, а в образовании костной ткани участвуют остеобласты. Дисбаланс в процессах резорбции и формирования кости приводит к ускорению костного обмена, преобладанию резорбции над формированием и, как следствие, к уменьшению костной массы.
Оба процесса образования и резорбции костной ткани тесно взаимосвязаны и являются результатом клеточного взаимодействия остеобластов и остеокластов. Остеобласты играют фундаментальную роль в модуляции костного ремоделирования и регуляции метаболической активности других клеток костной ткани. Они секретируют ряд биологически активных соединений, посредством которых осуществляется влияние на процесс созревания клетки-предшественника остеокластов, превращая его в большую многоядерную клетку, способную участвовать в резорбции. На рост и функциональную способность остеобластов оказывают влияние многочисленные паракринные и/или аутокринные факторы, регулирующие активность процессов внутриядерной транскрипции, синтез остеопонтина и остеокальцина.
Открытие сигнальной системы, состоящей из рецептора активатора ядерного фактора kВ (RANK), его лиганда (RANKL) и остеопротегерина (OPG), являющейся основным регулятором процессов дифференцировки, функционирования и апоптоза остеокластов, совершило прорыв в понимании патофизиологии ОП.
RANKL — это гликопротеин, продуцируемый клетками остеобластного ряда и активированными Т-лимфоцитами, принадлежит к суперсемейству лигандов фактора некроза опухоли (TNF) [20, 25] и является главным стимулом для созревания остеокластов. Повышение экспрессии RANKL напрямую ведет к повышению резорбции и потере костной ткани. Его специфический рецептор — RANK расположен на поверхности мембраны остеокластов, дендритных, гладкомышечных и эндотелиальных клеток [20]. Возрастание RANKL и его взаимодействие с RANK приводит к каскадным геномным трансформациям в костно-мозговых предшественниках остеокластов, превращающихся последовательно в преостеокласты, затем — в зрелые активные многоядерные остеокласты, осуществляющие резорбцию костной ткани. При этом одновременно отмечается торможение апоптоза зрелых остеокластов [4, 22].
OPG — растворимый рецептор для RANKL, синтезируемый остеобластными клетками, а также клетками стромы, эндотелиальными клетками сосудов и В-лимфоцитами. Он действует как эндогенный рецептор-ловушка для RANKL, блокируя его взаимодействие с собственным рецептором (RANK), и угнетает формирование зрелых многоядерных клеток остеокластов, нарушая процесс остеокластогенеза, понижая активность резорбции костной ткани [2].
Молекулярная основа межклеточного взаимодействия с участием RANKL-RANK-OPG-системы может быть представлена следующим образом: RANKL, экспрессированный на поверхности остеобластов, связывается с RANK-рецептором, расположенным на мембранах клеток-предшественников остеокластов, и индуцирует процесс дифференцировки и активации остеокластов [22, 43]. Одновременно стволовые клетки костного мозга и остебласты высвобождают фактор, стимулирующий образование колоний макрофагов (M-CSF) [28]. Этот полипептидный фактор роста, взаимодействуя с его высокоаффинным трансмембранным рецептором (c-fms), активирует внутриклеточную тирозинкиназу, стимулируя процесс пролиферации и дифференциации клетки-предшественника остеокластов [41]. OPG, являясь естественным рецептором-ловушкой для RANKL, конкурирует с RANK за связывание с RANKL. Блокируя этот процесс, OPG подавляет костную резорбцию, отдавая приоритет костному образованию [5, 43]. Нарушение связывания RANKL и OPG — существенное звено патогенеза многих заболеваний, протекающих с увеличением количества RANKL и сопровождающихся усилением костной резорбции. Схематически процесс взаимосвязи системы RANKL/RANK/OPG представлен на рисунке.
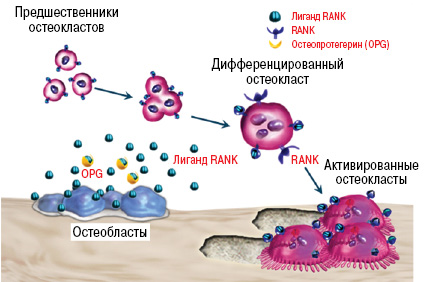
Рисунок. Регуляция ремоделирования кости через сигнальный путь RANKL/RANK/OPG (адаптировано по: Boyle W.J. et al. (2003). Nature, 423: 337–342)
Изменение соотношения RANKL/OPG в сторону преобладания RANKL в настоящее время рассматривается как основная причина развития постменопаузального ОП и других заболеваний скелета, включая множественную миелому, метастатическую болезнь, потерю костной массы, связанную с медикаментозными вмешательствами, в частности с применением глюкокортикоидов, ревматоидным и псориатическим артритами, болезнью Педжета [9]. Выходя за рамки опорно-двигательного аппарата, сигнальный путь RANKL вовлечен в процесс развития сердечно-сосудистых заболеваний, в частности кальцификации артерий и аорты, а также иммунных и редких генетических заболеваний [44].
В настоящее время стало очевидным, что поддержание взаимосвязи между RANKL и OPG является важным условием сохранения равновесия между резорбцией и формированием костной ткани. Сопряженность этих двух процессов, относительные концентрации RANKL и OPG в костной ткани определяют главные детерминанты массы и прочности кости. С момента открытия системы RANKL-RANK-OPG как конечного пути формирования и дифференциации остеокластов многими исследованиями подтверждена ведущая роль этого клеточно-молекулярного механизма патогенеза ОП, что открывает возможности в поиске новых подходов в лечении данного заболевания [13].
Деносумаб — первый представитель класса таргетных препаратов для лечения ОП. Базируясь на многочисленных экспериментальных исследованиях, RANKL оказался перспективной мишенью для целенаправленного воздействия на процессы костной резорбции. Результатом разработки новой концепции — синтеза «таргетного» препарата для лечения при постменопаузальном ОП стал синтез специфического, высокоаффинного человеческого моноклонального антитела (изотип иммуноглобулина IgG2), с высокой степенью аффинности к лиганду рецептора активатора ядерного фактора kB (RANKL). Создание деносумаба можно без преувеличения назвать выдающейся биотехнологической инновацией последнего десятилетия компании «Amgen» (США). Для получения деносумаба использовалась технология XenoMouse, которая заключается в модификации генома мыши и синтезе в ее организме человеческих антител вместо мышиных [47]. Деносумаб связывает RANKL и предотвращает его взаимодействие с соответствующим рецептором, полностью имитируя тем самым физиологическую функцию OPG, останавливая костную резорбцию путем подавления дифференцировки, функции и выживаемости остеокластов. В мае 2010 г. деносумаб (Пролиа) был одобрен EMEA для лечения при постменопаузальном ОП у женщин с повышенным риском переломов, в июне 2010 г. такое же показание утверждено FDA, а с сентября 2012 г. деносумаб рекомендован FDA для лечения ОП у мужчин.
Деносумаб имеет уникальную структуру и низкий антигенный потенциал, что позволяет избежать перекрестного реагирования с другими эндогенными компонентами. Эффективная доза деносумаба составляет 60 мг [35]. Препарат вводится подкожно каждые 6 мес в форме 1 мл раствора [7].
Исследования, в которых деносумаб сравнивали с другими человеческими моноклональными антителами, показали, что препарат имеет нелинейную фармакинетику. Исследования похожих IgG-антител позволяют выдвинуть гипотезу о том, что деносумаб адсорбируется лимфатической системой, а затем поступает в сосудистое русло. Клиренс деносумаба осуществляется двумя способами: один из них — непосредственное связывание с RANKL. Именно этот механизм обусловливает «таргетное» распределение препарата. А другой — неспецифический катаболизм препарата клетками ретикулоэндотелиальной системы. Биологическая доступность составляет от 50 до 100% [4].
Результаты клинических исследований деносумаба
В программу клинических исследований деносумаба для профилактики и лечения при ОП были включены более 10 тыс. пациенток. Опубликованы данные 1 исследования I фазы, оценивающего последствия эскалации дозы, 1 исследования II фазы, в котором изучались различные режимы дозирования деносумаба в сравнении со стандартной терапией алендронатом, и плацебо с переходом на деносумаб, и 4 исследования III фазы для исследования эффективности деносумаба в терапевтической дозе в сравнении с плацебо, алендронатом и результатов чередования алендронат-деносумаб. Обзор результатов указанных исследований приведен в табл. 2.
| Исследование/показание | Фаза | N | Дизайн/популяция | Основные клинические результаты |
|---|---|---|---|---|
| Лечение при ОП (FREEDOM) [11] | III | 7868 | 1:1, pандомизированное двойное слепое плацебо-контролируемое, 36 меc МПКТ (позвонок) <–2,5 >4,0; ДНБ 60 мг п/к, каждые 6 мес vs плацебо | Риск новых ПП ↓ на 68%; частота новых ПП на ДНБ 2,3% vsплацебо 7,2%; р<0,0001. Риск ПБ↓ на 40%; р=0,036. Риск НП↓; р=0,011 |
| Профилактика ОП* (DEFEND) [7] | III | 332 | 1:1, pандомизированное двойное слепое плацебо-контролируемое, 24 меc МПКТ (позвонок) ≤–1,5 и ≥2,5; ДНБ 60 мг п/к, каждые 6 мес vs плацебо | Повышение МПКТ (позвонок): ДНБ 6,5% vsплацебо — 0,6%; р<0,0001. Повышение МПКТ в бедре, лучевой кости, в костях в целом vs плацебо; р<0,0001 |
| Лечение при ОП/ сравнение ДНБ с АЛД (DECIDE) [8] | III | 1189 | 1:1, pандомизированное двойное слепое АЛД-контролируемое, 12 меc МПКТ (позвонок или бедро) ≤–2,0; ДНБ 60 мг п/к, каждые 6 мес vs АЛД 70 мг per os еженедельно | Относительное повышение МПКТ в бедре на 35% в группе ДНБ vs АЛД; ДНБ 3,5% vsАЛД 2,6%; p<0,0001. Большее повышение ПМКТ в группе ДНБ во всех отделах скелета, p≤0,0002 |
| Лечение при ОП/переход с АЛД на ДНБ (STAND) [24] | III | 504 | 1:1, pандомизированное двойное слепое АЛД-контролируемое, 12 меc МПКТ (позвонок или бедро) ≤–2,5 ≥–4,0; предшествующая терапия АЛД ≥6мес; ДНБ 60 мг п/к, каждые 6 мес vs АЛД 70 мг per os еженедельно | Относительное повышение МПКТ в бедре на 80% в группе ДНБ vs АЛД; ДНБ 1,9 vsАЛД 1,05; p<0,0001. Прирост МПКТ больше в группе ДНБ в позвоночнике, шейке бедра, ⅓ лучевой кости; p<0,0125 |
| Лечение при ОП[30, 33, 35] | II | 412 | Рандомизированное контролируемое, до 6 лет; МПКТ (позвоночник) ≤–1,8 и ≥–3,5; ДНБ 60 мг п/к (6; 14; 30 мг каждые 3 мес или 14; 60; 100; 210 мг каждые 6 мес) vs плацебо vs АЛД 70 мг per os еженедельно | Повышение МПКТ в 12/24 мес (позвоночник): ДНБ 3,0—6,7%/4,13—8,89%, АЛД 4,6%/24 мес данных нет, плацебо — 0,8%/ — 1,18%; Повышение МПКТ (бедро) в 12 мес: ДНБ 1,9—3,6%, АЛД 2,1%, плацебо – 0,6%;Повышение МПКТ (позвоночник) в 48 мес: ДНБ 9,4—11,8% |
| Здоровые женщины в постменопаузальный период, оценка фармакокинетики [6] | I | 49 | 1:3 рандомизированное, ранжированное по дозе исследование; однократная доза ДНБ 0,01; 0,03; 0,1; 0,3; 1,0; 3,0 мг/кг vs плацебо | Дозозависимое снижение концентрации N-телопептида в моче до — 84% через 12 ч до 6 мес |
*Показание не зарегистрировано в Украине; АЛД — алендронат; ДНБ — деносумаб; ПП — позвоночный перелом; ПБ — перелом бедра; НП — невертебральный перелом; п/к — подкожно.
О деносумабе как антирезорбтивном препарате, обладающем дозозависимым эффектом, стало известно в 2004 г., когда были опубликованы первые результаты его применения у здоровых женщин в постменопаузальный период [6]. Затем были проведены исследования деносумаба у женщин с постменопаузальным ОП. В первом таком исследовании оценивали эффективность и безопасность различных доз (6; 14; 30; 60; 100 и 210 мг) и режимов подкожного введения препарата (каждые 3 или 6 мес) и его эффектов при прекращении и последующем возобновлении терапии. В зависимости от дозы и интервала приема деносумаба через 12 мес терапии прирост МПКТ в поясничном отделе позвоночника составил от 3,0 до 6,7%, в общем показателе бедра — от 1,9 до 3,6%, а в лучевой кости — от 0,4 до 1,3%, в то время как в группе плацебо отмечалась отрицательная динамика во всех изучаемых отделах скелета (0,8; 0,6 и 2% соответственно; p<0,001) [1, 35]. Через 24 мес терапии положительный эффект деносумаба в отношении МПКТ сохранялся, при этом полученные данные свидетельствовали о том, что дозы 30 мг каждые 3 мес и 60 мг каждые 6 мес обеспечивали наиболее выраженное терапевтическое действие [29].
При применении препарата во всех исследуемых дозах отмечалось умеренное снижение уровня сывороточного кальция и фосфора, не достигшее статистической значимости. На начальном этапе терапии наблюдалось незначительное компенсаторное повышение паратиреоидного гормона в крови, средний уровень которого в дальнейшем возвращался к своему первоначальному значению. Изменений показателей иммунной системы (субпопуляции Т- и В-лимфоцитов) на фоне применения деносумаба не отмечено. В основной и контрольной группах частота возникновения нежелательных явлений (НЯ), связанных с разными инфекционными осложнениями, достоверно не различалась и составила 38 и 33% соответственно.
Теоретическое обоснование предрасположенности к инфекциям на фоне ингибиторов RANKL связано с экспрессией RANKL на Т-клетках, гемопоэтических и дендритных клетках [3, 27]. Более того, связывание RANKL с RANK может регулировать Т-клеточную активность и функционирование дендритных клеток [26, 27]. Ингибиция Т- и В-клеток продемонстрирована на мышах, лишенных RANKL [26]. Однако в ходе клинических исследований серьезных НЯ, связанных с препаратом, осложнений в месте введения препарата, негативного влияния на иммунную систему и развития антител к деносумабу не отмечено.
В исследовании II фазы женщины одной группы принимали алендронат, что позволило сравнить новый препарат с уже хорошо зарекомендовавшим себя бисфосфонатом. Деносумаб оказывал сходное с алендронатом действие на МПКТ позвоночника и более выраженное — в области бедра и дистального отдела предплечья. Продление данного исследования до 4 лет продемонстрировало продолжающуюся прибавку МПКТ, при этом на протяжении всех месяцев лечения отмечалось стойкое подавление костной резорбции [33]. Через 48 мес 200 пациенток продолжили участие в открытой фазе исследования, получая инъекции деносумаба, при этом часть из них — непрерывно в течение 6 лет. Прирост МПКТ у пациенток, получавших деносумаб все 72 мес наблюдения на фоне сниженного костного обмена, составил в поясничном отделе позвоночника 13,3%, в бедре — 6,1%, в дистальном отделе предплечья — 1,9% [8].
Достоверное (⅓) повышение МПКТ в дистальном отделе лучевой кости свидетельствовало о влиянии деносумаба на кортикальную кость, что не отмечалось ранее при лечении другими антиостеопоротическими препаратами [18]. Этот феномен, по-видимому, связан с разным механизмом действия антирезорбтивных препаратов. Механизм действия бисфосфонатов заключается в связывании их с резорбтивной поверхностью, площадь которой в кортикальной кости значительно меньше, чем в трабекулярной. Деносумаб является полностью человеческим моноклональным антителом к RANKL, которое подавляет формирование и активность остеокластов без связывания с костным матриксом, поэтому и воздействие деносумаба на кортикальную кость более выражено, чем у бисфосфонатов. Дальнейшие исследования с помощью компьютерной томографии высокого разрешения 3D подтвердили данное предположение [18, 42].
В III фазу клинического испытания деносумаба вошли 4 крупных исследования: The Denosumab Fortifies Bone Density (DEFEND); The fracture redaction evaluation of Denosumab in osteoporosis every 6 months (FREEDOM); The determining efficacy: comparison of initiating Denosumab versus Alendronate (DECIDE); The study of transitioning from Alendronate to Denosumab (STAND) [19, 21, 38].
Результаты проведенных исследований демонстрируют, что деносумаб эффективно повышает МПКТ, замедляет костное ремоделирование и достоверно снижает риск новых и повторных позвоночных переломов, а также переломов внепозвоночной локализации, включая шейку бедра. Костная резорбция при терапии деносумабом, судя по снижению концентрации маркеров костной резорбции в течение 12 ч, замедляется быстро, устойчиво (до 6 мес после однократного введения) и полностью обратимо. В прямых сравнительных исследованиях деносумаб был эффективнее алендроната по показателям прироста МПКТ во всех значимых отделах скелета. Переход на деносумаб с алендроната через 12 мес привел к повышению МПКТ в поясничном отделе позвоночника, общем показателе бедра и в дистальном отделе лучевой кости, а также к снижению маркеров костной резорбции в большей степени по сравнению с пациентками, продолжавшими терапию алендронатом. Деносумаб продемонстрировал более мощное и быстрое снижение маркеров костной резорбции по сравнению с алендронатом [8].
Таким образом, сравнительное исследование (head to head) двух антирезорбтивных препаратов с разным механизмом действия показало, что деносумаб в большей степени повышает МПКТ позвонков, проксимального отдела бедра и предплечья, чем алендронат. К тому же большее число пациентов, получавших деносумаб, отвечали на терапию повышением МПКТ. На фоне лечения деносумабом происходило более значимое снижение уровня маркеров костного метаболизма СТх (через 9 мес терапии) и Р1NP (через 12 мес), причем если максимальное снижение уровня СТх при лечении алендронатом наблюдалось к 3-му месяцу терапии, то при лечении деносумабом — уже через 1 мес. Несмотря на то что оба препарата повышают МПКТ путем снижения остеокластической костной резорбции, механизм действия и фармакодинамический профиль у них различаются. Различие в скорости снижения уровня маркера костной резорбции также может быть связано с разными механизмами действия препаратов, поскольку алендронат обладает высокой аффинностью к гидроксиапатиту, инкорпорируется в костный матрикс и в основном ингибирует активность зрелых остеокластов. Деносумаб, напротив, ингибирует ключевой медиатор дифференцировки, функционирования и выживаемости остеокластов RANKL. Вероятно, что большее повышение МПКТ при лечении деносумабом связано с более быстрым снижением скорости костного обмена.
В двух исследованиях III фазы изучали влияние деносумаба на качество и микроархитектуру кости [39]. В исследовании FREEDOM 92 пациенткам проводили биопсию подвздошно-крестцовой области (47 человек — деносумаб, 45 — плацебо). В группе деносумаба получено всего 53 биоптата и в группе плацебо — 62. Биопсию проводили на 24-м или на 36-м месяце. Для гистоморфометрического и качественного анализа костной ткани биопсийные образцы окрашивали трихромистым золотом. Оценку показателей костеобразования и скорости минерализации кости проводили с помощью метода двойной тетрациклиновой метки. В исследовании STAND биопсию проводили у женщин в постменопаузальный период с низкой костной массой, предварительно леченных алендронатом, рандомизированных в две группы: продолжающие лечение алендронатом (21 биопсия) и перешедшие на прием деносумаба. Результаты у пациенток, получавших деносумаб, были одинаковы в двух исследованиях. У всех пациенток выявлена нормальная трабекулярная ткань, степень минерализации и нормальная остеоидная ткань. Только у 5 пациенток в исследовании FREEDOM в биоптате не выявлен остеоид (не попал в поле зрения). Остеомаляции не было ни в одной группе, патология костного мозга зафиксирована у 1 пациентки в группе деносумаба, однако при повторной биопсии, взятой на 36-м месяце терапии, не установлено изменений. Фиброз костного мозга выявлен у 1 пациентки, получавшей алендронат. Двойная тетрациклиновая метка выполнена у всех больных, получавших плацебо, и у 40%, получавших деносумаб в исследовании FREEDOM, и у 60% — в исследовании STAND. Только одна метка была выполнена у 16 пациенток в двух исследованиях и методика не применялась у 21. Объем губчатого вещества и толщина кортикального слоя достоверно не различались в трех группах в данном участке скелета. Согласно механизму действия деносумаба статические и динамические показатели костной резорбции были подавлены. Эрозивная поверхность и количество остеокластов на ней были достоверно меньше у пациенток, получавших деносумаб. Показатели формирования кости, такие как остеоидная поверхность и толщина остеоидной ткани, а также скорость костеобразования, были достоверно снижены у получавших деносумаб по сравнению с плацебо, а толщина остеоидной ткани — по сравнению с получавшими алендронат. Скорость минерализации, измеренная с помощью одной тетрациклиновой метки, была достоверно ниже, чем в группе плацебо и в группе алендроната, и составила 0,3 ммоль/сут. Деносумаб, как и алендронат, значительно подавлял активацию частоты ремоделирующих единиц по сравнению с плацебо, что является признаком подавления костного обмена. Таким образом, полученные данные свидетельствовали о более выраженном антирезорбтивном эффекте деносумаба по сравнению с алендронатом, особенно на размеры резорбтивной поверхности и степень минерализации.
Полученные результаты позволяют позиционировать деносумаб как перспективный препарат для лечения при постменопаузальном ОП, а также для его профилактики у пациенток с остеопенией и высоким риском возникновения переломов [23, 45].
Безопасность деносумаба
Сигнальный путь RANKL/RANK/OPG не является строго специфичным для остеокластов и в известной мере функционирут в клетках эндотелия, остеобластах, T-лимфоцитах, незрелых тимоцитах, эпителии протоков молочных желез, хондроцитах, дендритных клетках [46]. В связи с этим вероятность влияния деносумаба на иммунологические процессы, канцерогенез, кальцификацию сосудов, минеральный обмен нуждается в дальнейшем изучении, несмотря на то что накопленные данные подтверждают отсутствие клинически значимых колебаний подобных осложнений в группах.
В исследованиях III фазы у женщин в постменопаузальный период частота НЯ и серьезных НЯ была сравнима между группами деносумаба, алендроната и плацебо [8, 11, 24, 37]. Нет данных о повышении риска инфекционных или онкологических заболеваний, развития сердечно-сосудистой патологии, гипокальциемии и замедлении образования костной мозоли после переломов. В исследовании DEFEND количество серьезных НЯ в группе деносумаба было больше, чем в группе плацебо, хотя разница не была достоверной [7, 37]. В исследовании FREEDOM частота серьезых воспалений подкожной клетчатки была выше среди пациенток, принимавших деносумаб, в сравнении с плацебо (0,3% против 0,1%; p=0,002), при том, что общая частота этих событий в группах была сравнима [11, 37].
Препараты, применяемые при лечении ОП с антирезорбтивным эффектом (бисфосфонаты, деносумаб), вследствие замедления процессов ремоделирования обладают потенциальной опасностью развития специфических побочных эффектов, таких как атипичные переломы или остеонекроз нижней челюсти. В исследовании FREEDOM не было ни одного случая перелома у пациентов, получавших деносумаб, и 3 (0,1%) случая переломов у пациентов, получавших плацебо [11]. Сообщалось о 2 (0,09%) случаях остеонекроза нижней челюсти в продленном исследовании FREEDOM у пациенток, переведенных на деносумаб из группы плацебо (n=2207). Одна из пациенток прекратила лечение деносумабом в связи с остеонекрозом нижней челюсти. В группе, получавшей деносумаб изначально (n=2343) в течение 5 лет, ни одного случая остеонекроза нижней челюсти не зарегистрировано [36]. Нейтрализующие антитела на деносумаб не выявлены ни у одного пациента [37].
Выводы
Проблема медикаментозной терапии ОП остается актуальной, несмотря на большой выбор одобренных средств. Побочные эффекты и низкая приверженность к длительной терапии — основные причины прекращения принятия лекарственных препаратов. Патогенетическая терапия при постменопаузальном ОП с целевым воздействием на ключевой процесс активации и выживаемости остеокластов — cигнальный путь RANKL/RANK/OPG — многообещающая стратегия преодоления многих недостатков существующих схем лечения, которая реализовалась с появлением инновационной молекулы деносумаба — первого человеческого рекомбинантного моноклонального антитела к RANKL.
Клинические исследования с участием более 10 тыс. пациенток убедительно показали эффективность деносумаба в предотвращении остеопоротических переломов основных локализаций в сравнении с плацебо, более мощный антирезорбтивный эффект в сравнении с алендронатом, благоприятный профиль безопасности и высокий уровень приверженности пациенток к лечению. Деносумаб продемонстрировал полную обратимость антирезорбтивных эффектов без накопления в костном матриксе, долгосрочную безопасность (>5 лет) и управляемость НЯ.
Таким образом, успешный международный опыт клинического применения и обширная доказательная база деносумаба демонстрируют его хороший профиль переносимости и высокую клиническую эффективность, позволяющую существенно улучшить прогноз пациентов с ОП. Потенциальная возможность применения деносумаба в качестве монотерапии у пациентов с ОП, удобство применения (1 раз в 6 мес подкожно) свидетельствуют о несомненных перспективах применения препарата для лечения и профилактики системного ОП и предупреждения переломов костей на фоне этого заболевания. В настоящее время лечение деносумабом получают 520 тыс. пациентов в 58 странах мира. Введение в лечебную практику деносумаба позволяет больным системным ОП с оптимизмом смотреть в будущее.
Список использованной литературы
1. Никитинская О.А., Торопцова Н.В. (2012) Деносумаб — первый генно-инженерный препарат д ля лечения остеопороза. Соврем. ревматология, 3: 68–73.
2. Сагаловски С., Кунце П., Шенерт М. (2012) Роль цитокиновой системы RANKL-RANK-OPG и катепсина К в патогенезе остеопороза: достижения и перспективы в лечении заболевания. Клиницист, 2: 9–16.
3. Скрипникова И.А., Косматова О.В., Оганов Р.Г. (2011) Инновационные методы лечения остеопороза: ингибиторы RANKL. Профилакт. медицина, 2: 23–30.
4. Юренева С.В. (2010) Новая концепция в лечении постменопаузального остеопороза (обзор литературы). Лечащий врач, 5: 88–91.
5. Anandarajah A.P.(2008) Role of RANKL in bone diseases. Trends Epidemiol. Metab., 20(2): 88–94.
6. Bekker P.J., Holloway D.L, Rasmussen A.S. et al. (2004) A single-dose placebo-controlled study of AMG 162, a fully human monoclonal antibody to RANKL, in postmenopausalwomen. J. Bone Miner. Res., 19: 1059–1066.
7. Bone H.G., Bolognese M.A., Yuen C.K., et al. (2011) Effects of denosumab on bone mineral density and bone turnover in postmenopausal women. J. Clin. Endocrinol. Metab., 96(4): 972–980.
8. Brown J.P., Prince R.L., Deal C. et al. (2009) Comparison of the effect of denosumab and alendronate on BMD and biochemical markers of bone turnover in postmenopausal women with low bone mass: a randomized blinded, phase 3 trial. J. Bone Miner. Res., 24: 153–161.
9. Cavalli L. (2012) Targeted approaches in the treatment of osteoporosis: differential mechanism of action of denosumab and clinical utility.Therap.Clin. Risk Management, 8: 253–266.
10. Cramer J.A., Gold D.T., Silverman S.L., Lewiecki E.M. (2007) A systematic review of persistence and compliance with bisphosphonates for osteoporosis. Osteoporosis Int.,18: 1023–1031.
11. Cummings S.R., San Martin J., McClung M.R., et al. (2009) Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N. Engl. J. Med., 361: 756–765.
12. Delmas P. (2002) Treatment of postmenopausal osteoporosis. Lancet, 359: 2018–2026.
13. Dougall W., Chaisson M. (2006) The RANK/RANKL/OPG triad in cancer-induced bone diseases. Cancer Metast. Rev., 25: 541–549.
14. EMEA recommends changes in the product information for Protelos/Osseor due to the risk of severe hypersensitivity reactions// Press release doc. Ref. EMEA/417458/2007// http://www.emea.europa.eu/docs/en_GB/document_library/Press_release/2009/11/WC500015592.pdf
15. European Medicines Agency recommends limiting longterm use of calcitonin medicines//Press release//EMA/CHMP/483874/2012// http://www.ema.europa.eu/docs/en_GB/document_library/Press_release/2012/07/WC500130122.pdf
16. European Medicines Agency starts review of Protelos/Osseor // EMA/CHMP/827880/2011// http://www.ema.europa.eu/docs/en_GB/document_library/Press_release/2011/10/WC500116860.pdf
17. Gallacher S.J., Dixon T. (2010) Impact of Treatments for Postmenopausal Osteoporosis (Bisphosphonates, Parathyroid Hormone, Strontium Ranelate, and Denosumab) on Bone Quality: A Systematic Review. Calcif. Tissue Inter., 87 (6): 469–484.
18. Genant H.K., Engelke K., Hanley D.A. et al. (2010) Denosumab improves density and strength parameters as measured by QCT of the radius in postmenopausal women with low bone mineral density. Bone, 47 (1): 131–139.
19. Geusens P. (2009) Emerging treatments for postmenopausal osteoporosis — focus on denosumab. Clin. Int. Aging., 4: 241–250.
20. Hsu H., Lacey D.L., Dunstan C.R. et al. (1999) Tumor necrosis factor receptor family member RANK mediates osteoclast differentiation and activation induced by osteoprotegerin ligand. Proc. Natl. Acad. Sci USA, 96(7): 3540–3545.
21. Iqbal J., Sun L., Zaidi M. (2010) Denosumab for the treatment of osteoporosis. Curr. Osteoporos. Rep., 8(4): 163–167.
22. Jabbar S., Drury J., Fordham J.N. et al. (2011) Osteoprotegerin, RANKL and bone turnover in postmenopausal osteoporosis. J. Clin. Pathol., 64: 354–357.
23. Josse R., Khan A., Ngui D., Shapiro M. (2013) Denosumab, a new pharmacotherapy option for postmenopausal osteoporosis. Curr. Med. Res. Opin., 29(3): 205–216.
24. Kendler D.L., Roux C., Benhamou C.L et al. (2010) Effects of denosumab on bone mineral density and bone turnover in postmenopausal women transitioning from alendronate therapy. J. Bone Miner. Res., 25: 72–81.
25. Kollias G., Sfikakis P.P. (Еds) (2010) TNF: pathophysiology, molecular and cellular mechanisms. Karger AG, Basel, 186 р.
26. Kong Y.Y., Yoshida H., Sarosi I. et al. (1999) OPGL is key regulator of osteoclactogenesis, lymphocyte development and lymph-node organogenesis. Nature., 397: 315–323.
27. Lacey D.L., Tinims E., Tan H.L. et al. (1998) Osteoprotegerin ligand is cytokine that regulated osteoclact differentiation and activation. Cell, 93:165–176.
28. Lee M.S., Kim H.S., Yeon J.T. et al. (2009) GM-CSF regulates fusion of mononuclear osteoclasts into bone-resorbing osteoclasts by activating the Ras/ERK pathway. J. Immunol., 183: 3390–3399.
29. Lewiecki E. (2009) Current and emerging pharmacologic therapies for the management of postmenopausal osteoporosis. J. Womens Health, 18: 1615–1626.
30. Lewiecki E.M., Miller P.D., McClung M.R. et al. (2007) Two year treatment with denosumab (AMG 162) in a randomized phase 2 study of postmenopausal women with low bone mineral density. J. Bone Miner. Res., 22: 1832–1841.
31. Marie P.J. (2006) Strontium ranelate: a dual mode of action rebalancing bone turnover in favour of bone formation. Curr. Opin. Rheumatol., 18 (Suppl. 1): S11–S15/
32. Meunier P.J., Roux C., Seeman E. et al. (2004) The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis. N. Engl. J. Med., 350: 459–468.
33. Miller P.D., Bolognese M.A., Lewiecki E.M. et al. (2008) Effect of denosumab on bone density and turnover in postmenopausal women with low bone mass after long-term continued, discontinued, and restarting of therapy: A randomized blinded phase 2 clinical trial. Bone., 43: 222–229.
34. Mosekilde L., Vestergaard P., Rejnmark L. (2013) The pathogenesis, treatment and prevention of osteoporosis in men. Drugs., 73(1): 15–29.
35. MсСlung M.R., Lewiecki E.M., Cohen S.B. et al. (2006) Denosumab, a RANKL inhibitor, in postmenopausal women with low bone mineral density. N. Engl. J. Med., 354: 821–831.
36. Papapoulos S., Chapurlat R., Libanati C. et al. (2012) Five Years of Denosumab Exposure in Women With Postmenopausal Osteoporosis: Results From the First Two Years of the FREEDOM Extension. J. Bone Miner. Res., 27 (3): 694–701.
37. Resch Н. (2010) Osteoporosis: New-Generation Drugs. Breast Care, 5: 313–319.
38. Roman-Gonzales A., Ackerman K.E. (2009) Pharmacotherapy of bone loss in postmenopausal women: focus on Denosumab. Clin. Med., 1: 1131–1143.
39. Reid I., Benhamou M., Bolognese M. et al. (2009) Effects of Denosumab on bone histology and histomorphometry: the FREEDOM and STEND studies. ASMBR 31st Annual Meeting. J Bone Min. Res., 24: Suppl 1: Abstract A09001480.
40. Sambrook P., Cooper C. (2006) Osteoporosis. Lancet, 367: 2010–2018.
41. Sarahrudi K., Mousavi M., Thomas A. et al. (2010) Elevated levels of macrophage colony-stimulating factor in human fracture healing. J. Orthoped. Res., 28(5): 671–676.
42. Seeman E., Delmas P.D., Hanley D.A. et al. (2010) Microarchitectural deterioration of cortical and trabecular bone: differing effects of denosumab and alendronate. J. Bone Miner. Res., 25 (8): 1886–1894.
43. Simonet W.S., Lacey D.L., Dunstan C.R. et al. (1997) Osteoprotegerin: a novel secreted protein involved in the regulation of bone density. Cell., 89(2): 309–319.
44. Vega D., Maalouf N.M., Sakhaee K. (2007) The role of receptor activator of nuclear factor kB (RANK) RANK-ligand/osteoprotegerin: clinical implications. J.Clin. Endocrinol. Metab., 92: 4514–4521.
45. Wensel T.M., Iranikhah M.M., Wilborn T.W. (2011) Effects of denosumab on bone mineral density and bone turnover in postmenopausal women. Pharmacotherapy., 31(5): 510–523.
46. Wright H. (2009) RANK, RANKL and osteoprotegerin in bone biology and disease. Curr. Rev. Musculoskelet. Med., 2: 56–64.
47. Yang X.D., Jia X.C., Corvalan J.R. et al. (2001) Development of ABX-EGF, a fully human anti-EGF receptor monoclonal antibody, for cancer therapy. Crit. Rev. Oncol. Hematol., 38(1): 17–23.
Статья опубликована
при поддержке ООО «ГлаксоСмитКляйн
Фармасьютикалс Украина»
PRLA/10/UA/1.03.2013/7323
____________________
Информация для профессиональной деятельности медицинских и фармацевтических работников.
Пролиа™
Р.с. UA/12077/01/01.
Фармакотерапевтическая группа. Средства, влияющие на структуру и минерализацию костей. Деносумаб. Код АТС. М05В Х04. Состав. 1 мл раствора содержит 60 мг деносумаба. Фармакологические свойства. Полностью человеческое моноклональное антитело (IgG2), обладающее высокой аффинностью и специфичностью к лиганду рецептора активатора ядерного фактора каппа B (RANKL). Показания к применению. Лечение при остеопорозе у женщин в постменопаузальный период с повышенным риском переломов (позвонков, бедра, внепозвоночной локализации). Лечение потери костной массы у мужчин с повышенным риском переломов позвонков, которые получают гормоносупрессивную терапию в связи с раком предстательной железы. Противопоказания. Повышенная чувствительность к любому из компонентов препарата. Гипокальциемия. Применение в период беременности и кормления грудью, у детей. Препарат не рекомендуется применять у беременных и детей. При необходимости лечения препаратом Пролиатм необходимо отказаться от грудного вскармливания. Побочные реакции. Часто: инфекции мочевыделительной системы, верхних дыхательных путей, ишиас, катаракта, запор, боль в конечностях, сыпь; нечасто: дивертикулит, целлюлит, инфекции уха, экзема, включая дерматит, аллергический, атопический и контактный дерматит; редко: остеонекроз челюсти; очень редко: гипокальциемия.
Полную информацию по применению препарата можно получить по запросу.
Перед применением Пролии ознакомьтесь с инструкцией по медицинскому применению, которая прилагается к лекарственному средству.
Сообщить о нежелательном явлении или жалобе на качество препарата Вы можете в ООО «ГлаксоСмитКляйн ФармасьютикалсУкраина» по тел.: (044) 585-51-85.
За дополнительной информацией по препарату Пролиа™ обращайтесь в ООО «ГлаксоСмитКляйн Фармасьютикалс Украина»: 03038, Киев, ул. Линейная, 17.
Тел./факс: (044) 585-51-85/86.

Leave a comment