Моніторинг небажаних явищ на фоні терапії глюкокортикоїдами у низьких дозах: рекомендації EULAR для проведення клінічних досліджень і повсякденної практики
M.C. van der Goes, J.W.G. Jacobs, M. Boers, T. Andrews, M.A.M. Blom-Bakkers, F. Buttgereit, N. Caeyers, M. Cutolo, J.A.P. Da Silva, L. Guillevin, J.R. Kirwan, J. Rovensky, G. Severijns, S. Webber, R. Westhovens, J.W.J. Bijlsma
Результати. Даних моніторингу виявилося замало; більшість статей спрямовані на терапевтичну ефективність ГК, а не на виникнення і моніторинг НЯ. Більшість рекомендацій базувалися на основі консенсусу. Рекомендації для клінічних досліджень спрямовані на досягнення розуміння захворюваності, поширеності та клінічної значущості НЯ для створення всеосяжного і дійсного профіля ГК-індукованих НЯ. Отже, обсяг НЯ для моніторингу більш широкий і часто складається з оцінки на початку та в кінці дослідження. Рекомендації для повсякденної практики призначені для захисту пацієнтів від реальних небезпек, яким можна запобігти або лікувати їх. Немає необхідності в розширенні стандартного моніторингу для пацієнтів, які застосовують ГК у низьких дозах, за винятком остеопорозу (згідно з національними настановами), а також базових оцінок набряку гомілок, глюкози крові натще і оцінки факторів ризику виникнення глаукоми.
Висновок. Враховуючи неповноту даних літератури, рекомендації з моніторингу ГК-індукованих НЯ створено окремо, на основі консенсусу, для повсякденної практики і клінічних випробувань.
Вступ
З часу їх відкриття глюкокортикоїди (ГК) широко застосовуються при різних захворюваннях [1, 2]. Їх ефекти опосередковані на геномних і не геномних механізмах. ГК ефективні при багатьох запальних і ревматичних захворюваннях завдяки їх протизапальній та імуносупресивній дії, зниженню активності захворювання і зменшенню вираженості болю [3]. У довгостроковій перспективі ГК мають імуномодулюючий потенціал при ревматоїдному артриті (РА), такий як захисний вплив на руйнування суглобів [4]. Однак їх застосування спричиняє виникнення небажаних явищ (НЯ) [5–10].
Незважаючи на постійне застосування, немає певної погодженості з відповідним ГК-індукованим профілем НЯ. Поширеною помилкою є те, що частота виникнення НЯ при ГК-терапії у високих дозах (>30 мг/добу за преднізолоном або еквівалентом) та ГК у низьких дозах (≤7,5 мг/добу за преднізолоном або еквівалентом) є однаковою. В останні роки Робоча група EULAR прикладає зусилля щодо стандартизації номенклатури [11] і розробки настанови стосовно НЯ, пов’язаних із терапією ГК у низьких дозах при РА [12]. Крім того, сформульовано рекомендації щодо проведення системної терапії ГК при ревматичних захворюваннях [13]. Останнім часом вивчення перспективи застосування ГК показало, що рекомендації з моніторингу ГК-індукованих НЯ були необхідними, але недостатніми [14]. Оскільки багато з ГК-індукованих НЯ є (принаймні частково) попереджуваними або піддаються лікуванню, ідентифікація НЯ може бути важливою в повсякденній практиці. На сьогодні докладається багато зусиль з метою розроблення інноваційних ГК або лігандів ГК-рецепторів, які мають краще співвідношення терапевтичного ефекту та НЯ [15, 16]. Так, для отримання істинного профілю НЯ необхідне порівняння НЯ, індукованих звичайними ГК та інноваційними формами ГК, а також розробка чітких рекомендацій та погодженості з моніторингу НЯ.
Мета проведеного дослідження полягала в розробленні рекомендацій з моніторингу ГК-індукованих НЯ у лікуванні пацієнтів із ревматичними захворюваннями із застосуванням ГК у низьких дозах у клінічних випробуваннях для отримання високоточних даних про виникнення НЯ, і в повсякденній практиці для безпечного лікування пацієнтів. Ці рекомендації мають визначити, які НЯ слід контролювати, яким чином і з якою частотою.
Методи
Пошук літератури
Огляд опублікованих даних про ГК-індуковані НЯ при ревматичних захворюваннях проводився з використанням бібліографічних баз даних PubMed, EMBASE та Cochrane Library для того, щоб надавати дані для Робочої групи і розробити, за можливості, рекомендації з доказовою основою.
Пошук був зосереджений на проспективних ревматологічних дослідженнях звітності НЯ терапії ГК. Були використані всі синоніми і множинні пошукові терміни, а також терміни інформаційної мережі MESH були додані для пошуку PubMed. Оцінювалися дослідження, якщо: 1) вони були проспективні; 2) орієнтовані на запальні ревматичні захворювання; 3) ГК були використані в дозі до 10 мг/добу за преднізолоном або еквівалентом і 4) були відсутні повідомлення про НЯ. Оскільки основна увага в цих рекомендаціях приділяється низьким дозам ГК, були включені дослідження з використанням до 10 мг/добу за преднізолоном або еквівалент, щоб збільшити набір даних. У багатьох дослідженнях були повідомлення про НЯ при дозах ГК до 10 мг/добу, і нами було розглянуто різницю між 7,5 і 10 мг/добу за преднізолоном, щоб уникнути непорозумінь. Критеріями виключення були: неєвропейські мови, дослідження на тваринах і описання випадків.
Отримані дані
Після застосування критеріїв включення і виключення та вивчення повнотекстових статей дані відповідних досліджень були враховані. Важливими пунктами були досліджувана популяція (кількість пацієнтів, захворювання) і ГК-терапія (препарат, доза і тривалість). Була зібрана інформація про звітність НЯ, таких як визначення поширеності НЯ, метод моніторингу, частота моніторингу та засліплення дослідника. Наведені дані про появи кожного НЯ були враховані.
Підведення підсумків
Наявні дані результатів пошуку літератури були розділені на результати рандомізованих контрольованих досліджень (РКД) і результати проспективного дослідження когорти. Більшу перевагу було віддано наявності інформації від РКД, ніж когортним дослідженням, оскільки рандомізація дає можливість уникнути ймовірну неправильну інтерпретацію та дані можуть бути порівнянні з контрольною групою без лікування ГК. За відсутності доступу до певних НЯ у РДК була використана інформація з когортних досліджень. Для покращання якості звітності окремо для кожного НЯ були описані основні помилки в інтерпретації даних.
Рішення щодо моніторингу
Наявні дані були представлені Робочій групі, що складається із ревматологів і хворих ревматологічного профілю, також були обговорені можливі методи моніторингу, його необхідність, спосіб та частота проведення. Для всіх НЯ обмірковані можливі кандидати для моніторингу, а також обсяг доступних серед населення настанов (ВООЗ, Американська асоціація серця тощо) щодо моніторингу та скринінгу. Остаточне рішення з моніторингу було засноване на даних про появу кожного НЯ, можливості їх моніторингу та значущості для пацієнтів ревматологічного профілю і ревматологів.
Результати
У результаті пошуку літератури переглянуто 6226, 3654 і 15 статей в PubMed, EMBASE і Cochrane Library відповідно (рисунок). Після фільтрації даних згідно з критеріями відбору 348 статей були визнані потенційно актуальними. Після ознайомлення з повним текстом 31 статтю було включено в аналіз. Відповідні дані про виникнення НЯ отримані з РКД [17–32]. Не було даних для 6 НЯ у дослідженнях із застосуванням ГК у низькій дозі. Додатковий пошук даних використання ГК у середніх і високих дозах привів до повідомлень про виникнення психозу, остеонекрозу чи міопатії у 14 статтях [33–46].
Для кожного НЯ наявні дані наведено в табл. 1.
| НЯ | Високий ризик у РКД____________НД — дані недоступні |
Труднощі в інтерпретації результатів______________с — суперечливі дані; м — мала кількість; к — кінцева точка визначена не точно |
Підвищення ризику в проспективному дослідженні когорти______________НД — дані недоступні | Статус і актуальність НЯ________________к (LE) — клінічна кінцева точка (тривалість життя); к (QoL) — клінічна кінцева точка (якість життя); с — сурогатна кінцева точка; б — біомаркер |
Можливий метод для моніторингу_____________ | Моніторинг рекомендований_________________– не зазначено; к — у клінічних дослідженнях; п — у щоденній практиці |
|---|---|---|---|---|---|---|
| Серцево-судинні | ||||||
| Дисліпідемія | Ні | к | – | с | Так | к |
| Електролітні порушення | НД | – | Ні | б | Так | к |
| Набряк | Ні | м,к | – | к (QoL) | Так | к,п |
| Ниркова дисфункція (кліренс креатиніну) | НД | – | НД | б | Так | – |
| Серцева недостатність | Ні | м,к | – | к (LE), к (QoL) | Ні | – |
| Гіпертензія | Ні | к | – | с | Так | к,п (стандартне лікування) |
| Ішемічні ССЗ/атеросклероз | Ні | м | – | к (LE), к (QoL) | Ні | к,п (стандартне лікування) |
| Інфекційні | ||||||
| Інфекції | Можливо | с,к | – | к (LE), к (QoL) | Ні | к |
| Гастроінтестинальні | ||||||
| Пептична виразка шлунка | Можливо | с,м | – | к (LE), к (QoL) | Так | к,п (стандартне лікування) |
| Панкреатит | НД | – | НД | к (LE) | Так | – |
| Психологічні | ||||||
| Порушення настрою | Можливо | с,м,к | – | к (QoL) | Ні | к |
| Психоз | Ні | – | Так | к (QoL) | Ні | к |
| Ендокринні та метаболічні | ||||||
| Цукровий діабет, порушення толерантності до глюкози | Можливо | с | – | с | Так | к,п |
| Маса тіла і жировий перерозподіл | Можливо | с | – | к (QoL) | Так | к,п (стандартне лікування) |
| Втручання в секрецію гормонів | Так | м,к | – | б | Ні | к |
| Дерматологічні | ||||||
| Атрофія шкіри | НД | – | НД | к (QoL) | Ні | к |
| Акне, гірсутизм, алопеція, синець |
Ні | м,к | – | к (QoL) | Так | к |
| М’язово-скелетні | ||||||
| Остеопороз (МЩКТ) | Можливо | с,к | – | с | Так | к,п |
| Остеонекроз | НД | – | Так | к (QoL) | Ні | к |
| Міопатія | НД | – | Так | к (QoL) | Ні | к |
| Офтальмологічні | ||||||
| Катаракта | Ні | м,к | – | к (QoL) | Так | к |
| Глаукома | Так | м,к | – | с | Так | к,п |
*Дані про те, що терапія ГК у високих дозах може підвищувати ризик. у табл. 1 і 2: МЩКТ — мінеральна щільність кісткової тканини, ССЗ — серцево-судинні захворювання.
Стовпці «підвищеного ризику» описують ризик виникнення для всіх НЯ. Переважно використані дані РКД. Якщо цього не вистачало, були також включені дані з проспективного дослідження когорти. «Кінцева точка не визначена» означає, що є проблеми з визначенням НЯ. У разі з «невеликим числом досліджень (або обмежена кількість включених пацієнтів), що повідомляють про НЯ, зробити остаточні висновки неможливо. «Суперечливі дані» означає, що в різних дослідженнях отримано протилежні результати щодо виникнення НЯ. Актуальність НЯ розділено на три різні рівні. Біомаркери характеризують об’єктивне вимірювання та оцінки як показники нормальних біологічних процесів, патогенних процесів або фармакологічні відповіді на терапевтичне втручання.
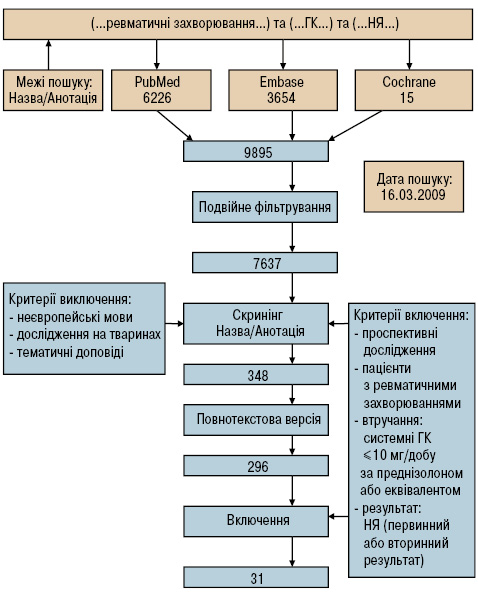
Рисунок. Схема стратегії пошуку.
Пошук літератури проводили з використанням баз даних PubMed, EMBASE і Cochrane Library. Після подвійної фільтрації, відбору всіх назв та рефератів відповідно до критеріїв включення і по прочитанні повних версій текстів, 31 стаття була включена. Відповідні дані записані з цих статей
Сурогатною кінцевою точкою є біомаркер, призначений для заміни клінічного результата, тобто біомаркер, що, як очікується, передбачає наявність або відсутність клінічних переваг чи шкоди. Кінцева точка є характерною чи змінною, яка відображає самопочуття, функції, виживаність.
Також є певні труднощі в інтерпретації наявних даних (див. табл. 1). Загалом ніяких певних висновків не може бути зроблено стосовно появи самих НЯ у зв’язку з тим, що переконливі докази часто відсутні. Більшість досліджень розроблено для оцінки ефективності лікування, а не для оцінки НЯ. Конкретні проблеми в інтерпретації даних були враховані. Недостатньо визначені НЯ утруднюють порівняння результатів. В умовах недостатньої кількості даних (невелика кількість досліджень, або обмежена кількість включених пацієнтів) формулювання остаточних висновків було неможливим. Більше того, часто отримували суперечливі дані, коли різні дослідження показали протилежні результати стосовно виникнення НЯ.
Рішення щодо моніторингу
Наявні дані обговорювалися в рамках Робочої групи, а також розглянуті відповідні методи моніторингу. Було вирішено розробити окремий обсяг рекомендацій для клінічних випробувань та повсякденної практики, в силу різних цілей моніторингу для обох направлень. Моніторинг НЯ для повсякденної практики спрямований на захист пацієнтів від реальних небезпек, яким можна запобігти або лікувати їх. Моніторинг НЯ має бути доступним і надійним, з можливістю інтерпретації моніторингових тестів. Тому моніторинг рекомендується для всіх НЯ, а не лише для клінічно значущих. Метою моніторингу в ході клінічних випробувань також є отримання наукового розуміння захворюваності, поширеності та клінічної значущості НЯ для створення справжнього профілю ГК-індукованих НЯ.
Для деяких НЯ циркадні ритми відіграють важливу роль. Моніторинг параметрів, таких як артеріальний тиск і глюкоза у крові, бажано виконувати в один і той самий час доби (наприклад вранці натще), щоб оптимізувати значення вимірювань і забезпечити зіставне порівняння між різними оцінками і пацієнтами.
Прийняття рішень з моніторингу НЯ більш докладно описане нижче. Остаточні рекомендації для моніторингу наведено у табл. 2.
| НЯ | Обстеження та можливі методи моніторингу | Мінімальна частота моніторингу | ||
|---|---|---|---|---|
| Клінічні дослідження | Щоденна практика (якщо відрізняється від клінічних досліджень) | Клінічні дослідження | Клінічна практика | |
| Серцево-судинні | ||||
| Дисліпідемія | Кров: ліпіди натще | – | На початку, в кінці | – |
| Електролітні порушення | Кров: натрій, калій | – | На початку, в кінці | – |
| Набряк | Фізикальне обстеження: набряк гомілок | – | На початку, в кінці | На початку |
| Гіпертензія | Вимірювання артеріального тиску | – | На початку, в кінці | Стандартне лікування |
| Ішемічні ССЗ/атеросклероз | 1.Опитування 2. Товщина комплексу інтима-медіа сонних артерій |
Опитування | 1. На початку, в кінці 2. На початку, в кінці** |
Стандартне лікування |
| Інфекційні | ||||
| Інфекції | Опитування: поява, лікування антибіотиками | – | На початку, протягом подальшого спостереження | – |
| Гастроінтестинальні | ||||
| Пептична виразка шлунка | 1. Опитування: скарги 2. Кров: Гемоглобін |
– | 1. На початку, в кінці 2. На початку, в кінці |
Стандартне лікування |
| Психологічні | ||||
| Порушення настрою | Опитування | – | На початку, в кінці | – |
| Психоз | Активного моніторингу не вказано; звіт про появу |
– | – | – |
| Ендокринні та метаболічні | ||||
| Цукровий діабет, порушення толерантності до глюкози | Кров: глюкоза, інсулін натще | Кров: глюкоза натще | На початку, в кінці | На початку, стандартне лікування |
| Маса тіла і жировий перерозподіл | 1. Зріст 2. Маса тіла 3. Окружність талії |
1. Зріст 2. Маса тіла |
1. На початку, в кінці 2. На початку, протягом подальшого спостереження 3. На початку, в кінці |
Стандартне лікування |
| Втручання в секрецію гормонів | 1. Опитування: менструальний цикл, втрата лібідо 2. Кров: АКТГ-стимулюючий тест |
– | 1. На початку, в кінці 2. На початку, через 48 год після зупинки дослідження |
– |
| Дерматологічні | ||||
| Атрофія шкіри | 1. Опитування 2. УЗД товщини шкіри (долонній ділянці руки) |
– | 1. На початку, в кінці 2. На початку, в кінці** |
– |
| Акне, гірсутизм, алопеція, синець | Опитування | – | На початку, в кінці | – |
| Гірсутизм | Опитування | – | На початку, в кінці | – |
| М’язово-скелетні | ||||
| Остеопороз (МЩКТ) | 1. Двоенергетична рентгенівська абсорбціометрія 2. Рентгенографія хребта (за можливістю) 3. Опитування щодо переломів |
– | 1. На початку, в кінці** (для тих, хто повторно почав терапію ГК протягом 6 міс) 2. На початку, в кінці 3. На початку, в кінці |
Стандартне лікування згідно з локальними настановами |
| Остеонекроз | Активного моніторингу не зазначено; знімки за наявністю скарг | – | – | – |
| Міопатії | Опитування | – | На початку, в кінці | – |
| Офтальмологічні | ||||
| Катаракта | Офтальмологічне обстеження | – | На початку, в кінці** | – |
| Глаукома | Офтальмологічне обстеження з тонометрією | Опитування щодо факторів ризику: спадковість, висока міопія, діабет | На початку, в кінці** | На початку (офтальмологічне обстеження за наявності факторів ризику) |
*Це кращий метод моніторингу, але, ймовірно, менш можливий. Ми просимо включити хоча б один із цих елементів у майбутні дослідження.
**Моніторинг лише для досліджень тривалістю не менше 1 року. АКТГ — адренокортикотропний гормон; HOMA — модель оцінки гомеостазу.
Для всіх НЯ описані можливі методи контролю із кращим інтервалом моніторингу. Це мінімальні рекомендації, але вони можуть бути розширені для пацієнтів із додатковими факторами ризику для певних НЯ. У більшості випадків контроль рекомендується на початку і в кінці дослідження. У разі дострокового виведення пацієнта з дослідження рекомендовано проведення заключного моніторингу.
Моніторинг у повсякденній практиці та клінічних випробуваннях
Цукровий діабет як приклад
Результати РКД щодо даних про розвиток цукрового діабету та підвищення рівня глюкози в крові під час терапії ГК суперечать один одному. Розвиток діабету після початку терапії ГК у низьких дозах виявляється рідко. Але прогресування діабету на фоні вже наявних порушень толерантності до глюкози можливе. У повсякденній практиці моніторинг має бути виконаний на початку терапії та протягом усього періоду спостереження відповідно до стандартів медичної допомоги пацієнтам.
У рекомендаціях ВООЗ зазначено, що діабет може бути діагностований за визначенням рівня глюкози крові натще або за результатами проведення орального глюкозотолерантного тесту [47]. Скринінг на рівень глюкози в сечі не є чутливим і тому не рекомендується. Тому ми рекомендуємо визначення глюкози та інсуліну в крові принаймні на початку і в кінці клінічних досліджень. За допомогою цих параметрів і оцінки гомеостазу (Homeostasis Model Assessment (HOMA)) може бути передбачений стан β-клітин і чутливості до інсуліну [48]. У разі явного цукрового діабету пацієнтів необхідно проінструктувати до початку лікування, для досягнення необхідного контролю за рівнем глюкози у крові після початку ГК-терапії.
Моніторинг лише
у клінічних дослідженнях
Гіпертензія та атрофія шкіри як приклад
Гіпертензія
Згідно з джерелами літератури немає даних про підвищений ризик гіпертензії у хворих, які отримують лікування ГК у низьких дозах. Скринінг гіпертензії є частиною стандартного догляду за пацієнтами у повсякденній практиці. Не існує певних ознак для додаткового моніторингу артеріального тиску у зв’язку з лікуванням ГК. У клінічних випробуваннях вимірювання артеріального тиску є частиною GCP (Good Clinical Practice — належної клінічної практики). Ми рекомендуємо проводити вимірювання артеріального тиску принаймні на початку і в кінці дослідження і повідомити про результати в майбутніх публікаціях. Звіти мають бути не лише на рівні груп (середні значення для груп лікування), але й на рівні пацієнтів (кількість пацієнтів з артеріальною гіпертензією відповідно до міжнародних визначень [49, 50]). Це дасть уявлення про клінічну значущість можливого підвищення артеріального тиску і покаже, що збільшення середнього значення у групі залежить від багатьох незначних підвищень артеріального тиску чи від деяких тяжких випадків артеріальної гіпертензії.
Атрофія шкіри
У літературі відсутні повідомлення про появу атрофії шкіри під час застосування ГК у низьких дозах. Незважаючи на відсутність даних літератури, вважається, що атрофія шкіри у вигляді НЯ виявляється порівняно часто, але її нелегко зареєструвати. У зв’язку з тим, що атрофія шкіри не піддається профілактиці та лікуванню, не рекомендується моніторинг цього НЯ в повсякденній практиці.
Тим не менш, реєстрація цього НЯ була б корисною для створення інформації про частоту його виникнення. Пацієнти можуть бути оглянуті стосовно наявності атрофії шкіри на початку і в кінці дослідження. Це дасть суб’єктивні результати. У дослідженнях із застосуванням ГК використано УЗД для вивчення загальної товщини шкіри об’єктивно, наприклад на долонній поверхні кисті [51, 52]. Ми рішуче підтримуємо ідею вимірювання товщини шкіри принаймні в одному дослідженні (із тривалістю не менше 1 року), щоб отримати точне уявлення про виникнення атрофії шкіри з пероральною терапією ГК у низьких дозах.
Обговорення
Після 60 років застосування ГК у клінічній практиці немає ніякої впевненості про фактичну захворюваність
і виникнення НЯ. Таким чином, Робочою групою EULAR щодо ГК викладено сформульовані рекомендації для моніторингу ГК-індукованих НЯ, що засновані на доповідях у літературі.
Уся література про ГК висвітлює можливі проблеми, пов’язані з наявністю різноманітних комбінацій НЯ. По-перше, можна припустити наявність цих комбінацій внаслідок прийому ГК за показаннями, що наявні в усіх дослідженнях, у тому числі групових, за даними літератури. Однак процес рандомізації запобігає цій проблемі й тому дані РКД були більш пріоритетними, аніж дані нерандомізованих досліджень у цьому проекті. Основне захворювання також має вплив на звітність НЯ. Наприклад, психологічні симптоми, пов’язані з ГК-терапією, притаманні також таким захворюванням, як системний червоний вовчак [53, 54]. Також остеопороз, пов’язаний із ГК, але характерний і для активного РА та системного червоного вовчака. По-третє, супутні захворювання можуть бути важливим фактором. Тривалий перебіг РА супроводжується більшою кількістю можливих супутніх захворювань. У свою чергу, наявність супутніх захворювань може приводити до поліпрагмазії, що може призвести до неможливості якісного контроля за ефективністю лікування, а також збільшити ризик виникнення НЯ [55]. Токсична дія інших препаратів також може бути помилково віднесена до ГК, що може утруднювати правильну інтерпретацію даних. Взаємодія лікарських засобів (наприклад поєднання ГК і нестероїдних протизапальних препаратів) може збільшити виникнення НЯ, що спричиняє виразку шлунка.
Пошук літератури продемонстрував дозозалежний зв’язок між застосуванням ГК і виникненням певних НЯ і показав водночас, що сила доказів про появу багатьох НЯ у низьких дозах ГК-терапії є недостатньою [7, 9]. Для збільшення обсягу даних були включені дослідження із застосуванням ГК до 10 мг/добу за преднізолоном або еквівалентом. Однак включені дослідження переважно не призначені для оцінки НЯ та не були зосереджені на лікуванні НЯ після 1 або 2 років лікування, тому звітність про виникнення НЯ часто є обмеженою. Тим не менше, припускаючи, що більшість опублікованих клінічних випробувань проведені відповідно до GCP (Good Clinical Practice — належна клінічна практика), що диктують широкі заходи безпеки, ймовірно, контроль безпеки був набагато більшим, ніж ті, про які повідомлено в публікації. Тому наша перша спільна рекомендація — повідомляти про всі результати моніторингу НЯ.
Крім того, найчастіше звітність виявилася б на середньому рівні груп (глюкоза у крові, маса тіла, артеріальний тиск), яка дає обмежене розуміння клінічного значення і не дає уявлення про поширеність НЯ, тому реальна кількість пацієнтів із НЯ невідома. Таким чином, наша друга спільна рекомендація — повідомляти про НЯ залежно від кількості пацієнтів у групах. Нарешті, деякі НЯ важко оцінити. Що стосується психологічних і поведінкових НЯ, а також НЯ, пов’язаних із зовнішнім виглядом або ознаками синдрому Кушинга, то необхідно розробити нові критерії для їх оцінки (третя загальна рекомендація).
Рекомендації з моніторингу
Окремі рекомендації були сформульовані для щоденної практики і клінічних випробувань. Хоча виникнення НЯ залежить від дози ГК і тривалості терапії основного захворювання, етапи лікування та супутні захворювання також відіграють певну роль. Таким чином, повсякденна практика згідно з рекомендаціями не може замінити повного обстеження на наявність захворювань, які часто виникають у населення старшого віку (таких як діабет і гіперхолестеринемія), і зазвичай здійснюється лікарем загальної практики. Вимірювання, які повинні бути частиною якісної клінічної допомоги у всіх хворих ревматологічного профілю, були помічені як «стандартне лікування» (див. табл. 2).
Крім безпеки, моніторинг клінічних досліджень також має на меті отримання наукового розуміння захворюваності, поширеності та клінічної значущості НЯ для створення справжнього профілю ГК-індукованих НЯ. У майбутніх клінічних випробуваннях із ГК мають бути додатковий інтерес і обізнаність не лише щодо проведення цього моніторингу, але і щодо звітності результатів. Результати необхідно представити у стандартизованій формі, навіть якщо ніяких проблем або підвищеної кількості виникнення НЯ не спостерігалося. Це дозволить у майбутньому провести метааналіз щодо ГК-індукованих НЯ. У клінічних дослідженнях проведення моніторингу для більшості НЯ рекомендується, принаймні, на початку і наприкінці дослідження. Наведені рекомендації включають мінімальний спектр обстежень: конкретні аспекти окремих пацієнтів можуть служити підставою для більш високої частоти моніторингу та/чи більш повного обсягу елементів для моніторингу. При відносно малих зусиллях може бути створений великий обсяг даних про виникнення ГК-індукованих НЯ. У разі дострокового виключення пацієнта з дослідження, ми б порадили негайне проведення кінцевих вимірювань.
Ця робота показала, що не вистачає достатньо доказів про настання декількох серйозних небажаних явищ (СНЯ), таких як ішемічні ССЗ, недостатність надниркових залоз і атрофія шкіри. Хочемо наголосити на необхідності більшої доказової бази на ці СНЯ і, зокрема, хочемо стимулювати виявлення хоча б одного з цих трьох елементів у майбутніх клінічних дослідженнях із ГК тривалістю не менше 1 року. Вимірювання товщини інтима–медіа для розвитку атеросклерозу, виконання тестів стимуляції адренокортикотропного гормону після припинення ГК-терапії для виявлення надниркової недостатності та застосування УЗД для виявлення розвитку атрофії шкіри допоможе виявити виникнення і тяжкість цих НЯ.
Висновок
Враховуючи неповноту даних літератури, на основі погодженості, рекомендації з моніторингу ГК-індукованих НЯ створено окремо для повсякденної практики і клінічних досліджень. Для щоденної практики Робоча група рекомендує не використовувати розширений стандартний моніторинг для пацієнтів, які застосовують ГК-терапію у низьких дозах, за деякими винятками. Для клінічних досліджень рекомендації носять більш широкий характер, щоб створити всеосяжний і дійсний профіль ГК-індукованих НЯ.
Список використаної літератури
1. Hench P.S., Kendall E.C., Slocumb C.H. et al. (1950) Effects of cortisone acetate and pituitary ACTH on rheumatoid arthritis, rheumatic fever and certain other conditions. Arch. Intern. Med. (Chic.), 85: 545–666.
2. Hillier S.G. (2007) Diamonds are forever: the cortisone legacy. J. Endocrinol., 195: 1–6.
3. Stahn C., Löwenberg M., Hommes D.W. et al. (2007) Molecular mechanisms of glucocorticoid action and selective glucocorticoid receptor agonists. Mol. Cell. Endocrinol., 275: 71–78.
4. Kirwan J.R., Bijlsma J.W., Boers M. et al. (2007) Effects of glucocorticoids on radiological progression in rheumatoid arthritis. Cochrane Database Syst. Rev., CD006356.
5. Caldwell J.R., Furst D.E. (1991) The effi cacy and safety of low-dose corticosteroids for rheumatoid arthritis. Semin. Arthritis Rheum., 21: 1–11.
6. Saag K.G., Koehnke R., Caldwell J.R. et al. (1994) Low dose long-term corticosteroid therapy in rheumatoid arthritis: an analysis of serious adverse events. Am. J. Med., 96: 115–123.
7. Curtis J.R., Westfall A.O., Allison J. et al. (2006) Population-based assessment of adverse events associated with long-term glucocorticoid use. Arthritis Rheum., 55: 420–426.
8. McDonough A.K., Curtis J.R., Saag K.G. (2008) The epidemiology of glucocorticoid-associated adverse events. Curr. Opin Rheumatol., 20: 131–137.
9. Huscher D., Thiele K., Gromnica-Ihle E. et al. (2009) Dose-related patterns of glucocorticoidinduced side effects. Ann. Rheum. Dis., 68: 1119–1124.
10. Hoes J.N., Jacobs J.W., Verstappen S.M. et al. (2009) Adverse events of low- to mediumdose oral glucocorticoids in infl ammatory diseases: a meta-analysis. Ann. Rheum. Dis., 68: 1833–1838.
11. Buttgereit F., da Silva J.A., Boers M. et al. (2002) Standardised nomenclature for glucocorticoid dosages and glucocorticoid treatment regimens: current questions and tentative answers in rheumatology. Ann. Rheum. Dis., 61: 718–722.
12. Da Silva J.A., Jacobs J.W., Kirwan J.R. et al. (2006) Safety of low dose glucocorticoid treatment in rheumatoid arthritis: published evidence and prospective trial data. Ann. Rheum. Dis., 65: 285–293.
13. Hoes J.N., Jacobs J.W., Boers M. et al. (2007) EULAR evidence-based recommendations on the management of systemic glucocorticoid therapy in rheumatic diseases. Ann. Rheum. Dis., 66: 1560–1567.
14. van der Goes M.C., Jacobs J.W., Boers M. et al. (2009) Patients’ and rheumatologists’ perspectives on glucocorticoids: an exercise to improve the implementation of the European League Against Rheumatism (EULAR) recommendations on the management of systemic glucocorticoid therapy in rheumatic diseases. Ann. Rheum. Dis., Epub ahead of print.
15. Song I.H., Gold R., Straub R.H. et al. (2005) New glucocorticoids on the horizon: repress, don’t activate! J. Rheumatol., 32: 1199–1207.
16. Schäcke H., Schottelius A., Döcke W.D. et al. (2004)Dissociation of transactivation from transrepression by a selective glucocorticoid receptor agonist leads to separation of therapeutic effects from side effects. Proc. Natl. Acad. Sci USA, 101: 227–232.
17. Capell H.A., Madhok R., Hunter J.A. et al. (2004) Lack of radiological and clinical benefi t over two years of low dose prednisolone for rheumatoid arthritis: results of a randomised controlled trial. Ann. Rheum. Dis., 63: 797–803.
18. Boers M., Nurmohamed M.T., Doelman C.J. et al. (2003) Infl uence of glucocorticoids and disease activity on total and high density lipoprotein cholesterol in patients with rheumatoid arthritis. Ann. Rheum. Dis., 62: 842–845.
19. Loftus J., Allen R., Hesp R. et al. (1991) Randomized, double-blind trial of defl azacort versus prednisone in juvenile chronic (or rheumatoid) arthritis: a relatively bone-sparing effect of defl azacort. Pediatrics, 88: 428–436.
20. van Everdingen A.A., Jacobs J.W., Siewertsz Van Reesema D.R. et al. (2002) Low-dose prednisone therapy for patients with early active rheumatoid arthritis: clinical effi cacy, disease-modifying properties, and side effects: a randomized, double-blind, placebocontrolled clinical trial. Ann. Intern. Med., 136: 1–12.
21. Kirwan J.R., Hällgren R., Mielants H. et al. (2004) A randomised placebo controlled 12 week trial of budesonide and prednisolone in rheumatoid arthritis. Ann. Rheum. Dis., 63: 688–695.
22. Wassenberg S., Rau R., Steinfeld P. et al. (2005) Very low-dose prednisolone in early rheumatoid arthritis retards radiographic progression over two years: a multicenter, double-blind, placebo-controlled trial. Arthritis Rheum., 52: 3371–3380.
23. Kirwan J.R. (1995) The effect of glucocorticoids on joint destruction in rheumatoid arthritis. The Arthritis and Rheumatism Council Low-Dose Glucocorticoid Study Group. N. Engl. J. Med., 333: 142–146.
24. Boers M., Verhoeven A.C., Markusse H.M. et al. (1997) Randomised comparison of combined step-down prednisolone, methotrexate and sulphasalazine with sulphasalazine alone in early rheumatoid arthritis. Lancet, 350: 309–318.
25. Svensson B., Boonen A., Albertsson K. et al. (2005) Low-dose prednisolone in addition to the initial disease-modifying antirheumatic drug in patients with early active rheumatoid arthritis reduces joint destruction and increases the remission rate: a two-year randomized trial. Arthritis Rheum., 52: 3360–3370.
26. Sheldon P. (2003) Ileum-targeted steroid therapy in rheumatoid arthritis: doubleblind, placebo-controlled trial of controlled-release budesonide. Rheumatol. Int., 23: 154–158.
27. van Everdingen A.A., Siewertsz van Reesema D.R., Jacobs J.W. et al. (2004) The clinical effect of glucocorticoids in patients with rheumatoid arthritis may be masked by decreased use of additional therapies. Arthritis Rheum., 51: 233–238.
28. Kirwan J.R., Hickey S.H., Hällgren R. et al. (2006) The effect of therapeutic glucocorticoids on the adrenal response in a randomized controlled trial in patients with rheumatoid arthritis. Arthritis Rheum., 54: 1415–1421.
29. Haugeberg G., Strand A., Kvien T.K. et al. (2005) Reduced loss of hand bone density with prednisolone in early rheumatoid arthritis: results from a randomized placebocontrolled trial. Arch. Intern. Med., 165:1293–1297.
30. van Everdingen A.A., Siewertsz van Reesema D.R., Jacobs J.W. et al. (2003) Low-dose glucocorticoids in early rheumatoid arthritis: discordant effects on bone mineral density and fractures? Clin. Exp. Rheumatol., 21: 155–160.
31. Hansen M., Podenphant J., Florescu A. et al. (1999) A randomised trial of differentiated prednisolone treatment in active rheumatoid arthritis. Clinical benefi ts and skeletal side effects. Ann. Rheum. Dis., 58: 713–718.
32. Laan R.F., van Riel P.L., van de Putte L.B. et al. (1993) Low-dose prednisone induces rapid reversible axial bone loss in patients with rheumatoid arthritis. A randomized, controlled study. Ann. Intern. Med., 119: 963–968.
33. Jover J.A., Hernández-García C., Morado I.C. et al. (2001) Combined treatment of giant-cell arteritis with methotrexate and prednisone. a randomized, double-blind, placebocontrolled trial. Ann. Intern. Med., 134: 106–114.
34. Chau S.Y., Mok C.C. (2003) Factors predictive of corticosteroid psychosis in patients with systemic lupus erythematosus. Neurology, 61: 104–107.
35. Caporali R., Cimmino M.A., Ferraccioli G. et al. (2004) Systemic Vasculitis Study Group of the Italian Society for Rheumatology. Prednisone plus methotrexate for polymyalgia rheumatica: a randomized, double-blind, placebo-controlled trial. Ann. Intern. Med., 141: 493–500.
36. Hunder G.G., Sheps S.G., Allen G.L. et al. (1975) Daily and alternate-day corticosteroid regimens in treatment of giant cell arteritis: comparison in a prospective study. Ann. Intern. Med., 82: 613–618.
37. Nesher G., Sonnenblick M., Friedlander Y. (1994) Analysis of steroid related complications and mortality in temporal arteritis: a 15-year survey of 43 patients. J. Rheumatol., 21: 1283–1286.
38. Chevalet P., Barrier J.H., Pottier P. et al. (2000) A randomized, multicenter, controlled trial using intravenous pulses of methylprednisolone in the initial treatment of simple forms of giant cell arteritis: a one year followup study of 164 patients. J. Rheumatol., 27: 1484–1491.
39. Nagasawa K., Tada Y., Koarada S. et al. (2005) Very early development of steroid-associated osteonecrosis of femoral head in systemic lupus erythematosus: prospective study by MRI. Lupus, 14: 385–390.
40. Oinuma K., Harada Y., Nawata Y. et al. (2001) Osteonecrosis in patients with systemic lupus erythematosus develops very early after starting high dose corticosteroid treatment. Ann. Rheum. Dis., 60: 1145–1148.
41. Ono K., Tohjima T., Komazawa T. (1992) Risk factors of avascular necrosis of the femoral head in patients with systemic lupus erythematosus under high-dose corticosteroid therapy. Clin. Orthop. Relat. Res., 277: 89–97.
42. Zizic T.M., Marcoux C., Hungerford D.S. et al. (1985) Corticosteroid therapy associated with ischemic necrosis of bone in systemic lupus erythematosus. Am. J. Med., 79: 596–604.
43. Aranow C., Zelicof S., Leslie D. et al. (1997) Clinically occult avascular necrosis of the hip in systemic lupus erythematosus. J. Rheumatol., 24: 2318–2322.
44. Hollingworth P., de Vere Tyndall A., Ansell B.M. et al. (1982) Intensive immunosuppression versus prednisolone in the treatment of connective tissue diseases. Ann. Rheum. Dis., 41: 557–562.
45. Mazlumzadeh M., Hunder G.G., Easley K.A. et al. (2006) Treatment of giant cell arteritis using induction therapy with high-dose glucocorticoids: a double-blind, placebo-controlled, randomized prospective clinical trial. Arthritis Rheum., 54: 3310–3318.
46. Spiera R.F., Mitnick H.J., Kupersmith M. et al. (2001) A prospective, double-blind, randomized, placebo controlled trial of methotrexate in the treatment of giant cell arteritis (GCA). Clin. Exp. Rheumatol., 19: 495–501.
47. Report of a World Health Organization/International Diabetes Federation consultation (2006) Definition and diagnosis of diabetes mellitus and intermediate hyperglycaemia. WHO Press.
48. Haffner S.M., Kennedy E., Gonzalez C. et al. (1996) A prospective analysis of the HOMA model. The Mexico City Diabetes Study. Diabetes Care, 19: 1138–1141.
49. Chobanian A.V., Bakris G.L., Black H.R. et al. (2003) National Heart, Lung, and Blood Institute Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure; National High Blood Pressure Education Program Coordinating Committee. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure: the JNC 7 report. JAMA, 289: 2560–2572.
50. Whitworth J.A. (2003) World Health Organization, International Society of Hypertension Writing Group. 2003 World Health Organization (WHO)/International Society of Hypertension (ISH) statement on management of hypertension. J. Hypertens., 21: 1983–1992.
51. Cossmann M., Welzel J. (2006) Evaluation of the atrophogenic potential of different glucocorticoids using optical coherence tomography, 20-MHz ultrasound and profi lometry; a double-blind, placebo-controlled trial. Br. J. Dermatol., 155: 700–706.
52. Korting H.C., Unholzer A., Schäfer-Korting M. et al. (2002) Different skin thinning potential of equipotent medium-strength glucocorticoids. Skin Pharmacol. Appl. Skin Physiol., 15: 85–91.
53. Denburg S.D., Carbotte R.M., Denburg J.A. (1997) Psychological aspects of systemic lupus erythematosus: cognitive function, mood, and self-report. J. Rheumatol., 24: 998–1003.
54. Kozora E., Thompson L.L., West S.G. et al. (1996) Analysis of cognitive and psychological deficits in systemic lupus erythematosus patients without overt central nervous system disease. Arthritis Rheum., 39: 2035–2045.
55. Treharne G.J., Douglas K.M., Iwaszko J. et al. (2007) Polypharmacy among people with rheumatoid arthritis: the role of age, disease duration and comorbidity. Musculoskeletal Care, 5: 175–190.
Мониторинг нежелательных явлений на фоне терапии глюкокортикоидами в низких дозах: рекомендации EULAR для проведения клинических исследований и повседневной практики
Резюме. Цель. Разработка рекомендаций по мониторингу нежелательных явлений (НЯ) на фоне терапии глюкокортикоидами (ГК) в низких дозах (≤7,5 мг/сут по преднизолону или эквиваленту) в клинических исследованиях и повседневной практике.
Методы. Проведен поиск литературы, в частности статей, содержащих информацию о заболеваемости и мониторинге ГК-индуцированных НЯ. Кроме этого, авторы искали широко принятые руководства по мониторингу некоторых НЯ (в том числе руководство ВОЗ по скринингу диабета). Полученные данные обобщены и обсуждены среди членов (ревматологов и пациентов) Рабочей группы EULAR относительно того, какой объем НЯ должен быть оценен, каким образом и через какой интервал.
Результаты. Данных мониторинга оказалось мало, большинство статей направлены на терапевтическую эффективность ГК, а не на возникновение и мониторинг НЯ. Большинство рекомендаций базировались на основе консенсуса. Рекомендации для клинических исследований направлены на получение понимания заболеваемости, распространенности и клинической значимости НЯ для создания всеобъемлющего и действительного профиля ГК-индуцированных НЯ. Следовательно, объем НЯ для мониторинга более широкий и часто состоит из оценки в начале и в конце исследования. Рекомендации для повседневной практики предназначены для защиты пациентов от реальных опасностей, которые можно предотвратить или лечить. Нет необходимости в расширении стандартного мониторинга для пациентов, применяющих ГК в низких дозах, за исключением остеопороза (согласно национальным руководствам), а также базовых оценок отека голеней, глюкозы крови натощак и факторов риска возникновения глаукомы.
Вывод. Учитывая неполноту данных литературы, рекомендации по мониторингу ГК-индуцированных НЯ были созданы отдельно, на основе консенсуса, для повседневной практики и клинических испытаний.
ревматические болезни, глюкокортикоиды, нежелательные явления.

Leave a comment