Нові можливості в діагностиці та лікуванні раннього ревматоїдного артриту
Ребров Б.О., Касинець С.С., Комарова О.Б.
Резюме. У пацієнтів із раннім ревматоїдним артритом ультразвукове дослідження суглобів допомогає визначати рівень активності захворювання та є перспективним неінвазивним методом моніторингу. Додавання до стандартної терапії раміприлу зумовлює покращання ультразвукової картини.
Вступ
Ревматоїдний артрит (РА) — найбільш розповсюджене запальне аутоімунне захворювання, яке вже протягом перших років призводить до втрати працездатності та інвалідності (Коваленко В.М., Шуба Н.М. (ред.), 2004). Серед пацієнтів, які отримують лікування базисними препаратами, 16% втрачають працездатність через 5 років, 90% — через 20 років (Шуба Н.М., 2003). Активна терапія медикаментозними методами в перші роки захворювання знижує інвалідність на 50% (Коваленко В.М., Шуба Н.М., 2004). Саме дебют хвороби є вирішальним у розвитку і прогресуванні патологічного процесу, у зв’язку з цим в останні роки в ревматології розвивається концепція діагностики та інтенсивного лікування раннього РА (рРА) (Emery Р. et al., 2008).
Поява сучасних методів інструментального обстеження, а саме ультразвукового дослідження (УЗД) суглобів, надала змогу встановлювати діагноз РА на ранніх стадіях (Коваленко В.М. та співавт., 2008). УЗД суглобів є зручним та доступним засобом діагностики рРА та ангіогенезу в панусі як предиктора кісткових ерозій. Але на ранній стадії розвитку деструктивних процесів у суглобах хворих на РА можна виявити лише панус, а одним з основних механізмів, що призводить до суглобової деструкції, є гіперваскуляризація та ангіогенез у панусі (Борткевич О.П. та співавт., 2003; Шуба Н.М., 2003; Коваленко В.М. та співавт., 2010), які є попередниками ушкоджень хряща і кістки при прогресуванні захворювання. Це надає оцінці васкуляризації пануса важливого значення для прогнозу прогресування РА, а найбільш прийнятним методом візуалізації служить УЗД суглобів (Коваленко В.М.та співавт., 2006; Назаренко Г.И. и соавт., 2007).
У дебюті РА головну роль у пошкодженні суглобових тканин відіграють активовані Т-клітини і макрофаги, що виробляють прозапальні цитокіни (ПЦ) (Яременко О.Б., 2004). В той же час ПЦ займають провідне місце в активації ренін-ангіотензин-альдостеронової системи, центральне місце в якій відведене ангіотензину II (AнII) (Соловьев А.Г. и соавт., 2006). Поряд із відомими гемодинамічними властивостями AнII виявляє прозапальні та ремоделюючі ефекти шляхом активації АнII рецепторів типу-1, які призводять до стимуляції ядерного фактора транскрипції каппа-β, основного стимулятора вироблення ПЦ і молекул адгезії (Шуба Н.М., 2003; Nigel J. Dagenais, 2005). Одним із наважливіших впливів АнII на ріст клітин у пацієнтів з РА є його вплив на ангіогенез. Формування нових кровоносних судин розвивається у відповідь на запалення, травму чи гіпоксію (Каратеєв Д.Е., 2003). Так, підвищення рівня АнII у синовіальній рідині призводить до стійкої синовіальної гіпоксії, яка, в свою чергу, може індукувати формування нових кровоносних судин, що вважається важливим компонентом підтримування запалення в суглобі та формування панусу (Kiefer F.N., 2003; Ichiki T., 2004). Таким чином, можна припустити, що при рРА АнII посилює ангіогенез у панусі, призводячи до прискореного прогресування хвороби. Саме тому розробка нових комплексних підходів до лікування хворих на рРА є актуальною проблемою у клініці внутрішніх хвороб.
Мета роботи — вивчити Уз-показники змін суглобів у хворих на рРА та оцінити ефективність застосування інгібіторів ангіотензинперетворювального ферменту в комплексному лікуванні хворих на рРА.
Об’єкт і методи дослідження
В умовах ревматологічного відділення Луганської обласної клінічної лікарні обстежено 62 пацієнти на рРА, який було встановлено відповідно до критеріїв АСR/EULAR, 2010. Усім обстеженим було проведено УЗД суглобів кистей та періартикулярних структур м’яких тканин, у тому числі сухожиль кистей при первинному огляді та через 12 міс на фоні проведеного лікування.
Вік пацієнтів у середньому становив 42,96 року (від 22 до 59 років), 88,7% обстежених — жінки, середня тривалість захворювання (медіана) на момент первинного дослідження становила 15,5 міс. Детальну характеристику хворих, включених у дослідження, наведено в табл. 1.
| Показник | Хворі на рРА (n=62) |
|---|---|
| Вік пацієнтів, років (М±σ) | 42,96±9,77 |
| Тривалість РА, міс, Ме (LQ; UQ) | 15,5 (10–24) |
| Кількість чоловіків/жінок, n (%) | 7 (11,3)/55 (88,7) |
| Активність рРА I/II/III, n (%) | 21 (33,9)/32 (51,6)/9 (14,5) |
| Рентгенологічна стадія 0/I/II/III, n (%) | 18 (29)/38 (61,3)/6 (9,7)/0 (0) |
| Розподіл рРА за РФ—/РФ+, n (%) | 24 (38,7)/38 (61,3) |
| Розподіл рРА за анти-ЦЦП—/ анти-ЦЦП+, n (%) |
22 (35,5)/40 (64,5) |
| Функціональна недостатність суглобів I/II/III, n (%) | 9 (14,5)/34 (54,8)/19((30,7) |
Тут і далі: РФ — ревматоїдний фактор; анти-ЦЦП — антитіла до циклічного цитрулінованого пептиду.
Пацієнтів методом випадкової вибірки розподілили на дві групи. До 1-ї групи увійшли 30 хворих, які впродовж 12 міс спостереження отримували стандартне лікування РА згідно з програмою лікування ревматичних хвороб (Наказ МОЗ України від 12.10.2006 р. № 676), яке включало — метотрексат в дозі 10–15 мг/тиж або лефлуномід 10–20 мг/добу, нестероїдні протизапальні препарати та за необхідності глюкортикоїди; до 2-ї групи — 32 хворих, які протягом 12 міс одержували комплексне лікування, що включало стандартну терапію і 2,5–5 мг раміприлу на добу. Цільова доза раміприлу (5 мг/добу) була вибрана відповідно до максимальної дози, дозволеної особам із високим нормальним артеріальним тиском (АТ), яка базується перш за все на результатах дослідження PHARAO (Luders S. et al., 2008).
Методика УЗД суглобів, розроблена робочою групою Асоціації ревматологів України та затверджена МОЗ України у 2009 р. (Коваленко В.М. та співавт., 2010), включала оцінку кісткових суглобових поверхонь (включаючи зміни поверхні субхондральної кістки — наявність кіст, ерозій, інших дефектів), наявність випоту, УЗД суглобової щілини, синовіальної оболонки (СО) та навколосуглобових структур у режимі сірої шкали та при використанні енергетичного допплерівського дослідження. УЗД суглобів проводили за допомогою УЗ-апарата «ESAOTE MyLAB40» (Нідерланди) з лінійним датчиком довжиною 7 см та робочою частотою 7,5 Mгц в умовах діагностичного стаціонару Луганської обласної клінічної лікарні.
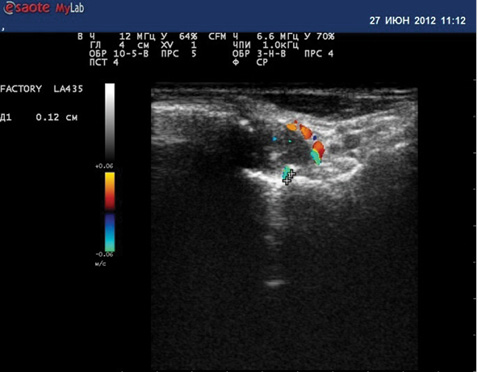
УЗД суглобів кистей виконували в режимі «ortho» при стандартних — поздовжньому і поперечному — позиціонуваннях датчика з дорзального боку кистей, причому суглоби знаходилися в положенні 20˚ долонного згинання для оцінки суглобової щілини і стану хряща. Проводили дослідження променезап’ясткового суглоба по ліктьовій і променевій поверхнях, усіх плеснофалангових і міжфалангових суглобів із тильної, долонної та бічної поверхонь. Оцінку пануса і васкуляризації проводили за методикою, запропонованою M. Hau та співавторами (1999), що включає 3-бальну шкалу (0 — відсутність візуалізації пануса/кольорових сигналів на отриманому зображенні в аналізованій ділянці; 1 — незначна візуалізація пануса і/або одиничні кольорові сигнали; 2 — помірна візуалізація пануса чи помірна кількість кольорових сигналів; 3 — максимальна візуалізація пануса і/або висока щільність кольорових сигналів, що зливаються на отриманому зображенні).
Статистичний аналіз отриманих результатів проводили в системі Statistica, версії 8.0 (StatSoft., USA). Нормальний розподіл підтверджували за допомогою тесту Шапіро — Вілка. За відсутності нормального розподілу ознаки, величини представлялись як медіана (Ме), нижні та верхні квартилі (LQ; UQ). Для визначення достовірності відмінностей за наявності великого розкиду даних використовували тест Мана — Уїтні (Z), W-критерій Вілкоксона. Достовірними вважали результати при рівні значущості р<0,05.
Результати та їх обговорення
Первинне УЗД суглобів кистей проведено на момент верифікації діагнозу рРА та до початку лікування пацієнтів, повторне — через 12 міс після проведеного стандартного та комплексного лікування.
Динаміку УЗ-змін суглобів кистей хворих на рРА на фоні стандартного та комплексного лікування відображено в табл. 2.
|
УЗ-зміни |
1-ша група (n=30) |
2-га група (n=32) |
||
| до лікування | після лікування | до лікування | після лікування | |
Зміни суглобової щілини, n (%)
|
30 (100)2 (6,6)28 (93,4) | 24 (80)*2 (6,6)22 (73,4)* | 32 (100)1 (3,1)31 (96,9) | 18 (56,2)#1 (3,1)17 (53,1)# |
| Випіт у порожнині суглобів, n (%) | 30 (100,0) | 22 (73,3)* | 32 (100) | 17 (53,1)# |
Зміни в СО, n (%):
|
29 (96,6)29 (96,6)24 (80) | 26 (86,6)26 (86,6)22 (73,3) | 30 (93,7)30 (93,7)25 (78,1) | 25 (78,1)25 (78,1)18 (56,2 ) |
| Оцінка гіперваскуляризації СО за шкалою M. Hau та співавторів (1999), n (%):0 балів:1 бал:2 бали:3 бали: | 6 (20)9 (30)10 (33,3)5 (16,7) | 8 (26,6)12 (40)7 (23,4)3 (10) | 7 (21,9)5 (15,6)12 (37,5)8 (25) | 14 (43,7)12 (37,5)*4 (12,5)*2 (6,3)* |
| Кістково-хрящові ерозії, n (%) | 17 (56,6) | 19 (63,3) | 19 (59,4) | 19 (59,4) |
| Наявність пануса, n (%) | 5 (16,6) | 5 (16,6) | 7 (21,8) | 7 (21,8) |
| Тендосиновіт, n (%) | 27 (90) | 20 (66,6)* | 30 (93,7) | 13 (40,6)# |
| Кістково-хрящові ерозії, n (%) | 17 (56,6) | 19 (63,3) | 19 (59,4) | 19 (59,4) |
| Наявність пануса, n (%) | 5 (16,6) | 5 (16,6) | 7 (21,8) | 7 (21,8) |
| Тендосиновіт, n (%) | 27 (90) | 20 (66,6) | *30 (93,7) | 13 (40,6) |
*Відмінності між УЗ-показниками до і після лікування у групах статистично вірогідні (р<0,05); відмінності УЗ-показників у групах до і після лікування високо вірогідні (p<0,001).
Як видно з табл. 2, при аналізі даних сонографічного дослідження пацієнтів, які перебували під наглядом впродовж 12 міс, в обох групах спостерігалася позитивна динаміка відносно випоту у порожнині суглобів, наявності вогнищ гіперваскуляризації СО і тендосиновіту.
Як свідчать дані, представлені на рис. 1, у 1-й групі після лікування спостерігалося вірогідне зменшення кількості пацієнтів із розширенням суглобової щілини (χ=4,32; p=0,03) за рахунок зменшення випоту в порожнині суглобів (χ=9,23; p=0,002). Стандартне лікування привело до вірогідного зменшення кількості тендосиновіту (χ=4,81; p=0,02). Однак у 2 (6,7%) хворих з’явилися нові кістково-хрящові ерозії, не зафіксовані до початку лікування. При оцінці гіперваскуляризації СО достовірних відмінностей не виявлено. Серед хворих 1-ї групи на тлі проведеного лікування спостерігалося збільшення кількості хворих з 0 балів (χ=0,37; р=0,54), яке відбувалося за рахунок зменшення кількості пацієнтів із 2 та 3 балами (χ=0,74; р=0,39; χ=0,58; р=0,44) та збільшення кількості хворих з 1 балом (χ=0,66; р=0,41). Ці дані відзеркалено на рис. 2.
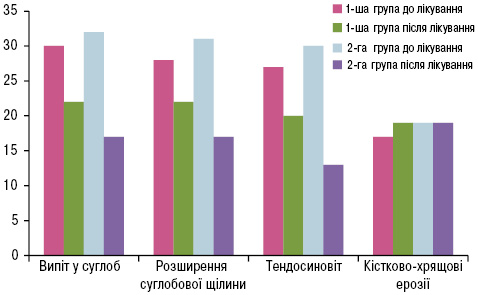
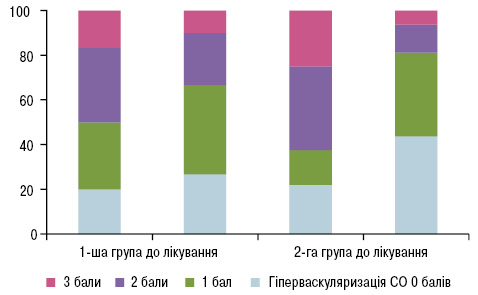
Комплексна терапія сприяла значному зменшенню кількості пацієнтів із розширенням суглобової щілини (χ=16,33; p<0,001) та випотом у порожнині суглобів (χ=19,59; p<0,001; рис. 3 і 4), вірогідно знизилися показники гіперваскуляризації СО 2-ї та 3-ї градації (відповідно χ=5,33; p=0,02 та χ=4,27; p=0,03) та збільшилась кількість 1-ї градації (χ=3,92; p=0,04). Ці дані наведено (див. рис. 1, 2, рис. 5, 6). Високовірогідно зменшилась кількість тендосиновіту (χ=20,48; p<0,001) порівняно зі стандартною терапією.
Кореляційні зв’язки васкуляризації СО та кістково-хрящових ерозії з показниками суглобових індексів та маркерів запального процесу наведені в табл. 3, вони не суперечать результатам численних досліджень (Walther M., 2001; Labanauskaite G., Sarauskas V., 2003).
Як видно з табл. 3, гіперваскуляризація СО мала прямі кореляційні зв’язки з рівнем анти-ЦЦП (R=0,34; р=0,006), з РФ (R=0,28; р=0,005), функціональною недостатністю суглобів (ФНС) (R=0,25; р=0,04), сіаловими кислотами (R=0,24; р=0,04) та АнII (R=0,51, р<0,001). Кореляцій із С-реактивним протеїном (СРП), ранковою скутістю, кількістю болючих та набряклих суглобів не спостерігалося (R=0,17; р=0,12; R=0,21; р=0,06; R=–0,10; р=0,4; R=–0,05; р=0,6 відповідно). Також простежувалися кореляції кістково-хрящових ерозій з рівнем анти-ЦЦП, РФ, СРП, ФНС та ранковою скутістю (R=0,36; р=0,003; R=0,24; р=0,05; R=0,29; р=0,01; R=0,28; р=0,02; R=0,25; р=0,04 відповідно). Кореляції кістково-хрящових ерозій із сіаловими кислотами, кількістю болючих та набряклих суглобів та АнII не набували значущості (R=0,11; р=0,36; R=0,12; р=0,32; R=–0,04; р=0,72; R=0,09; р=0,48).
| Показник | Васкуляризація СО | ерозії | ||
|---|---|---|---|---|
| R | p | R | p | |
| 1 | 0,34 | 0,006 | 0,36 | 0,003 |
| 2 | 0,28 | 0,005 | 0,24 | 0,05 |
| 3 | 0,17 | 0,12 | 0,29 | 0,01 |
| 4 | 0,25 | 0,04 | 0,28 | 0,02 |
| 5 | 0,24 | 0,04 | 0,11 | 0,36 |
| 6 | 0,21 | 0,06 | 0,25 | 0,04 |
| 7 | –0,10 | 0,4 | 0,12 | 0,32 |
| 8 | –0,05 | 0,6 | –0,04 | 0,72 |
| 9 | 0,51 | <0,001 | 0,09 | 0,48 |
У графі «Показник»: 1 — анти-ЦЦП; 2 — РФ, 3 — СРП; 4 — ФНС; 5 — сіалові кислоти; 6 — ранкова скутість; 7 — кількість болючих суглобів; 8 — кількість набряклих суглобів; 9 — АнII.
Висновки
1. Об’єм випоту в порожнині суглобів, інтенсивність гіперваскуляризації в СО, а також наявність тендосиновіту є УЗ-ознаками, які першими реагують при проведенні медикаментозного лікування та можуть служити моніторингом запального процесу у суглобах.
2. Ступінь васкуляризації СО за шкалою M. Hau та співавторів (1999) корелює з імуноферментними маркерами запалення, а саме анти-ЦЦП (r=0,34), РФ (0,28) та АнII (r=0,51).
3. Застосування комплексної терапії із застосуванням раміприлу зумовлює покращання УЗ-картини, а саме гіперваскуляризація СО знижується в 2 рази, тоді як при стандартній терапії — в 1,5 раза (р<0,001), випіт у порожнині суглобів зменшувався на 30% більше ніж при стандартному лікуванні, а тендосиновітів виявляється на 50% менше. Застосування комплексної терапії запобігало утворенню нових ерозій та прогресуванню деструкції суглобів, тоді як у 6,7% хворих, які не отримували раміприл, виявлено нові ерозії.
Таким чином, УЗД є інструментальним методом дослідження, який поряд з іншими, може визначати рівень активності захворювання на РА в ранній стадії його розвитку, а застосування інгібіторів ангіотензинперетворювального ферменту дозволяє знизити інтенсивність кровотоку в СО та запобігти прогресуванню РА.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- Борткевич О.П. Шуба Н.М., Мазуренко О.В. (2003) Оптимизация мониторинга течения ревматоидного артрита на основе ультразвукового исследования и магнитно-резонансной томографи. Укр. мед. часоп., 5(37): 61–64.
- Каратеев Д.Е. (2003) Ангиогенез при ревматоидном артрите. Вест. Рос. Акад. мед. наук, 7: 47–51.
- Коваленко В.М., Борткевич О.П., Білявська Ю.В. (2010) Сучасні аспекти діагностики ревматоїдного артриту. Здоров’я України, 1 (березень): 74–77.
- Коваленко В.М., Борткевич О.П., Терзов К.А. (2006) Ураження дрібних суглобів у хворих на ревматоїдний артрит на ранній стадії розвитку захворювання за даними ультразвукового дослідження. Проблеми остеології, 9: 55–56.
- Коваленко В.М., Шуба Н.М. (ред.) (2004) Номенклатура, класифікація, критерії діагностики та програми лікування ревматичних хвороб. Зовнішторгвидав України, Київ, 95–99.
- Коваленко В.М., Шуба Н.М., Борткевич О.П. та ін. (2008) Ультразвукове дослідження опорно-рухового апарату: Метод. рекомендації. Київ, 40.
- Назаренко Г.И., Героева И.Б., Хитрова А.Н. и др. (2007) Возможности ультразвукового исследования в оценке активности воспалительного процесса и эффективности лечения пациентов с ревматоидным артритом. Ультразвуковая и функциональная діагностика, 5: 83–91.
- Соловьев А.Г., Резников Л.Л., Назаров П.Г. и др. (2006) Провоспалительные цитокининдуцирующие свойства ангиотензина II и механизм антицитокиновых эффектов ингибитора ангиотензинпревращающего фермента каптоприла. Цитокины и воспаление, 5(3): 40–45.
- Шуба Н.М. (2003) Сучасні підходи до лікування ревматоїдного артриту. Здоров’я України, 80: 85–91.
- Яременко О.Б. (2004) Ранний ревматоидный артрит: диагностика и лечение. Мистецтво лікування, 3: 38–45.
- Emery P., Breedveld F.C., Hall S. et al. (2008) Comparison of methotrexate monotherapy with a combination of methotrexate and etanercept in active, early, moderate to severe rheumatoid arthritis (COMET): a randomised, double-blind, parallel treatment trial. Lancet, 372: 375–382.
- Nigel J. Dagenais (2005) Protective Effects of Angiotensin II Interruption: Angiotensin-Converting Enzyme Inhibitors and Angiotensin II Receptor Blockers. Pharmacotherapy, 25(9): 1213–1229.
- Kiefer F.N., Neysari S., Humar R. et al. (2003) Hypertension and angiogenesis. Curr. Pharm. Design, 9: 1733–1744.
- Ichiki T. (2004) Role of renin angiotensin system in angiogenesis: it is still elusive. Arterioscler Thromb. Vasc. Biol., 24: 622–624.
- Luders S., Schrader J., Berger J. et al. (2008) The PHARAO study: prevention of hypertension with the angiotensin-converting enzyme inhibitor ramipril in patients with high-normal blood pressure: a prospective, randomized, controlled prevention trial of the GermanHypertension League. Hypertens, 26: 1487–1496.
- Labanauskaite G., Sarauskas V. (2003) Correlation of power Doppler sonography with vascularity of the synovial tissue. Medicina (Kaunas), 39(5): 480–483.
- Walther M., Harms H., Krenn V. et al. (2001) Correlation of power Doppler sonography with vascularity of the synovial tissue of the knee joint in patients with osteoarthritis and rheumatoid arthritis. Arthritis Rheum., 44(2): 331–338.
НОВЫЕ ВОЗМОЖНОСТИ В ДИАГНОСТИКЕ И ЛЕЧЕНИИ РАННЕГО РЕВМАТОИДНОГО АРТРИТА
Резюме. У больных ранним ревматоидным артритом ультразвуковое исследование суставов помогает определять уровень активности заболевания и является перспективным неинвазивным методом мониторинга. Добавление к стандартной терапии рамиприла приводит к улучшению ультразвуковой картины.
Ключевые слова: ранний ревматоидный артрит, ультразвуковое исследование суставов, ангиотезин II, рамиприл.
Адреса для листування:
Ребров Борис Олексійович
ДЗ «Луганський державний медичний університет»
E-mail: fpdo@ukr.net

Leave a comment