Фармакотерапія при ревматоїдному артриті: сучасний погляд на проблему
Рудюк Л.І. 1, Харітонова О.М.2
- 1Науково-дослідний інститут проблем військової медицини Збройних Сил України, Ірпінь Київської області
- 2Головний військово-медичний клінічний ордена Червоної Зірки центр «Головний військовий клінічний госпіталь»
Резюме. Серед імунозапальних ревматичних захворювань ревматоїдний артрит — найпоширеніша хвороба. У статті наведено сучасні дані про принципи фармакотерапії у хворих на ревматоїдний артрит.
Поширеність імунозапальних захворювань у загальній популяції досягає 10%. Ревматичні хвороби серед них займають значну частку. Для сучасної медицини значення цієї категорії хвороб визначається їх поширеністю, складністю ранньої діагностики, швидким розвитком інвалідності та несприятливим прогнозом для життя. Серед імунозапальних ревматичних захворювань ревматоїдний артрит (РА) — найпоширеніша хвороба, частота якої в популяції досягає 1% [1]. Відсутність ефективної терапії через 10–15 років від початку захворювання приводить більшість хворих до повної інвалідизації та потреби у високовартісних хірургічних втручаннях (ендопротезування суглобів) [2], а економічні втрати для суспільства можна порівняти зі втратами від ішемічної хвороби серця та злоякісними новоутвореннями. Тривалість життя у хворих на РА залишається нижче популяційної, що патогенетично зумовлено неконтрольованим ревматоїдним запаленням [1].
На початку XXI ст. переглянуто патогенез РА. Відповідно до сучасної наукової концепції основу патогенезу РА становлять складні дефекти Т-клітинної імунорегуляції та В-клітинної толерантності, що в результаті приводять до переваги синтезу прозапальних цитокінів (фактора некрозу пухлин (ФНП)-α, інтерлейкінів (ІЛ)-6, -1, -17 та ін.) над протизапальними цитокінами (ІЛ-10 та ін.) [3].
На сьогодні важливу увагу науковці приділяють вивченню ІЛ-6 — плейотропного цитокіну, який має широкий спектр прозапальних біологічних ефектів [4, 5]. Доведено значення ІЛ-6 у розвитку РА порівняно з іншими прозапальними цитокінами (таблиця).
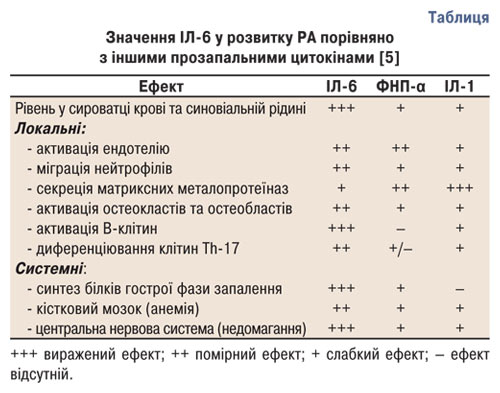
Одним із найхарактерніших системних прозапальних ефектів ІЛ-6 є індукція гострофазової відповіді, яка асоціюється зі збільшенням експресії гена ІЛ-6 в печінці та проявляється в підвищенні концентрації білків гострої фази запалення (С-реактивного білка, амілоїдного білка А та ін.) та гіпоальбумінемією. Іншим проявом системної дії ІЛ-6 є розвиток лихоманки та анемії. ІЛ-6 індукує синтез гепсидину — пептиду, який регулює синтез заліза в печінці. Гепсидин зв’язується із транспортною молекулою феропортином та інгібує секрецію заліза макрофагами й абсорбцію заліза в кишечнику. Гіперпродукція ІЛ-6 індукує гіпоферемію, яка веде до анемії хронічного запалення. Також ІЛ-6 стимулює синтез лаптину — гормону, який бере участь у розвитку анорексії, характерної для РА. Індукуючи диференціювання В-клітин та синтез аутоантитіл, зокрема ревматоїдних факторів і антитіл до цитрулінованих білків, ІЛ-6 відіграє важливу роль в аутоімунітеті, який є фундаментальним компонентом патогенезу РА [4, 6]. ІЛ-6 викликає активацію ендотеліальних клітин, синтез ІЛ-8, експресію молекул адгезії, що стимулює накопичення лейкоцитів у порожнині суглоба. Комплекс ІЛ-6 — ІЛ-6Р стимулює проліферацію синовіоцитів та диференціювання остеобластів, а сам ІЛ-6 індукує експресію фактора росту судинного ендотелію, який відіграє важливу роль у неоваскуляризації гіперплазованої синовіальної оболонки при РА. У синергізмі з ІЛ-1 посилює секрецію матриксних металопротеїназ. Все це призводить до утворення панусу та кісткової деструкції [6].
У сучасній науковій літературі як один із ключових етапів імунопатогенезу РА розглядається експансія особливої субпопуляції Т-лімфоцитів, так званих клітин Тh-17, які синтезують ІЛ-17. Вважають, що саме ІЛ-17 є вагомим медіатором запалення та деструкції суглобів при РА. А ІЛ-6 у комбінації з іншими цитокінами (ІЛ-1β, -23, трансформуючий фактор росту) сприяють диференціюванню наївних Т-клітин у клітини Тh-17. Це є одним із основних аспектів імунопатологічної дії ІЛ-6.
Патогенетичні стадії розвитку РА визначають клінічний розвиток хвороби, для якої спочатку характерний безсимптомний перебіг або прояви у вигляді артралгії, потім у вигляді раннього артриту чи недиференційованого артриту. В подальшому відбувається трансформування у класичний РА (швидкопрогресуючий або повільнопрогресуючий) чи дуже рідко завершується спонтанною ремісією [6]. Доведено, що застосування сучасних базисних протизапальних препаратів (БПЗП) на ранніх стадіях захворювання в сукупності з ретельним моніторингом їх ефективності дозволяє суттєво зменшити прогресування деструкції суглобів, а також покращити прогноз хвороби [1, 3, 6].
Згідно з сучасною концепцією «Лікування ревматоїдного артриту до досягнення цілі — Treat To Target» (сформульованою Європейською антиревматичною лігою — European League Against Rheumatism (EULAR)), ціллю фармакотерапії РА є досягнення ремісії, яка може бути зумовлена призначенням максимально активної базисної терапії в перші місяці формування суглобового синдрому [7, 8]. Концепція базується на суровому (tight) контролі ефективності терапії з використанням стандартизованих показників динаміки активності захворювання. Прогноз при РА у багатьох випадках залежить від можливості ранньої діагностики, яка дозволяє проводити активну протизапальну терапію в дебюті хвороби (так зване вікно можливості) на стадії раннього РА. Тому це привело до розробки EULAR нових класифікаційних критеріїв РА, які забезпечують ранню діагностику цієї хвороби [9].
Навіть за відсутності повної відповідності класифікаційним критеріям РА в дебюті захворювання призначають БПЗП. У ≈50% пацієнтів вони недостатньо ефективно контролюють клінічний прояв хвороби та прогресування деструктивного процесу в суглобах, часто викликають побічні реакції, обмежуючи можливість їх застосування в дозах, необхідних для досягнення стійкого клінічного ефекту. Частота формування ремісії не перевищує 25%. Неможливість досягнення позитивного ефекту базисної протизапальної терапії у всіх хворих на РА не лише ставить перед ревматологами питання про причини гетерогенності відповіді на цей сучасний і теоретично обґрунтований спосіб лікування, але спрямовує їх на пошук діагностичних біологічних маркерів, які б дозволили прогнозувати ефективність терапії до її призначення у кожного конкретного хворого. Відсутність чутливих і специфічних імунологічних та молекулярно-біологічних маркерів прогнозування перебігу РА створює бар’єр для реалізації концепції індивідуалізованої фармакотерапії цього захворювання [10]. Ключовим моментом індивідуалізації лікування при РА та покращання його результатів є оцінка активності захворювання на ранній стадії та подальший ретельний моніторинг.
Сьогодні суттєво змінилася тактика лікування пацієнтів із РА. Метотрексат застосовують для лікування РА вже понад 60 років. На початку 90-х років ХХ ст. метотрексат став активно витісняти інші БПЗП (препарати золота, амінохінолінові препарати), але перші переконливі докази його ефективності, отримані в результаті проведення подвійних сліпих плацебо-контрольованих досліджень, були опубліковані лише чверть століття тому. Управління з контролю за якістю харчових продуктів та фармпрепаратів (США) схвалило застосування цього лікарського засобу у хворих на РА. Після цього розпочалося його широке застосування і визнання провідним БПЗП. У наш час, незважаючи на появу генно-інженерних біологічних препаратів (ГІБП), метотрексат і надалі залишається золотим стандартом базисної терапії, препаратом першої лінії в лікуванні при РА. Згідно з рекомендаціями EULAR і Американського коледжу ревматологів (American College of Rheumatology — ACR) він застосовується як стартовий препарат у монотерапії чи в комбінації з іншими БПЗП. Звичайна стартова доза метотрексату становить 7,5 мг/тиж із поступовим підвищенням дози препарату. У дослідженнях S. Medley та співавтори довели безпеку стартової дози 25 мг/тиж метотрексату, а кількість побічних ефектів була зіставна з такою у тих, хто отримував препарат у низьких дозах (7,5 мг/тиж) [11]. Вважають, що саме застосування метотрексату у високих стартових дозах (25 мг/тиж) дозволяє досягти контролю над прогресуванням РА. Хоч відомо, що застосування препарату у високих ефективних дозах обмежено побоюванням лікарів щодо розвитку побічних реакцій, а також низькою комплаєнтністю пацієнтів.
Доведено ефективність метотрексату у досягненні ремісії хвороби у 15–40% пацієнтів із РА [12]. В оцінці ефективності препарату важливу роль відіграють гетерогенність перебігу хвороби та індивідуальні особливості переносимості препарату. Тому зараз все частішають рекомендації щодо призначення біологічних препаратів як препаратів першої лінії у хворих із раннім агресивним перебігом РА та високою активністю. У пацієнтів із менш активним перебігом РА чи з більш тривалим періодом хвороби біологічні препарати можуть розглядатися як препарати другої лінії у разі неадекватної відповіді на метотрексат [13].
У сучасній науковій літературі дискутується питання щодо застосування ГІБП як стартових препаратів. Тому виявлення хворих, які потребують призначення біологічних препаратів із самого початку захворювання чи монотерапії метотрексатом або комбінованої терапії, є основною проблемою у веденні пацієнтів із РА [14].
Завдяки появі ГІБП у фармакотерапії при РА досягнено значного прогресу. До них належать моноклональні антитіла проти прозапальних цитокінів або мембранних молекул лімфоцитів, а також рекомбінантні молекули [15]. Донедавна основним ГІБП були інгібітори прозапальних цитокінів ФНП. Проте досвід тривалого застосування цих препаратів у клінічній практиці свідчив, що ⅓ пацієнтів були рефрактерні до терапії, у <⅓ вдалося досягнути ремісії, а в деяких пацієнтів розвивалися побічні реакції, що призводило до припинення лікування. Це стало стимулом для розробки нових підходів до лікування при РА, пов’язаних із пригніченням активності інших прозапальних медіаторів запалення [16].
Впродовж останніх років увага науковців спрямована на вивчення ІЛ-6 як важливого об’єкта для антицитокінової терапії [4, 5]. Першим та єдиним на сьогодні препаратом, здатним пригнічувати залежні від ІЛ-6 запальні реакції і дозволений до застосування при РА, є тоцилізумаб (ТЦЗ). У дослідженнях з оцінки ефективності й безпеки ТЦЗ у монотерапії чи комбінованій терапії з іншими БПЗП, які повністю відповідали рекомендаціям про проведення випробувань нових протиревматичних препаратів [17], взяли участь близько 5000 пацієнтів із РА, що суттєво більше, ніж кількість пацієнтів, включених у дослідження інших БПЗП та ГІБП. У дослідженнях SAMURAI, SATORI та АМBITION встановлено, що монотерапія ТЦЗ суттєво ефективніша від монотерапії метотрексатом за критеріями АСR та динамікою індексу DAS28 [18]. Потенційними перевагами ТЦЗ перед іншими ГІБП є швидкий ефект (після першої інфузії), висока частота ремісії (основна мета фармакотерапії РА), яка вища (83,8%), ніж інших ГІБП, можливість застосування у вигляді монотерапії, низький ризик реактивації туберкульозної інфекції [19]. Все це визначає особливе місце ТЦЗ в терапії, а в подальшому, можливо, дозволить максимально індивідуалізувати лікування хворих на РА.
Ефективність ГІБП доведена в декількох масштабних рандомізованих дослідженнях, в яких безпосередньо порівнювали біологічні агенти. Саме такі дослідження мають цінність, оскільки висока вартість препаратів, різні шляхи введення, різні профілі безпеки, досить високий ризик потенційних ускладнень завжди викликають сумніви у клініцистів щодо правильності вибору біологічних препаратів. Знання про переваги того чи іншого препарату можуть сприяти швидкому прийняттю вірних рішень [20].
Неоднорідність РА утруднює, з одного боку, контроль захворювання, а з іншого — зумовлює гетерогенність відповіді БПЗП та біологічну терапію [21]. Якщо одному пацієнту для досягнення низької активності РА достатньо монотерапії одним БПЗП, то інший потребує комбінованої терапії з раннім включенням ГІБП. На сьогодні не визначений порядок і оптимальні терміни переходу на альтернативні БПЗП та біологічні препарати. У рекомендаціях АСR немає чіткості відносно переходу або призначення альтернативних БПЗП пацієнтам, які раніше отримували базисну терапію. Єдиним винятком є рекомендація щодо призначення біологічного препарату лише після неефективності небіологічної терапії. Однак не уточнено, скільки має бути таких невдалих спроб, щоб почати терапію біологічними препаратами [14].
Перед ревматологами постає питання вибору оптимальної стратегії лікування для кожного конкретного пацієнта, вибору препарату та часу переходу на новий етап терапії у разі, якщо відповідь на попереднє лікування неповна чи неадекватна. Тому нині основні зусилля спрямовані на індивідуалізацію лікування РА, що базується на особливостях клінічного перебігу РА і відповіді на терапію [20].
Таким чином, на сьогодні важливим питанням у ревматології залишається індивідуалізація лікування хворих на РА. Сучасний стан проблеми є серйозним стимулом для розробки нових підходів у фармакотерапії РА.
Список використаної літератури
1. Насонов Е.Л., Каратеев Д.Е., Балабанова Р.М. (2008) Ревматоидный артрит. В кн.: Насонов Е.Л., Насонова В.А. (ред.). Ревматология. Нац. руководство. Гэотар-Медиа, Москва, с. 290–331.
2. Pincus T., Callahan I. (1993) Whаt is the natural history of rheumatoid arthritis. Rheum. Dis. Clin. North Am., 4: 123.
3. Насонов Е.Л. (2005) Фармакотерапия ревматоидного артрита — взгляд в 21 век. Клин. мед., 6: 8–12.
4. Насонов Е.Л. (2008) Новые возможности фармакотерапии ревматических болезней — ингибирование интерлейкина-6. Клин. фармокол. и тер., 1: 60–67.
5. Dayer J.M., Choy E. (2009) Therapeutic targets in rheumatoid arthritis: the interleukin-6 receptor. Rheumatology (Oxford), 49(1): 15–24.
6. Насонов Е.Л. (2011) Перспективы лечения ревматических болезней в начале XXI века. Тер. архив., 5: 5–9.
7. Smolen J.S., Aletaha D., Bijsma J.W.J. et al. (2010) Treating rheumatoid arthritis to target: recommendations of an international task force. Ann. Rheum. Dis., 69: 631–637.
8. Smolen J.S., Landewe R., Breedveld F.C. et al. (2010) EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological diseas-modifying antirheumatic drugs. Rheum. Dis., 69: 964–974.
9. Aletaha D., Neogi T., Silman A.J. et al. (2010) Rheumatoid arthritis classification criteria. An American College of Rheumatology. Europen League against Rheumatism collaborative initiative. Arthr. Rheum., 62: 2569–2581.
10. Isaacs J.D., Ferraccioli G. (2011) The need for personalized medicine for rheumatoid arthritis. Ann. Rheum. Dis., 70(1): 4–7.
11. Medley S.E.J., Dolan A.L., Coakley G. (2009) How safe is starting high dose methotrexate? [abstract]. Ann. Rheum. Dis., 69(3): 591.
12. Breedveld F.C., Weisman M.H., Kavanaugh A.F. et al. (2006) The PREMIER study: a multicenter, randomized, double-blind clinical trial of combination therapy with adalimunad plus methotrexate versus methotrexate alone or adalimunad alone in patients with early, aggressive rheumatoid arthritis who have not had previous methotrexate treatment. Arthr. Rheum., 54: 26–37.
13. American College of Rheumatology (2008) American College of Rheumatology 2008 recommendations for the use of nonbiologic and biologic disease-modifying antirheumatic drugs in rheumatoid arthritis. Arthr. Rheum., 59: 762–784.
14. van Vollenhoven R.F. (2009) Treatment of rheumatoid arthritis: state of the art 2009. Nat. Rev. Rheumatol., 5: 531–541.
15. Furst D.E., Keystone E.C., Kirkham B. et al. (2008) Updated consensus statement on biological agents for the treatment of rheumatic diseases. Ann. Rheum. Dis., 67: 112–125.
16. Brennan F., McInnes I. (2008) Evidence that cytokines play a role in rheumatoid arthritis. J. Clin. Invest., 118: 3537—3545.
17. Aletaha D., Landewee R., Karonitsch T. et al. (2008) Reporting disease activity in clinical trials of patients with rheumatoid arthritis: EUEAR/ACR collaborative recommendations. Arthr. Care Res., 59: 1371–1377.
18. Насонов Е.Л. (2010) Новые подходы к фармакотерапии ревматоидного артрита: перспективы применения тоцилизумаба (моноклональные антитела к рецептору интерлейкина-6). Терапевт. арх., 5: 64–71.
19. Hirabayashi Y., Ishii T., Hangae H. (2009) Clinical efficacy of tocilizumab in patients with active rheumatoid arthritis in real clinical practice. Rheumatol. Int., 22 August, on line.
20. Коваленко В.Н., Головач И.Ю., Борткевич О.П. (2011) Индивидуализация лечения ревматоидного артрита: курс на достижение оптимальних результатов. Укр. ревматол. журн., 3 (45): 5–15.
21. Сигидин Я.А., Лукина Г.В. (2009) Биологическая терапия в ревматологии. 2-е изд., доп. Практическая медицина. Москва, 245 с.
Фармакотерапия при ревматоидном артрите: современный взгляд на проблему
Резюме. Среди иммуновоспалительных ревматических болезней ревматоидный артрит — наиболее распространенное заболевание. В статье приведены современные данные о принципах фармакотерапии у больных ревматоидным артритом.
ревматоидный артрит, базисные противовоспалительные препараты, биологическая терапия, ремиссия.
Адреса для листування:
Рудюк Людмила Іванівна
08200, Київська область, Ірпінь, 11-та лінія, 1
Науково-дослідний інститут проблем
військової медицини Збройних Сил України

Leave a comment