СИСТЕМНИЙ ЧЕРВОНИЙ ВОВЧАК І ЕКОЛОГІЯ
Синяченко О.В., Ливенцова Е.В., Фомичева К.С., Игнатенко Е.Г.
Резюме. Резюме. Поширення системного червоного вовчака тісно пов’язане з розвитком в регіонах хімічної промисловості та виробництва будівельних матеріалів, з рівнями в атмосфері діоксиду вуглецю та 3,4-бензпірену, із вмістом у ґрунті токсичних вісмуту і кобальту, а в ґрунтових водах — барію та нікелю. Формування в крові аутоантитіл залежить від концентрацій в атмосфері аміаку, фенолу, діоксидів азоту та вуглецю, а інтегральні значення несприятливої екологічної ситуації повітряного простору впливають на розвиток і тяжкість ураження шкіри, серця та нирок. Нітрати у питній воді впливають на рівень нітратемії, який прямо корелює з тяжкістю перебігу вісцериту. Показники мікроелементозу в довкіллі визначають летальність хворих і ступінь вираженості окремих клінічних ознак захворювання, впливаючи на вміст барію, літію та свинцю у волоссі та крові пацієнтів, з якими, у свою чергу, пов’язаний перебіг патологічного процесу.
Введение
В настоящее время начала изучаться негативная роль неблагоприятных факторов окружающей среды в учащении распространенности в таких регионах системной красной волчанки (СКВ) (Javierre B.M. et al., 2011; Costenbader K.H. et al., 2012; Kumar P., Imam B., 2012; Abdwani R. et al., 2013; Zou Y.F. et al., 2013). L. Korkina и соавторы (2010) вообще относят СКВ к экологически ассоциированным заболеваниям. Роль загрязняющих агентов окружающей среды (ксенобиотиков) в развитии СКВ даже стала рассматриваться в рамках отдельного научного направления — геоэпидемиологии (Shapira Y. et al., 2010; Toboіn G.J. et al., 2010; Vincent F.B. et al., 2013). Необходимо отметить, что F.M. Strickland и соавторы (2012) создали экспериментальную экологическую модель СКВ на животных.
Загазованность атмосферы является одним из ведущих факторов риска возникновения и последующего неблагоприятного течения СКВ (Scott D.L. et al., 2010; Hoovestol R.A., Mikuls T.R., 2011). Особое внимание уделяется постоянному вдыханию воздуха с высоким содержанием угарного газа, диоксидов, нитратов и органических соединений (Cooper G.S. et al., 2010; Farhat S.C. et al., 2011; Corsaro G.B. et al., 2012), прежде всего — полициклических ароматических углеводородов (Elie M.R. et al., 2012). Немаловажная значимость в распространении СКВ отводится плохому качеству питьевой воды в регионах (Zhang X. et al., 2012).
Цель данного исследования — определение влияния экологических факторов окружающей среды на распространенность и течение СКВ.
Объект и методы исследования
Проанализированы результаты обследования 194 больных СКВ в возрасте от 15 до 63 лет (в среднем — 35±0,8 года). Среди этих пациентов были 11% мужчин и 89% женщин. Длительность манифестации заболевания составила 9±0,5 года. Подострое течение СКВ констатировано в 22% наблюдений, хроническое — в 78%, минимальная степень активности болезни имела место у 18% больных, умеренная — у 34%, высокая — у 48%. Волчаночные клетки в периферической крови и антинуклеарный фактор (АНФ) соответственно выявлены в 78% случаев, антитела к нативной дезоксирибонуклеиновой кислоте (АДНК) — в 77%.
Поражение кожи (васкулитная бабочка, дискоидные очаги, эритематозный фотодерматит, синдром Роуэлла, анулярные очаги, пурпура, сетчатое ливедо) диагностировано в 70% наблюдений, алопеция — в 39%, антифосфолипидный синдром — в 27%, синдром Рейно — в 24%, асептический остеонекроз — в 6%, суставной синдром (артрит, артралгия, контрактуры) — в 80%, поражение слизистой оболочки (язвенный стоматит, хейлит) — в 22%, скелетных мышц (миозит, миалгии) — в 34%, лимфаденопатия — в 47%, поражение миокарда (миокардит, миокардиодистрофия, коронарит) — в 66%, эндокарда и клапанов сердца — в 72%, серозных оболочек (плеврит, перикардит) — в 43%, легких (интерстициальный пневмонит, фиброзирующий альвеолит, дисковидные ателектазы, высокое стояние диафрагмы, легочная гипертензия) — в 52%, печени — в 46%, селезенки — в 29%, щитовидной железы (тиреоидит, тиреоидная дисфункция) — в 15%, центральной нервной системы (дисциркуляторная энцефалопатия, астеновегетативный, кортиконуклеарный, пирамидный, псевдобульбарный и эпилептиформный синдромы, корковая и мозжечковая атаксия) — в 37%, периферической нервной системы (моно- и полинейропатия, радикулопатия, цервикокраниалгия, мортоновская метатарзалгия, синдромы метакарпального канала и канала Гуйона) — в 13%, почек (гломерулонефрит, тубулоинтерстициальный нефрит) — в 77%. Нефротический синдром зарегистрирован у 18% обследованных больных с волчаночной нефропатией, снижение функции почек — у 46%.
Жители городов составили 76% наблюдений, а сельской местности — 24%. Гигиеническую оценку антропогенного загрязнения окружающей среды проводили на основании определения ксенобиотиков в четырех ее объектах — атмосферном воздухе, почве, питьевой воде, воде поверхностных водоемов и подземных водоисточников. Данные получены в результате лабораторных исследований санитарно-гигиенических станций, региональных отделений Государственных комитетов по гидрометеорологии, контролю природной среды и экологической безопасности 33 регионов Донецкой области. Оценивали: 1) распределение выбросов в атмосферу металлургической, угледобывающей, химической и машиностроительной отраслей промышленности, производства строительных материалов, энергетики, сельского хозяйства, железнодорожного и автомобильного транспорта; 2) уровень
выбросов в атмосферу и накопление в ней промышленных отходов за год из расчета на площадь территории и одного человека; 3) содержание в воздухе аммиака, 3,4-бензпирена, диоксида азота, серы и углерода, оксида углерода, сероводорода и фенола; 4) минерализацию и жесткость питьевой воды разных регионов, содержание в ней хлоридов, сульфатов, фосфатов и нитратов; 5) показатели эссенциальных и токсичных микроэлементов (МЭ) в почве (Ba, Be, Bi, Co, Cr, Cu, Hg, Li, Mn, Mo, Ni, Pb, Sn, Ti, V, Zn) и в грунтовых водах (Ba, Cu, Li, Mn, Ni, Pb, Ti, Zn). Определяли интегральные показатели неблагоприятной экологической нагрузки на атмосферу (Q), воду (R) и почву (S) регионов.
Больным выполняли электрокардиографию (апараты «МІДАК-ЕК1Т», Украина, и «Fukuda Denshi Cardimax-FX326», Япония), трансторакальную и/или эзофагеальную эхокардиографию («Acuson-Aspen-Siemens», Германия), проводили рентгенологическое («Multix-Compact-Siеmens», Германия) и ультразвуковое («Envisor-Philips», Нидерланды) исследование периферических суставов, позвоночника, внутренних органов, лимфоузлов и щитовидной железы. У части обследованных больных проведена компьютерная («Somazom-Emotion-6 Siemens», Германия) и магнитно-резонансная томография («Gygoscan-Intera-Philips», Нидерланды) головного мозга и внутренних органов, а также спирография («Master-Scope-Jaeger», Германия). Иммуноферментным методом исследовали содержание в сыворотке крови АНФ, АДНК и антител к кардиолипину (АКЛ), используя ридер «PR2100 Sanofi diagnostic pasteur» (Франция), наборы «ProCon» (Россия) и «Amercham pharmacia biotech» (Великобритания). С помощью атомно-абсорбционного спектрометра с электрографитовым атомизатором (аппарат «SolAAr-Mk2-MOZe», Великобритания) в сыворотке крови и волосах изучали содержание тех токсичных МЭ, которые определяли во внешней среде — Ba, Li, Pb.
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного, непараметрического, корреляционного, регрессионного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы «Microsoft Excel» и «Statistica-Stat-Soft», США). Оценивали средние значения (M), стандартные отклонения (SD) и ошибки, коэффициенты корреляции, критерии регрессии, дисперсии, Стьюдента, Уилкоксона — Рао, Макнемара — Фишера и достоверность статистических показателей.
Результаты исследований
и их обсуждение
По Донецкой области средняя распространенность СКВ составляет 1,22±0,110 на 10 тыс. населения, причем в сельских регионах — 1,11±0,191 на 10 тыс. населения, а в городах — на 16% больше. При этом уровень выбросов в атмосферу в сельских районах составляет 0,72±0,116 т/км/год, а в городских — 8,45±2,178 т/км/год. По данным регрессионного анализа существует прямая зависимость распространенности СКВ в отдельных регионах от уровня выбросов в атмосферу ксенобиотиков отдельными отраслями промышленности и степени накопления в воздушном бассейне неутилизированных промышленных отходов. Вместе с тем влияние на заболеваемость СКВ уровня нагрузки на атмосферу и накопления промышленных отходов недостоверно. Это касается и корреляционных связей.
Сейчас четко установлено неблагоприятное действие на организм в контексте с экологическим загрязнением окружающей среды развития в регионе энергетики (Mulloy K.B., 2003), производства строительных материалов (Makol A. et al., 2011), металлургической (Bertazzi P.A. et al., 2012; Corsaro G.B. et al., 2012), химической (Cavallo D.M., Cattaneo A., 2012) и других отраслей промышленности (Kluger N., 2011). Выполненный нами корреляционный анализ свидетельствует о прямых соотношениях распространенности СКВ со степенью развития химической промышленности и производства строительных материалов (рис. 1). В этой связи заметим, что, по данным литературы, стимулирующее влияние на синтез аутоантител отмечается именно у жителей регионов с высоким развитием огнеупорной шамотно-динасовой промышленности (Hogan S.L. et al., 2007; Makol A. et al., 2011). В этих случаях к так называемым экологическим ядам относятся высокие концентрации в атмосфере зон проживания людей кремнезема (Kim M. et al., 2012; Yang X. et al., 2013). Z. Rihova и соавторы (2005), J. Bartunkova и соавторы (2006), M. Chen и C.G. Kallenberg (2010), А. Makol и соавторы (2011) установили связь формирования аутоантител у лиц, по роду своей профессиональной деятельности контактирующих с Si.
Распространенность СКВ прямо коррелирует с показателями в атмосфере диоксида углерода и 3,4-бензпирена. Подчеркнем, что возникновению всех системных заболеваний соединительной ткани способствует как раз высокая степень загрязнения вдыхаемого воздуха такими ксенобиотиками, как диоксиды (Farhat S.C. et al., 2011; Corsaro G.B. et al., 2012) и 3,4-бензпирен (Zhang K. et al., 2012).
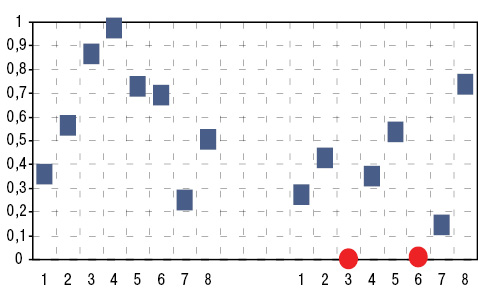
Рис. 1. Достоверность дисперсионного влияния (слева) и корреляционных связей (справа) нагрузки отдельных отраслей промышленности, энергетики, транспорта и сельского хозяйства на распространенность в регионах СКВ. 1 — металлургическая промышленность, 2 — угледобывающая промышленность, 3 — химическая промышленность, 4 — машиностроительная промышленность, 5 — энергетика, 6 — производство строительных материалов, 7 — железнодорожный и автомобильный транспорт, 8 — сельское хозяйство
Постоянное влияние на организм токсичных МЭ окружающей среды считается одним из важных экологически обусловленных патогенетических факторов многих болезней (Hosseini S.V. et al., 2012). Значительное содержание солей тяжелых металлов в воздухе, почве и воде зон проживания людей повышает распространенность в этих регионах системных аутоиммунных заболеваний (Moyer C.F. et al., 2009; Kim M. et al., 2012; Yang X. et al., 2013). По нашим данным, на распространенность и заболеваемость СКВ влияет содержание Со в почве регионов проживания людей. По результатам корреляционного анализа, распространенность СКВ прямо соотносится с концентрацией в почве Bi. W.H. Gao и соавторы (2012) установили, что степень загрязнения водных источников МЭ обычно следующая: Ni>Co>Pb>Cr>V>Zn. Наши данные демонстрируют наличие прямых корреляционных связей между распространенностью СКВ и содержанием в грунтовых водах Ni, хотя основные соотношения медицинского статистического показателя касаются все-таки уровня Ва, поскольку отмечается не только обратная корреляция, а и достоверное влияние на распространенность СКВ данного МЭ.
Как свидетельствует многофакторный анализ Уилкоксона — Рао, место жительства больных СКВ высокодостоверно влияет на интегральное загрязнение атмосферы ксенобиотиками. Среди изученных веществ (рис. 2) только уровень аммиака мало отличается в городских и сельских регионах. Содержание 3,4-бензпирена в городах выше в 3,3 раза, диоксида углерода — в 3,8 раза, диоксида азота — в 2,5 раза. По данным ANOVA/MANOVA, показатель Q не оказывает достоверного влияния на интегральные клинико-лабораторные признаки течения СКВ. По результатам выполненного ANOVA, от параметра Q не зависит характер течения и степень активности СКВ, наличие АНФ и АДНК, но состояние Q определяет причины смерти больных. Непараметрическая статистика Макнемара — Фишера демонстрирует влияние места жительства пациентов на летальность от мозгового инсульта, которая оказалась свойственной лишь представителям сельских регионов.
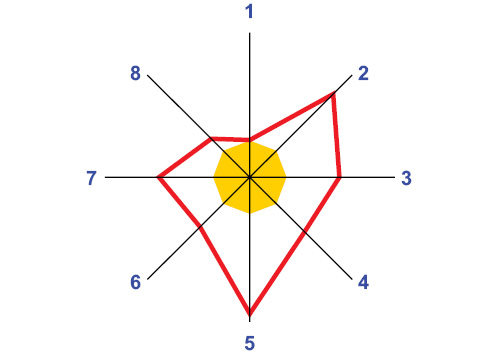
Рис. 2. Различия показателей ксенобиотиков в атмосферном воздухе городов и сел, которые приняты за 100%. 1 — аммиак, 2 — 3,4-бензпирен, 3 — диоксид азота, 4 — диоксид серы, 5 — диоксид углерода, 6 — оксид углерода, 7 — сероводород, 8 — фенол
Согласно результатам однофакторного дисперсионного анализа, более молодой возраст пациентов в начале заболевания тесно связан с относительной влажностью в регионах воздуха, с уровнем накопления в атмосфере промышленных отходов, со степенью развития химической промышленности и энергетики. На характер течения СКВ оказывает достоверное воздействие уровень во вдыхаемом воздухе аммиака, на формирование в крови АНФ — аммиака и диоксида азота, АДНК — фенола, АКЛ — аммиака. Кроме того, частота появления АДНК связана с развитием в регионе производства строительных материалов. Следует подчеркнуть, что параметры в крови АДНК и АКЛ прямо коррелируют с уровнем химической промышленности.
По результатам дисперсионного анализа, интегральный показатель Q в регионе достоверно воздействует на характер поражения кожи, почек, миокарда, эндокарда и клапанов сердца. Помимо этого, тяжесть волчаночного нефрита зависит от уровня в атмосфере промышленных отходов, 3,4-бензпирена и сероводорода. Содержание в воздухе аммиака определяет тяжесть алопеции, фенола — синдрома Рейно и периферической полинейропатии, диоксида азота — скелетных мышц, диоксида серы — лимфатических узлов.
Развитие в регионе металлургической промышленности у больных СКВ влияет на развитие асептического остеонекроза, химической — на выраженность суставного синдрома и появление нарушений электрической проводимости сердца, угольной — на характер кардиопатии, в частности на угнетение диастолической функции левого желудочка, машиностроительной — на поражение щитовидной железы и появление легочной гипертензии, сельского хозяйства — на возникновение нефротического синдрома при волчаночном нефрите.
По нашим данным, в городах проживания больных СКВ степень минерализации питьевой воды составляет 1,0±0,04 г/л, жесткости — 7,4±0,22 мг·экв/л, уровень в ней хлоридов — 93,8±5,22 мг/л, сульфатов — 489,8±16,35 мг/л, фосфатов — 268,0±7,44 мкг/л, нитратов — 5,3±0,19 мг/л. У пациентов сельских регионов питьевая вода в 2,4 раза большей минерализации и в 2,5 раза — жесткости, содержит в 9,1 раза больше нитратов, в 2,8 раза — хлоридов, в 2,3 раза — сульфатов и в 2,2 раза — фосфатов. Как показывает ANOVA/MANOVA, от места проживания больных СКВ высокодостоверно зависит качественный состав питьевой воды, а ANOVA демонстрирует зависимость всех изученных составляющих — жесткости, минерализации, концентраций хлоридов, сульфатов, фосфатов и нитратов. По результатам выполненного анализа Уилкоксона — Рао, с местом жительства больных СКВ значительно связан интегральный экологический показатель S. Установлено, что пациенты в начале манифестации СКВ в регионах с повышенным содержанием в питьевой воде нитратов достоверно моложе, а высокий уровень фосфатов и нитратов определяет частоту летальности и характер причин смерти. Об этих данных свидетельствует выполненный однофакторный дисперсионный анализ.
Интегральный уровень гигиенического состояния питьевой воды S негативно воздействует на развитие и тяжесть алопеции, серозитов, нефрита, электрической проводимости сердца и легочной гипертензии. Необходимо отметить, что темпы прогрессирования почечной патологии, формирование волчаночного пневмонита, спленомегалии и диастолической дисфункции левого желудочка сердца тесно связаны с содержанием в воде нитратов. В этой связи заметим, что на показатели нитратемии у больных СКВ оказывает дисперсионное влияние уровень нитратов в питьевой воде, хотя корреляционные связи между этими параметрами отсутствуют. При этом концентрация нитратов в крови прямо коррелирует с содержанием АНФ, АДНК и АКЛ.
По данным выполненного ANOVA, степень наличия в питьевой воде изученных неорганических компонентов, которые иногда выступают в качестве ксенобиотиков, у больных СКВ способствуют либо формированию, либо ухудшению предсуществующих признаков болезни, таких как антифосфолипидный синдром, полисерозиты, пневмонит и поражение селезенки. С учетом результатов проведенного дисперсионного и корреляционного анализа сделаны следующие заключения, имеющие практическую направленность: 1) показатели нитратов в питьевой воде >67 мг/л (>M+2SD зон проживания больных СКВ) являются негативными в контексте развития и дальнейшего течения патологии легких, селезенки и почек; 2) показатели в регионе S>1,1 о.е. являются прогнознеблагоприятными в отношении почечной и селезеночной патологии.
По нашим данным, место жительства больных СКВ высокодостоверно влияет на интегральный состав МЭ в почве и грунтовых водах, о чем свидетельствует выполненный анализ Уилкоксона — Рао. У жителей городов только содержание в почве Ві из всех токсичных МЭ достоверно (на 6%) меньше, чем в сельских регионах, тогда как уровень грунтового Ba у горожан достоверно выше на 89%, Be — на 33%, Co — на 11%, Cr — на 88%, Hg — в 7 раз, Li — на 43%, Ni — на 40%, Pb — в 4,2 раза, Ti — на 6% и Sn — на 64%. Следует подчеркнуть, что в городских регионах проживания пациентов с СКВ содержание эссенциальных МЭ в грунте также выше, чем в сельских: Cu — на 58%, Mn — в 2,1 раза, Mo — на 40%, V — на 7% и Zn — в 2,6 раза. В городских регионах установлен больший на 83% уровень в грунтовых водах Li, в 2,0 раза Ti и в 9,0 раз Zn.
По результатам однофакторного дисперсионного анализа, на возраст пациентов с СКВ в начале заболевания оказывают воздействие параметры в почве Be, Bi, Li, Pb и Zn, а также содержание в грунтовых водах Ni и Pb. Как свидетельствует корреляционный анализ, возраст во время манифестации СКВ обратно связан с Be и Cu в грунте. С учетом полученных данных, нами сделано следующее заключение, имеющее практическую значимость: начало манифестации СКВ в регионах с содержанием Ве в почве >260 мкг/кг (>M+2SD всех регионов) является фактором риска развития заболевания в детском и юношеском возрасте.
По данным ANOVA, характер течения и степень активности СКВ не зависят от уровня МЭ в почве и подземных водах зон проживания больных. При этом формирование волчаночного клеточного феномена связано с содержанием Со в грунте и Pb в грунтовых водах, АНФ — c параметрами Ва в почве, АДНК — с концентрацией в почве Ве, Ti и V, a в водах — Li. От токсичных Li Ni и Pb прямо зависит летальность больных СКВ и характер причин смерти. Показатели АНФ в крови больных СКВ прямо коррелируют с уровнем Ва в почве, АДНК — с содержанием Be, Ti и V в почве и Li в грунтовых водах. Предикторами образования высоких параметров антиядерных аутоантител при СКВ является концентрация в почве Ba >2 г/кг, Be >250 мкг/кг и Ti >540 мг/кг, Li >3 мг/л в подземных водах (>M+2SD регионов проживания больных).
Уровень Ва в почве влияет на возникновение нарушений электрической проводимости сердца, Ве — на развитие лимфаденопатии, Ві — на тяжесть суставного синдрома, кардиопатии, спленомегалии и нефропатии, Со — асептических остеонекрозов, тиреоидита и нейролюпуса, Cr и Li — антифосфолипидного синдрома, Hg и Sn — на темпы прогрессирования волчаночного нефрита, Pb — на алопецию, V — на формирование легочной гипертензии и диастолической дисфункции левого желудочка сердца. Таким образом, только уровни в почве Cu, Mn, Mo, Ni, Ti и Zn не оказывают воздействия на отдельные клинические признаки СКВ. Помимо сказанного, антифосфолипидный синдром и поражение почек зависят от концентрации в грунтовых водах Ni, волчаночная артропатия — от Bi, лимфаденопатия — от Mn, спленомегалия — от Ti, гипертензия в малом круге кровообращения — от Li, диастолическая дисфункция левого желудочка сердца — от Pb.
Содержание Pb в организме больных СКВ не связано с параметрами одноименного тяжелого металла во внешней среде. Вместе с тем показатели Ва в почве и подземных водах достоверно влияют на концентрации данного МЭ в волосах, Li в грунте на уровень Li в волосах и сыворотке крови, Li в водах — только на параметры в крови (таблица). Показатели Ва в волосах больных СКВ прямо коррелирует с содержанием Pb в почве, Ва и Li в почвенных водах. Учитывая выполненный дисперсионный и корреляционный анализ, с параметрами Ва в окружающей среды самым тесным образом связано содержание этого токсичного МЭ в организме больных СКВ. Значения интегральной степени микроэлементоза при СКВ влияют на параметры АНФ и периферического сосудистого сопротивления, развитие и степень тяжести алопеции, язвенного стоматита, спленомегалии и периферической нейропатии, что демонстрирует ANOVA. С уровнем АДНК существует прямая корреляционная связь.
с уровнем МЭ в организме больных СКВ
| Характерсвязи | Объектисследования | МЭ | Объект исследования | |||||
|---|---|---|---|---|---|---|---|---|
| почва | грунтовые воды | |||||||
| МЭ | ||||||||
| Ba | Li | Pb | Ba | Li | Pb | |||
| Влияние на содержание МЭ в организме больных СКВ | Волосы | BaLiPb | 0,0180,9520,844 | 0,1070,0450,616 | 0,1200,0940,196 | 0,0470,7120,369 | 0,3270,2550,296 | 0,1830,4950,611 |
| Кровь | BaLiPb | 0,8800,0940,892 | 0,6270,0480,679 | 0,5840,0790,683 | 0,5530,7910,530 | 0,9240,0460,354 | 0,9710,0590,307 | |
| Корреляции с содержанием МЭ в организме больных СКВ | Волосы | BaLiPb | 0,4640,5420,267 | 0,5620,4460,918 | 0,0440,2250,149 | 0,0390,0130,222 | 0,9070,8400,922 | 0,4410,7710,135 |
| Кровь | BaLiPb | 0,8370,1600,536 | 0,2290,2490,783 | 0,9890,6370,432 | 0,9510,7960,809 | 0,8320,5550,750 | 0,7840,2510,324 | |
Выводы
Распространенность СКВ тесно связана с развитием в регионах химической промышленности и производства строительных материалов, с уровнями в атмосфере диоксида углерода и 3,4-бензпирена, с содержанием в почве токсичных Bi и Со, а в грунтовых водах — Ва и Ni. Степень загазованности атмосферы в городских регионах проживания больных СКВ намного выше, чем в сельских, причем, особенности экологической ситуации определяют более раннее по возрасту начало заболевания, частоту летальности и характер причин смерти. Формирование в крови аутоантител зависит от уровня в атмосфере аммиака, фенола, диоксидов азота и углерода, от производства строительных материалов и химической промышленности, а интегральные значения неблагоприятной экологической ситуации воздушного пространства влияют на развитие и тяжесть поражения кожи, сердца и почек. Нитраты в питьевой воде оказывают воздействие на уровень нитратемии, который прямо коррелирует с тяжестью течения висцеритов. Показатели МЭ в окружающей среде определяют летальность больных СКВ, появление антиядерных аутоантител и выраженность отдельных клинических признаков заболевания, влияя на содержание Ba, Li и Pb в волосах и крови пациентов, с которыми, в свою очередь, связано течение патологического процесса. Считается, что определение степени воздействия неблагоприятных экологических факторов на организм больных СКВ будет способствовать пониманию новых звеньев патогенеза заболевания (Kobayashi S. et al., 2008), а реабилитационные мероприятия уже сейчас необходимо осуществлять с учетом экологического окружения пациентов (Stamm T.A. et al., 2010).
СПИСОК ИСПОЛЬЗОВАННОЙ Литературы
- Abdwani R., Al-Abrawi S., Sharef S.W. et al. (2013) Geographical clustering of juvenile onset systemic lupus erythematosus within the sultanate of Oman. Oman Med. J., 28(3): 199–203.
- Bartunkova J., Pelclova D., Fenclova Z. et al. (2006) Exposure to silica and risk of ANCA-associated vasculitis. Am. J. Ind. Med., 49(7): 569–576.
- Bertazzi P.A., Bollati V., Bonzini M. (2012) Hazard identification and risk evaluation in the metal industry: the epigenetic challenge. G. Ital. Med. Lav. Ergon, 34(3): 223–228.
- Cavallo D.M., Cattaneo A. (2012) Environmental and biological monitoring in the plating industry. G. Ital. Med. Lav. Ergon, 34(3): 247–250.
- Chen M., Kallenberg C.G. (2009) New advances in the pathogenesis of ANCA-associated vasculitides. Clin. Exp. Rheumatol., 27(1): 108–114.
- Cooper G.S., Wither J., Bernatsky S. et al. (2010) Occupational and environmental exposures and risk of systemic lupus erythematosus: silica, sunlight, solvents. Rheumatology, 49(11): 2172–2180.
- Corsaro G.B., Gabusi V., Pilisi A. (2012) Health risk assessment in the metal scrap recycle: the case of Brescia. G. Ital. Med. Lav. Ergon, 34(3): 259–266.
- Costenbader K.H., Gay S., Alarcon-Riquelme M.E. et al. (2012) Genes, epigenetic regulation and environmental factors: which is the most relevant in developing autoimmune diseases? Autoimmun. Rev., 11(8): 604–609.
- Elie M.R., Clausen C.A., Geiger C.L. (2012) Reduction of benzo[a]pyrene with acid-activated magnesium metal in ethanol: a possible application for environmental remediation. J. Hazard. Mater., 15(203–204): 77–85.
- Farhat S.C., Silva C.A., Orione M.A. et al. (2011) Air pollution in autoimmune rheumatic diseases: a review. Autoimmun. Rev., 11 (1): 14–21.
- Gao W.H., Du Y.F., Wang D.D. et al. (2012) Distribution patterns of heavy metals in surficial sediment and their influence on the environment quality of the intertidal flat of Luoyuan Bay, Fujian coast. Huan Jing Ke Xue, 33(9): 3097–3103.
- Hogan S.L., Cooper G.S., Savitz D.A. et al. (2007) Association of silica exposure with anti-neutrophil cytoplasmic autoantibody small-vessel vasculitis: a population-based, case-control study. Clin. J. Am. Soc. Nephrol., 2(2): 290–299.
- Hoovestol R.A., Mikuls T.R. (2011) Environmental exposures and rheumatoid arthritis risk. Curr. Rheumatol. Rep., 23(7): 60–66.
- Hosseini S.V., Aflaki F., Sobhanardakani S. et al. (2012) Analysis of mercury, selenium, and tin concentrations in canned fish marketed in Iran. Environ Monit. Assess., 12(12): 117–119.
- Javierre B.M., Hernando H., Ballestar E. (2011) Environmental triggers and epigenetic deregulation in autoimmune disease. Discov. Med., 12(67): 535–545.
- Kim M., Bae M., Na H. et al. (2012) Environmental toxicants — induced epigenetic alterations and their reversers. J. Environ Sci. Health Environ Carcinog. Ecotoxicol. Rev., 30(4): 323–367.
- Kluger N. (2011) Tattoo-induced vasculitis: is it really the ink? Am. J. Emerg. Med., 29(3): 347–348.
- Kobayashi S., Momohara S., Kamatani N. et al. (2008) Molecular aspects of rheumatoid arthritis: role of environmental factors. FEBS J., 275(18): 4456–4462.
- Korkina L., Scordo G., Deeva I. et al. (2010) The chemical defensive system in the pathobiology of idiopathic environment-associated diseases. Curr. Drug. Metab., 7(1): 233–238.
- Kumar P., Imam B. (2012) Footprints of air pollution and changing environment on the sustainability of built infrastructure. Sci. Total. Environ., 20(444): 85–101.
- Makol A., Reilly M.J., Rosenman K.D. (2011) Prevalence of connective tissue disease in silicosis (1985–2006)-a report from the state of Michigan surveillance system for silicosis. Am. J. Ind. Med., 54(4): 255–262.
- Moyer C.F., Kodavanti U.P., Haseman J.K. et al. (2009) Systemic vascular disease in male B6C3F1 mice exposed to particulate matter by inhalation: studies conducted by the National Toxicology Program. Toxicol. Pathol., 30(4): 427–434.
- Mulloy K.B. (2003) Silica exposure and systemic vasculitis. Environ Health Perspect., 111(16): 1933–1938.
- Rihova Z., Maixnerova D., Jancova E. et al. (2005) Silica and asbestos exposure in ANCA-associated vasculitis with pulmonary involvement. Ren. Fail., 27(5): 605–608.
- Scott D.L., Wolfe F., Huizinga T.W. (2010) Rheumatoid arthritis. Lancet, 376(9746): 1094–1108.
- Shapira Y., Agmon-Levin N., Shoenfeld Y. (2010) Geoepidemiology of autoimmune rheumatic diseases. Nat. Rev. Rheumatol., 6(8): 468–476.
- Stamm T.A., Machold K.P., Smolen J. et al. (2010) Life stories of people with rheumatoid arthritis who retired early: how gender and other contextual factors shaped their everyday activities, including paid work. Musculoskeletal. Care, 8(2): 78–86.
- Strickland F.M., Hewagama A., Lu Q. et al. (2012) Environmental exposure, estrogen and two X chromosomes are required for disease development in an epigenetic model of lupus. J. Autoimmun., 38(2–3): 135–143.
- Toboіn G.J., Youinou P., Saraux A. (2010) The environment, geo-epidemiology, and autoimmune disease: Rheumatoid arthritis. J. Autoimmun., 35(1): 10–14.
- Vincent F.B., Bourke P., Morand E.F. et al. (2013) Focus on systemic lupus erythematosus in Indigenous Australians: towards a better understanding of autoimmune diseases. Intern. Med. J., 43(3): 227–234.
- Yang X., Shen Z., Zhang B. et al. (2013) Silica nanoparticles capture atmospheric lead: implications in the treatment of environmental heavy metal pollution. Chemosphere, 90(2): 653–656.
- Zhang X., Lv G., Liao L. et al. (2012) Removal of low concentrations of ammonium and humic acid from simulated groundwater by vermiculite/palygorskite mixture. Water Environ Res., 84(8): 682–688.
- Zou Y.F., Xu J.H., Tao J.H. et al. (2013) Impact of environmental factors on efficacy of glucocorticoids in chinese population with systemic lupus erythematosus. Inflammation, 10(7): 163–168.
Адрес для переписки:
Синяченко Олег Владимирович
83003, Донецк, просп. Ильича, 16
Национальный медицинский университет
им. Максима Горького,
кафедра пропедевтики внутренней медицины
и общей практики — семейной медицины

Leave a comment