ОСОБЛИВОСТІ КЛІНІЧНОЇ СИМПТОМАТИКИ І ШЛЯХИ КОРЕКЦІЇ ГОНАРТРОЗУ ПРИ ЗнижЕННІ МІНЕРАЛЬНОЇ ЩІЛЬНОСТІ КІСТКОВОЇ ТКАНИНИ
Резюме. Резюме. З метою вивчення особливостей клінічного прояву гонартрозу у пацієнтів зі зниженою мінеральною щільністю кісткової тканини (МЩКТ) і уточнення найбільш оптимальної терапії у хворих цієї категорії обстежено 120 пацієнтів з остеоартрозом колінних суглобів II–III рентгенологічної стадії за Kellgren — Lawrence, з яких 54,2% — зі зниженою МЩКТ. Залежно від проведеної терапії учасників розподілили на 4 групи. Пацієнти 1-ї групи приймали хондроїтин сульфат (ХС)-4,6 по 1 г/добу протягом 6 міс і німесулід 200 мг/добу до 15 днів. Пацієнти 2-ї групи приймали ХС-4,6 по 1 г/добу протягом 6 міс і диклофенак 150 мг/добу до 15 днів. Пацієнти 3-ї групи приймали німесулід 200 мг/добу до 15 днів. Пацієнти 4-ї групи приймали диклофенак 150 мг/добу до 15 днів. Виявлено кореляційні зв’язки між МЩКТ і клінічними та лабораторними параметрами. Встановлено відмітні особливості перебігу гонартрозу в пацієнтів зі зниженою МЩКТ: більш виражені больовий синдром та обмеження функціональної активності, підвищений рівень С-реактивного білка. Протягом дослідження, через 6 та 12 міс встановлено достовірно менше зниження показників МЩКТ (Т- і Z-індексів у стандартних відхиленнях) у групах, пацієнти яких приймали ХС-4,6, що дозволяє зробити висновок про його позитивний вплив на МЩКТ.
Введение
Из всех болезней опорно-двигательного аппарата остеоартроз (ОА) имеет самый высокий показатель распространенности. ОА является изнурительным и прогрессирующим заболеванием, которое стало одной из основных причин инвалидности и нарушения качества жизни в пожилом возрасте. От 35 до 40 млн европейцев страдают ОА (Mobasheri А., 2013). Около 40% людей в возрасте старше 70 лет страдают ОА коленных суставов (Fardellone P. et al., 2013).
ОА — патология с достаточно сложным патогенезом, при участии различных медиаторов, что приводит к иммунным нарушениям с развитием воспаления и деструкции хрящевой ткани и субхондральной кости. Недавние исследования показали, что системные факторы регулируют метаболизм всех тканей сустава, включая хрящ, субхондральную кость, синовиальную оболочку, сухожилия и мышцы (Sellam J., Berenbaum F., 2010; Mahjoub M. et al., 2012; Berenbaum F. et al., 2013; Mobasheri А., 2013). Распространенность ОА значительно выше у женщин, особенно в постменопаузальный период и с коморбидными метаболическими состояниями костной ткани, в их числе остеопороз (ОП) (Zhuo Q. et al., 2012; Mobasheri А., 2013). Последние исследования показали, что между костной и хрящевой тканями существуют общие и зависимые между собой механизмы взаимодействия (Richette P., Funk-Brentano T., 2010). Становится больше приверженцев теории, что субхондральная кость должна быть приоритетной целью лечения ОА. Считается, что сосудистая патология и потеря минеральной плотности в субхондральной кости важны для инициирования и прогрессирования ОА, и что изменения в субхондральной кости могут ускорить прогрессирование уже существующей болезни (Findlay D.M. et al., 2007; Goldring M.B., Goldring S.R., 2010; Castaneda S. et al., 2012; Mahjoub M. et al., 2012; Suri S., Walsh D.A., 2012). Синовит и аномальный метаболизм субхондральной кости способствуют прогрессированию заболевания, а также связаны с развитием боли при ОА (Walsh D.A., Chapman V., 2011). Отмечена отрицательная корреляция между уровнями воспалительных маркеров (С-реактивный белок (СРБ), интерлейкин (ИЛ)-6, фактор некроза опухоли (ФНО)) и показателями минеральной плотности костной ткани (МПКТ) (Ganesan K. et al., 2005; Ding C. et al., 2008; Herman S. et al., 2008).
Системный ОП и ОА имеют парадоксальную взаимосвязь: как низкая, так и высокая МПКТ могут привести к индукции и прогрессированию ОА. Последние данные свидетельствуют о том, что некоторые лекарственные средства могут быть полезны в терапии при обоих процессах одновременно, по крайней мере в подгруппе пациентов с ОА и ОП (Castaneda S. et al., 2012).
Недавние исследования препаратов группы SYSADOA, в частности хондроитин сульфата (ХС), показали воздействие его на определенные биомаркеры субхондральной кости и костную резорбцию (Kwan Tat S. et al., 2007). ХС повышал экспрессию молекул OPG и снижал уровень экспрессии генов RANKL, тем самым увеличивая мРНК-отношения OPG/RANKL и снижение костной резорбции (Kwan Tat S. et al., 2007; Iovu M. et al., 2008).
Цель исследования — изучение особенностей клинического проявления гонартроза у пациентов со сниженной МПКТ и уточнение наиболее оптимальной терапии у данной категории больных.
Объект и методы исследования
На базе Днепропетровской областной консультативной поликлиники обследованы 120 пациентов (112 женщин, 8 мужчин) в возрасте от 37 до 78 лет (в среднем — 55,28±9,49 года) с подтвержденным ОА коленных суставов (критерии Американского колледжа ревматологов (ACR), 1990). У пациентов констатирован ОА II–III рентгенологической стадии по классификации Kellgren — Lawrence. Индекс массы тела (ИМТ) составил 20–45 кг/м2 (в среднем — 30,57±5,20 кг/м2). Длительность заболевания составила 1 год–30 лет (в среднем — 6,7±5,13 года). Пациенты не имели сопутствующей суставной патологии согласно клинической оценке, лабораторным и рентгенологическим данным. С целью изучения особенностей клинического проявления гонартроза у лиц со сниженной МПКТ, пациентов распределили на две категории в зависимости от показателей МПКТ: пациенты со сниженной МПКТ — 65 (54,2%) человек, из них 42 человека с остеопенией (Оп) и 23 — ОП; и пациенты с нормальной МПКТ — 55 (45,8%) человек (рис. 1). Пациенты в зависимости от проводимой терапии были распределены на четыре группы. Пациенты 1-й группы применяли ХС-4,6 по 500 мг 2 раза в сутки в течение 6 мес и нимесулид в гранулированной форме 100 мг 2 раза в сутки до 15 дней. Пациенты 2-й группы принимали ХС-4,6 по 500 мг 2 раза в сутки в течение 6 мес и диклофенак 50 мг 3 раза в сутки до 15 дней. Пациенты 3-й группы принимали нимесулид в гранулированной форме 100 мг 2 раза в сутки до 15 дней. Пациенты 4-й группы принимали диклофенак 50 мг 3 раза в сутки до 15 дней. При выраженном болевом синдроме проведенный курс терапии нестероидными противовоспалительными препаратами (НПВП) повторяли с интервалом не менее 2 нед.
Всем пациентам до и через 1; 3; 6; 9 и 12 мес от начала лечения проведено комплексное клиническое, лабораторное и инструментальное обследование. Для оценки выраженности боли в суставах использовали альгофункциональный индекс Lequesne, индекс WOMAC. У всех больных рассчитывали ИМТ. Рентгенографию коленных суставов осуществляли по стандартной методике в переднезадней и боковой проекциях. Рентгенологическую стадию гонартроза устанавливали согласно классификации Kellgren — Lawrence.
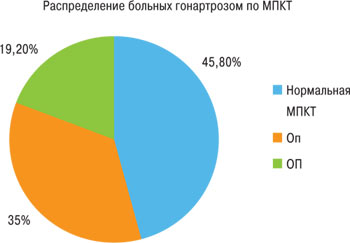
Рис. 1. Распределение больных гонартрозом по уровню МПКТ
Структурно-функциональное состояние костной ткани оценивали с помощью метода ультразвуковой денситометрии с использованием прибора Achilles («LUNAR»). Диагностику Оп и ОП проводили согласно принятым стандартным критериям диагностики. Уменьшенную костную массу (Оп) определяли при снижении МПКТ ниже стандартных средних значений этого показателя у женщин молодого возраста на >1 SD, но <–2,5 SD (T-score <–1 SD, но >–2,5 SD). ОП диагностировали при снижении МПКТ ниже референтных средних значений этого показателя у женщин молодого возраста на ≥2,5 SD (T-score ≤–2,5 SD).
Лабораторное обследование пациентов состояло из общеклинического анализа крови, общего анализа мочи, биохимических исследований крови, включавших: СРБ, мочевую кислоту, креатинин, аспартатаминотрансферазу, аланинаминотрансферазу.
Статистический анализ проводили с определением параметрических (критерий Стьюдента) и непараметрических критериев (корреляционный анализ Спирмена), используя пакеты программ «Statistika 6,0».
Результаты и их обсуждение
В результате обследования было выявлено, что показатель боли по индексу WOMAC в группе пациентов со сниженной МПКТ (232,65±25,99 мм) оказался достоверно (р<0,0001) выше, чем в группе с нормальной МПКТ (194,73±21,23 мм) (табл. 1). Уровень боли по ВАШ в покое у пациентов со сниженной МПКТ (53,91±8,94 мм) также был достоверно выше (р<0,0001), чем в группе с нормальной МПКТ (45,0±5,62 мм). Уровень боли по ВАШ при ходьбе у пациентов со сниженной МПКТ (69,37±9,21 мм) был также достоверно выше (р<0,0001), чем в группе с нормальной МПКТ (54,75±9,11 мм). Показатель ограниченной подвижности сустава по WOMAC в группе со сниженной МПКТ (104,23 ± 24,08 мм) был выше (р<0,0001), чем во 2-й группе (70,38±15,21 мм). Показатель затруднения в выполнении повседневной деятельности по WOMAC в группе, где наблюдалось снижение МПКТ (709,78±133,29мм), достоверно (р<0,0001) был существенно выше, чем в группе с нормальной плотностью кости (557,58±115,50 мм). В результате у пациентов с гонартрозом, у которых по данным ультразвуковой денситометрии наблюдалось снижение МПКТ до значений ОП и Оп, суммарный индекс WOMAC (1046,66±167,17 мм) был достоверно (р<0,0001) выше, чем у пациентов с нормальной МПКТ (822,69±141,98 мм). Индекс Lequesne в группе со сниженной МПКТ (15,78±1,98) был также достоверно выше (р<0,0001), чем во 2-й группе (12,89±1,89). По данным ультразвуковой денситометрии Т-индекс у пациентов с Оп и ОП (–2,15±0,73) соответственно был ниже (р<0,0001), чем в группе с нормальной МПКТ (–0,14±0,57).
| Показатель | Группа пациентов | |
|---|---|---|
| с нормальной МПКТ (n=55) | со сниженной МПКТ (n=65) | |
| Уровень боли по ВАШ в покое, мм | 45,00±5,62 | 53,91±8,94* |
| Уровень боли по ВАШ при ходьбе, мм | 54,75±9,11 | 69,37±9,21* |
| Уровень боли по WOMAC, мм | 194,73±21,23 | 232,65±25,99* |
| Показатель ограниченной подвижности сустава по WOMAC, мм | 70,38±15,21 | 104,23±24,08* |
| Показатель затруднения в выполнении повседневной деятельности по WOMAC, мм |
557,58±115,50 | 709,78±133,29* |
| Суммарный показатель индекса WOMAC, мм | 882,69±141,98 | 1046,66±167,17* |
| Індекс Лекена, баллов | 12,89±1,89 | 15,78±1,98* |
| МПКТ, Т-критерий, SD | –0,14±0,57 | –2,15±0,73* |
| СРБ, мг/л | 4,74±0,75 | 7,32±1,67* |
*p<0,0001.
У обследованных нами больных выявляли следующие уровни лабораторных маркеров воспаления: скорость оседания эритроцитов (СОЭ) в обеих группах пациентов не отличалась друг от друга и от нормы (в группе со сниженной МПКТ 10,17±2,38, в группе с нормальной МПКТ 9,26±2,17). В то время, как СРБ был существенно выше (р<0,0001) в группе пациентов со сниженной МПКТ (соответственно 7,32±1,67 и 4,74±0,75 мг/л, при норме 0–5 мг/л). Изменений в других лабораторных параметрах не выявлено.
Данные клинических, лабораторных и инструментальных исследований у пациентов с ОА были подвергнуты корреляционному анализу с определением показателя ранговой корреляции Спирмена. Проведено сопоставление показателей МПКТ (T- и Z-индексы) и показателей возраста, пола, ИМТ, длительности заболевания, индексов WOMAC и Lequesne, рентгенологической стадии гонартроза, уровня СОЭ, СРБ.
В результате установлено:
1. Корреляционные связи с ИМТ:
- достоверной корреляционной связи между МПКТ и ИМТ не выявлено (r<0,3);
- ИМТ коррелировал с уровнем боли по WOMAC (r=0,541), ограничением повседневной активности по WOMAC (r=0,421), индексом Lequesne (r=0,463) и рентгенологической стадией ОА (r=0,393).
2. Корреляционная связь с возрастом:
- выявлена обратная корреляционная связь между МПКТ (Т- и Z-индексы) и возрастом больных (r=–0,562);
- возраст больных коррелировал с длительностью заболевания (r=0,954);
- рентгенологической стадией ОА (r=0,468);
- индексом Lequesne (r=0,470);
- уровнем боли по WOMAC (r=0,505);
- показателем ограниченной подвижности сустава по WOMAC (r=0,472);
- показателем ограничения повседневной активности по WOMAC (r=0,414).
3. Корреляционная связь с рентгенологической стадией:
- длительность заболевания гонартрозом коррелировала с рентгенологической стадией (r=0,593).
4. Тесная корреляционная связь между показателями боли, скованности суставов и ограничения повседневной деятельности по WOMAC и индексом Lequesne (r=0,721).
5. Корреляционная связь с МПКТ, а именно выявлена:
- умеренная обратная корреляционная связь показателей МПКТ и уровня боли по WOMAC (r=–0,575);
- умеренная обратная корреляционная связь показателей МПКТ и ограничения подвижности сустава по WOMAC (r=–0,663);
- умеренная обратная корреляционная связь показателей МПКТ и ограничения повседневной активности по WOMAC (r=–0,586);
- умеренная обратная корреляционная связь показателей МПКТ и индекса Lequesne (r=–0,627);
- незначительная обратная корреляционная связь показателей МПКТ и рентгенологической стадии гонартроза (r=–0,314);
- умеренная обратная корреляционная связь показателей МПКТ и уровня СРБ (r=–0,402).
6. Корреляционная связь с уровнем СРБ:
- выявлена сильная корреляционная связь с уровнем боли по WOMAC (r=0,747);
- умеренная корреляционная связь с показателем ограничения подвижности сустава по WOMAC (r=0,697);
- умеренная корреляционная связь с показателем ограничения повседневной активности по WOMAC (r=0,562);
- умеренная корреляционная связь с индексом Lequesne (r=0,641).
Как видно из представленных данных, выявлена корреляционная связь МПКТ с выраженностью боли в покое и при ходьбе, уровнем СРБ, функциональной активностью суставов и их рентгенологической стадией гонартроза.
С целью уточнения наиболее оптимальной схемы терапии гонартроза у пациентов со сниженной МПКТ были оценены результаты лечения четырех групп пациентов различными схемами терапии. При этом учитывали клинико-лабораторные показатели: уровень боли по ВАШ, альгофункциональные индексы WOMAC и Lequesne, рентгенологическая стадия гонартроза, лабораторные маркеры воспаления и показатели МПКТ по данным ультразвуковой денситометрии.
В данном исследовании применение препаратов всех групп приводило к улучшению симптомов заболевания, более выраженному в 1-й и 2-й группах, где применяли ХС-4,6. Анальгезивный эффект достигался у пациентов всех групп на 2–4-й неделе терапии, без статистически значимых различий между группами через 1 мес от начала наблюдения. Уже через 3 мес наблюдался достоверно более выраженный анальгезирующий эффект в 1-й и 2-й группах, где применяли ХС и НПВП (нимесулид и диклофенак), чем в 3-й и 4-й группах, где применяли нимесулид и диклофенак соответственно (табл. 2, рис. 2). Так, уровень боли по шкале WOMAC через 3 мес достоверно (р<0,0001) был ниже в 1-й группе (163,55± 26,27), чем в 3-й (204,43±24,33) и 4-й (201,28±31,38), и во 2-й группе (173,41±21,67) в сравнении с 3-й и 4-й группами (р<0,01). Через 6 мес от начала терапии уровень боли по шкале WOMAC достоверно (р<0,0001) был ниже в 1-й группе (138,53±27,24), чем в 3-й (179,57± 24,06) и 4-й (176,33±30,44), а также во 2-й группе (173,41±21,67) в сравнении с 3-й и 4-й группами (р<0,01). Через 12 мес от начала исследования отмечен достоверно (р<0,005) более низкий уровень боли по шкале WOMAC в 1-й группе (176,53±29,17), чем в 3-й (208,70±28,07) и 4-й группе (208,77±36,93). Также через 12 мес отмечен более низкий уровень боли по шкале WOMAC (р=0,024) у пациентов 2-й группы (184,63±33,58) в сравнении с 3-й (208,70±28,07). В результате исследования выявлено достоверное снижение уровня боли у пациентов с гонартрозом, которые принимали ХС-4,6 через 3; 6 и 12 мес от начала терапии.
| Период | Группа | |||
|---|---|---|---|---|
| 1-я (ХС-4,6 + нимесулид) |
2-я (ХС-4,6 + диклофенак) |
3-я (нимесулид) |
4-я (диклофенак) |
|
| До лечения | 965,90±201,24 | 905,70±191,91 | 979,17±191,03 | 925,27±182,39 |
| Через 6 мес | 676,87±178,86 (р=0,016 в сравнении с 3-й группой) |
665,83±171,23 (р=0,006 в сравнении с 3-й группой) |
818,37±170,38 | 784,80±168,27 |
| Через 12 мес | 801,47±183,90 (р=0,033 в сравнении с 3-й группой) |
800,07±193,90 (р=0,036 в сравнении с 3-й группой) |
944,93±201,51 | 917,20±207,10 |
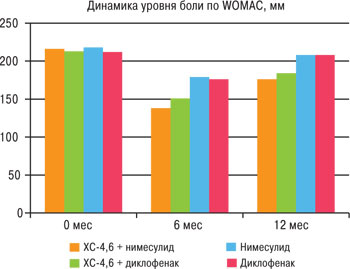
Рис. 2. Динамика интенсивности боли на фоне терапии
Показатель ограниченной подвижности сустава по WOMAC достоверно не различался во всех группах больных на протяжении всего исследования.
В тоже время показатель затруднения в выполнении повседневной деятельности по WOMAC через 6 мес достоверно (р=0,012) снизился во 2-й группе (451,03±132,37) в сравнении с 3-й группой (560,93±131,22). Такая же тенденция сохранилась и через 12 мес: показатель затруднения в выполнении повседневной деятельности по WOMAC во 2-й группе (537,83±148,25) был достоверно ниже (р=0,042), чем в 3-й группе (646,43±156,18).
Суммарный индекс WOMAC через 6 мес достоверно (р=0,006) снизился во 2-й группе (666,83±171,23) в сравнении с 3-й группой (818,37±170,38) (см. табл. 2). Также через 6 мес суммарный индекс WOMAC снизился в 1-й группе (676,87±178,86) в сравнении с 3-й группой (р=0,016). Такая же тенденция сохранилась и через 12 мес: суммарный индекс WOMAC во 2-й группе (800,07±193,90) был достоверно ниже (р=0,036), чем в 3-й группе (944,93±201,51).
Индекс Lequesne через 6 мес в 1-й группе (11,27±2,35) был достоверно ниже (р=0,006) в сравнении с 3-й (13,33±2,26), а также ниже (р=0,042) в сравнении с 4-й группой (12,9±2,2). Индекс Lequesne через 6 мес был ниже и во 2-й группе (11,37±2,17) в сравнении с 3-й и 4-й группами (р<0,01). Через 12 мес индекс Lequesne также был ниже у пациентов, применявших ХС-4,6.
Такая динамика альгофункциональных индексов WOMAC и Lequesne свидетельствует о выраженном анальгезирующем и противовоспалительном эффекте ХС-4,6.
Стандартные лабораторные показатели не имели значимой динамики в исследуемых группах и находились в пределах возрастной нормы. Достоверная разница наблюдалась только между уровнями СРБ в течение наблюдения (табл. 3). Через 6 мес от начала лечения уровень СРБ в 1-й группе (4,21±1,33) был достоверно ниже (p=0,017), чем в 3-й (5,50±1,84), а также достоверно ниже во 2-й группе (4,17±1,11), чем в 3-й (p=0,007) и 4-й (p=0,024). Через 1 год после начала исследования уровень СРБ был достоверно ниже (p=0,047) в 1-й группе (4,97±1,25) по сравнению с 3-й (6,15±1,99). Это свидетельствует о выраженном противовоспалительном эффекте ХС-4,6 и его стойком эффекте последействия.
| Период | Группа | |||
|---|---|---|---|---|
| 1-я | 2-я | 3-я | 4-я | |
| До лечения | 6,52±2,01 | 6,23±1,66 | 6,15±2,00 | 5,66±1,68 |
| Через 6 мес | 4,21±1,33 (р=0,017 в сравнении с 3-й группой) |
4,17±1,11 (р<0,05 в сравнении с 3-й и 4-й группами) |
5,50±1,84 | 5,19±1,50 |
| Через 12 мес | 4,97±1,25 (р=0,047 в сравнении с 3-й группой) |
5,07±1,20 | 6,15±1,99 | 5,74±1,72 |
Через полгода после начала исследования при ультразвуковой денситометрии было выявлено отрицательную динамику показателей МПКТ (Т- и Z-индексы в стандартных отклонениях) в 3-й и 4-й группах, где применяли нимесулид и диклофенак соответственно (рис. 3). Снижение Т-критерия в динамике за 6 мес было достоверно (p<0,01) более выражено в 4-й группе (–0,05±0,07) в сравнении с 1-й (0,00±0,04) и со 2-й группой (0,00±0,03). Отрицательная динамика Z-индекса через 6 мес также была отмечена в 3-й и 4-й группах. При этом снижение Z-индекса в стандартных отклонениях в динамике за 6 мес достоверно (p=0,018) было более выражено в 4-й группе (–0,04±0,06) по сравнению с 3-й (–0,01±0,02). Снижение Z-критерия в динамике за 6 мес было достоверно (p=0,007) в 4-й группе (–0,04±0,06) в сравнении с 1-й (0,00±0,04). Это свидетельствует о том, что потери костной массы в группах пациентов, принимавших ХС-4,6, за 6 мес исследования почти не наблюдалось, в то время как в группах, где применяли только НПВП, имело место снижение МПКТ.
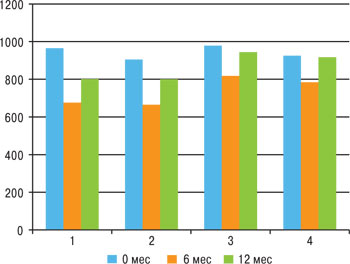
Рис. 3. Динамика показателей МПКТ (Т-критерий, SD)
| Период | Группа | |||
|---|---|---|---|---|
| 1-я (ХС-4,6 + нимесулид) |
2-я (ХС-4,6 + диклофенак) |
3-я (нимесулид) |
4-я (диклофенак) |
|
| Т-индекс, SD | ||||
| 0–6 мес | 0,00±0,04 (р=0,003 в сравнении с 4-й группой) |
0,00±0,03 (р=0,007 в сравнении с 4-й группой) |
–0,01±0,03 | –0,05±0,07 |
| 0–12 мес | –0,03±0,06 (р=0,002 в сравнении с 4-й группой) |
–0,02±0,05 (р=0,0002 в сравнении с 4-й группой) |
–0,06±0,07 | –0,10±0,08 |
| Z-индекс, SD | ||||
| 0–6 мес | 0,00±0,04 (р=0,007 в сравнении с 4-й группой) |
0,00±0,03 (р=0,007 в сравнении с 4-й группой) |
–0,01±0,02 (р=0,018 в сравнении с 4-й группой) |
–0,04±0,06 |
| 0–12 мес | –0,02±0,06 (р=0,002 в сравнении с 4-й группой) |
–0,02±0,06 (р=0,001 в сравнении с 4-й группой) |
–0,05±0,07 | –0,09±0,07 |
Через 1 год после начала наблюдения отрицательная динамика показателей МПКТ отмечалась уже во всех группах пациентов (табл. 4). Снижение Т-критерия в динамике за 12 мес было достоверно (p=0,0002) более выражено в 4-й группе (–0,10±0,08) в сравнении со 2-й группой (–0,02±0,05). Снижение Т-критерия в динамике за 12 мес также было достоверно (p=0,002) выражено в 4-й группе (–0,10±0,08) в сравнении с 1-й группой (–0,03±0,06). Отрицательная динамика Z-индекса за 12 мес также была отмечена во всех группах. При этом снижение Z-индекса в стандартных отклонениях в динамике за 12 мес достоверно (p=0,003) было более выражено в 4-й группе (–0,09±0,07) в сравнении с 1-й (–0,02±0,06). А также снижение Z-индекса в стандартных отклонениях в динамике за 12 мес достоверно (p=0,001) было более выражено в 4-й группе (–0,09±0,07) в сравнении со 2-й группой (–0,02±0,06). Динамика показателей МПКТ за 12 мес наблюдения свидетельствует о снижении МПКТ в обеих группах наблюдения, но в группах ХС-4,6 это снижение было менее выраженным. Такая динамика показателей ультразвуковой денситометрии свидетельствует о наличии положительного влияния ХС-4,6 на метаболизм костной ткани.
Выводы
1. Установлены отличительные особенности течения гонартроза у пациентов со сниженной МПКТ по сравнению с пациентами с нормальной МПКТ, а именно: более выраженные болевой синдром и ограничение функциональной активности, повышенный уровень СРБ.
2. Выявлено позитивное влияние ХС-4,6 на динамику показателей МПКТ. На протяжении исследования, через 6 и 12 мес установлено достоверно меньшее снижение Т- и Z-индексов в стандартных отклонениях в группах применения ХС-4,6.
3. На протяжении исследования выявлен значительный клинический эффект ХС-4,6 у пациентов с гонартрозом II–III рентгенологической стадии по Kellgren — Lawrence, что подтверждено клиническими и лабораторными показателями.
4. Монотерапия гонартроза с применением НПВП (нимесулид и диклофенак) имеет симптом-модифицирующее действие, уменьшает выраженность клинических проявлений заболевания только по факту их применения, но не имеет клинического эффекта последействия и не влияет на динамику маркеров воспаления.
5. Отмечено достоверно более значимое снижение Z-индекса (в стандартных отклонениях) в динамике за 6 мес в группе пациентов, применявших диклофенак, в сравнении с пациентами, принимавшими только нимесулид. Это позволяет предположить влияние нимесулида на метаболизм костной ткани.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
Berenbaum F., Eymard F., Houard X. (2013) Osteoarthritis, inflammation and obesity. Cur. Opin. Rheumatol., 25(1): 114–118.
Castaneda S., Roman-Blas J.A., Largo R. et al. (2012) Subchondral bone as a key target for osteoarthritis treatment. Biochem. Pharmacol., 83(3): 31.
Ding C., Parameswaran V., Udayan R. et al. (2008) Circulating levels of inflammatory markers predict change in bone mineral density and resorption in older adults: a longitudinal study. J. Clin. Endocrinol. Metab., 93(5): 1952–1958.
Ganesan K., Teklehaimanot S., The-Huy Tran et al. (2005) Relationship of C-reactive protein and bone mineral density in community-dwelling elderly females. J. Natl. Med. Assoc., 97(3): 329–333.
Goldring M.B., Goldring S.R. (2010) Articular cartilage and subchondral bone in the pathogenesis of osteoarthritis. Ann. NY Acad. Sci., 1192: 230–237.
Herman S., Krönke G., Schett G. (2008) Molecular mechanisms of inflammatory bone damage: emerging targets for therapy. Trends Mol. Med., 14(6): 245–253.
Iovu M., Dumais G., Du Souich P. (2008) Anti-inflammatory activity of chondroitin sul-fate. Osteoarthritis Cartilage, 16: S14–8.4.
Fardellone P., Zaim M., Saurel A. et al. (2013) Comparative efficacy and safety study of two chondroitin sulfate preparations from different origin (avian and bovine) in symptomatic osteoarthritis of the knee. Open Rheumatol. J., 7: 1–12.
Findlay D.M. (2007) Vascular pathology and osteoarthritis. Rheumatology (Oxford), 46(12): 1763–1768.
Kwan Tat S., Pelletier J.P., Verges J. et al. (2007) Chondroitin and glucosamine sulfate in combination decrease the pro-resorptive properties of human osteoarthritis subchondral bone osteoblasts: a basic science study. Arthritis Res. Ther, 9(6): R 117.
Mahjoub M., Berenbaum F., Houard X. (2012) Why subchondral bone in osteoarthritis? The
importance of the cartilage bone interface in osteoarthritis. Osteoporos Int., 23(Suppl. 8): 841–846.
Mobasheri А. (2013) The Future of Osteoarthritis Therapeutics: Targeted Pharmacological Therapy. Rheumatol. Rep., 15: 364.
Richette P., Funk-Brentano T. (2010) What is New on Osteoarthritis Front? Eur. Musculoskel. Rev., 5(2): 8–10.
Sellam J., Berenbaum F. (2010) The role of synovitis in pathophysiology and clinical symptoms of osteoarthritis. Nat. Rev. Rheumatol., 6(11): 625–635.
Suri S., Walsh D.A. (2012) Osteochondral alterations in osteoarthritis. Bone, 51(2): 204–211.
Zhuo Q., Yang W., Chen J. et al. (2012) Metabolic syndrome meets osteoarthritis. Nat. Rev. Rheumatol., 8(12): 729–737.
Walsh D.A., Chapman V. (2011) Bisphosphonates for osteoarthritis. Arthritis Res. Ther., 13(5): 128.
Адрес для переписки:
Шуба Неонила Михайловна
04112, Киев, ул. Дорогожицкая, 9
Национальная медицинская
академия последипломного
образования им. П.Л. Шупика

Leave a comment