Можливості запобігання розвитку та прогресуванню структурно-функціональних змін периферичних артерій у хворих із метаболічним синдромом та остеоартрозом шляхом застосування препарату системної ензимної терапії
Мітченко О.І. 1, Сіренко Ю.М.2, Козлюк А.С.1
- 1ДУ «Національний науковий центр «Інститут кардіології ім. М.Д. Стражеска» НАМН України», Київ
- 2ДУ «ННЦ «Інститут кардіології ім. М.Д. Стражеска НАМН України»
Резюме. У статті наведено дані дослідження ефективності препарату системної ензимотерапії (СЕТ) у запобіганні розвитку та прогресуванню структурно-функціональних змін периферичних артерій у хворих із метаболічним синдромом та остеоартрозом. У результаті проведеного дослідження виявлено, що у досліджуваних хворих спостерігаються ознаки ремоделювання та вираженої ендотеліальної дисфункції периферичних артерій порівняно зі здоровими особами. Застосування препарату СЕТ протягом 6 міс характеризувалося відновленням функціонального стану ендотелію на макро- та мікросудинному рівнях. Про це свідчили зростання вираженості вазодилатації плечової артерій та збільшення приросту кровотоку при проведенні проби з реактивною гіперемією. Лікування препаратом СЕТ у досліджуваних хворих, незважаючи на вірогідне зниження інтенсивності системного запалення та суттєве відновлення функціонального стану артеріальної судинної стінки, суттєво не впливало на вираженість структурних порушень. Водночас воно запобігало їх подальшому прогресуванню, тенденція до якого спостерігалась у хворих контрольної групи.
Незважаючи на значні досягнення останніх років у лікуванні та профілактиці розвитку захворювань атеросклеротичної природи, смертність від кардіоваскулярних подій на сьогодні посідає чільне місце у структурі летальності в більшості країн світу [7, 8]. Важливою передумовою такого стану речей є тривалий безсимптомний перебіг атеросклерозу, наслідком чого є його пізня діагностика вже на фоні гострих клінічних форм. У таких умовах загальновизнаною є необхідність виявлення і терапевтичного втручання на доклінічному етапі атерогенезу, коли зміни ще мають зворотний характер. Подібний підхід привів до формування концепції метаболічного синдрому (МС), який є кластером основних патогенетичних факторів атеросклерозу, що включає ожиріння, інсулінорезистентність, дисліпідемію, порушення толерантності до глюкози, артеріальну гіпертензію, системне запалення, оксидативний стрес, активацію коагулянтної системи крові [11].
В останній час значна увага в наукових і клінічних дослідженнях приділяється частому поєднанню МС із хронічними запальними захворюваннями, особливо з ураженням опорно-рухової системи запального характеру, що пояснюється широкою розповсюдженістю цієї патології та її безперечним впливом на ризик розвитку серцево-судинних захворювань. Крім того, результати досліджень останніх років демонструють залежність між активністю запального процесу в суглобах, вираженістю та кількістю компонентів МС, незалежно від наявності інших традиційних факторів кардіоваскулярного ризику, зокрема надмірної маси тіла, порушень обміну ліпідів. Зокрема, при проведенні проспективного дослідження «The Framingem Offspring Study» встановлено залежність між частотою остеоартрозу (ОА) колінного суглоба та наявністю МС, крім того, виявлено зв’язок між активністю запального процесу та кількістю компонентів МС, який зберігався навіть після врахування маси тіла [10].
Встановлено, що закономірним результатом хронічного підвищення активності запального процесу в поєднанні з комплексом метаболічних порушень у вигляді МС у цих хворих є ураження артеріальних судин атеросклеротичним процесом, ранній та пришвидшений розвиток його клінічного перебігу. Зокрема, показано, що у хворих на ОА та ревматоїдний артрит значно підвищена розповсюдженість дисліпопротеїнемії, дисфункція ендотелію, потовщення комплексу інтима–медіа (КІМ), ніж у середньому серед популяції, що зумовлює віднесення хворих цієї категорії до групи дуже високого ризику розвитку серцево-судинної патології [12, 14].
Багато дослідників вважають, що однією з основних причин розвитку та прогресування МС до клінічної форми ішемічної хвороби серця (ІХС) у пацієнтів із ревматичними захворюваннями суглобів може бути хронічне підвищення активності імунозапальних процесів. Згідно з результатами експериментальних та клінічних досліджень встановлено здатність медіаторів запалення, зокрема — фактора некрозу пухлини (ФНП)-α, інтерлейкінів (ІЛ)-1β, -6, С-реактивного протеїну, інгібітору активатора тканинного плазміногену 1 та інших, викликати розвиток МС з усім каскадом пов’язаних із ним метаболічних, структурних та коагуляційних порушень.
Більшість авторів пояснюють таке поєднання впливом хронічного запального процесу та оксидативного стресу як основного його ефекторного механізму на стан функціональної регуляції та процеси ремоделювання артеріальної стінки. Основним джерелом вільних радикалів в умовах системного запалення є НАД(Ф)Н-оксидаза лейкоцитів та циклооксигеназа ендотеліоцитів. Зростання продукції супероксидрадикалу призводить до інактивації ендотеліального зниження біодоступності NO та розвитку ендотеліальної дисфункції [5]. Крім того, вільні радикали спричинюють ріст концентрації пероксинітриту (ONOO), який має цитотоксичні властивості та індукує апоптоз, посилює продукцію тромбоксану, лейкотрієнів, пригнічує синтез простацикліну [5]. Таким чином, в умовах оксидативного стресу не лише втрачаються антиатерогенні захисні властивості NO, але і приєднуються додаткові механізми пошкодження стінки. Як результат зниження концентрації діючого NO, зменшується контроль за активністю проліферації гладком’язових клітин, послаблюються антиадгезивні та протизапальні властивості ендотелію, що призводить до міграції в судинну стінку запальних клітин крові, перш за все — моноцитів, активації локального запального процесу, формування бляшки зі зростанням товщини стінки і зменшенням просвіту судин, розростання інтими судин. Серед факторів, які пригнічують продукцію активного NO, також визначають підвищення концентрації медіаторів запалення, таких як ФНП-α, ІЛ-1, -6 та ін.
Накопичення результатів багатьох клінічних та експериментальних досліджень стало підставою для створення концепції, згідно з якою системне запалення є однією з найважливіших причин розвитку МС, патогенетичною ланкою, що поєднує всі його компоненти та зумовлює виражений проатерогенний вплив на стінку артерії.
Останнім часом у комплексному лікуванні ревматологічних та інших захворювань запального характеру широко використовують системну ензимотерапію (СЕТ). У багатьох дослідженнях підтверджено наявність вираженої протизапальної дії препаратів СЕТ, їх виражений нормалізуючий вплив на супутні порушення системного метаболізму та інші прояви МС. Це стало підставою для планування дослідження, мета якого — визначення можливості запобігання розвитку та прогресуванню порушень структурно-функціонального стану периферичних артерій у хворих із МС та ОА шляхом пригнічення системного запалення препаратами СЕТ.
Об’єкт і методи дослідження
Нами обстежено 78 хворих на ОА одного або обох колінних суглобів, І–ІІ рентгенологічна стадія із супутнім МС, серед них — 46 жінок середнього віку (39,8±3,6 року) та 33 чоловіки середнього віку (42,5±2,5 року). Усі обстежені перебували на лікуванні у стаціонарі відділення некоронарогенних хвороб серця та клінічної ревматології ДУ «ННЦ «Інститут кардіології ім. М.Д. Стражеска» НАМН України» у 2011–2014 рр. Клінічний діагноз ОА встановлювали згідно з критеріями Американського коледжу ревматології (American College of Rheumatology) та Європейської антиревматичної ліги (The European League Against Rheumatism) 2010 р. [16]. МС визначали у пацієнтів відповідно до критеріїв Консенсусу з діагностики метаболічного синдрому 2009 р. (A Joint Interim Statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity) для європейської популяції — за наявності щонайменше трьох із п’яти компонентів, серед яких: окружність талії >80 см, рівень тригліцеридів ≥1,7 ммоль/л, систолічний артеріальний тиск (АТ) >130 мм рт. ст. та/або діастолічний АТ >85 мм рт. ст., рівень холестерину ліпопротеїнів високої щільності <1,3 ммоль/л, гіперглікемія натще — рівень глюкози >5,6 ммоль/л [3].
Згідно з протоколом дослідження, пацієнтів розподілили на дві групи: 1-ша група (група лікування) — 35 хворих, які отримували препарат СЕТ — 19 жінок та 16 чоловіків, 2-га група (група порівняння) — 43 хворих, що не отримували протизапального лікування — 20 жінок та 22 чоловіка. Усім хворим в обох групах проведено навчання відносно модифікації способу життя та лікувальної фізкультури.
У дослідження не включали пацієнтів із посттравматичним ОА, клінічними ознаками ІХС, церебрального атеросклерозу, цукровим діабетом ІІ типу та з тяжкою неконтрольованою артеріальною гіпертензією. В усіх хворих на момент їх участі в дослідженні не спостерігалось ознак активного запального процесу в суглобах. Контрольну групу становили 25 практично здорових осіб середнього віку (40,4+2,1 року).
Детально вивчали скарги пацієнтів, анамнез із метою уточнення давності останнього загострення суглобового синдрому. Усі досліджувані хворі не менше 6 міс до початку дослідження проходили немедикаментозне лікування — дозовані фізичні вправи, корекцію маси тіла, дієту [6].
Допплерівське обстеження периферичних судин проводили на апараті «Imagic-5000» («Kontron Medical», Франція), за допомогою лінійного датчика 7 МГц у триплексному режимі (В-режим, кольорове допплерівське картування потоку, спектральний аналіз допплерівського зсуву частот). Обстеження проводили в положенні лежачи, після 15 хв перебування у спокої, в напівзатемненому приміщенні. У день обстеження виключався прийом жирної їжі, вживання кави, чаю, алкоголю і тютюнопаління.
Дослідження брахіоцефальних судин проводили за стандартною методикою [1]. Оцінювали структурно-функціональний стан екстракраніального відділу загальної сонної артерії (ЗСА) за результатами вимірювання діаметра судини, пікової систолічної швидкості кровотоку (Vps) і кінцевої діастолічної швидкості (Ved). Для оцінки периферичного опору в досліджуваному басейні визначали індекс резистентності (RI).
Вимірювання товщини КІМ (ТКІМ) проводили згідно з Консенсусом Американського товариства ехокардіографії (Use of Carotid Ultrasound to Identify Subclinical Vascular Disease and Evaluate Cardiovascular Disease Risk: A Consensus Statement from the American Society of Echocardiography Carotid Intima-Media Thickness) 2008 р. [13]. Вимірювання проводили трикратно по задній стінці ЗСА на 1,0 см проксимально від її біфуркації; значення КІМ визначали як середнє трьох вимірювань. За ТКІМ приймали відстань між внутрішньою (відносно просвіту судини) поверхнею інтими та зовнішньою (відносно адвентиції) поверхнею медії. За нормальне вважали значення <0,9 мм. Наявність атеросклеротичної бляшки визначали при потовщенні артеріальної стінки >1,3 мм, або у разі перевищення на 0,5 мм чи 50% ТКІМ прилеглих ділянок, що відповідає рекомендаціям Європейського товариства гіпертензії та Європейського товариства кардіологів (ЄТК) (Guidelines for the management of arterial hypertension, 2007) [9].
Для оцінки ендотеліального механізму регуляції судинного тонусу використовували пробу потікзалежної (ендотелійзалежної) вазодилатації (ЕЗВД). Пробу проводили на плечовій артерії (ПА) на 2–5 см вище ліктьової впадини з вимірюванням внутрішньопросвітного діаметра артерії та швидкості кровотоку (Vps ПА,Ved ПА). Вимірювання проводили первинно за 30 с до компресії артерії та повторно через 30 с після 5-хвилинної компресії плеча манжеткою сфігмоманометра. Компресію плеча відтворювали відповідно до методики D. Celermajer: з використанням тиску в середньому 250 мм рт. ст., або такого, що перевищував показник систолічного АТ не менше ніж на 40–50 мм рт. ст. [4] — до припинення кровотоку в досліджуваній артерії. Реакцію ендотелію ПА оцінювали як відношення різниці між діаметром у спокої та під час гіперемії до діаметра у спокої (%).
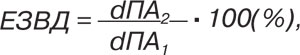
де dПА1 — середній діаметр ПА у спокої, dПА2 — середній діаметр ПА після накладання манжети. Збільшення просвіту ПА на <10% після компресії вважали проявами ендотеліальної дисфункції [2].
Ступінь дилатації артерії напряму залежить від напруження зсуву на ендотелії, до виникнення якого призводить зміна швидкості току крові в місці дослідження внаслідок декомпресії. Формування гемодинамічного удару відбувається внаслідок впливу багатьох факторів, основними з яких є стан дистального русла (активація метаболічного та біогенного механізмів регуляції), рівень серцевого викиду, показник системного АТ, в’язкість крові. Тому при збереженні ендотеліальної функції ступінь дилатації артерії при реактивній гіперемії може бути різним. Враховуючи складнощі у порівнянні результатів, коли в одних хворих значно зростала швидкість кровотоку та не спостерігалося достовірної зміни діаметра артерії, а в інших — вірогідно менше змінювався діаметр артерії при порівнюваних швидкостях, нами було застосовано уніфікований показник — коефіцієнт чутливості артерії до напруження зсуву на ендотелії, що характеризує її здатність до ЕЗВД.
Напруження зсуву вираховували за формулою:
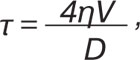
де η — в’язкість крові (в середньому — 0,05 Пз), V — максимальна швидкість кровотоку, D — діаметр артерії.
За цією формулою вираховували напруження зсуву — початкове (τ0) та при реактивній гіперемії (τ1). Знаючи зміну стимулу — напруження зсуву та відповідну йому зміну діаметра артерії, можна вирахувати чутливість ПА до напруження зсуву (К):
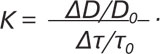
Таким чином, застосування цього методу у пацієнтів із ОА та супутнім МС дає можливість оцінювати вираженість дилататорної реакції залежно від сили гемодинамічного удару (у вигляді зміни швидкості потоку крові).
Для оцінки стану периферичних артерій нижніх кінцівок визначали кісточково-плечовий індекс (КПІ), зниження якого <0,9, згідно з даними літератури, дозволяє виявити стеноз артерій нижніх кінцівок вираженістю >50% із чутливістю 79% та специфічністю 96%.
Визначення та оцінку КПІ проводили згідно з Рекомендаціями ЄТК з діагностики та лікування захворювань периферичних артерій (Guidelines on the diagnosis and treatment of peripheral artery diseases, 2011) [15]. Для визначення КПІ за допомогою ультразвукового (УЗ)-датчика знаходили ПА, після чого накладали манжету сфігмоманометра на плече та нагнітали в ній повітря до тиску, що перевищує систолічний АТ. Тиск повітря в манжеті поступово стравлювали і фіксували показник сфігмоманометра в момент появи допплерівського сигналу кровотоку. Таким же чином проводили вимірювання систолічного АТ на протилежній руці. Після цього манжету сфігмоманометра накладали на гомілку, знаходили УЗ-датчиком задню гомілкову артерію та нагнітали повітря в манжету до зникнення артеріального кровотоку. Поступово стравлюючи повітря з манжети фіксували показник сфігмоманометра в момент появи в артерії кровотоку. Обстеження проводили на задніх та передніх гомілкових артеріях на обох ногах. Після визначення всіх показників розраховували за формулою КПІ для кожної ноги окремо.
КПІ = АТлн/АТр та КПІ = АТпн/АТр,
де АТлн — найнижчий із зафіксованих показників АТ на лівій нозі; АТр — найвищий із зафіксованих на руках показників АТ; АТпн — найнижчий із зафіксованих показників АТ на правій нозі).
Результати дослідження та їх обговорення
У результаті проведеного УЗ-дослідження периферичних судин у пацієнтів з ОА та МС виявлено виражене порушення функціональної регуляції периферичних артерій, що характеризувалося пригніченням ендотелійзалежних механізмів на макро- та мікросудинному рівні, зниженими швидкісними показниками, підвищеною жорсткістю судин та периферичним опором (рисунок). Крім того, у цих пацієнтів спостерігали структурні зміни артеріальної стінки у вигляді збільшення ТКІМ. Комплекс функціональних та структурних змін, виявлених у цих пацієнтів, мав усі ознаки ремоделювання та раннього етапу атеросклеротичного ураження судин.
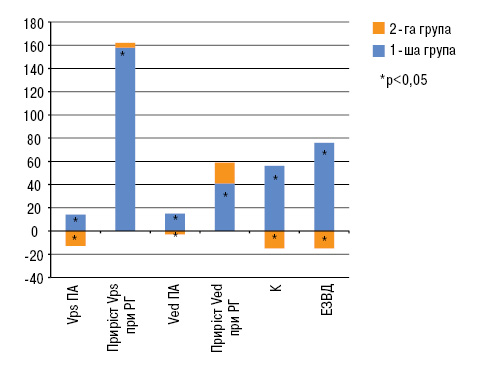
Так, при первинному вимірюванні діаметра ПА перед проведенням проби з реактивною гіперемією не виявлено достовірних відмінностей між хворими в обох досліджуваних групах та здоровими особами. У здорових осіб середнє значення діаметра ПА становило 3,83±0,07 мм, у хворих 1-ї групи — 3,94±0,07 мм, 2-ї групи — 3,85±0,05 мм. Проте в учасників дослідження у судинній стінці виявлено виражені порушення регуляції. Так, вихідне значення Vps в 1-й та 2-й групах було зменшене на 12 та 10% відповідно (до 53,67±1,58 та 55,46±1,40 см/с) порівняно з 61,02±1,18 у здорових осіб (р<0,001). Ще більш виражено були зменшені показники Ved (на 33 та 25% відповідно) у 1-й та 2-й групах (до 6,82±0,20 та 7,66±0,21см/с порівняно з 10,2±0,7 см/с у здорових; р<0,001).
У пацієнтів обох груп при проведенні манжеткової проби спостерігалася дилататорна реакція ПА, проте вона була вірогідно зменшеною порівняно з реакцією, яку спостерігали у здорових осіб. У нормі приріст діаметра артерії при реактивній гіперемії становив 12,2% (від 3,83±0,07 до 4,29±0,07 мм; р<0,001), тоді як у хворих як 1-ї, так і 2-ї груп від досягав тільки 5%, тобто 41% нормальної реакції (від 3,94±0,07 до 4,14±0,08 мм та від 3,85±0,05 до 4,06±0,05; р<0,001).
При порівняльному аналізі інтегрального показника — коефіцієнта чутливості артеріальної стінки до напруження зсуву на ендотелії — у досліджених хворих також встановлено вірогідно нижче його значення: у 1-й групі це зниження досягало в середньому 44%, у 2-й — 38% і становило відповідно 0,052±0,003 та 0,058±0,002 порівняно із 0,093±0,005 — у здорових (р<0,001).
Достовірно зменшеним у досліджених хворих був також приріст швидкісних показників потоку крові у ПА під час реактивної гіперемії. У групі контролю середня величина приросту Vps становила 92,1 см/с (від 61,02±1,18 до 153,12±4,3 см/с; р<0,001). У пацієнтів 1-ї групи середня величина приросту Vps становила 45,63 м/с і була зменшена на 50% (від 53,67±1,58 до 99,31±5,06 см/с; р<0,001), у осіб 2-ї групи приріст Vps на висоті проби досягав 46,12 см/с (від 55,46±1,40 до 101,58±3,95см/с; р<0,001) і був на 45% меншим порівняно з аналогічною реакцією у здорових осіб (р<0,001). Ще більшою мірою був зменшений приріст Ved, який у групі контролю становив 6,7 м/с (від 10,2±0,7 до 16,9±1,3 м/с; р<0,001), у 1-й групі хворих досяг лише 1,98 см/с (від 6,82±0,20 до 8,8±0,9 см/с; р<0,05) і був зменшений порівняно з нормою на 70% (р<0,001). У 2-й групі досліджених хворих приріст Ved був у межах 1,86 м/с (від 7,66±0,21 до 9,50±0,7см/с; р<0,05) і на 72% нижчим значення у групі контролю (р<0,001).
Наведені дані свідчать про розвиток у хворих обох груп значно більш вираженої дисфункції ендотелію як ПА, що проявлялося в умовах реактивної гіперемії менш вираженою її дилатацією та зниженою чутливістю до напруження зсуву, так і периферичних артерій басейну ПА, що визначали за вірогідно меншим приростом Vps та Ved у ПА в цих умовах.
Водночас в учасників дослідження хворих спостерігалися також виражені зміни структури стінки ЗСА, що проявлялося зростанням ТКІМ. Її значення було збільшене практично рівною мірою як в обох ЗСА (із правого та лівого боку), так і в обох групах хворих. У нормальних досліджених ТКІМ правої ЗСА становила 0,72±0,025 мм, а у хворих 1-ї групи вона була збільшена на 32% (до 0,96±0,01 мм; р<0,001), у хворих 2-ї групи — на 26% (до 0,95±0,02 мм; р<0,001). ТКІМ лівої ЗСА у групі контролю становила 0,77±0,031 мм і зросла на 33% (до 0,99±0,02 мм; р<0,001) у хворих 1-ї групи і на 25% (до 0,96±0,01 мм; р<0,001) — у хворих 2-ї групи (табл. 1, див. рисунок).
(1-ша група) та групі порівняння (2-га група)
| Показник | Здорові | 1-ша група | 2-га група |
|---|---|---|---|
| dЗСА пр. | 5,9±0,14 | 6,15±0,11 | 6,08±0,18 |
| – | р>0,05 | р>0,05 | |
| dЗСА лів. | 6,18±0,16 | 6,04±0,09 | 5,9±0,1 |
| – | р>0,05 | р>0,05 | |
| ТКІМ пр. | 0,72±0,025 | 0,96±0,01 | 0,95±0,02 |
| – | р<0,001 | р<0,001 | |
| ТКІМ лів. | 0,77±0,031 | 0,99±0,02 | 0,96±0,01 |
| – | р<0,001 | р<0,001 | |
| Vps пр. | 93,4±4,7 | 80,96±4,01 | 83,21±3,94 |
| – | р<0,05 | р>0,05 | |
| Vps лів. | 95,01±3,17 | 77,84±6,32 | 79,54±5,87 |
| – | р<0,05 | р<0,05 | |
| Ved пр. | 26,2±1,7 | 20,63±2,11 | 21,14±1,61 |
| – | р<0,05 | р<0,05 | |
| Ved лів. | 24,4±1,5 | 19,66±1,03 | 20,09±1,4 |
| – | р<0,01 | р<0,01 |
При оцінці діаметра ЗСА вірогідних міжгрупових відмінностей не встановлено (6,15±0,11 та 6,08±0,18 мм у 1-й та 2-й групі відповідно порівняно з 5,9±0,14 мм у здорових осіб; р>0,05). Водночас за результатами вимірювання швидкісних показників току крові спостерігалося вірогідне зниження їх показників в обох групах хворих. Так, Vps у ЗСА у 1-й групі порівняно із середнім значенням у групі контролю була нижчою на 13 та 18% справа та зліва при її значенні 80,96±4,01 та 77,84±6,32 см/с відповідно (93,4±4,7 та 95,01±3,17 см/с справа і зліва відповідно у групі здорових осіб; р<0,05). У 2-й групі різниця становила 11 та 16% (83,21±3,94 та 79,54±5,87 см/с порівняно з 93,4±4,7 та 95,01±3,17 см/с справа і зліва відповідно; р<0,05). Ще більше зниженою була Ved у ЗСА, яка в лівій ЗСА 1-ї групи була нижчою на 15% (20,63±2,11 см/с порівняно з 24,4±1,5 см/с у групі здорових; р<0,05) та на 25% — у правій ЗСА (19,66±1,03 см/с порівняно з 26,2±1,7см/с у групі здорових; р<0,05). У 2-й групі величина Ved у лівій ЗСА була зменшена на 13% (21,14±1,61см/с порівняно з 24,4±1,5 см/с у групі здорових; р<0,05), у правій — на 23% (20,09±1,4см/с порівняно з 26,2±1,7см/с у групі здорових; р<0,05).
Більш низькі швидкісні показники потоку крові в ЗСА поєднувалися з підвищеним рівнем судинного опору в її басейні, що встановлено за ≈10% більш високими показникам RI в обох групах порівняно зі здоровими особами (0,790±0,04 та 0,793±0,03 в 1-й та 2-й групі відповідно порівняно з 0,68±0,03 у групі здорових осіб; р<0,05).
Згідно з отриманими результатами значення КПІ у досліджуваних хворих було у межах встановленої норми (від 0,9 до 1,4). Проте при порівняльному аналізі показника КПІ встановлено вірогідно більш низьке його значення у хворих на ОА та МС (1,07±0,06 справа та 1,08±0,05 зліва — у 1-й групі та 1,06±0,0 справа та 1,04±0,07 зліва у 2-й групі порівняно з 1,3±0,07 справа та 1,28±0,04 зліва у здорових осіб; р<0,05). Ці дані свідчили про початкове ремоделювання стінки крупних артерій зі зростанням її жорсткості, яке ще не мало самостійного клінічного значення.
При оцінці швидкісних показників кровотоку в ПА в стані спокою через 6 міс спостереження у хворих, які отримували протизапальну терапію, спостерігалось їх наближення до нормального рівня. Так, Vps ПА у цій групі хворих була на 14% вищою вихідної (від 53,67±1,58 до 61,2±2,34 см/с; р<0,05); відзначена також тенденція до зростання значення Ved ПА (від 6,82±0,20 до 7,88±0,94 см/с; р>0,05). Водночас у групі хворих, які не отримували лікування, рівень Vps вірогідно знизився від вихідного значення на 12,8% (від 55,46±1,40 до 48,33±2,14 см/с; р<0,05), а Ved практично не змінився (табл. 2, див. рисунок).
у ПА до та під час проби з реактивною
гіперемією (РГ) у групі застосування СЕТ (1-ша група)
та групі порівняння (2-га група)
| Показник | 1-ша група | 2-га група | |||
|---|---|---|---|---|---|
| Вихідні | Через 6 міс | Вихідні | Через 6 міс | ||
| D0, Мм | M+m | 3,94±0,07 | 3,86±0,08 | 3,85±0,05 | 3,9±0,04 |
| р | – | >0,05 | – | >0,05 | |
| D1, Мм | M+m | 4,14±0,08 | 4,20±0,08 | 4,06±0,05 | 4,1±0,07 |
| p | – | >0,05 | – | >0,05 | |
| ΔD% (ЕЗВД) | M+m | 5,01±0,37 | 8,80±0,94 | 6,06±0,36 | 5,12±0,27 |
| p | – | <0,05 | – | <0,05 | |
| Vps до РГ,см/с | M+m | 53,67±1,58 | 61,2±2,34 | 55,46±1,40 | 48,33±2,14 |
| p | – | <0,05 | – | <0,05 | |
| Vps під час РГ, см/с | M+m | 99,3±5,06 | 134,5±6,75 | 101,58±3,95 | 96,2±3,22 |
| p | – | <0,05 | – | >0,05 | |
| Ved до РГ,см/с | M+m | 6,82±0,20 | 7,88±0,94 | 7,66±0,21 | 7,89±0,81 |
| p | – | >0,05 | – | >0,05 | |
| Ved під час РГ, см/с | M+m | 8,8±0,9 | 11,15±0,92 | 9,50±1,02 | 10,1±1,02 |
| p | – | <0,05 | – | >0,05 | |
| К | M+m | 0,052±0,003 | 0,081±0,007 | 0,058±0,002 | 0,049±0,002 |
| p | – | <0,05 | – | <0,05 | |
Відзначали значно більш виражений вплив лікування препаратом СЕТ протягом дослідження на стан функції ендотелію магістральних судин, про що свідчили зміни діаметра ПА в умовах проведення манжеткової проби. Так, ЕЗВД ПА в ході реактивної гіперемії хоча і не досягала нормального рівня, проте характеризувалася збільшенням на 76% відносно рівня, який спостерігався до початку лікування (від 5,01±0,37 до 8,80±0,94%; р<0,001). Водночас у групі порівняння ендотеліальна дисфункція продовжувала прогресувати, та вираженість її ЕЗВД знизилася на 15% відносно вихідного значення (від 6,06±0,36 до 5,12±0,27%; р<0,05). Варто зазначити, що у групі лікування у 4 осіб спостерігалося відновлення ЕЗВД >10%, що дозволяє розцінювати у них функцію ендотелію як нормальну. Ще одним підтвердженням функціональної нормалізації ендотелійзалежних механізмів у групі застосування СЕТ було зростання коефіцієнта чутливості до напруження зсуву на 56% від вихідного показника (від 0,052±0,003 до 0,081±0,007; р<0,05).
Крім того, на фоні застосування препарату СЕТ суттєво відновлювалася й функція периферичних судин, про що свідчило збільшення приросту Vps після декомпресії ПА на 158% (від 53,67±1,58 до 99,3±5,06 см/с на початку дослідження та від 61,2±2,34 до 134,5±6,75см/с — на його завершальному етап; р<0,05) та приросту Ved — на 41% (відповідно від 7,88±0,94 до 11,15±0,92 см/с та від 6,82±0,20 до 8,8±0,9), тоді як у групі порівняння приріст швидкості в ПА під час реактивної гіперемії вірогідно не змінився.
При порівняльному аналізі результатів швидкісних характеристик кровотоку в ЗСА після 6 міс дослідження у групі лікування не встановлено вірогідного зростання Vps та Ved, і отримані дані дозволяють оцінювати їх збільшення лише на рівні тенденції (табл. 3). Разом з тим TКІМ у хворих, у яких застосовували препарат СЕТ, вірогідно не зростала (від 0,96±0,01 до 0,97±0,02 мм справа та від 0,99±0,02 до 0,98±0,03 мм — зліва в кінці дослідження; р>0,05), що в умовах нормалізації судинно-рухової функції та ендотеліальних механізмів антиатерогенного захисту було свідченням відсутності інтенсивного прогресування атеросклеротичного процесу. Вірогідної зміни у ТКІМ не встановлено і в групі, в якій лікування не застосовувалося, проте у 4 осіб виявлено новоутворену атеросклеротичну бляшку, наявність якої визначали за різницею товщини двох суміжних ділянок КІМ на >50%.
| Показник | 1-ша група | 2-га група | |||
|---|---|---|---|---|---|
| Вихідні | Через 6 міс | Вихідні | Через 6 міс | ||
| D пр. ЗСА, мм | M+m | 6,15±0,11 | 6,02±0,41 | 6,08±0,18 | 6,1±0,2 |
| р | – | >0,05 | – | >0,05 | |
| D лів. ЗСА, мм | M+m | 6,04±0,09 | 6,01±0,21 | 5,9±0,1 | 5,9±0,03 |
| р | – | >0,05 | – | >0,05 | |
| TКІМ пр. ЗСА, мм | M+m | 0,96±0,01 | 0,97±0,02 | 0,95±0,02 | 0,98±0,01 |
| р | – | >0,05 | – | >0,05 | |
| TКІМ лів. ЗСА, мм | M+m | 0,99±0,02 | 0,98±0,03 | 0,96±0,01 | 1,01±0,3 |
| р | – | >0,05 | – | >0,05 | |
| Vps у пр. ЗСА, см/с | M+m | 80,96±4,01 | 85,37±5,31 | 83,21±3,94 | 80,6±2,16 |
| р | – | >0,05 | – | >0,05 | |
| Vps у лів. ЗСА, см/с | M+m | 77,84±6,32 | 81,4±4,8 | 79,54±5,87 | 77,3±4,49 |
| р | – | >0,05 | – | >0,05 | |
| Ved у пр. ЗСА, см/с | M+m | 20,63±2,11 | 20,18±1,97 | 21,14±1,61 | 22,34±1,98 |
| р | – | >0,05 | – | >0,05 | |
| Ved у лів. ЗСА, см/с | M+m | 19,66±1,03 | 20,41±1,76 | 20,09±1,4 | 20,9±2,1 |
| р | – | >0,05 | – | >0,05 | |
| RI судин басейну пр. ЗСА | M+m | 0,790±0,05 | 0,78±0,05 | 0,793±0,04 | 0,827±0,02 |
| р | – | >0,05 | – | >0,05 | |
| RI судин басейну лів. ЗСА | M+m | 0,802±0,05 | 0,78±0,07 | 0,798±0,04 | 0,834±0,05 |
| р | – | >0,05 | – | >0,05 | |
Результати оцінки КПІ у групі протизапального лікування знаходились у межах норми, а також вірогідно не відрізнялися від початкового рівня та від середнього показника у групі порівняння (табл. 4).
| Показник | 1-ша група | 2-га група | |||
|---|---|---|---|---|---|
| Вихідні | Через 6 міс | Вихідні | Через 6 міс | ||
| КПІ пр. | M+m | 1,07±0,06 | 1,1±0,07 | 1,08±0,05 | 1,09±0,04 |
| р | – | >0,05 | – | >0,05 | |
| КПІ лів. | M+m | 1,06±0,06 | 1,15±0,04 | 1,04±0,07 | 1,04±0,08 |
| р | – | >0,05 | – | >0,05 | |
Висновки
1. У осіб із МС та ОА виражене системне запалення зберігається навіть в умовах ремісії та поєднується зі значними системними судинними функціональними та структурними порушеннями на рівні як магістральних, так і дрібних судин артеріального русла.
2. У магістральних артеріальних судинах в учасників дослідження спостерігається виражене ремоделювання зі зростанням ТІМ, підвищенням жорсткості судинної стінки та порушенням функції ендотелію, що проявляється зменшенням дилататорної реакції в умовах реактивної гіперемії при проведенні манжеткового тесту. Наявність виражених структурних змін у периферичних відділах басейнів сонних артерій та ПА проявляється наявністю підвищеного опору потоку крові та зменшенням інтенсивності кровотоку, функціональних — зменшенням приросту кровотоку у систолу та діастолу в умовах реактивної гіперемії, а також значно меншим зниженням судинного опору в цих умовах.
3. Застосування препарату СЕТ супроводжувалось як вираженим зниженням інтенсивності системного запалення, так і поліпшенням функціонального стану ендотелію на макро- та мікросудинному рівнях. Про це свідчили зростання вираженості вазодилатації ПА та збільшення приросту кровотоку при проведенні проби з реактивною гіперемією.
4. Лікування хворих препаратом СЕТ, незважаючи на вірогідне зменшення інтенсивності системного запалення та суттєве відновлення функціонального стану артеріальної судинної стінки, суттєво не впливало на вираженість структурних порушень. Водночас воно запобігало їх подальшому прогресуванню, тенденція до якого спостерігалась у хворих контрольної групи.
5. Отримані дані свідчать про те, що функціональні зміни артеріальних судин у пацієнтів із МС та ОА мають значною мірою зворотний характер, а застосування протизапальної терапії супроводжувалось їх вираженою регресією.
Список використаної літератури
- 1. Лелюк В.Г., Лелюк С.Є. (2003) Ультразвуковая ангіологія. Реальное время, Москва, 120–126 с.
- 2. Терегулов Ю.Г., Хусаинова Д.К., Салихов И.Г. и др. (2004) К методологии проведения пробы и оценки эндотелийзависимой дилатации плечевой артерии. Эхография, 5: 217.
- 3. Alberti K., Robert H., Scott M. (2009) Harmonizing the metabolic syndrome Circulation, 120: 1640–1645.
- 4. Celermajer D.S., Sorensen K.E., Gooch V.M. (1992) Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis. Lancet, 340: 1111–1115.
- 5. Chartrain N.A., Geller D.A., Koty P.P. et al. (1994) Molecular cloning, structure, and chromosome all ocalization of thehuman inducible nitric oxide synthase gene. J. BiolChem., 269: 6765–6772.
- 6. Fernandes L., Hagen K.B., Bijlsma J.W. et al. (2013) EULAR recommendations for the non-pharmacological core management of hip and knee osteoarthritis. Ann. Rheum. Dis., 72: 1125–1135.
- 7. Ford E.S. (2005) Risks for all-cause mortality, cardiovascular disease, and diabetes associated with the metabolic syndrome: a summary of evidence. Diabetes Care., 28: 1769–1778.
- 8. Malik S., Wong N.D., Franklin S.S. et al. (2004) Impact of the metabolic syndrome on mortality from coronary heart disease, cardiovascular disease, and all causes in United States adults. Circulation, 110(10): 1240–1245.
- 9. Mancia G., Backer G.D., Dominiczak A. (2007) Guidelines for the management of arterial hypertension. Eur. Heart J., 28: 1462–1536.
- 10. Monira H., Wang Y., Cicuttini F. et al. (2014) Incidence of total knee and hip replacement for osteoarthritis in relation to the metabolic syndrome and its components: a prospective cohort study. Semin. Arthritis Rheum. 43(4): 429–436.
- 11. Khot U.N., Khot M.B., Bajzer C.T. et al. (2003) Prevalence of conventional risk factors in patients with coronary heart disease. JAMA, 290: 898–904.
- 12. Randall O., Esler M., Calfee R. (1976) Arterial compliance in hypertension. Austral. And N.Z. J. Med., 6(2): 49—57.
- 13. Stein J.H.(2008) Use of Carotid Ultrasound to Identify Subclinical Vascular Disease and Evaluate Cardiovascular Disease Risk: A Consensus Statement from the American Society of Echocardiography Carotid Intima-Media Thickness. The Journal of the American Society of Echocardiography (JASE), 21(2): 93–111.
- 14. Tam L.S., Fan B., Li E.K. et al. (2003) Patients with systemic lupus erythematosus show increased platelet activation and endothelial dysfunction induced by acute hyperhomocysteinemia. J. Rheumatol., 30(7): 1479–1484.
- 15. Tendera M. (2011) Guidelines on the diagnosis and treatment of peripheral artery diseases. Eur. Heart J., 32: 2851–2906.
- 16. Zhang W., Doherty М., Peat G. et al. (2010) EULAR evidence-based recommendations for the diagnosis of knee osteoarthritis. Ann. Rheum. Dis., 69: 483–489.
Возможности предупреждения развития и прогрессирования структурно-функциональных изменений периферических артерий у больных с метаболическим синдромом и остеоартрозом с помощью применения препарата системной энзимной терапии
Резюме. В статье представлены данные исследования эффективности препарата системной энзимотерапии (СЕТ) в предупреждении развития и прогрессирования структурно-функциональных изменений периферических артерий у больных с метаболическим синдромом и остеоартрозом. Согласно полученным результатам установлено, что у исследуемых больных наблюдаются признаки ремоделирования и выраженной эндотелиальной дисфункции периферических артерий в сравнении с показателями у здоровых. Применение препарата СЕТ на протяжении 6 мес характеризировалось восстановлением функционального состояния эндотелия на макро- и микрососудистом уровнях. Об этом свидетельствовали возрастание выраженности вазодилатации плечевой артерии и увеличение прироста кровотока при проведении пробы с реактивной гиперемией. Лечение препаратом СЕТ у исследуемых больных, несмотря на вероятное уменьшение интенсивности системного воспаления и существенное восстановление функционального состояния артериальной стенки, существенно не влияло на выраженность структурных нарушений. В то же время оно предупреждало их дальнейшее прогрессирование, тенденция к которому наблюдалась у больных группы контроля.
эндотелиальная дисфункция, остеоартроз, метаболический синдром, системная энзимотерапия.
Адреса для листування:
Аліна Сергіївна Козлюк
03680, Київ, вул. Народного ополчення, 5
ДУ «Національний науковий центр
«Інститут кардіології
ім. М.Д. Стражеска»
НАМН України»

Leave a comment