Ураження суглобів при системному васкуліті
Синяченко О.В., Ермолаева М.В., Егудина Е.Д., Седая Л.В.
Резюме. Мета і завдання дослідження — вивчення уражень окремих суглобів при системному васкуліті, їх рентгеносонографічна характеристика, взаємозв’язок тяжкості артикулярного синдрому із позасуглобовими проявами захворювань, а також аспекти патогенезу артриту у цієї категорії хворих. Об’єкт і методи: під наглядом перебували 525 хворих у співвідношенні числа обстежених із васкулітом Шенляйна — Геноха, мікроскопічним поліангіїтом, кріоглобулінемічним васкулітом, вузликовим поліартеріїтом, аортоартеріїтом Такаясу, гранулематозом із поліангіїтом Вегенера та еозинофільним гранулематозним поліангіїтом Черджа — Стросс як 7:4:3:1:1:1:1. Результати: ураження суглобів у вигляді артриту або артралгії спостерігається у 32–67% кількості хворих різних груп, що залежить від тривалості захворювань, ступеня активності патологічного процесу, тяжкості екстраартикулярних ознак, функцій легень і стану гемодинаміки в малому колі кровообігу, частоти уражень окремих кісткових зчленувань, тендовагініту, ентезопатії та рентгеносонографічних ознак суглобового синдрому при різних васкулітах має свій диморфізм, а в патогенетичних побудовах артропатії беруть участь порушення системи імунітету, реологічних властивостей крові та ендотеліальної функції судин, причому високі параметри ревматоїдного фактора в крові є чинником ризику тяжкості перебігу уражень суглобів. Висновки: суглобовий синдром при різних варіантах системного васкуліту розвивається у ⅓–⅔ випадків, має свої особливості перебігу й патогенезу.
Введение
Распространенность системного васкулита (СВ) в мире неуклонно повышается, составляя 2–3 случая на 10 тыс. населения (Mohammad A.J. et al., 2009). В настоящее время изучение СВ относится к наиболее динамично развивающимся областям ревматологии (Бекетова Т.В., 2014), при этом подчеркивается как клинико-патогенетическая общность этих заболеваний, так и определенные отличия отдельных нозологических форм (Gibelin A. et al., 2011; Дядык А.И. (ред.), 2013; Кузьміна А.П., 2013). Дифференциальная диагностика является довольно сложной, поскольку клиническая симптоматика СВ характеризуется наличием «перекрещивающихся синдромов» (Шилкина Н.П., Дряженкова И.В., 2013).
Суставной синдром является одним из основных признаков, составляющих аортоартериит Такаясу (ААТ) (Borchers A.T., Gershwin M.E., 2012), микроскопический полиангиит (МПА) (Tsuchiya N., 2012), гранулематоз с полиангиитом Вегенера (ГПА) (Salazar-Exaire D. et al., 2012; Soriano A. et al., 2012), криоглобулинемический васкулит (КГВ) (Lamprecht P. et al., 2012; Terrier B., Cacoub P., 2013). Поражение суставов в виде артрита или артралгии наблюдается у 65–70% числа больных эозинофильным гранулематозом с полиангиитом Черджа — Стросс (ЭПА) (Gendelman S. et al., 2013), у 40–50% КГВ (Terrier B. et al., 2012), у 45–65% васкулитом Шенляйна — Геноха (ВШГ) (Poterucha T.J. et al., 2013; Belli A.A., Dervis E., 2014; Calvo-Rio V. et al., 2014), причем чаще всего в патологический процесс вовлекаются коленное и голеностопное сочленения (Chen O. et al., 2013). При МПА число пациентов с костно-мышечными изменениями увеличивается в течение первых 5 лет после дебюта заболевания, когда, помимо прочего, начинает развиваться снижение параартикулярной минеральной плотности кости (Itabashi M. et al., 2014).
Необходимо отметить, что в современной литературе продолжает в основном отмечаться лишь частота артропатии у больных СВ. Цель и задачи данного исследования — изучение поражения отдельных суставов при ААТ, МПА, ГПА, ЭПА, ВШГ, КГВ и узелковом полиартериите (УПА), их рентгеносонографическая характеристика, взаимосвязь тяжести артикулярного синдрома со внесуставными проявлениями заболеваний, а также аспекты патогенеза артрита у такой категории больных.
Объект и методы исследования
Под наблюдением находились 525 больных СВ, характеристика которых представлена в табл. 1. Соотношение числа больных ВШГ, МПА, КГВ, УПА, ААТ, ГПА и ЭПА составило как 7:4:3:1:1:1:1. Согласно общепризнанной Чэпел — Хиллской классификации (США, 2012), ААТ относится к СВ крупных сосудов, УПА — средних, все остальные — мелких, причем МПА, ГПА и ЭПА являются СВ, ассоциированными с антинейтрофильными цитоплазматическими антителами, а ВШГ и КГВ — иммунокомплексными. При ААТ превалировали женщины, при УПА — мужчины, соответственно в соотношении 3:1 и 2:1, более молодого возраста были пациенты с ВШГ, а старшего — с КГВ. Следует подчеркнуть, что клиническая характеристика больных представлена на момент их обследования. Так, на предыдущих этапах все обследованные с МПА, ВШГ и КГВ имели изменения кожи, 93% с ВШГ — суставной синдром. В случаях УПА, МПА и КГВ превалировали поражения периферической нервной системы (моно- и полинейропатия, радикулопатия, мортоновская метатарзалгия), а у больных ААТ и ГПА — центральной нервной системы (дисциркуляторная энцефалопатия, нарушения мозгового кровообращения, кортиконуклеарный и псевдобульбарный синдромы). 55% числа пациентов с ААТ имели аортальный порок сердца, 17% перенесли инфаркт миокарда, 21% — мозговой инсульт, 36% с УПА были носителями антигена вирусного гепатита В (HВV), а 29% с КГВ — гепатита С (HСV). Криоглобулины на момент обследования выявлены у 97% числа больных КГВ, повышенный уровень иммуноглобулина (Ig) A — у 72% с ВШГ, противонейтрофильные цитоплазматические антитела — у 75% с ГПА, у 71% с МПА и у 57% с ЭПА (соответственно в соотношениях антител к миелопероксидазе и протеиназе-3 как 1:6, 2:1 и 8:1). Уровень эозинофилов в крови больных ЭПА составил 15,1±2,12% числа лейкоцитов или 2,1±0,82⋅10/л.
| Показатель | Группа больных СВ (n=525) | |||||||
|---|---|---|---|---|---|---|---|---|
| ААТ | УПА | МПА | ГПА | ЭПА | ВШГ | КГВ | ||
| Число больных в группах | 29 | 39 | 116 | 28 | 27 | 193 | 93 | |
| Мужчины/женщины, % | 24/76 | 62/38 | 41/59 | 57/43 | 44/56 | 51/49 | 41/59 | |
| Возраст (M±m), лет | 44,2±2,48 | 44,2±1,88 | 44,8±1,23 | 46,0±2,41 | 40,4±2,59 | 26,2±0,72 | 52,3±1,28 | |
| Длительность болезни(M±m, годы) | 10,4±1,98 | 8,5±1,30 | 6,4±0,70 | 4,3±0,83 | 10,7±2,05 | 9,0±0,60 | 4,6±0,62 | |
| II–III степени активности, % | 86 | 79 | 85 | 93 | 85 | 72 | 92 | |
| Острое течение, % | – | 15 | 28 | 56 | – | 19 | 43 | |
| Признаки поражения, % | кожи скелетных мышц сердца печени селезенки нервной системы почек |
17 48 76 28 4 21 62 |
31 54 80 56 13 90 62 |
82 38 51 56 8 48 67 |
21 36 50 46 7 46 64 |
52 37 48 33 19 37 56 |
64 15 31 22 7 18 67 |
85 26 61 62 25 40 68 |
| Почечная недостаточность, % | 35 | 26 | 35 | 29 | 26 | 18 | 32 | |
| Скорость клубочковой фильтрации, мл/мин | 107,1±4,78 | 104,4±4,18 | 101,2±2,51 | 108,2±3,99 | 110,5±4,34 | 110,3±1,92 | 103,3±2,68 | |
Рентгенологическое исследование периферических суставов, крестцово-подвздошных сочленений, позвоночника и легких проводили на аппарате «Multix-Compact-Siеmens» (Германия), ультразвуковое исследование суставов и внутренних органов — на «Envisor-Philips» (Нидерланды), электрокардиографическое — на «МІДАК-ЕК1Т» (Украина) и «Bioset-8000» (Германия), эхокардиографическое — на «HD-11-XE-Philips» (Нидерланды), спирографическое — на «Master-Scope-Jaeger» (Германия), исследование альвеолярно-капиллярной мембраны — на «Master-Screen-Body-Jaeger» (Германия). Для оценки лабораторных показателей использовали анализаторы «BS-200» (Китай) и «Olympus-AU640» (Япония), ридер «PR2100-Sanofi diagnostic pasteur» (Франция), иммуноблот «Euroline-Euroimmun» (Германия), компьютерные тензиометры «ADSA-Toronto» (Германия — Канада) и «PAT2-Sinterface» (Германия). Подсчитывали число болезненных суставов (NPJ), индексы Лансбури (iL), iDAS, iDAS28 и интегральной тяжести артропатии (iWA) по формуле:
iWA = √iL•DAS.
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного, непараметрического, корреляционного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы «Microsoft Excel» и «Statistica-Stat-Soft», США). Оценивали средние значения (M), их стандартные ошибки (m), стандартные отклонения (SD), коэффициенты корреляции, критерии дисперсии, Стьюдента, Уилкоксона — Рао, Макнемара — Фишера и достоверность статистических показателей.
Результаты исследования
Такие поражения суставов, как артрит или артралгия, отмечают у 32% числа больных ГПА, у 41% — ААТ, у 47% — ВШГ, у 52% — УПА, у 63% — МПА и ЭПА, у 67% — КГВ, а моноолигоартрит — соответственно в 33; 50; 54; 25; 58; 18 и 50% наблюдений. По данным однофакторного дисперсионного анализа, на развитие суставного синдрома при МПА влияют изменения скелетных мышц и легких, при ГПА — длительность заболевания, наличие изменений со стороны кожи, сердца и печени, при ВШГ — возраст пациентов, степень активности патологического процесса, поражение кожи и почек, при ЭПА — только кожный синдром, при КГВ — миозит/миалгия, пневмопатия и нефропатия. Возникновение артропатии зависит от тяжести экстраартикулярных проявлений болезни при УПА, МПА, ГПА, ВШГ и КГВ. С учетом связей частоты формирования артропатии при МПА и КГВ мы провели дополнительный анализ. Оказалось, что на суставной синдром у больных МПА достоверно влияют показатели соотношения систолического давления в легочной артерии к периферическому артериальному давлению и диффузионной способности легких, а в случаях КГВ — параметры легочного сосудистого сопротивления и конечно-диастолического размера правого желудочка.
Как свидетельствует выполненный ANOVA, характер суставного синдрома при ААТ зависит от параметров в крови фибриногена, при УПА — от концентрации циркулирующих иммунных комплексов и антител к нативной дезоксирибонуклеиновой кислоте (аДНК), при МПА — от уровня антител к протеиназе-3, при ГПА — от содержания последних и значений фибронектинемии, при ЭПА — от показателей в крови С-реактивного протеина и наличия антител к миелопероксидазе, при ВШГ — от параметров IgA, индексов агрегации тромбоцитов и эритроцитов, тромбоксана A2, простациклина и простагландина E2, при КГВ — от показателей фактора некроза опухоли-γ, эндотелина-1 и простагландина F2a. Необходимо подчеркнуть, что при УПА имеет место достоверное влияние на развитие поражений суставов носительства HBV. У таких пациентов суставной синдром констатируют во всех случаях, тогда как без HBV — только в 48% (различия высокодостоверны).
В табл. 2 в обобщенном виде представлена частота вовлечения в патологический процесс отдельных суставов и наличия рентгеносонографических признаков артропатии, при этом выявлены особенности артикулярного синдрома у больных с разными вариантами СВ. Так, для ЭПА оказались относительно характерными поражения верхнечелюстных и грудино-ключичных суставов, для ААТ — проксимальных межфаланговых кистей, плечевых и коленных, для УПА — локтевых и плюснефаланговых, для МПА — лучезапястных и голеностопных, для КГВ — крестцово-подвздошных и позвонковых. В свою очередь, изменения грудино-ключичных сочленений относятся к «суставам-исключениям» ААТ, ГПА и КГВ, голеностопных, крестцово-подвздошных и позвонковых — ГПА, локтевых — ААТ, плечевых — ЭПА и КГВ.
| ААТ | УПА | МПА | ГПА | ЭПА | ВШГ | КГВ | ААТ | УПА | МПА | ГПА | ЭПА | ВШГ | КГВ | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | ⊕ | ∅ | I | ∅ | ⊕ | ∅ | ⊕ | ||||||||
| 2 | ∅ | ∅ | ⊕ | ∅ | II | ∅ | ∅ | ||||||||
| 3 | ⊕ | III | |||||||||||||
| 4 | IV | ⊕ | ∅ | ⊕ | |||||||||||
| 5 | ⊕ | V | ⊕ | ⊕ | ∅ | ||||||||||
| 6 | ∅ | ⊕ | VI | ∅ | ∅ | ∅ | ∅ | ||||||||
| 7 | ⊕ | ∅ | ∅ | VII | ∅ | ∅ | |||||||||
| 8 | VIII | ∅ | ∅ | ∅ | |||||||||||
| 9 | ⊕ | IX | ∅ | ∅ | |||||||||||
| 10 | ⊕ | ∅ | X | ⊕ | ⊕ | ∅ | |||||||||
| 11 | ⊕ | XI | ∅ | ∅ | |||||||||||
| 12 | XII | ⊕ | ∅ | ||||||||||||
| 13 | ∅ | ⊕ | XIII | ∅ | |||||||||||
| 14 | ∅ | ∅ | ⊕ | XIV | ⊕ |
Суставы: 1 — верхнечелюстные; 2 — грудино-ключичные; 3 — проксимальные межфаланговые кистей; 4 — пястно-фаланговые; 5 — лучезапястные; 6 — локтевые; 7 — плечевые; 8 — проксимальные межфаланговые стоп; 9 — плюснефаланговые; 10 — голеностопные; 11 — коленные; 12 — тазобедренные; 13 — крестцово-подвздошные; 14 — позвонковые. Признаки: I — тендовагинит; II — энтезопатия; III — эпифизарный остеопороз; IV — субхондральный склероз; V — остеокистоз; VI — остеоузурация; VII — лигаментоз; VIII — асептический некроз; IX — артрокальцинаты; X — изменения менисков; XI — кисты Бейкера; XII — тела Пеллагри — Штайди; ХIII — хондромные тела; XIV — тела Гоффа; ⊕ характерный признак; ∅ отсутствие признака.
Для ААТ относительно характерны изменения рогов менисков, наличие интраартикулярных тел Пеллагри — Штайди и Гоффа, для УПА — кисты Бейкера. Тендовагиниты можно считать типичными при УПА и КГВ, субхондральный склероз и остеокистоз — для пациентов с ГПА и ЭПА. Отмечают отсутствие случаев тендовагинита и энтезопатии при ААТ и МПА, а в целом скудное разнообразие «рентгеносонографического пейзажа суставного синдрома» отмечают в случаях ГПА.
По данным многофакторного анализа Уилкоксона — Рао, характер течения артропатии у больных МПА зависит от поражения легких и сердца, при ВШГ — от вовлечения в процесс легких и печени, при КГВ — от патологии почек и интегральной тяжести экстраартикулярных признаков болезни. Как свидетельствует ANOVA/MANOVA, интегральные рентгеносонографические признаки изменений суставов у больных УПА зависят от степени активности заболевания и тяжести внесуставных проявлений, при МПА — от характера нефропатии, при ВШГ — пневмопатии.
Обсуждение
Как демонстрирует выполненный ANOVA, возраст больных ААТ, УПА, МПА и ЭПА влияет на частоту поражения верхнечелюстных сочленений. С возрастом пациентов с ААТ тесно связаны изменения проксимальных межфаланговых суставов кистей, при УПА — коленных суставов, при МПА — грудино-ключичных, spy on cell phone лучезапястных и проксимальных межфаланговых стоп, при ВШГ — лучезапястных и плечевых. Наличие кардиопатии (нарушения возбудимости миокарда, электрической проводимости сердца, изменения миокарда, эндокарда и сердечных клапанов, диастолическая и систолическая дисфункции левого желудочка) оказывают дисперсионное воздействие на проксимальные межфаланговые суставы пальцев рук, лучезапястные и голеностопные у больных ААТ, а только на лучезапястные — при КГВ, от характера нефропатии (мочевой или нефротический синдром, состояние функции почек) зависят при ААТ плюснефаланговые сочленения, при УПА — лучезапястные, при КГВ — проксимальные межфаланговые стоп и тазобедренные.
Возникновение тендовагинита при УПА и ЭПА тесно связано с печеночной патологией, энтезопатий при МПА и ВШГ — с почечной. Появление внутрисуставных тел (хондромных, Пеллагри — Штайди, Гоффа) у больных ААТ происходит параллельно увеличению длительности заболевания, а при МПА — определяется тяжестью кожно-мышечного синдрома. От экстраартикулярных проявлений СВ зависят костнодеструктивные признаки со стороны опорно-двигательного аппарата. Необходимо отметить, что кисты Бейкера при МПА и поражения верхнечелюстных суставов при ВШГ наблюдаются исключительно у мужчин, тогда как частота поражения проксимальных межфаланговых суставов кистей и пястно-фаланговых у больных ВШГ достоверно превалирует в женской группе, соответственно в 3,7 и 3,2 раза.
Как видно из табл. 3, наибольший артикулярный счет (NPJ) присущ больным ГПА, а большая интегральная тяжесть суставного синдрома — пациентам с ААТ. По данным дисперсионного анализа, параметры NPJ при УПА тесно связаны с тяжестью поражения кожи, при МПА — с острым течением болезни, при ВШГ — с изменениями со стороны нервной системы, при КГВ — с выраженностью печеночной патологии.
| СВ | Показатель | ||||
|---|---|---|---|---|---|
| NPJ, абс. | iL, баллы | iDAS, о.е. | iDAS28, о.е. | iWA,о.е. | |
| ААТ УПА МПА ГПА ЭПА ВШГ КГВ |
10,6±3,10 11,9±2,68 8,5±1,38 14,4±4,79 13,1±2,91 7,7±0,87 7,3±1,32 |
78,7±14,38 60,6±9,30 58,7±4,85 48,0±17,07 60,8±12,12 60,8±4,54 53,8±4,37 |
2,4±0,50 2,2±0,32 1,7±0,19 2,3±0,62 2,0±0,27 1,5±0,18 1,2±0,09 |
3,4±0,51 2,9±0,32 2,7±0,20 3,3±0,67 2,9±0,29 2,5±0,19 2,2±0,10 |
22,7±6,10 19,3±4,25 15,0±2,29 18,8±8,33 16,7±4,11 13,9±2,10 9,5±1,26 |
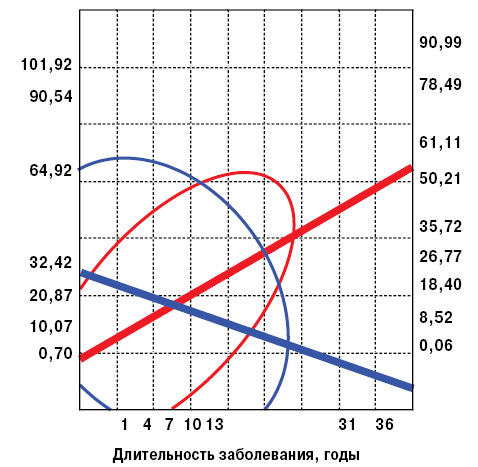
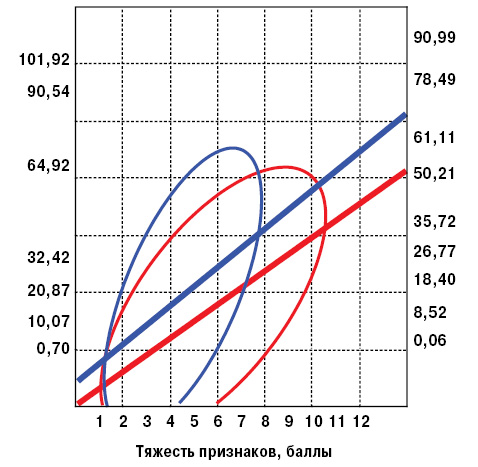
Степень тяжести суставного синдрома, оцененная по iWA, при УПА и ВШГ зависит от функционального состояния почек, при МПА и ВШГ — от интегральной тяжести экстраартикулярных признаков заболевания. Кроме того, на iWA в группе ВШГ влияет общая степень активности болезни. Если выраженность артропатии с увеличением продолжительности МПА возрастает, то у больных ВШГ уменьшается (рис. 1). В свою очередь, в обеих группах больных СВ iWA повышается, согласно увеличению интегральной тяжести экстраренальных проявлений заболеваний (рис. 2).
На распространенность суставного синдрома у больных ААТ достоверно влияют показатели в крови циркулирующих иммунных комплексов и антител к кардиолипину, при МПА — уровни ревматоидного фактора (РФ), фибриногена, аДНК, эндотелина-1, гомоцистеина и модуля вязкоэластичности сыворотки крови, при ГПА — концентрации РФ, антител к миелопероксидазе, IgG, циклического гуанозинмонофосфата и поверхностной вязкости крови, при ВШГ — аДHК, антител к кардиолипину и фактора некроза опухоли-α, при КГВ — РФ и IgM. Тяжесть течения суставного синдрома в случаях ААТ, УПА и МПА связана с серопозитивностью болезней по РФ, ГПА — с наличием антител к протеиназе-3, ЭПА — с содержанием фибронектина, ВШГ — с уровнями IgА, b2-микроглобулина и РФ, КГВ — с объемной вязкостью, поверхностной упругостью, релаксацией и тромбоксаном А2. По данным корреляционного анализа, показатель iWA у больных МПА прямо соотносится с параметрами РФ в крови, а обратно — с ее вязкоэластичностью, при ВШГ — с концентрацией IgA, при КГВ — с уровнем тромбоксанемии.
С учетом выполненной статистической обработки полученных результатов исследований сделаны заключения, имеющие определенную практическую значимость: 1) прогнознегативными факторами в отношении частоты развития и течения суставной патологии у больных УПА является носительство HBV, а при МПА, ВШГ и КГВ — тяжесть экстраартикулярных признаков заболеваний; 2) параметры РФ в крови при ААТ, УПА, МПА, ВШГ и КГВ >20 МЕ/мл (>M±SD больных СВ) считаются факторами риска тяжелого течения артропатии.
Выводы
Такие поражения суставов, как артрит или артралгия, выявляют у 32% больных ГПА, у 41% — ААТ, у 47% — ВШГ, у 52% — УПА, у 63% — МПА и ЭПА, у 67% — КГВ, что имеет гендерные отличия, зависит от длительности заболеваний, степени активности патологического процесса, тяжести экстраартикулярных признаков, функций легких и состояния гемодинамики в малом круге кровообращения, частоты поражений отдельных костных сочленений, тендовагинита, энтезопатии и рентгеносонографических признаков суставного синдрома. При разных нозологиях это имеет свой диморфизм, у больных УПА связано с носительством HBV, а в патогенетических построениях артропатии при СВ участвуют нарушения системы иммунитета (иммуновоспалительные белки, цитокины, различные антитела), реологических свойств крови и эндотелиальной функции сосудов, причем высокие параметры РФ в крови являются факторами риска тяжелого течения поражений суставов в случаях ААТ, УПА, МПА, ВШГ и КГВ.
Список использованной литературы
- Бекетова Т.В. (2014) Современная классификация системных васкулитов. Терапевт. арх., 86 (5): 94–98.
- Дядык А.И. (ред.) (2013) Системные васкулиты в современной клинической практике. Издатель Заславский, Донецк, 248 с.
- Кузьміна А.П. (2013) Клінічна схожість симптомів системних васкулітів при різному походженні. Укр. ревматол. журн., 53(3): 133–134.
- Шилкина Н.П., Дряженкова И.В. (2013) Системные васкулиты: этапы диагностики. Терапевт. арх., 85(4): 39–42.
- Belli A.A., Dervis E. (2014) The correlation between cutaneous IgM deposition and renal involvement in adult patients with Henoch-Schönlein purpura. Eur. J. Dermatol., 24(1): 81–84.
- Borchers A.T., Gershwin M.E. (2012) Giant cell arteritis: a review of classification, pathophysiology, geoepidemiology and treatment. Autoimmun. Rev., 11(6–7): 544–554.
- Calvo-Rio V., Loricera J., Mata C. et al. (2014) Henoch-Schönlein purpura in northern Spain: clinical spectrum of the disease in 417 patients from a single center. Medicine, 93(2): 106–113.
- Chen O., Zhu X.B., Ren P. et al. (2013) Henoch Schonlein purpura in children: clinical analysis of 120 cases. Afr. Health Sci., 13(1): 94–99.
- Gendelman S., Zeft A., Spalding S.J. (2013) Childhood-onset eosinophilic granulomatosis with polyangiitis (formerly Churg-Strauss syndrome): a contemporary single-center cohort. J. Rheumatol., 40(6): 929–935.
- Gibelin A., Maldini C., Mahr A. (2011) Epidemiology and etiology of wegener granulomatosis, microscopic polyangiitis, churg-strauss syndrome and goodpasture syndrome: vasculitides with frequent lung involvement. Semin. Respir. Crit. Care Med., 32(3): 264–273.
- Itabashi M., Takei T., Moriyama T. et al. (2014) Long-term damage assessment in patients with microscopic polyangiitis and renal-limited vasculitis using the Vasculitis Damage Index. Mod. Rheumatol., 24(1): 112–119.
- Lamprecht P. (2012) Cryoglobulinaemic vasculitis: new aspects. Clin. Exp. Rheumatol., 30(1): 3–5.
- Mohammad A.J., Jacobsson L.T., Westman K.W. et al. (2009) Incidence and survival rates in Wegener’s granulomatosis, microscopic polyangiitis, Churg-Strauss syndrome and polyarteritis nodosa. Rheumatology, 48(12): 1560–1565.
- Poterucha T.J., Wetter D.A., spy phone pro review Gibson L.E. et al. (2013) Histopathology and correlates of systemic disease in adult Henoch-Schönlein purpura: a retrospective study of microscopic and clinical findings in 68 patients at Mayo Clinic. J. Am. Acad. Dermatol., 68(3): 420–424.
- Salazar-Exaire D., Ramos-Gordillo M., Vela-Ojeda J. et al. (2012) Silent ischemic heart disease in a patient with necrotizing glomerulonephritis due to Wegener’s granulomatosis. Cardiorenal. Med., 2(3): 218–224.
- Soriano A., Lo Vullo M., Casale M. et al. (2012) Meningeal involvement in Wegener granulomatosis: case report and review of the literature. Int. J. Immunopathol. Pharmacol., 25(4): 1137–1141.
- Terrier B., Krastinova E., Marie I. et al. (2012) Management of noninfectious mixed cryoglobulinemia vasculitis: data from 242 cases included in the CryoVas survey. Blood, 119(25): 5996–6004.
- Terrier B., Cacoub P. (2013) Cryoglobulinemia vasculitis: an update. Curr. Opin Rheumatol., 25(1): 10–18.
- Tsuchiya N. (2012) Genetics of ANCA-associated vasculitis in Japan: a role for HLA-DRB1*09:01 haplotype. Clin. Exp. Nephrol., 23(11): 132–136.
Адрес для переписки:
Синяченко Олег Владимирович
84404, Красный Лиман, ул. Кирова, 27
Донецкий национальный медицинский
университет им. Максима Горького,
кафедра внутренней медицины № 1
Е-mail: synyachenko@ukr.net

Leave a comment