Подагра — мультиморбідна патологія
Резюме. У статті обговорюються сучасні аспекти етіології та патогенезу подагричного артриту, висвітлено нові погляди на патофізіологічне значення сечової кислоти у розвитку кардіоваскулярних, церебральних ускладнень, метаболічного синдрому, наведено останні клінічні рекомендації (ACR, 2012, та Ініціатива 3Е, 2013) щодо лікування пацієнтів із подагрою та гіперурикемією. Також наведено дані за останніми lipitor diabetes сучасними методами фармакотерапії при подагрі.
Подагра (pos, podis — нога, agra — капкан) — «нога в капкане» — системное заболевание, развивающееся в связи с воспалением в местах отложения кристаллов моноурата натрия у людей с гиперурикемией, обусловленной внешнесредовыми и/или генетическими факторами (код по Международной классификации болезней 10-го пересмотра — М10 Подагра). Согласно эпидемиологии, подагра диагностирована у не менее 1–3% взрослого населения. По экспертным оценкам, соотношение мужчин и женщин составляет 7:1. Пик заболеваемости отмечают у мужчин в возрасте 40–50 лет, у женщин — ≥60 лет (Насонова В.А., Барскова В.Г., 2004).
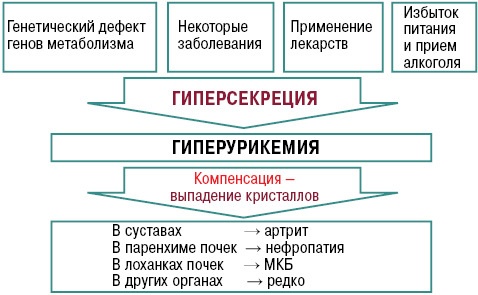
Причины подагры разнообразны. Среди них выделяют дефекты генов, которые отвечают за активность ферментов, влияющих как на синтез мочевой кислоты (МК) (гиперпродукция) так и на ее транспорт в почках (гипоэкскреция). Причинами могут быть заболевания, сопровождающиеся массивным распадом нуклеотидов из клеточных ядер (гиперурикемия), а именно: болезни крови, лимфопролиферативные заболевания, тяжелый псориаз, саркоидоз и другие заболевания, нарушающие почечную экскрецию, то есть — болезни накопления, гипотиреоз, гиперпаратиреоз, хроническая почечная недостаточность, застойная сердечная недостаточность, гестозы, ожирение и другие, а также химио- и лучевая терапия. Кроме того, гиперурикемию могут вызывать загрязнение окружающей среды (работа бензиновых двигателей) и токсические вещества (свинец), которые нарушают экскрецию уратов почками (Насонова В.А., Барскова В.Г., 2004).
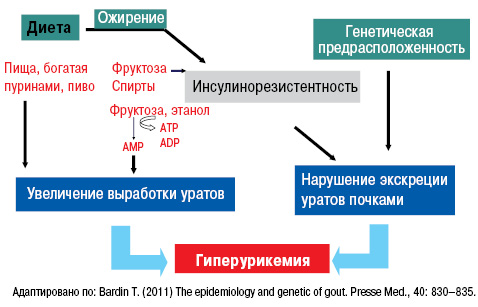
Существуют также факторы риска развития подагры, такие как высокопуриновые продукты питания, которые вызывают в организме избыток субстрата для синтеза МК. Кроме того, следует помнить, что жирная пища нарушает экскрецию уратов почками, алкоголь, метаболизируясь до молочной кислоты, препятствует экскреции уратов. Наибольшую опасность представляют крепкие алкогольные напитки и пиво, а также продукты, содержащие фруктозу (рис. 1). Аналогично могут действовать и большие физические нагрузки.
Не мнение важным фактором является применение препаратов, вызывающих гиперурикемию. К ним относятся противотуберкулезные лекарственные средства (пиразинамид и этамбутол), которые способны вызывать гиперурикемию и обострение подагры, боль в суставах (как на фоне гиперурикемии, так и без нее). Аналогичным эффектом обладает диданозин, применяемый при ВИЧ. Для этих препаратов гиперурикемия является прогнозированным побочным эффектом, вызванным конкуренцией с уратами на пути элиминации.
Иммуносупрессор циклоспорин может увеличивать урикемию, снижать экскрецию уратов почками и вызывать их дисфункцию. Через несколько лет иммуносупрессивной терапии тяжелая подагра развивается у 10% пациентов.
Кроме того, салицилаты (ацетилсалициловая кислота в низких дозах) вызывают нарушение выделения уратов почками.
Никотиновая кислота, инозин метаболизируются до нуклеотидов и далее — до МК. Сходным метаболизмом обладает противовирусное средство изопринозин.
С осторожностью при гиперурикемии и подагре назначают комплексный церебропротекторный препарат, содержащий инозин, мононуклеотид рибофлавина, никотинамид, янтарную кислоту.
Рутин при длительном применении может способствовать образованию уратов в почках. Поэтому применение таких препаратов у пациентов с нарушениями пуринового обмена требует осторожности.
Нарушение пуринового обмена вызывают также силденафил, статины и даже ингибиторы ангиотензинпревращающего фермента.
В настоящее время выделяют подагру и синдром гиперурикемии. По этиологии они могут быть: первичными (генетически детерминированными) и вторичными (вследствие заболеваний, влияния лекарственных средств, токсинов, питания и пр.).
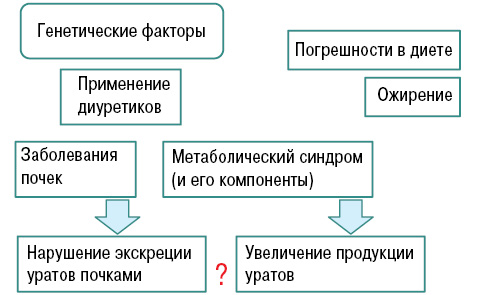
В зависимости от механизмов патогенеза выделяют: метаболический (гиперпродуктивный), почечный (гипоэкскреторный) и смешанный типы.
По клиническим проявлениям выделяют:
- бессимптомную гиперурикемию;
- острый/интермиттирующий артрит;
- межприступный период;
- хроническую тофусную подагру (Насонова В.А., Барскова В.Г., 2004).
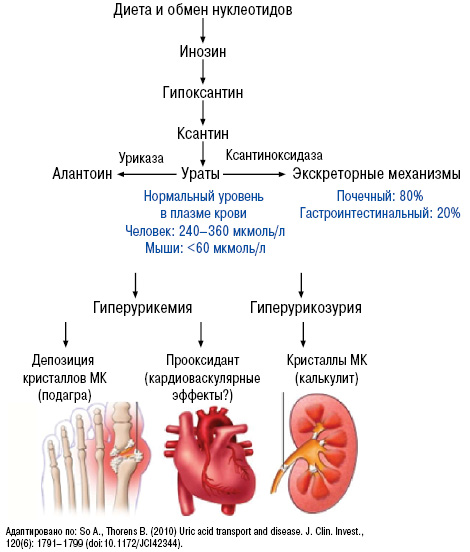
Нормальный уровень МК — важный фактор гомеостаза. МК — конечный продукт обмена пуриновых нуклеотидов аденина и гуанина (компонентов ДНК и РНК). В норме содержание ее в крови 200–360 и 160–320 ммоль/л у мужчин и женщин соответственно. Нормальный метаболизм МК осуществляется следующем путем (рис. 2, 3).
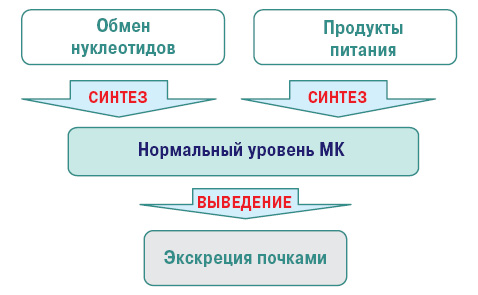

Нарушение пуринового обмена и развитие гиперурикемии представлено на рис. 4 и 5, баланс уровня МК — на рис. 6.
Клиническая классификация подагры:
1. Клинические стадии:
а) острый подагрический артрит;
б) межприступная (интервальная) подагра;
в) хроническая тофусная подагра (хронический подагрический артрит, нефролитиаз, подагрическая нефропатия и др.);
г) обострение;
д) ремиссия.
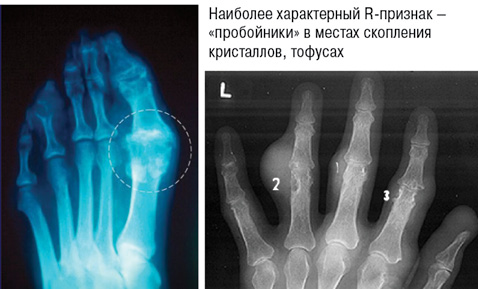
2. Рентгенологические стадии поражения суставов (рис. 7):
- I — крупные кисты (тофусы) в субхондральной кости и в более глубоких слоях, иногда уплотнения мягких тканей;
- II — крупные кисты вблизи сустава и мелкие эрозии суставных поверхностей, постоянное уплотнение околосуставных мягких тканей, иногда — с кальцификатами;
- III — обширные эрозии не менее чем на ⅓ суставной поверхности, остеолиз эпифиза, значительное уплотнение мягких тканей с кальциевыми депозитами.
3. Степень функциональной недостаточности:
- 0 — сохранена;
- I — сохранена профессиональная способность;
- II — утрачена профессиональная способность;
- III — утрачена способность к самообслуживанию.
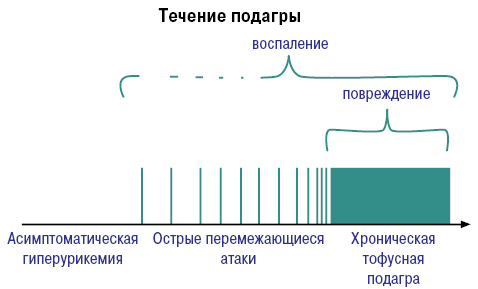
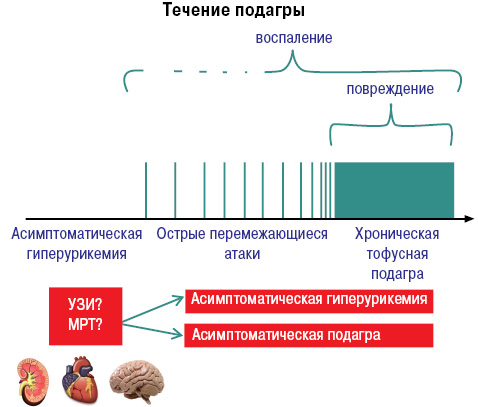
Развитие и течение подагры можно представить следующим образом (рис. 8, 9).
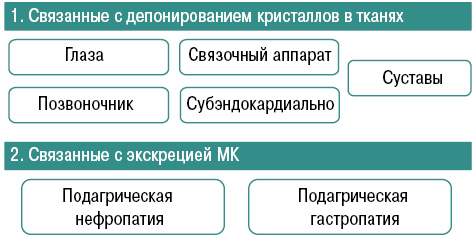
Характерны системные проявления подагры как тофусной болезни, связанные с депонированием кристаллов в тканях (суставы, связочный аппарат, субэндокардиально, позвоночник, глаза) и связанные с экскрецией МК (подагрическая нефропатия, гастропатия) (рис. 10).
Образовавшиеся кристаллы МК фагоцитируются макрофагами (моноцитами), в результате чего идет активация инфламасом, каспазы-1, интерлейкина (ИЛ/IL)-1β, что приводит к развитию воспалительного процесса в местах отложения кристаллов МК, в том числе в эндотелии сосудов (рис. 11).
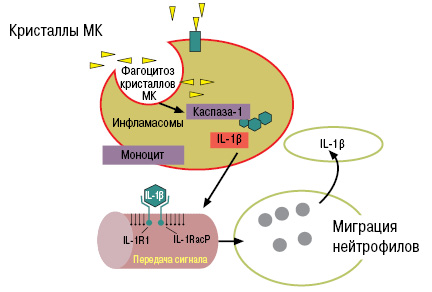
Что такое инфламасомы? Это цитоплазматический комплекс протеинов, который приводит к трансформации провоспалительных цитокинов в их активное состояние. На сегодняшний день идентифицированы 4 типа инфламасом (Martinon F. et al., 2009): NLRP1, NLRP2, AIM2, IPAF.
Как видно из представленного (см. рис. 11), подавление фагоцитоза кристаллов МК приводит к блокированию воспалительного процесса в очагах накопления в МК. Исследования, проведенные академиком В.А. Насоновой (Насонова В.А., Барскова В.Г., 2004), показали, что нимесулид блокирует фагоцитоз кристаллов МК. В связи с чем купируется острый приступ подагры. Результаты данного исследования в клинике свидетельствовали о более высокой эффективности нимесулида среди других нестероидных противовоспалительных препаратов (НПВП) в купировании острого приступа подагры.
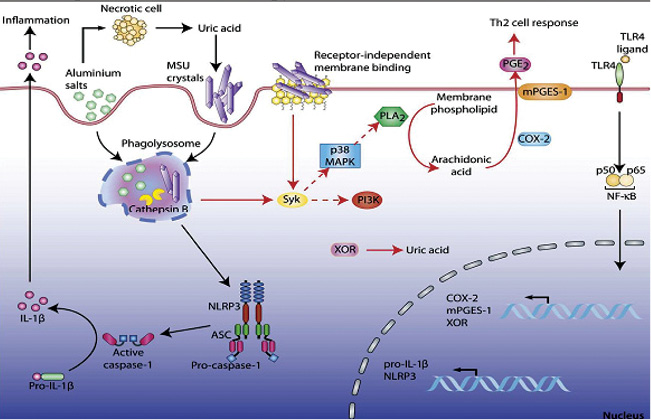
Кристаллы моноурата натрия являются триггерами других воспалительных медиаторов:
- Цитокины: ИЛ-1α и -1β, -6, фактор некроза опухоли (ФНО).
- Хемокины: ИЛ-8.
- Мини-молекулы: простагландин, гистамин.
- Жирные кислоты выступают как вторичный сигнал и необходимы для развития подагрического артрита.
Кроме того, кристаллы МК активируют циклооксигеназу (ЦОГ/СОХ)-2, Syk, p38 MAPK (рис. 12).
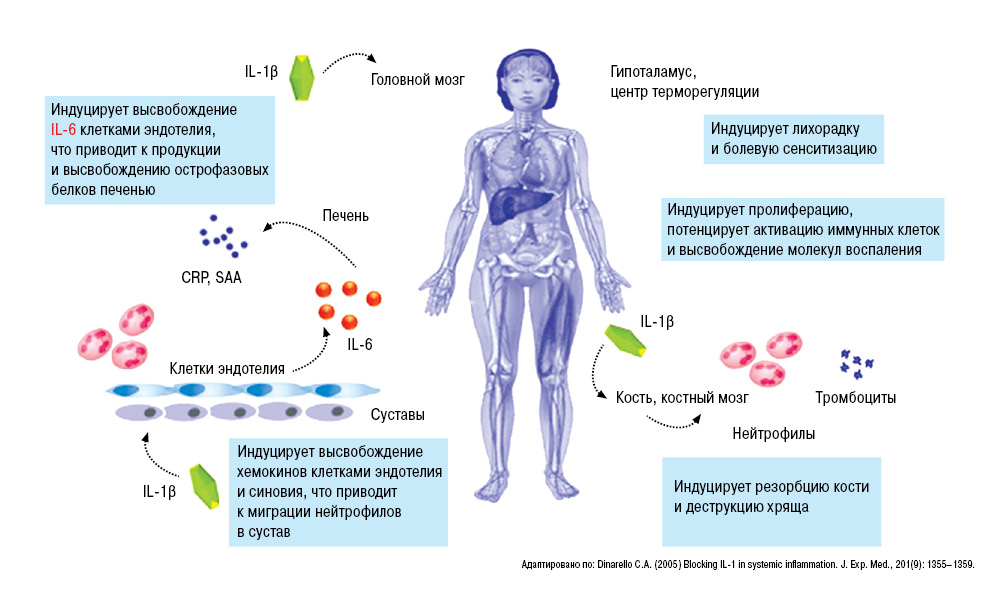
Очень важная роль в развитии подагры принадлежит ИЛ-1β (рис. 13).
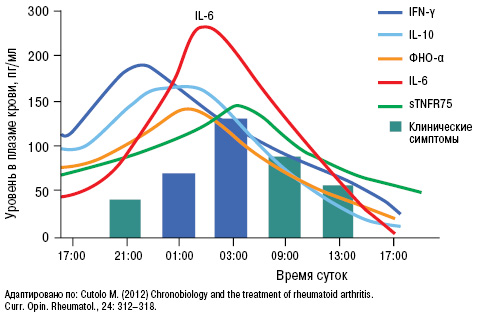
Возникновение и течение подагрического артрита четко коррелирует с уровнем провоспалительных цитокинов в ранние утренние часы (рис. 14). Пик цитокинов наблюдается именно в это время суток, что совпадает с возникновением острого приступа подагры.
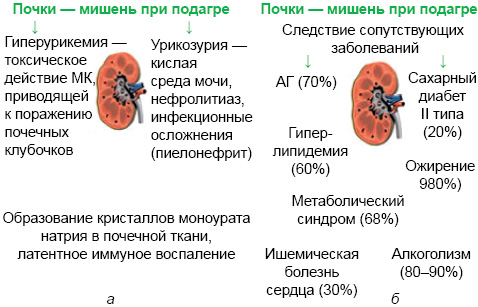
Важное место в клинике подагры занимает поражение почек. И гиперурикемия, и подагра связаны с развитием уратного нефролитиаза. Поражение почек при подагре условно разделяют на обусловленные собственно гиперурикемией и кристаллообразованием (рис. 15а) и являющиеся атрибутом сопутствующих болезней (рис. 15б).
Классическими факторами риска уратного нефролитиаза считают: гиперурикозурию, небольшой объем мочи и низкий pН мочи. Рассмотрим особенности указанных факторов риска при подагре.
Гиперурикозурия — специфический признак при подагре, отмечаемый в ряде случаев: у больных молодого возраста, при неконтролируемом сахарном диабете ІІ типа (высокая гипергликемия), синдроме Леш — Нихена, а также может быть вызвана медикаментозно при лечении урикозуриками (бензбромароном). Среди других причин гиперурикозурии чаще всего отмечают миелопролиферативные болезни и химиотерапию, приводящие в ряде случаев к острому уратному кризу при отсутствии надлежащей профилактики. Почками экскретируется до 70% МК, кишечником — 15–20%, кожа, волосы и ногти берут на себя остаточный объем. При этом МК полностью фильтруется клубочками, но при этом 99% реабсорбируется в проксимальных канальцах. Громадный объем реабсорбции МК генетически детерминирован. Таким образом, один из классических факторов уратного нефролитиаза — гиперурикозурия — не подходит для объяснения нефролитиаза при подагре. При гипоурикемической гиперурикозурии (дефект транспортера URAT1) — подагры не бывает, поскольку для подагры необходима гиперурикемия, то есть супернасыщение крови, а не мочи.
Незначительный объем мочи не является ведущим при подагре, поскольку подагра не сопровождается диареей (за исключением нежелательных явлений в результате применения колхицина в высоких дозах), а также другими видами потери жидкости.
В моче МК присутствует в двух формах: растворимой в виде урата (ионизированная форма, не связанная с транспортными белками) и нерастворимой в виде собственно МК. Их различает всего лишь один ион водорода, который приобретает способность соединяться с растворимым уратом при pН<5,5. Показано, что у больных подагрой количество ионов Н повышено, что дает предпосылку к активному соединению с уратом. Большое количество ионов водорода связывают с дефектом экскреции аммония (NH4) (уринарного буфера), что, в свою очередь, может происходить вследствие дефекта синтеза глютаминазы и/или глютаматдегидрогеназы, которые метаболизируют глютамин в аммоний и α-кетоглютарат.
Среди других факторов риска также обсуждаются генетические детерминанты нефролитиаза: ZNF365 на хромосоме 10q21–q22 и опять же ген SLC2A9, кодирующий URAT1.
Кроме того, ряд симптомокомплексов и болезней (табл. 1) связывают с развитием нефролитиаза. Отметим, что при подагре частота указанных сопутствующих болезней стабильно высокая во всех популяциях. Например, ожирение считается независимым фактором развития нефролитиаза, и масса тела обратно коррелирует с pН. При инсулинорезистентности (помимо наличия ожирения) продемонстрировано снижение аммониогенеза и экскреции аммония.
для которых типичен низкий уровень рН
(Насонова В.А., Барскова В.Г., 2004)
| Сопутствующие состояния | Частота при подагре, % | Особенность |
|---|---|---|
| Ожирение | 80 | pН обратно коррелирует с массой тела. Независимый фактор нефролитиаза |
| Инсулинорезистентность | 60 | Снижение аммониогенеза и экскреции аммония, что приводит к снижению рН |
| Сахарный диабет ІІ типа | 20 | При сочетании сахарного диабета ІІ типа с подагрой — риск развития нефролитиаза выше. Независимый фактор нефролитиаза |
| Высокопуриновый стереотип питания | 100 | Транзиторное повышение экскреции МК |
Подагра является междисциплинарной патологией и одним из компонентов метаболического синдрома (рис. 16). Основное место в структуре метаболического синдрома занимают абдоминальное ожирение, инсулинорезистентность, дислипидемия и АГ.
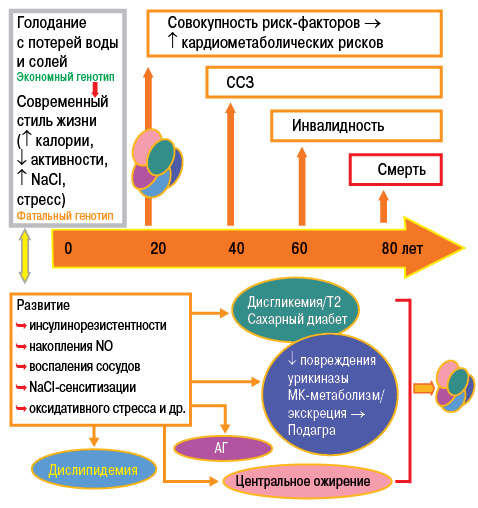
Инсулинорезистентность приводит к снижению экскреции почками МК (что связано с повышением канальцевой реабсорбции натрия, индуцированной инсулином) и впоследствии — к гиперурикемии, которая, в свою очередь, приводит к повышению уровня гликозилированного гемоглобина (НbА1с) — предиктора развития сахарного диабета ІІ типа (Братусь В.В. та співавт., 2009) (табл. 2).
| Абдоминальное ожирение | Липопротеиды низкой плотности |
| Гипертриглицеридемия | Эндотелиальная дисфункция |
| Низкий уровень липопротеидов холестерина высокой плотности | Ненормальный фибринолиз |
| Нарушение утилизации глюкозы | МК |
| АГ | Гиперандрогенизм |
Мнение о том, что гиперурикемия может свидетельствовать об инсулинорезистентности, подтверждено в 8-летнем исследовании, доказавшем связь между уровнем МК и инсулинорезистентностью (Kekäläinen P. et al., 2000).
Кроме того, в последние годы в ряде крупных клинических исследований доказано важное место гиперурикемии (рис. 17) и в патогенезе АГ, ишемической болезни сердца, хронической сердечной недостаточности (Бильченко А.В., 2009).
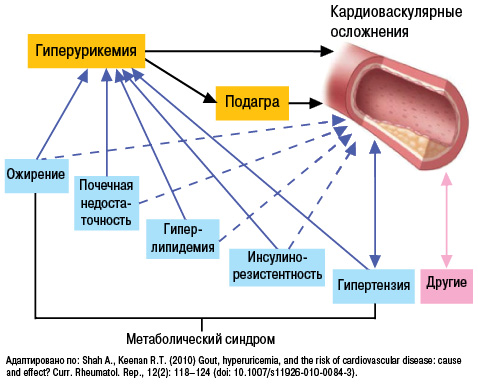
Уровень МК коррелирует с экскрецией альбуминов с мочой, что является предвестником развития нефросклероза, а нарушение почечной гемодинамики предшествует нарушению метаболизма МК у пациентов с нефропатией. Таким образом, гиперурикемия у пациентов с АГ наиболее вероятно отражает нарушение почечной гемодинамики, вызывает микроальбуминурию и дисфункцию эндотелия (Братусь В.В. та співавт., 2009).
К числу провоспалительных и проатерогенных эффектов МК относят стимуляцию пролиферации гладкомышечных клеток эндотелия, активацию макрофагов с высвобождением хемокинов и провоспалительных медиаторов (ИЛ-1, -6, -8; ФНО-α, фосфолипазы А2, эйкозаноидов, кининов и т.д.). Также показано, что аллопуринол способен не только тормозить действие ксантиноксидазы, но и улучшать эндотелийзависимую сосудистую релаксацию, замедлять процесс гипертрофии левого желудочка. Таким образом, нормальный уровень МК — важный фактор гомеостаза.
У больных АГ повышение уровня МК является независимым предиктором повышения риска развития кардиоваскулярных событий (рис. 18, 19), фатальных кардиоваскулярных событий и общей смертности (Lottmann K. et al., 2012). Применение при АГ тиазидных и тиазидоподобных диуретиков у 50% больных обусловливает повышение уровня МК (Насонова В.А., Барскова В.Г., 2004).
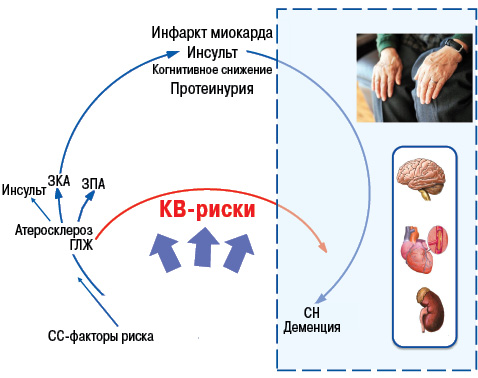
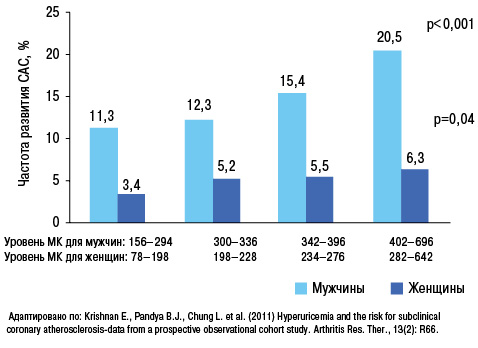
Аналогичные свидетельства получены и в отношении каротидных артерий (Pacifico L. et al., 2009).
Гиперурикемия обусловливает развитие:
- АГ (повышение риска в 2–3 раза за 5–7 лет).
- Повреждения почек (повышение риска в 5 раз за 2 года при уровне МК в плазме крови >330 мкмоль).
- Прогрессирование IgA-нефропатии.
Таким образом, при лечении пациентов терапевтической целью становится снижение МК <360 мкмоль. Поскольку чем ниже уровень МК, тем быстрее уменьшаются тофусы. Наблюдается значительно более быстрое растворение кристаллов МК при низком уровне МК. И вследствие этого можно говорить о том, что подагра — один из немногих артритов, который можно вылечить.
В то же время следует отметить, что чрезмерное снижение уровня МК или низкий ее уровень является риском развития дегенеративно-дистрофических процессов центральной нервной системы (ЦНС), таких как болезнь Паркинсона или болезнь Альцгеймера (рис. 20, 21) (Gariballa S.E. еt al., 2002; Gordon M.H., 2012).
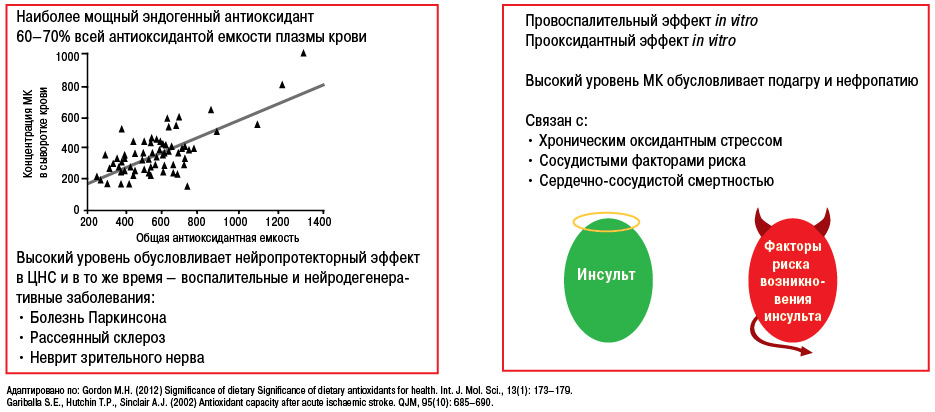
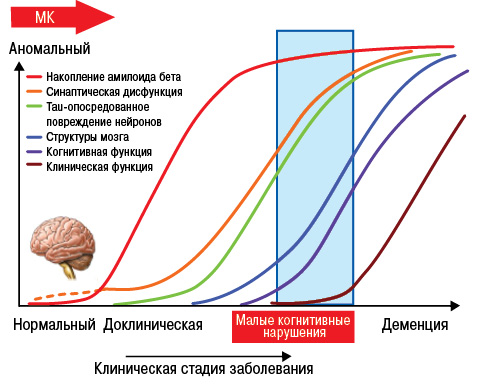
Понимание механизмов патогенеза при развитии данной патологии является очень важным, поскольку медикаментозная терапия направлена на разные этапы метаболизма МК (рис. 22).
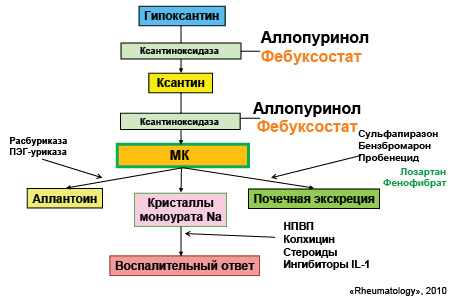
Цели антигиперурикемической терапии:
- Уровень МК <360 мкмоль.
- Снижение уровня МК в плазме крови до 420 мкмоль/л не решает проблему. Это только замедляет прогрессирование заболевания.
- Уменьшение очагов накопления уратов в организме.
- Уменьшение объема (размеров) тофусов.
- Значительное снижение частоты приступов подагры.
- Снижение риска дальнейшей преципитации уратов в кристаллы МК.
- Предупреждение структурных поражений суставов.
- Целевой уровень МК должен коррелировать с уровнем уратов в сыворотке крови и предпочтительно быть несколько ниже нормальных лабораторных значений.
- Еще более низкий уровень МК должен быть у пациентов с сопутствующими заболеваниями.
- Согласно рекомендациям Британской ассоциации ревматологов, уровень МК должен быть <300 мкмоль/л.
Лечение больных подагрой на сегодня остается актуальным вопросом и было освещено в последних рекомендациях 2012 г. (Khanna D. et al., 2012) и 2013 г. (Sivera F. et al., 2014).
Последние рекомендации 2013 г. разработаны на основе ответов на 10 наиболее актуальных практических клинических вопросов, предложенных рабочим группам Инициативы 3Е (Evidence — доказательность, Expertise — профессиональность, Exchange — преемственность). Инициатива 3Е является уникальным мультинациональным сотрудничеством, цель которого — пропагандирование данных доказательной медицины в ревматологии путем разработки практических рекомендаций.
10 клинических вопросов, предложенных рабочей группой Инициативы 3Е, 2013:
1. В каких случаях диагноз подагры может быть установлен на основании клинических симптомов с/без лабораторных тестов или визуализационными тестами и когда необходима идентификация кристаллов МК?
2. У пациентов с гиперурикемией и/или с диагнозом подагры должны ли мы регулярно мониторировать коморбидность и кардиоваскулярные риски?
3. Какое значение глюкокортикоидов, колхицина, НПВП, анти-ИЛ-1-агентов и парацетамола в лечении острой подагры?
4. Какие изменения образа жизни (таких как диета, употребление алкоголя, уменьшение массы тела, курение и/или физическая активность) являются эффективными в лечении/предупреждении подагры?
5. Что является эффективным, экономически обоснованным и безопасным для уратоснижающей терапии (аллопуринол, но также фебуксостат, пегуриказа, бензбромарон и пробенецид) в лечении при подагре? Какая последовательность уратоснижающих препаратов или их комбинации могут быть рекомендованы?
6. Когда начата уратоснижающая терапия, какое лечение является наилучшим в предупреждении острой атаки и как долго оно должна продолжаться? Когда оптимально начинать уратоснижающую терапию после острого приступа подагры?
7. Как часто коморбидность (такая как метаболический синдром, кардиоваскулярная и гастроинтестинальная патологии, болезни почек) влияют на выбор специфических для подагры препаратов (таких как колхицин, аллопуринол и другие уратоснижающие препараты) в острый период подагры, хронической подагры и профилактики острого приступа?
8. Какие должны быть цели терапии и как следует вести пациентов (какими методами)? Это определяется со слов пациента, по клиническим симптомам, биохимическим показателям и/или визуализационными методами.
9. Как лечить тофусы?
10. Можем ли мы предупредить подагрический артрит, болезни почек и кардиоваскулярные события путем снижения уровня МК в сыворотке крови у пациентов с асимптоматической гиперурикемией? Если да, то какие целевые уровни МК?
Вашему вниманию представляем сравнение рекомендаций Инициативы 3Е, 2013, с рекомендациями ACR (Ammerican College of Rheumatologists), 2012, которые дополняют друг друга.
Инициатива 3Е, 2013
1. Идентификация кристаллов моноурата натрия должна быть определена для установления диагноза подагры; если это невозможно, диагноз подагры может быть подтвержден классическими клиническими симптомами (такими как подагра, тофусы, быстрый ответ на колхицин) и/или характерными визуализационными признаками.
2. У пациентов с подагрой и/или гиперурикемией рекомендовано определять функцию почек и оценивать кардиоваскулярные факторы риска.
3. При острой подагре необходимо применение колхицина в низких дозах (до 2 мг/сут), НПВП и/или глюкокортикоидов (внутрисуставно, per os, или внутримышечно), в зависимости от коморбидности и факторов риска развития побочных эффектов.
Рекомендации ACR, 2012
4. Колхицин, НПВП и глюкокортикоиды являются терапией первой линии у пациентов с острой подагрой. Выбор препарата основывается на предпочтениях пациента и врача и с учетом коморбидности (особенно наличия хронических заболеваний почек и пищеварительного тракта). Возможно, потребуется продолжение лечения до 7–10 дней (сила рекомендации — 97 (96–98)).
5. Для острой подагры колхицин в низких дозах (1,2 мг назначать как можно раньше с последующим применением 0,6 мг через 1 ч) эффективен и хорошо переносится. Лечение колхицином должно быть продолжено до 7–10 дней или до полного купирования приступа подагры. Колхицин в высоких дозах не показан и не должен назначаться (сила рекомендации — 93 (92–94)).
6. При остром приступе подагры после соблюдения всех мер предосторожности эффективной является внутрисуставная аспирация с последующим введением глюкокортикоидов длительного действия. Процедура хорошо переносится пациентами (сила рекомендации — 95 (93–96)).
Инициатива 3Е, 2013
4. Пациентам должен быть настойчиво рекомендован здоровый образ жизни, включая уменьшение массы тела, регулярное выполнение физических упражнений, отказ от курения и алкоголя, а также сахаросодержащих напитков.
Рекомендации ACR, 2012
3. Особое внимание в лечении при подагре следует уделять сочетанию образа жизни и модифицируемых факторов риска, таких как гиперлипидемия, гипертензия, гипергликемия, ожирение и курение (сила рекомендации — 96 (95–97)).
Инициатива 3Е, 2013
5. Аллопуринол должен быть препаратом первой линии уратоснижающей терапии; другие альтернативы включают урикозурические препараты (такие как бензбромарон и пробеницид) или фебуксостат, а уриказу в монотерапии можно применять только у пациентов с тяжелой подагрой, у которых все другие методы терапии оказались безуспешными или противопоказанными. Уратоснижающую терапию (кроме уриказы) необходимо начинать с низких доз и повышать их до достижения целевого уровня МК.
Комментарий по поводу аллопуринола
- Является ингибитором ксантиноксидазы (гидрогеназы).
- Низкая чувствительность к аллопуринолу отмечается редко и связана, как правило, с низким комплаенсом, неадекватными дозами и продолжающимся приемом алкоголя.
- Необходимость в тщательной титрации дозы.
- FDA (Food and Drug Administration) одобрены дозировки до 800 мг/сут.
Побочные реакции на аллопуринол
- Отмечаются в 5–20% случаев.
- В основном — обострение подагры.
- Реже — макулопапулезные высыпания (2–3,5%).
- Редко — синдром гиперчувствительности к аллопуринолу. Среднее время развития — на 3-й и 5-й неделе: http://nexiumpharmacy-generic.org/ лихорадка, острый дерматит, острый гепатит, нефрит, лейкоцитоз, эозинофилия.
- Отмечается повышение концентрации в плазме крови оксипуринола, что может наблюдаться у пациентов с почечной недостаточностью при неадекватном подборе дозы.
- Лечение включает раннюю диагностику, отмену препарата, поддерживающие мероприятия.
- Эффективность стероидов не доказана.
Рекомендации ACR, 2012
7. Показания для уратоснижающей терапии: количество атак >1 в год, хроническая артропатия, наличие тофусов, нефролитиаз или рентгенологические признаки подагры. Рекомендована пожизненная уратоснижающая терапия (сила рекомендации — 97 (96–98)).
9. Ингибиторы ксантиноксидазы (аллопуринол или фебуксостат) являются препаратами выбора для уратоснижающей терапии и достижения целевого уровня МК в плазме крови <360 мкмоль/л. Дозу необходимо титровать с учетом безопасности препарата и одновременно со снижением частоты развития приступов подагры. Уровень МК необходимо постоянно мониторировать. Также следует проводить соответствующий мониторинг токсичности (сила рекомендации — 95 (94–96)).
10. Аллопуринол необходимо назначать с низкой дозы (100 мг/сут) с шагом титрации в 100 мг каждые 2–4 нед (до максимально разрешенной дозы — 800 мг/сут) по необходимости для достижения целевого уровня МК <360 мкмоль/л. При развитии токсических эффектов аллопуринол следует немедленно отменить и рассмотреть другие препараты для уратоснижающей терапии: фебуксостат или пробенецид (сила рекомендации — 95 (94–96)).
11. Фебуксостат: стартовая доза 40 мг/сут, следующее повышение дозы до 80 мг/сут возможно не ранее чем через 2 нед, если это необходимо can lipitor lower triglycerides для достижения целевого уровня МК <360 мкмоль/л. При развитии побочных эффектов требуется рассмотреть другие варианты лечения: аллопуринол или пробенецид. В любом случае недопустимо одновременное применение аллопуринола и фебуксостата (сила рекомендации — 97 (96–98)).
Комментарий по поводу Фебуксоста
- Селективный ингибитор ксантиноксидазы.
- Естественный печеночный метаболизм: глюкуронизация и оксидация.
- Почечная экскреция фебуксостата и активных метаболитов <10% дозы.
- Мощное гипоурикемическое действие (Becker М.А. еt al., 2004; Takano Y. et al., 2005).
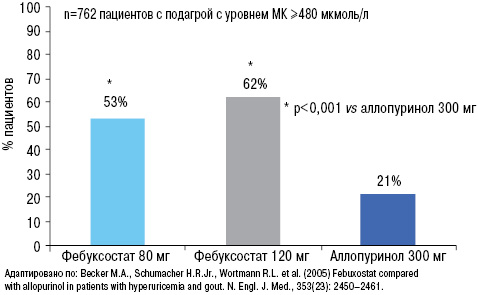
В исследовании М.А. Becker и соавторов (2005), в котором оценивали эффективность аллопуринола 300 мг и фебуксостата 80 и 120 мг у пациентов с начальным уровнем МК >480 мкмоль/л, после 52-недельной терапии соответствующими препаратами четко показано, что целевого уровня МК достигли >50% пациентов на фоне лечения фебуксостатом, в отличие от аллопуринола (только 21%) (рис. 23). При этом степень достоверности различий была очень высокой — р<0,001.
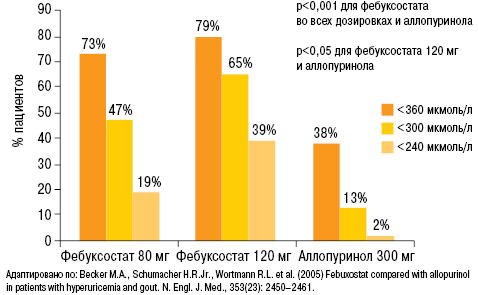
Анализ полученных результатов исследования свидетельствует о том, что на фоне лечения фебуксостатом 80 и 120 мг уровень МК <360 мкмоль/л достигнут у 73 и 79% пациентов соответственно (38% — аллопуринол), <300 мкмоль/л — у 47 и 65% соответственно (13% — аллопуринол) и <240 мкмоль/л у 19 и 39% соответственно (2% — аллопуринол) (рис. 24). Таким образом, на фоне лечения фебуксостатом статистически достоверно большее количество пациентов достигали целевого и ниже целевого уровня МК в сравнении с группой аллопуринола.
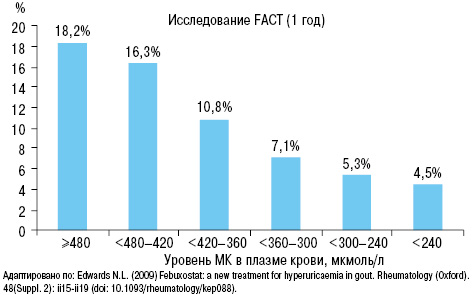
Также в исследовании FAST N.L. Edward (2009) четко доказана связь приступов подагры с уровнем МК (рис. 25).
Фебуксостат на сегодняшний день рассматривается как альтернатива уратоснижающей терапии у пациентов с приступом подагры и профилактике повторных приступов подагры. Клинические исследования показали высокую эффективность препарата в сравнении с аллопуринолом, при этом профиль безопасности и переносимости фебуксостата значительно превосходит таковой аллопуринола. Отметим, что при лечении фебуксостатом не требуется коррекции дозы у пациентов пожилого возраста и его применение не противопоказано лицам с хронической почечной недостаточностью. Согласно рекомендациям EMEA (European Medicines Agency) 2013 г., с некоторой осторожностью следует применять фебуксостат у пациентов с уже имеющейся ишемической болезнью сердца и хронической сердечной недостаточностью, хотя в исследованиях показано значительное снижение общей и кардиальной смертности у пациентов с гиперурикемией на фоне лечения фебуксостатом. Кстати, FDA не указывает на подобные ограничения при применении фебуксостата. Более того, согласно рекомендациям FDA, начинать лечение уратоснижающими препаратами следует немедленно после констатации/подтверждения высокого уровня МК, не дожидаясь его клинических манифестаций.
Аллопуринол vs Фебуксостат
- Теоретически все пациенты с подагрой могут применять тот или другой препарат.
- Но, фебуксостат не требует снижения дозы при клиренсе креатинина >30 мл/мин.
- Фебуксостат может быть более безопасен у лиц с непереносимостью аллопуринола.
- Если не достигается уровень МК <360 мкмоль/л, рекомендуется повышать дозы:
– фебуксостат 80 или 120 мг имеет более высокую эффективность, чем аллопуринол 300 мг;
– максимально разрешенная доза аллопуринола 800 мг/сут в большинстве стран мира, но безопасность доз >300 мг/сут не изучена;
– комбинировать с урикозурической терапией.
Инициатива 3Е, 2013
6. К началу уратоснижающей терапии пациенты должны быть осведомлены о рисках и необходимости лечения обострений; профилактику следует проводить с применением колхицина (в дозе до 1,2 мг/сут) или при наличии противопоказаний или его непереносимости — НПВП, или могут быть применены глюкокортикоиды в низких дозах. Длительность профилактического лечения зависит от индивидуальных особенностей пациента.
Рекомендации ACR, 2012
13. Профилактику острого приступа подагры в течение первых 6–12 мес уратоснижающей терапии можно проводить колхицином (с учетом переносимости — 0,6 мг однократно или 2 раза в сутки) или НПВП (с гастропротекторами по показаниям). Профилактика должна быть начата за 2 нед до начала уратоснижающей терапии (сила рекомендации — 97 (96–98)).
Инициатива 3Е, 2013
7. У пациентов с умеренным нарушением функции почек аллопуринол может быть применен с тщательным мониторингом побочных эффектов; начинать лечение с низких суточных доз (50–100 мг) с дальнейшим титрованием до достижения обычных целевых доз МК в сыворотке крови; фебуксостат и бензбромарон являются альтернативными препаратами, которые могут быть применены без коррекции дозы.
8. Целевой уровень МК должен быть <360 мкмоль/л (<6 мг/дл), что ниже точки кристаллизации урата натрия (408 мкмоль/л), при этом, по возможности, должны отсутствовать подагрические атаки и уменьшаться тофусы; кроме того, мониторинг должен включать контроль уровня МК, частоту атак подагры и размеры тофусов.
В этом аспекте оба документа совпадают.
Инициатива 3Е, 2013
9. Тофусы необходимо лечить медикаментозно путем достижения устойчивого снижения МК в сыворотке крови, предпочтительно <300 мкмоль/л; хирургическое лечение показано только в исключительных случаях (таких как компрессия нервных стволов, механическое повреждение или инфицирование).
10. Фармакологическое лечение асимптоматической гиперурикемии не рекомендовано для предупреждения подагрического артрита, заболевания почек или кардиоваскулярных событий.
Следующие положения, отсутствующие в рекомендациях Инициативы 3Е, 2013, имеются в рекомендациях ACR.
12. Пробеницид (урикозурик) можно применять как альтернативу ингибиторам ксантиноксидазы у пациентов с нормальной функцией почек, но он относительно противопоказан пациентам с нефролитиазом и неэффективен у лиц с почечной недостаточностью. Пробеницид можно назначать сочетанно с аллопуринолом или фебуксостатом, если необходимо, для достижения целевого уровня МК. Доза — 500 мг/сут, с ежемесячной титрацией до максимальной 3 г/сут (сила рекомендации — 93 (92–94)).
Применение цитратных препаратов (гексакалия-гексанатрия-тригидропентацитратный комплекс) дополнительно к ингибиторам ксантиноксидазы у пациентов с гиперурикемией снижает уровень МК в крови, повышает скорость клубочковой фильтрации и улучшает функцию почек. При уратной нефропатии длительное лечение частично восстанавливает функцию почек (Saito J. et al., 2010).
14. Некоторые диуретики способны повышать риск возникновения острого приступа подагры. С учетом этого применение и дозы диуретиков должны быть пересмотрены. При наличии сердечной недостаточности применение диуретиков является необходимым. В таких случаях возможно развитие приступов подагры, которые необходимо купировать в соответствии с общими рекомендациями (сила рекомендации — 91 (90–92)).
15. У пациентов с рефрактерной подагрой и/или резистентной тофусной болезнью препаратом выбора может быть пеглотиказа. Пеглотиказу назначают внутривенно, она имеет крайне неблагоприятный профиль безопасности. Пациентов, которым показана пеглотиказа, необходимо направлять к специалистам, имеющим опыт ее применения (сила рекомендации — 94 (93–95)).
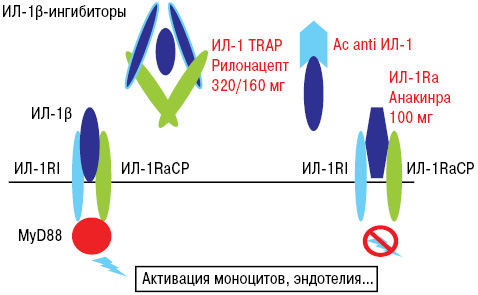
Кроме того, учитывая важную роль цитокинов при развитии подагры, на данный момент проводятся исследования по применению таких препаратов, как ингибиторы ИЛ-1 (табл. 3).
| Заболевание | Ингибитор | N пациентов | Ссылки |
|---|---|---|---|
| Подагра | Анакинра | 10 | So A. et al. (2007) ARTSimpkin P. (2010) Arthritis Rheum, abstract |
| Подагра | Рилонацепт | 20 100 |
Terkeltaub R. (2009) ARDSchumacher H. (2010) Arthritis Rheum, abstract |
| Подагра | Канакинумаб | 200 | So A. et al. (2010) Arthritis RheumSchlesinger N. (2010) ART |
Механизм действия блокаторов ИЛ-1β представлен на рис. 26.
Исходы при уровне МК <360 мкмоль/л:
- Чем ниже уровень МК, тем быстрее уменьшаются тофусы.
- Значительно более быстрое растворение кристаллов МК при низком уровне МК.
- Подагра — один из немногих артритов, который можно вылечить.
Таким образом, «Подагра — как спички»: НПВП — гасят огонь, колхицин (профилактически) — держит спички мокрыми, ингибиторы ксантиноксидазы — удаляют спички (Becker М.А. et al., 2010).
Список использованной литературы
- 1. Бильченко А.В. (2009) Гиперурикемия как фактор риска развития сердечно-сосудистых заболеваний и смертности. Здоров’я України, 10(1): 46–48.
- 2. Братусь В.В., Талаева Т.В., Шумаков В.А. (2009) Ожирение, инсулинорезистентность, метаболический синдром: фундаментальные и клинические аспекты. Четверта хвиля, Киев, 413 с.
- 3. Насонова В.А., Барскова В.Г. (2004) Лекции для практикующих врачей. Рос. национ. конгресс «Человек и лекарство», Москва.
- 4. Bardin T. (2011) The epidemiology and genetic оf gout. Presse Med., 40: 830–835.
- 5. Becker M.A., Kisicki J., Khosravan R. et al. (2004) Febuxostat (TMX-67), a novel, non-purine, selective inhibitor of xanthine oxidase, is safe and decreases serum urate in healthy volunteers. Nucleosides Nucleotides Nucleic Acids, 23: 1111–1116.
- 6. Becker M.A., Schumacher H.R., Espinoza L.R. et al. (2010) The urate-lowering efficacy and safety of febuxostat in the treatment of the hyperuricemia of gout: the CONFIRMS trial Arthritis Research & Therapy, 12: R63.
- 7. Becker M.A., Schumacher H.R.Jr., Wortmann R.L. et al. (2005) Febuxostat compared with allopurinol in patients with hyperuricemia and gout. N. Engl. J. Med., 353(23): 2450–2461.
- 8. Cutolo M. (2012) Chronobiology and the treatment of rheumatoid arthritis. Curr. Opin. Rheumatol., 24: 312–318.
- 9. Dinarello C.A. (2005) Blocking IL-1 in systemic inflammation. J. Exp. Med., 201(9): 1355–1359.
- 10. Edwards N.L. (2009) Febuxostat: a new treatment for hyperuricaemia in gout. Rheumatology (Oxford). 48(Suppl. 2): ii15-ii19 (doi: 10.1093/rheumatology/kep088).
- 11. Gariballa S.E., Hutchin T.P., Sinclair A.J. (2002) Antioxidant capacity after acute ischaemic stroke. QJM, 95(10): 685–690.
- 12. Gordon M.H. (2012) Sigmificance of dietary Significance of dietary antioxidants for health. Int. J. Mol. Sci., 13(1): 173–179.
- 13. Kekäläinen P., Sarlund H., Laakso M. (2000) Long-term association of cardiovascular risk factors with impaired insulin secretion and insulin resistance. Metabolism, 49(10): 1247–1254.
- 14. Khanna D., Khanna P.P., FitzGerald J.D. et al. (2012) American College of Rheumatology Guidelines for Management of Gout. Arthritis Care Res., 64(10): 1447–1461 (doi 10.1002/acr.21773, 2012, American College of Rheumatology).
- 15. Krishnan E., Pandya B.J., Chung L. et al. (2011) Hyperuricemia and the risk for subclinical coronary atherosclerosis-data from a prospective observational cohort study. Arthritis Res. Ther., 13(2): R66.
- 16. Lottmann K., Chen X., Schädlich P.K. (2012) Association between gout and all-cause as well as cardiovascular mortality: a systematic review. Curr. Rheumatol. Rep., 14(2): 195–203.
- 17. Martinon F., Mayor A., Tschopp J. (2009) The inflammasomes: guardians of the body. Ann. Rev. Immunol., 27: 229–265.
- 18. Pacifico L., Cantisani V., Anania C. et al. (2009) Serum uric acid and its association with metabolic syndrome and carotid atherosclerosis in obese children. Eur. J. Endocrinol.,160(1): 45–52.
- 19. Rathmann W., Funkhouser E., Dyer A.R. et al. (1998) Relations of hyperuricemia with the various components of the insulin resistance syndrome in young black and white adults: the CARDIA study. Coronary Artery Risk Development in Young Adults. Ann. Epidemiol., 8: 250–261.
- 20. Saito J., Matsuzawa Y., Ito H. et al. (2010) The alkalizer citrate reduces serum uric Acid levels and improves renal function in hyperuricemic patients treated with the xanthine oxidase inhibitor allopurinol. Endocrinol. Res., 35(4): 145–154.
- 21. Shah A., Keenan R.T. (2010) Gout, hyperuricemia, and the risk of cardiovascular disease: cause and effect? Curr. Rheumatol. Rep., 12(2): 118–124 (doi: 10.1007/s11926-010-0084-3).
- 22. Sivera F., Andres M., Carmona L. et al. (2014) Multinational Evidence-based Recommendations for the Diagnosis and Management of Gout. Ann. Rheum. Dis., 73(2): 328–335.
- 23. So A., Thorens B. (2010) Uric acid transport and disease. J. Clin. Invest., 120(6): 1791–1799 (doi:10.1172/JCI42344).
- 24. Takano Y., Hase-Aoki K., Horiuchi H. et al. (2005) Selectivity of febuxostat, a novel non-purine inhibitor of xanthine oxidase/xanthine dehydrogenase. Life Sci, 76: 1835–1847.
Адрес для переписки:
Шуба Неонила Михайловна
04112, Киев, ул. Дорогожицкая, 9
Национальная медицинская
академия последипломного
образования им. П.Л. Шупика

Leave a comment