Роль біомаркерів пошкодження суглобового хряща у діагностиці й оцінці ефективності лікування хворих на остеоартроз
Резюме. У статті наведено дослідження про роль біомаркерів (COMP та CTX I) у ранній діагностиці та контролі ефективності лікування пацієнтів з остеоартрозом при супутньому абдомінальному ожирінні. Також у публікації висвітлено дослідження клінічної ефективності препаратів кверцетин та L-аргініну гідрохлорид у комплексному застосуванні у хворих із поєднаною патологією. COMP та CTX-I — ранні та перспективні маркери ремоделювання суглобового хряща. Виявлено позитивний вплив лікування на перебіг остеоартрозу, комбінованого з ожирінням. Через 1 міс у всіх хворих виявлено позитивний ефект лікування, кращі показники отримано у тих, хто на фоні базової терапії отримував кверцетин та L-аргініну гідрохлорид.
Остеоартроз (ОА) — одне з найтяжчих захворювань суглобів, що project payday scam характеризується ураженням суглобового хряща, субхондральної кісткової тканини, зв’язок, капсули, синовіальної оболонки, періартикулярних тканин, затяжним прогресуючим перебігом із частими загостреннями процесу, високим ступенем тимчасової втрати працездатності та стійкої інвалідності й становить 80% усієї патології суглобів [3].
Раніше ОА вважався хворобою старості, що діагностувалася при променевих обстеженнях; вважалося, що рентгенографічні зміни при цьому репрезентували всі аспекти хвороби. Тепер нам відомо, що роки або навіть десятки років патології передують рентгенографічним змінам при ОА [9]. Тривалий період патології на молекулярному рівні асоціюється з першими проявами ОА, які можна виявити лише за допомогою серологічних аналізів [10]. Наступною після молекулярної є доклінічна стадія, за якої аномалії суглоба можна виявити лише точними методами візуалізації, такими як магнітно-резонансна томографія (МРТ), ультразвук чи сцинтиграфія кісток [9]. Зрештою, патологія при ОА помітна у вигляді рентгенографічних змін, кульмінацією яких часто є потреба заміни суглоба, яка супроводжується його дисфункцією чи «відмиранням». До того як сформувалася концепція сприйняття ОА як захворювання-континууму, наявність характерної для ОА патології не розглядалась як етіологія болю в суглобах у пацієнтів із нормальною рентгенограмою. Аналогічна парадигма з’явилася стосовно інших хронічних хвороб, таких як ревматоїдний артрит, який відомий як захворювання, що теж прогресує протягом довготривалої доклінічної стадії аж до відкритої форми [10]. Так само, як у разі ревматоїдного артриту [6],передбачається, що рання діагностика і лікування ОА сповільнюють чи запобігають функціональній неспроможності та клінічній прогресії.
Оскільки хрящ позбавлений нервової чутливості, біль не пов’язаний безпосередньо з його деградацією. Очевидно, за біль при ОА, яким можуть характеризуватися кілька стадій у процесі захворювання, відповідають інші уражені структури. На сьогодні існує велика потреба у глибшому розумінні походження та механізмів виникнення болю у суглобах при ОА. Більше того, існує потреба в дослідженнях з метою виявлення ознак болю у суглобах на різних стадіях хвороби та поглиблення розуміння того, яким чином і коли доцільне терапевтичне втручання. Біомаркери необхідні для кращого розуміння процесів болю протягом перебігу ОА.
У найближчому майбутньому біомаркери відіграватимуть все важливішу роль у діагностиці та лікуванні пацієнтів з ОА різних стадій. Наприклад, генетичний скринінг відіграватиме більшу роль у медичному скринінгу ризику щодо багатьох захворювань, у тому числі й щодо ОА, оскільки вважається, що схильність до захворювання залежить від деяких генетичних поліморфізмів (природних варіацій ДНК) [7]. Розчинні біомаркери, такі як продукти метаболізму при деградації суглоба, можуть бути потенційними показниками закритої форми захворювання на молекулярній стадії. Якщо розглядати їх в сукупності, маркери генетичної схильності до ОА могли б визначати підгрупу для регулярного спостереження разом з розчинними біомаркерами для виявлення молекулярної стадії ОА.
Чутливі біомаркери візуалізації, особливо з використанням МРТ, дозволяють оцінити цілісність хряща, визначити його розміри і виявити патологічні зміни у хрящі та прилеглих складових частинах суглоба [4]. Генетичні біомаркери були визначеними та прив’язаними до больової чутливості та вимог щодо анальгетиків [8],які можуть відігравати важливу роль у відчутті болю пацієнтом. Намагання пов’язати стадії хвороби із симптомами може допомогти розкрити розуміння болю, причиною якого є ОА. Отже, центр досліджень у цій галузі зосередився на співвідношенні генетичних поліморфізмів до болю при цій хворобі в осіб з розвинутими рентгенографічними аномаліями суглобів, тим самим залишаючи значні прогалини в знаннях.
Використання біомаркерів також необхідне для розроблення диференціації болю в суглобі з/без прогресуючої структурної деградації. На сьогодні для діагностики ОА необхідне рентгенографічне підтвердження; інакше причиною болю вважається не ця патологія або біль вважається невідомої етіології. У майбутньому біомаркери покращать процес визначення структурної патології при ОА та сприятимуть встановленню кращих співвідношень між симптомами та структурними змінами. До сьогодні в умовах неточних рентгенографічних досліджень встановлено недостатній зв’язок між симптомами та структурними змінами при ОА.
Біомаркери чутливості до болю могли б використовуватися для прийняття поінформованих рішень у процесі лікування, тим самим уможливлюючи більш індивідуальний підхід [4]. Так само біомаркери фармакодинаміки лікарських засобів могли б використовуватися для передбачення ефективності й безпеки застосування ліків для кожного пацієнта індивідуально, водночас зводячи до мінімуму кількість випадків неефективності чи низької результативності лікування [11]. У перспективі дослідники могли б взятися за розроблення біомаркерів, зміни яких протягом короткого терміну могли б послужити для прогнозування результату як короткочасного, так і тривалого лікування від болю.
На сьогодні визначені біомаркери болю, пов’язаного з ОА, можна класифікувати як варіативні та інваріативні. Інваріативні біомаркери є незмінними, зазвичай генетичними (дезоксирибонуклеїнова кислота — ДНК) поліморфізмами, такими як генетичні показники ступеня больового порогу та схильність до розвитку больових станів (наприклад артрит і біль у спині), а також реакція на анальгетики. Варіативними біомаркерами є такі, що змінюються протягом перебігу хвороби і є зазвичай біохімічними молекулами, також можуть бути рибонуклеїновими кислотами (РНК). Варіантом біомаркерів болю payday при ОА часто бувають метаболіти тканин суглоба та запальні молекули.
Дослідження варіативних біомаркерів першого класу, метаболітів тканин суглобів мають від самого початку бути зосередженими на співвідношенні з болем згідно з індексацією артриту, запропонованою Університетом Західного Онтаріо та Університетом payday loan МакМастера (The Western Ontario and McMaster Universities Arthritis Index — WOMAC). Насправді переважну більшість досліджень біомаркерів тканин суглобів та болю при ОА аналізували, використовуючи систему оцінювання WOMAC для виведення результатів. WOMAC — стандартизований, затверджений і достовірний опитувальник, заснований у 1988 р., широко використовуваний для дослідження клінічних проявів ОА [13]. Суть дослідження полягає в пересуванні хворого по плоскій поверхні, при ходьбі вверх і вниз, під час нічного сну, сидячи чи лежачи, при цьому біль він оцінює як «відсутній», «незначний», «помірний», «значний» та «надзвичайно високий». До уваги http://onlinepaydayloansusca.com береться біль в осіб протягом 48 год.
Усі вивчені варіантні біомаркери є складовими позаклітинної матриці хряща чи тканини суглоба, відомої як синовіальна оболонка. Відзначали зв’язки між болем і наявністю позаклітинних елементів матриці у сироватці крові чи сечі [5]. Інтенсивність болю в коліні згідно з опитуванням WOMAC була пов’язана з рівнем хрящового олігомерного матрикспротеїну (COMP) [6]у сироватці крові. Одне з досліджень асоціює біомаркери розщеплення (рівень у сироватці крові перехресно зв’язаного С-термінального телопептиду колагену ІІ типу (CTX II)) хрящового колагену, резорбції кістки (рівень перехресно зв’язаного N-термінального телопептиду колагену І типу (NTX І) в сечі) та синовіту (рівень гіалуронану в крові) з болем у колінному суглобі протягом більшості днів минулого місяця.У цьому дослідженні помічено прямий зв’язок між біомаркерами та болем у коліні, незалежно від рентгенографічної стадії прояву ОА [5]. Це спостереження особливо цінне, оскільки досі було важко продемонструвати відповідність між клінічними симптомами та рентгенографічними змінами.
Використання більш достовірних показників патології зумовлює кращу асоціацію між структурою та симптомами, що робить внесок у лікування пацієнтів з ОА. Розвиток ОА пов’язується зі змінами в метаболізмі колагену хворого протягом п’ятирічного спостереження [7], в той час як рівень COMP в сироватці крові чи сечі асоціюється з рентгенографічною прогресією ОА коліна, болем та тугорухомістю [8]. Ці дослідження в майбутньому стануть підвалинами розроблення алгоритмів лікування пацієнтів з болем у суглобах, відзначеним біомаркерами запалення та структурної дегенерації, а також стануть основою для більш детального визначення розвитку хвороби, що, в свою чергу, допоможе більш специфічно, індивідуально та ефективно спрямовувати лікування на першопричини болю.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
У роботі наведено результати клінічного, лабораторно-інструментального обстеження і терапії 60 хворих на ОА у поєднанні з ожирінням, які перебували на стаціонарному лікуванні в ревматологічному відділенні Івано-Франківської обласної клінічної лікарні з 2011 по 2013 р. Верифікацію діагнозу проводили на основі даних клінічних, лабораторних та інструментальних обстежень. Обстеження проводили тричі: при госпіталізації, на 5-й день лікування та після 30-го дня терапії.
Контрольну групу становили 20 осіб того ж віку, які в результаті проведення клінічних і додаткових досліджень визнані практично здоровими, мали нормальні показники опорно-рухового апарату, індекс маси тіла (ІМТ) 19–24 кг/м. Середній вік у групі практично здорових осіб склав (49,92±1,96) років.
Також паралельно обстежено групу хворих, до якої входило 15 пацієнтів з ОА без ожиріння. Середній вік у цій групі склав (48,79±1,94) років.
Клінічну характеристику проведено після ґрунтовного вивчення скарг, анамнезу хвороби і життя, даних об’єктивного обстеження, яке доповнювалось інструментальними методами аналізу функціонального стану опорно-рухового апарату і серцево-судинної системи, біохімічними і рентгенологічними дослідженнями.
Серед досліджуваних хворих payday advance near me на ОА з супутнім ожирінням payday loans no credit check переважали жінки — 42 особи (70,0%), чоловіків було 18 (30,0%). Середній вік пацієнтів склав (59,18±1,26) років, тобто превалювали пацієнти працездатного віку, що підкреслює не тільки медичне, але й соціальне значення проблеми діагностики і лікування ОА та ожиріння, середня тривалість захворювання становила — (9,82±0,62) років. Серед них: у 7 пацієнтів (11,7%) діагностовано І рентгенологічну (Rtg)-стадію ОА, у 24 (40%) — ІІ Rtg-стадію, 20 (33,3%) — ІІІ Rtg-стадію, а у 9 (15%) — ІV Rtg-стадію.
Середня маса тіла склала (99,31±1,46) кг, середній ІМТ становив (33,80±0,34) кг/м, середня окружність талії (ОТ) — (104,65±0,64) см, середня окружність стегон (ОС) — (101,94±1,04) см, відношення ОТ/ОС у середньому становило — (1,03±0,01).
Усі пацієнти з ОА, поєднаним з ожирінням, отримували базову терапію (БТ), до якої входять нестероїдні протизапальні препарати (НПЗП), хондропротектори, інгібітори КоА-редуктази.
У період лікування дотримувалися раціонального режиму та дієтичного харчування.
З метою вивчення ефективності запропонованих способів лікування пацієнтів розподілено на групи: 1-ша група (n=15) — обстежувані перебували на традиційній патогенетичній терапії, яка включала такі схеми лікування: НПЗП — переважно селективні інгібітори циклооксигенази (ЦОГ)-2 (німесулід 200 мг/добу у 2 прийоми, мелоксикам — 7,5–15 мг на 1 прийом, целекоксиб — 100 мг у 2 прийоми), неселективні інгібітори ЦОГ (диклофенак по 50 мг у 3 прийоми); хондропротектори — хондроїтину сульфат внутрішньом’язово — 100 мг/добу, глюкозаміну сульфат перорально — 1,5 г/добу, комбіноване застосування цих препаратів — по 1 капсулі 2 рази на добу протягом 1 міс з подальшим застосуванням по 1 капсулі на добу протягом 1 міс; фізіотерапевтичне лікування (лазеротерапія, магнітотерапія); 2-га група (n=15) — пацієнтам до БТ додано антиоксидантний препарат кверцетин у дозі 50 мг, розведеного у 50 мл ізотонічного розчину, внутрішньовенно 1 раз на добу 5 днів, з переходом на пероральну його форму — кверцетин у дозі 40 мг 2 рази на добу до 1 міс; 3-тя група (n=15) — приймали БТ з додаванням амінокислоти L-аргініну гідрохлорид у дозі 100 мл 1 раз на добу 5 днів із переходом на пероральну його форму у вигляді сиропу по 5 мл 3 рази на добу протягом 1 міс; 4-та група (n=15) — лікували препаратами БТ у комплексі з кверцетином та L-аргініну гідрохлоридом за вищенаведеними схемами.
Антропометричні обстеження. Включали визначення маси тіла, росту та ІМТ, ОТ, ОС. ОТ вимірювали на середині відстані між пупком та мечоподібним відростком, а ОС — на рівні вертлюгів стегнової кістки. З метою детальної оцінки вираженості ожиріння вивчали показники відношення ОТ до ОС. Значення ОТ/ОС >0,85 у жінок і >0,9 — у чоловіків, а також ОТ >80 см у жінок та >94 см — у чоловіків трактували як абдомінальний тип ожиріння [1, 2]. ІМТ розраховували як співвідношення маси тіла хворого (кг) до квадрата його зросту (м).
Серед обстежуваних із метаболічним синдромом (МС) надмірну масу тіла відзначали у 19,44% обстежених, ожиріння I ступеня — у 54,17%, II ступеня — у 18,06%, III ступеня — у 8,33%. Таким чином, найбільшу когорту становили пацієнти з ожирінням I ступеня.
Визначення рівня COMP у сироватці крові. Проводили на імуноферментному аналізаторі 194-0801 компанії «BioVendor», згідно з методикою виробника.
Визначення вмісту перехресно зв’язаного CTX I. Проводили на імуноферментному аналізаторі 434-2000 із використанням імуноферментної тест-системи «CrossLapsTM» компанії «Nordic Bioscience Diagnostics A/S», згідно з методикою виробника.
Отримані результати обробляли за допомогою програми «STAТISTICA 6.0» (StatSoftInc, США) та «Microsoft Excel» з обчисленням середньої величини М, середньоквадратичного відхилення, середньої помилки середньої величини m, значення вірогідності (p), коефіцієнта кореляції Спірмена (r). При нормальному розподілі використовуватиметься t-критерій Стьюдента і парний критерій Стьюдента.
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ ТА ЇХ ОБГОВОРЕННЯ
Дані антропометричних досліджень наведено в табл. 1. Так, у хворих досліджуваної групи ІМТ був вищим у 1,4 раза порівняно з практично здоровими особами та у 1,2 раза — порівняно з групою пацієнтів, хворих на ОА без ожиріння (р<0,05). Подібні зміни встановлено при визначенні ОТ, ОС та їх співвідношення. У хворих на ОА з ожирінням показник ОТ вірогідно був вищим у 1,2 раза, ніж у практично здорових, та у 1,14 раза порівняно з пацієнтами лише з ОА (р<0,05). Подібні зміни виявлені при визначенні індексу ОТ/ОС у обстежених пацієнтів із ОА та МС, що підтверджувалося вірогідно вищими показниками у 1,3 раза порівняно з практично здоровими та пацієнтами з ОА (р<0,05).
| Показник | Здорові | ОА(n=15) | Ожиріння + ОА(n=60) |
|---|---|---|---|
| ІМТ, кг/м | 22,4±2,1 | 24,6±1,8 | 31,5±2,0 |
| ОТ, см | 82,4±6,2 | 88,5±4,8 | 109,4±2,1 |
| ОС, см | 100,4±5,9 | 102,9±6,1 | 100,1±4,3 |
| ОТ/ОС | 0,82±0,08 | 0,86±0,05 | 1,11±0,09 |
*Достовірність відмінностей між показниками у практично здорових осіб та хворих відповідних груп (р<0,05). У табл. 1–2: достовірність відмінностей між показниками у хворих на ОА та ОА + ожиріння (р<0,05).
COMP є одним із неколагенових білків матриксу, який виявляється в тканинах хряща, в значно меншій мірі протеїн присутній в зв’язках, меніску і синовіальній onlinepaydayloansusca.com мембрані. Молекули COMP зв’язують між собою колагенові волокна, стабілізуючи колагенову сітку в тканинах хряща. При станах, які супроводжуються пошкодженням хряща, матриксні протеїни попадають в синовіальну рідину, а потім у кров. Дослідження показали, що виявлення збільшеної концентрації COMP є більш чутливим методом діагностики хрящової деструкції, ніж рентгенологічні зміни.
В останні роки показана висока кореляція між сироватковим рівнем COMP і ступенем тяжкості ОА, в тому числі його гістологічними проявами [13].
Усім пацієнтам з ОА та супутнім ожирінням ми провели визначення рівня в сироватці крові COMP. Як видно з табл. 2, рівень COMP у обстежуваних пацієнтів достовірно відрізнявся від групи контролю (р<0,001) і був у 5,4 разів більший, ніж у осіб контрольної групи. Також виявлено достовірне збільшення цього показника у хворих на ОА без ожиріння у порівнянні з пацієнтами досліджуваної групи (р<0,05).
| Маркер | Контроль | ОА | ОА + ожиріння |
|---|---|---|---|
| COMP | 3,1±0,11 | 11,7±0,21* | 16,75±0,67* |
| CTX I, нг/мл | 0,21±0,02 | 0,33±0,02* | 0,47±0,03* |
*Достовірність відмінностей між показниками у практично здорових осіб та хворих відповідних груп (р<0,001).
У багатьох дослідженнях у хворих на ОА виявлено зв’язок між концентрацією COMP у сироватці крові та рентгенологічними змінами суглобів. Концентрація у сироватці крові при першому візиті — предиктор повільного чи швидко прогресуючого перебігу захворювання [12].
Нами визначено зв’язок між концентрацією COMP у сироватці крові та рентгенологічними змінами в суглобах при ОА, де встановили, що чим тяжча рентгенологічна стадія, тим вища концентрація COMP у сироватці крові (рис. 1).
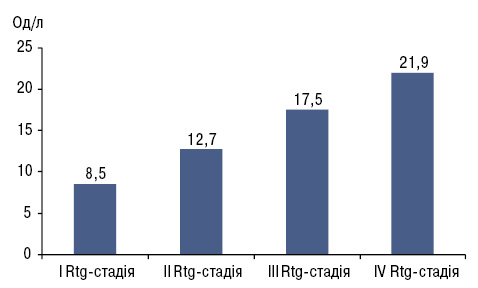
CTX I — маркер кісткової резорбції. Підвищення рівня цього маркера в крові спостерігається на різних стадіях ОА. У клінічній практиці перевага визначення полягає в тому, що рівень СTX І дозволяє оцінити ступінь ефективності всіх видів терапії ОА.
У всіх пацієнтів з ОА та супутнім ожирінням нами проведено визначення рівня в сироватці крові CTX I, підвищення якого є маркером кісткової резорбції. Як видно з табл. 2, рівень CTX I у обстежуваних пацієнтів достовірно відрізнявся від групи контролю (р<0,001) і був у 2,2 раза більший, ніж в осіб контрольної групи. Також виявлено достовірне підвищення цього показника у 1,4 раза у пацієнтів досліджуваної групи порівняно із хворими на ОА без ожиріння (р<0,05) (див. табл. 2).
Отже, отримані нами результати дослідження доводять взаємообтяжувальний вплив ОА та ожиріння. Наявність абдомінального ожиріння суттєво впливає на клінічний перебіг ОА, сприяє прогресуванню захворювання та погіршує якість життя цих хворих.
На основі результатів дослідження, висвітлених у цьому розділі, можна зробити висновок, що своєчасна діагностика та лікування ожиріння у хворих на ОА позитивно впливають на перебіг ОА та покращення якості життя пацієнтів.
Лікування ОА залишається вкрай складною і невирішеною проблемою. Воно має бути комплексним, послідовним і постійним. Основними його завданнями вважаються уповільнення прогресування захворювання, збереження структурно-функціональної цілісності хряща, зменшення вираженості болю в суглобах і зниження частоти загострень патологічного процесу.
Невід’ємна частина при лікуванні хворих на ОА — НПЗП. У багатьох випадках НПЗП як симптоматичні лікарські засоби не впливають на фундаментальні патогенетичні online payday loans механізми, що лежать в основі синтропії. Завдяки протизапальній і знеболювальній дії їх можна приймати довгостроково — протягом багатьох місяців і років, проте навіть нетривале застосування цих препаратів у невисоких дозах може призвести до розвитку побічних ефектів. Особливо високий ризик побічної дії у людей похилого віку, які становлять приблизно 60% споживачів НПЗП. Тому актуальним залишається розроблення ефективних лікувальних комплексів, які б дали змогу вплинути на основні патогенетичні ланки поліморбідної патології.
Нами вивчався вплив кверцетину та L-аргініну гідрохлориду на клініко-функціональний стан хворих на ОА в поєднанні з абдомінальним ожирінням. Пацієнти 1-ї групи отримували традиційну БТ, комплекс якої включав: НПЗП, хондропротектори, інгібітори КоА-редуктази і симптоматичну терапію, рекомендовану наказом МОЗ України від 12.10.2006 р. № 676 «Про затвердження клінічних протоколів надання медичної допомоги хворим із остеоартрозом» [2]. Динаміку показників оцінювали на початку лікування, через 5 днів та через 1 міс після проведеної комплексної терапії.
Дослідження вмісту в сироватці крові COMP, підвищення рівня якого свідчить про деструкцію хрящової тканини, проведено всім пацієнтам з поєднаною патологією. До лікування рівень COMP у обстежених хворих становив (16,9±1,1) Од/л, а після лікування БТ через 5 днів — (15,0±0,3) Од/л та через 30 днів — (12,4±0,7) Од/л, що доводить недостатню ефективність БТ ОА в лікуванні при деструкції суглобового хряща. Це обґрунтовує необхідність пошуку нових схем у терапії хворих на ОА, особливо при поєднанні з ожирінням, з метою оптимізації лікування (рис. 2).
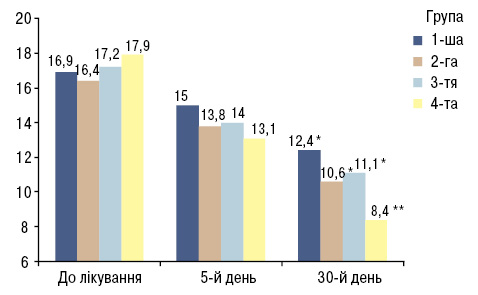
На рис. 2 і 3: *р<0,05 — різниця достовірна відносно показників до лікування; **р<0,001 — достовірність відмінностей до та після лікування.
При дослідженні змін рівня COMP у пацієнтів 2-ї групи, які отримували кверцетин, нами виявлено зниження його рівня з (16,4±1,1) до (13,8±0,92) Од/л на 5-й день лікування та до (10,6±1,0) Од/л — на 30-й день (р<0,05). У хворих 3-ї групи, які разом із БТ отримували L-аргініну гідрохлорид, виявлено зниження цього маркера з (17,2±1,08) до (14,0±1,22) Од/л на 5-й день та до (11,1±2,1) Од/л — на 30-й день лікування (р<0,05).
Рівень COMP у обстежуваних 4-ї групи, що на фоні БТ приймали кверцетин та L-аргініну гідрохлорид, був достовірно нижчим порівняно із пацієнтами інших груп і до лікування становив (17,9±0,69) Од/л, на 5-й день лікування — (13,1±1,38) Од/л та на 30-й день — (8,4±2,03) Од/л (р<0,001).
Враховуючи, що кісткова резорбція, маркером якого є CTX I, є важливою ланкою в патогенезі ОА із ожирінням, ми вивчили вплив кверцетину та L-аргініну гідрохлориду на цей показник. В усіх хворих через 5 днів та через 1 міс спостереження встановлене зниження вмісту зазначеного маркера ОА у сироватці крові (рис. 3).
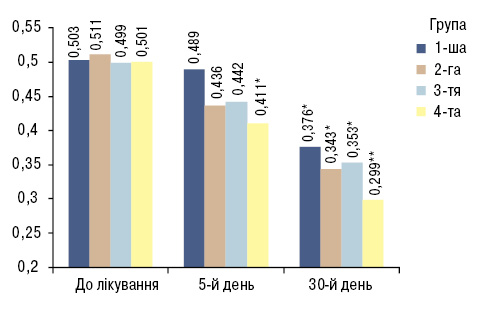
Для оцінки кісткової резорбції у хворих 1-ї групи, які отримували БТ, при визначенні CTX I на 5-ту та 30-ту добу терапії спостерігалося достовірне зниження цього показника, який до лікування становив (0,503±0,05) нг/мл, на 5-й день — (0,489±0,01) нг/мл та на 30-й день — (0,376±0,03) нг/мл (р<0,005) (див. рис. 3). Однак у цій групі CTX I не досяг норми. Це свідчить про те, що БТ ОА має ефективний вплив на CTX I, але недостатній для того, щоб привести рівень цього показника до норми.
При оцінці кісткової резорбції нами виявлено достовірне зниження CTX I на фоні лікування БТ з додаванням кверцетину та L-аргініну гідрохлориду на 5-ту та 30-ту добу терапії у 2-й та 3-й групах (р<0,05) (див. рис. 3): у 2-й групі рівень цього маркера знизився з (0,511±0,08) нг/мл до (0,436±0,07) нг/мл на 5-ту добу лікування та (0,343±0,041) нг/мл — на 30-ту добу, у 3-й — до лікування (0,499±0,07) нг/мл, на 5-ту добу — (0,442±4,9) нг/мл, на 30-ту добу — (0,353±0,08) нг/мл. Однак у жодній групі CTX I не досяг норми. Це свідчить про те, що препарати БТ при лікуванні пацієнтів з ОА в поєднанні з кверцетином та в поєднанні з L-аргініном гідрохлоридом мають виражений позитивний вплив на цитокіновий статус, але недостатній для того, щоб привести рівень CTX I до норми.
При дослідженні протизапальних властивостей комплексного project payday scam лікування (БТ, кверцетин, L-аргініну гідрохлорид) нами виявлено позитивний вплив запропонованої терапії на рівень CTX I. На фоні лікування спостерігали достовірне зниження CTX І у пацієнтів 4-ї групи (див. рис. 3): до лікування він становив (0,501±0,044) нг/мл, на 5-ту добу рівень цього маркера знизився до (0,411±0,054) нг/мл, на 30-ту добу — (0,299±0,035) нг/мл (р<0,001).
Включення до комплексної терапії пацієнтів з ОА, поєднаним з ожирінням, кверцетину та L-аргініну гідрохлориду зумовлює потенціювання позитивних ефектів цих препаратів, сприяє більш вираженій динаміці клінічних, лабораторних та інструментальних показників, значному покращенню якості життя, що обґрунтовує доцільність використання запропонованої схеми з метою підвищення ефективності лікування пацієнтів із досліджуваними захворюваннями.
ВИСНОВКИ
1. Виявлено, що приєднання ожиріння до перебігу ОА веде до значного погіршення перебігу основної патології.
2. Доведено, що у хворих на ОА у поєднанні з абдомінальним ожирінням виражена деструкція хрящової тканини та значна резорбція кісткової тканини, що проявляється підвищенням концентрації COMP та перехресно зв’язаного CTX I порівняно з контролем.
3. Визначали зв’язок між концентрацією COMP у сироватці крові та рентгенологічними змінами в суглобах при ОА у поєднанні з МС і встановили, що рівень маркера у крові корелює з рентгенологічною стадією ОА (r=0,34; р<0,001).
4. Включення до комплексної терапії хворих на ОА в поєднанні з абдомінальним ожирінням кверцетину та L-аргініну гідрохлориду зумовлює потенціювання позитивних ефектів цих препаратів, сприяє більш вираженій динаміці клінічних та лабораторних (зниження рівня COMP та перехресно зв’язаного CTX I) показників, що обґрунтовує online payday loans доцільність використання запропонованої схеми з метою підвищення ефективності лікування досліджуваних захворювань.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Лутай М.И. (2003) Атеросклероз: современный взгляд на патогенез. Укр. кардіол. журн., 1: 12–16.
2. Митченко Е.И. (2007) Метаболический синдром, сахарный диабет и сердечно-сосудистые заболевания. Укр. кардіол. журн., 5: 74–80.
3. Насонов Е.Л. (2002) Иммунологические маркеры атероклероза. Тер. арх., 5: 80–85.
4. Gami A.S., Witt B.J., Howard D.E. et al. (2007) Metabolic syndrome and risk of incident cardiovascular events and death: a systematic review and meta-analysis of longitudinal studies.. J. Am. Coll. Cardiol., 49: 403–414.
5. Gelber A.C., Hochberg M.C., Mead L.A. et al. (1999) Body mass index in young men and the risk of subsequent knee and hip osteoarthritis. Am. J. Med., 107: 542–548.
6. Gomez R., Lago F., Gomez-Reino J. et al. (2009) Adipokines in the skeleton: influence on cartilage function and joint degenerative diseases. J. Molecular. Endocrinol., 43: 11–18.
7. Grip O., Janciauskiene S., Lindgren S. (2002) Atorvastatin activates PPAR-γ and attenuates the inflammatory response in human monocytes. Inflamm. Res., 51: 58–62.
8. Guidelines Committee (2003) European Society of Hypertension — European Society of Cardiology guidelines for management of arterial hypertension. J. Hypertens., 21: 1011–1053.
9. Filkova M., Liskova M., Hulejova H. et al. (2009) Increased serumadiponectin levels in female patients with erosive compared non erosive osteoarthritis.. Ann. Rheum. Dis., 68: 295–296.
10. Forst T., Pfutzner A., Lubben G. et al. (2007) Efect of simvastatin and/or pioglitazone on insulin resistance, insulin secretion, adiponectin, and proinsulin levels in nondiabetic patients at cardiovascular risk — the PIOSTAT Study.. Metabolism,, 56(4): 491–496.
11. Hochberg M.C., Lethbridge-Cejku M., Scott W.W.Jr. et al. (1995) The association of body weight, body fatness and body fat distribution with osteoarthritis of the knee: data from the Baltimore Longitudinal Study of Aging. J. Rheumatol., 22: 488–493.
12. Monahti P., Ahmad A., Ghanim H. et al. (2004) Evidence for a Potent Antiinflammatory Effect of Rosiglitazone. J. Clin. Endocrinol. Metab., 89(6): 2728–2735.
13. Wan Y., Chong L.-W., Evans R.M. (2007) PPAR-γ regulates osteoclastogenesis in mice. Nat. Med., 13(12): 1496–1503.
Роль биомаркеров повреждения суставного хряща в диагностике и оценке эффективности лечения больных остеоартрозом
Резюме. В статье приведены исследования о роли биомаркеров (COMP и CTX I) в ранней диагностике и контроле эффективности лечения остеоартроза при сопутствующем абдоминальном ожирении. Также в публикации освещены исследования клинической эффективности препаратов кверцетин и L-аргинина гидрохлорид в комплексном лечении у больных с сочетанной патологией. COMP и CTX-I — ранние и перспективные маркеры ремоделирования суставного хряща. Выявлено положительное влияние лечения на течение остеоартроза с ожирением. Через 1 мес у всех больных выявлен положительный эффект лечения, лучшие показатели получены у тех, кто на фоне базовой терапии принимал кверцетин и L-аргинина гидрохлорид.
остеоартроз, абдоминальное ожирение, маркеры, кверцетин, L-аргинина гидрохлорид.
Адреса для листування:
Сухоребська Марія Ярославівна
76018, Івано-Франківськ, вул. Галицька, 2
ДВНЗ «Івано-Франківський національний
медичний університет»,
кафедра внутрішньої медицини № 1
клінічної імунології та алергології ім. Є.М. Нейка
Е-mail: s_marya@mail.ru

Leave a comment