Оцінка нейропатичного болю у пацієнтів із хронічним суглобовим синдромом
Головач І.Ю., Чіпко Т.М., Семенів І.П., Авраменко О.М., Лазоренко О.О.
Резюме. Хронічні ураження суглобів — суттєво поширені в популяції — найчастіша причина інвалідизації, проте досі відсутнє ясне розуміння природи суглобового болю. Механізми хронічного болю при остеоартриті та ревматоїдному артриті до кінця не вивчені. У 112 пацієнтів з остеоартритом і у 88 пацієнтів із ревматоїдним артритом проведено тестування з метою виявлення нейропатичного компонента больового синдрому. Проведені дослідження дозволили встановити значну частку пацієнтів, у яких діагностується нейропатичний характер болю в поєднанні з ноцицептивним болем. Так, у 48,2% пацієнтів з остеоартритом при тестуванні за опитувальником DN4 виявлено нейропатичний біль і у 56,25% — при використанні опитувальника LANSS. Нейропатичний характер болю встановлено у 44,3% пацієнтів із ревматоїдним артритом за опитувальником DN4 і у 48,86% пацієнтів — при тестуванні за LANSS. Найчастіше при характеристиці больового синдрому серед скарг, що свідчать про нейропатичний компонент, пацієнти акцентували увагу на відчутті печії в больовій ділянці, поколювання, «повзання мурашок», біль за типом «удару струмом». При хронічній суглобовій патології нейропатичний компонент больового синдрому був асоційований з больовою гіпералгезією, більшою інтенсивністю болю, запаленням, більш вираженими порушеннями функції суглобів, тривогою.
Вступ
Захворювання опорно-рухового апарату — найчастіша причина інвалідизації в сучасному світі, поширеність цих захворювань зростає із загрозливою швидкістю [3]. Основним синдромом хронічних захворювань суглобів (остеоартрит (ОА), ревматоїдний артрит (РА), серонегативний спондилоартрит, хронічний подагричний артрит) є больовий. Саме він призводить до функціональної недостатності й обмеження соціальної активності пацієнтів, є вирішальним чинником звернення за медичною допомогою, знижуючи якість життя, призводячи врешті-решт до формування больової поведінки [5].
Донедавна вважалося, що біль при хронічних захворюваннях суглобів носить виключно ноцицептивний характер і зумовлений запально-дегенеративними змінами в ділянці ураженого суглоба. Однак така модель формування болю не здатна пояснити наявність невідповідності між ступенем вираженості патологічного процесу й інтенсивністю болю, зокрема рентгенологічна стадія ОА та РА погано корелює з вираженістю больового синдрому та недієздатністю. Водночас ця модель не може пояснити присутність таких клінічних проявів при хронічних захворюваннях суглобів, як висока поширеність вторинної гіпералгезії та зміна поверхневої чутливості в ділянках, розміщених поза суглобом [5]. В останні роки проведено численні клініко-експериментальні дослідження, що демонструють роль нейрогенних механізмів у патогенезі болю при цих хворобах, зокрема при РА та ОА [2, 4, 8], а також значна частка нейропатичного компонента больового синдрому.
Ноцицептивний біль з’являється в результаті стимуляції нервових закінчень, так званих ноцицепторів, розміщених у шкірі та глибоких тканинах, чутливих до ушкоджувальних стимулів. Цей тип болю включає поверхневий і глибокий соматичний біль, а також вісцеральний — відповідно до джерела больових стимулів. Пошкодження тканин веде до посилення відповідей на болючі й навіть неболючі в нормі стимули. У цьому беруть участь два основних механізми: по-перше, підвищення чутливості периферичних ноцицепторів в результаті впливу медіаторів, що вивільняються внаслідок пошкодження тканин, по-друге, зміни всередині самого спинного мозку, що викликають підвищення чутливості ноцицептивних нейронів задніх рогів [6, 7]. Джерелом ноцицептивного болю при ОА та РА є нехрящові структури суглоба, що включають, насамперед, синовіальну оболонку, кістку і м’які тканини (періартикулярні тканини і м’язи). Додатковим процесом, який сприяє виникненню болю при артриті, є периферична сенситизація, при якій активація ноцицептивних рецепторів змінюється й аферентні нерви стають надчутливими як до звичайних, так і до надмірних рухів у суглобі [3].
На відміну від гострого, хронічний біль підтримується активацією нейрогенних механізмів. Постійна активація первинних аферентних волокон, що повторюється, змінює функціональний стан і активність центральних нервових шляхів. Ці зміни зумовлюють посилену відповідь на больові стимули як в ділянці запалення, так і в навколишніх непошкоджених тканинах. Зазначений феномен називається wind-up, або сумація болю. Він зумовлений підвищеною електричною активністю нейронів задніх рогів спинного мозку, яка призводить до зміни спінальної збудливості — центральної сенситизації [1]. Сенситизація центральних ноцицептивних структур, поряд із периферичною сенситизацією в результаті хронічного запального процесу в суглобі, є основними механізмами патогенезу болю і підтримки її у хронічному стані у хворих на РА та ОА [10, 11].
Встановлення нейропатичного компонента больового синдрому має не лише теоретичний інтерес, але й відкриває можливості до диференційованого лікування при больовому синдромі у пацієнтів із хронічною суглобовою патологією [7].
Мета проведеного нами дослідження — визначення поширеності нейропатичного болю та встановлення особливостей больового синдрому у пацієнтів з ОА та РА.
Об’єкт і методи дослідження
До дослідження залучено 112 пацієнтів із ОА колінних суглобів (за критеріями Американської колегії ревматологів — ACR), а також 88 пацієнтів із достовірним діагнозом РА (критерії EULAR/ACR’2010). Усі пацієнти проходили обстеження і лікування в ревматологічному відділенні Клінічної лікарні «Феофанія» ДУС (Київ). Серед обстежених хворих на ОА було 69 (61,6%) жінок і 43 (38,4%) чоловіки. Вік хворих коливався від 37 до 74 років і в середньому становив 64,3±8,6 року. Середня тривалість захворювання (від маніфестації больового синдрому) — 5,7±6,1 року. Серед пацієнтів із РА переважали жінки — 63 (71,6%), чоловіків, відповідно, було 25 (28,4%). Середній вік коливався від 27 до 65 років, у середньому — 40,2±9,2 року. У 28 (25,0%) пацієнтів верифіковано реактивний синовіт колінних суглобів.
Для встановлення стадії ОА колінних суглобів за J.H. Kellgren i J.S. Lawrence (1957) проводили рентгенографію суглобів у двох проекціях. Згідно з цією класифікацією, виділяли три стадії ОА за ступенем дегенерації суглобового хряща і відповідних компенсаторних явищ. Стадію РА визначали за О. Steinbroker (1941).
Клінічне обстеження включало: аналіз скарг, анамнестичних даних, неврологічного статусу з акцентом на дослідження стану периферичної нервової системи (сила м’язів, рефлекторна сфера, чутливі порушення, вираженість, характер і розподіл болю). Протокол обстеження хворих на ОА і РА також включав визначення таких клініко-функціональних тестів, що дозволяли оцінити клінічний стан суглобів та наявність нейропатичного компонента у структурі больового синдрому:
1. Альгофункціональний індекс Лекена визначали методом опитування хворого про характер больового синдрому (час виникнення, максимальна дистанція ходьби без болю, тривалість ранкової скутості суглобів, труднощі у самообслуговуванні); відповіді оцінювали в балах. Ступінь тяжкості гонартрозу за Лекеном визначали таким чином: 1–4 бали — слабкий, 5–7 — середній, 8–10 — виражений, 11–13 — значно виражений і ≥14 — максимально виражений [9].
2. Візуально-аналогову шкалу болю (ВАШ) — 10-сантиметрову шкалу, на якій 10 відповідає максимальній вираженості больового синдрому, 0 — відсутність болю. Виділяють також такі градації больового синдрому: 2 бали (або 2 см) — помірний біль, 4 бали — середній біль, 6 балів — сильний біль, 8 балів — дуже сильний біль, 10 балів — максимальний біль.
3. Лідську шкалу оцінки нейропатичного болю (LANSS) для диференціації нейропатичного болю від ноцицептивного. За умов набирання >12 балів підтверджується нейропатичний механізм больового синдрому [1].
4. Опитувальник DN4 для діагностики нейропатичного болю. Опитувальник складається з двох блоків: перший блок (7 питань) заповнюється на підставі опитування пацієнта, другий блок (3 питання) — клінічного огляду. Перший блок дозволяє оцінити позитивні сенсорні симптоми, такі як спонтанний біль (відчуття печії, хворобливе відчуття холоду, відчуття як від ударів током), парестезії та дизестезії (відчуття «повзання мурашок», поколювання, оніміння, свербіж). Другий блок дозволяє лікарю виявити алодинію та негативні сенсорні симптоми. Кількість балів >4 означає наявність у пацієнта нейропатичного болю [1].
5. Оцінку рівня тривоги і депресії, яку виконували за допомогою госпітальної шкали тривоги і депресії HADS [12] для уточнення впливу афективних порушень на ступінь вираженості болю, визначали стан антиноцицептивної системи за рахунок вимірювання порогів болю на тиск як в ділянці ураженого суглоба, так і в інтактній зоні, а також виконували дослідження феномена роздування (wind-up). При інтерпретації результатів враховувалися сумарний показник тривоги і депресії, при цьому виділяли три ділянки його значень: 0–7 — норма (відсутність достовірно виражених симптомів тривоги і депресії); 8–10 — субклінічно виражена тривога/депресія; ≥11 — клінічно виражена тривога/депресія.
Для об’єктивної оцінки ступеня вірогідності результатів дослідження нами застосовувався варіаційно-статистичний метод аналізу отриманих результатів на персональному комп’ютері із використанням пакета статистичних програм «Statistica 5.0» і Microsoft Escel.
Результати та їх обговорення
Серед пацієнтів із ОА переважали особи з ожирінням (індекс маси тіла (ІМТ) становив 33,8±4,7 кг/м) та ІІ–ІІІ рентгенологічною стадією ОА. Пацієнти з ОА колінних суглобів висловлювали скарги, головним чином, на біль, пов’язаний із навантаженням на суглоби, а також нічний біль, ранкову скутість до 20–30 хв, тугорухомість суглобів, хрускіт, наростаюче зменшення обсягу рухів у колінному суглобі, обмеження функціональної активності, порушення сну, спричинене болем. У хворих на ОА спостерігалися зміни клініко-функціональних тестів відповідно до варіантів перебігу і стадії захворювання. Так, у пацієнтів зі множинним ураженням суглобів встановлено достовірне зростання альгофункціонального індексу Лекена, щодо інтенсивності больового синдрому за ВАШ статистично значущої відмінності між групами з поліостеоартрозом і моноолігоартрозом не встановлено. Клінічна симптоматика наростала також пропорційно стадії патологічного процесу. Так, при гонартрозі ІІ рентгенологічної стадії реєстрували достовірно вищі показники больового синдрому та функціональної обмеженості. Загалом у групі хворих на ОА інтенсивність больового синдрому за ВАШ становила в середньому 5,8±3,3 бала, альгофункціональний індекс Лекена — 8,4±3,7 бала.
Для диференціації ноцицептивного і нейропатичного компонентів больового синдрому використовували Лідську шкалу оцінки нейропатичного болю (LANSS). У процесі співбесіди лікар збирав інформацію про ступінь вираженості дизестезії, алодинії та болючої реакції на тепло, а також щодо наявності гострого пароксизмального болю і вегетативної дисфункції. Загалом у 63 (56,25%) пацієнтів зареєстровано нейропатичний біль, за даними шкали LANSS, тобто у цієї когорти пацієнтів кількість балів перевищувала 12. Загалом у обстежених пацієнтів середній показник за шкалою LANSS становив 15,6±3,2 бала. У решти хворих на ОА біль носив суто ноцицептивний характер: за шкалою LANSS сума не перевищувала 12 балів. Найчастіше пацієнти давали позитивні відповідь на такі запитання: «чи змінюється чутливість при доторканні в тій ділянці, де локалізований біль» і «чи можливо описати больові відчуття як колючі, пронизливі, щипаючі чи проникаючі»; також у більшості пацієнтів встановлено наявність алодинії. Характеристику тестування за шкалою LANSS обстежених пацієнтів наведено в табл. 1.
| Категорія пацієнтів | Кількість балів за шкалою LANSS |
|---|---|
| Усі пацієнти з ОА | 15,6±3,2 |
| Жінки | 16,1±4,7 |
| Чоловіки | 12,7±5,8 |
| Моноолігоартроз (ураження колінних суглобів) | 15,2±3,7 |
| Поліостеоартроз | 15,6±5,8 |
| Наявність реактивного синовіту колінних суглобів | 17,3±5,8 |
| Стадія ІІ | 13,9±5,6 |
| Стадія ІІІ | 13,4±4,2 |
За даними проведеного нами дослідження, нейропатичний компонент болю частіше реєструвався у жінок за наявності реактивного синовіту та не залежав від стадії процесу і кількості уражених суглобів.
Серед пацієнтів із РА також переважали особи з ІІ–ІІІ рентгенологічною стадією та середньою і високою активністю процесу за DAS28 (середній показник DAS28 становив 3,82±2,03 бала). Серед скарг превалювали біль і скутість у суглобах; щодо больового синдрому пацієнти зазначали відчуття тяжкості в кінцівках, оніміння, періодично гострий «стріляючий» біль, болючість при доторканні до суглоба, особливо за умов синовіту. Інтенсивність больового синдрому за ВАШ у обстежених пацієнтів з РА незначно переважала таку у групі пацієнтів з ОА і становила 6,2±2,7 бала. Нейропатичний характер больового синдрому, за даними шкали LANSS, встановлено у 43 (48,86%) пацієнтів. Cередній показник за шкалою LANSS у обстежених хворих на РА становив 14,8±4,2 бала. Характеристику тестування за шкалою LANSS обстежених пацієнтів із РА наведено в табл. 2.
| Категорія пацієнтів | Кількість балів за шкалою LANSS |
|---|---|
| Усі пацієнти з РА | 14,8±4,2 |
| Жінки | 15,9±3,6 |
| Чоловіки | 11,7±4,8 |
| 5,1>DAS28>3,2 | 13,2±2,6 |
| DAS28>5,1 | 16,2±4,1 |
| Серопозитивний варіант | 15,0±5,8 |
| Серонегативний варіант | 14,3±5,8 |
| Стадія ІІ | 14,1±4,2 |
| Стадія ІІІ | 14,4±5,2 |
Отже, вищі показники за шкалою LANSS відзначено у жінок та при високій активності РА за DAS28; сероприналежність і рентгенологічна стадія не впливали на наявність і вираженість нейропатичного компонента больового синдрому.
У неврологічному обстеженні не виявили ураження соматосенсорної нервової системи в обох групах хворих на ОА і РА. Однак при дослідженні чутливої сфери встановлено наявність больової гіпералгезії (підвищеної чутливості до больового подразника) у 60,7% пацієнтів з ОА та у 51,1% хворих на РА. Гіпералгезію частіше відзначали у пацієнтів з наявністю нейропатичного компонента болю як при ОА, так і при РА (77,4% випадків; р=0,057). Гіпералгезія поділялася на первинну, з наявністю підвищеної чутливості до болю в ділянці ураженого суглоба, і вторинну, з наявністю підвищеної чутливості у віддалених від ураженого суглоба ділянках. Для групи пацієнтів із ознаками нейропатичного болю більш властива наявність вторинної гіпералгезії (69,7%; р=0,068), яка може бути розцінена як клінічний корелят центральної сенситизації.
На підставі нейропатичного опитувальника DN4 було виділено по дві групи серед хворих на РА та ОА залежно від величини показника: групи пацієнтів із ознаками нейропатичного болю (DN4 ≥4 балів, що відповідає позитивному нейропатичному тесту) і група пацієнтів без нейропатичного компонента больового синдрому (DN4 <4 балів). Серед пацієнтів із ОА DN4 ≥4 встановлено у 54 (48,2%) осіб, DN4 <4 — у 58 (51,8%). У групі хворих із РА нейропатичний компонент болю (DN4 ≥4) визначено у 39 (44,3%), його відсутність (DN4 <4) — у 49 (55,7%) пацієнтів. Отже, загалом, наявність нейропатичного компонента больового синдрому верифіковано у 93 осіб із ОА та РА серед когорти обстежених пацієнтів; у 107 хворих — лише ноцицептивний характер болю.
У хворих на ОА з показником DN4 ≥4 відзначали вищу інтенсивність болю за ВАШ та вищі значення альгофункціонального індексу Лекена, ніж у осіб без нейропатичного компонента. Наявність ознак нейропатичного болю корелювала з вищим рівнем тривоги 10,4±3,3 бала порівняно із пацієнтами з DN4 <4 — 8,4±3,7 бала (р=0,036). DN4 ≥4 також корелювало із величиною LANSS, тобто дві шкали нейропатичного болю корелюють між собою та уточнюють вірогідність його наявності (табл. 3).
| Параметр | DN4 ≥4 | DN4 <4 | р |
|---|---|---|---|
| Пацієнти з ОА | |||
| Вік, років | 65,7±7,7 | 61,7±6,5 | 0,245 |
| ІМТ, кг/м | 33,4±6,3 | 34,1±5,7 | 0,762 |
| Інтенсивність болю за ВАШ, мм | 6,3±3,3 | 4,8±2,7 | 0,006 |
| Альгофункціональний індекс Лекена, балів | 8,8±4,1 | 7,9±2,6 | 0,056 |
| Тривога, балів | 10,4±3,3 | 8,4±3,7 | 0,036 |
| LANSS, балів | 16,1±4,7 | 10,8±2,2 | 0,003 |
| Пацієнти з РА | |||
| Вік, років | 39,7±9,3 | 43,2±7,2 | 0,078 |
| ІМТ, кг/м | 29,5±5,2 | 30,4±4,7 | 0,286 |
| Інтенсивність болю за ВАШ, мм | 7,7±2,6 | 5,0±3,1 | 0,003 |
| DAS28 | 5,4±1,7 | 3,6±2,1 | 0,002 |
| Тривога, балів | 11,2±3,7 | 8,7±4,0 | 0,026 |
| LANSS, балів | 16,5±3,6 | 11,8±2,2 | 0,003 |
При РА не встановлено різниці у віковій і антропометричній характеристиці пацієнтів із наявністю чи відсутністю нейропатичного болю. Однак за DN4 ≥4 реєстрували вищі показники болю за ВАШ, за DAS28 — вищу активність ревматоїдного процесу; рівень тривоги у таких пацієнтів також був вищим: 11,2±3,7 бала у групі пацієнтів із нейропатичним болем проти 8,7±4,0 бала з його відсутністю.
При DN4 ≥4 у пацієнтів як із ОА, так і РА такі відчуття, як «пощипування» і «повзання мурашок», відчуття болю як удару «електричного струму», наявність свербіння в ділянці болю, посилення болю при проведенні пензликом (алодинія), відзначали достовірно частіше, ніж при DN4 <4 (рисунок).
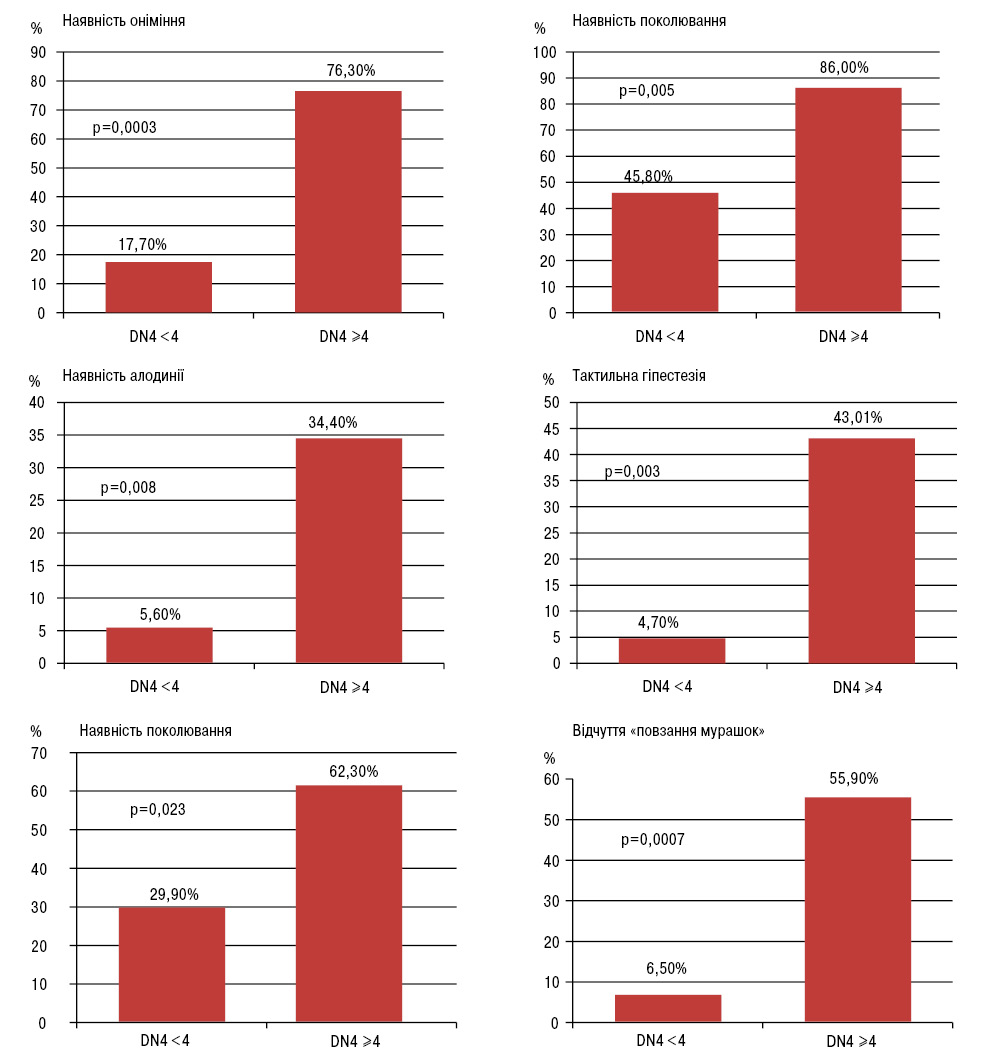
Рисунок. Характеристика больового синдрому (%) у пацієнтів із ОА та РА залежно від наявності (DN4 ≥4) чи відсутності (DN4 <4) нейропатичного компонента
Отримані нами дані дозволяють припустити, що хронічний біль при ОА та РА — результат комплексної взаємодії різних патогенетичних механізмів. Пацієнти із хронічною суглобовою патологією можуть відчувати біль різного характеру, в основі якого лежать два механізми: ноцицептивний і нейропатичний. Нейропатичний компонент больового синдрому відзначали у 48,2% пацієнтів із ОА, у 44,3% — із РА.
Для нейропатичного болю властива наявність печії, поколювання, свербежу, відчуття проходження електричного струму, тепла чи холоду, а також оніміння, пощипування і підвищеної чутливості до холоду, тепла, дотику й тиску. На підставі зазначених описових характеристик болю розроблено спеціальні опитувальники, які дозволяють виявити нейропатичний компонент болю. Однак для клінічної діагностики нейропатичного болю обов’язкова наявність ураження соматосенсорної нервової системи, що виявляється при клінічному та інструментальному дослідженні. У наших хворих таких порушень не виявлено. Ймовірно, при хронічній суглобовій патології наявні дисфункціональні порушення, пов’язані з перебудовою больової/протибольової системи на нейробіохімічному рівні, які призводять до появи ознак нейропатичного болю [3]. Наявність скарг, властивих нейропатичному болю, та показники LANSS і DN4 корелювали з інтенсивністю болю за ВАШ, запальним компонентом (DAS28), альгофункціональним індексом Лекена, рівнем тривоги, тобто з основними клінічними характеристиками ОА та РА.
Отже, біль при ОА та РА — результат комплексної взаємодії різних патогенетичних механізмів. Чіткі, виразні уявлення про механізми, залучені в генерацію болю в суглобі, та процеси передачі сенсорної інформації від периферичних рецепторів до центральної кори можуть привести до значної клінічної користі у майбутньому. Оскільки в патогенезі хронічного больового синдрому при хронічній суглобовій патології поряд із ноцицептивним відіграють важливу роль дисфункціональні/нейропатичні механізми, то раціональна терапія має націлюватися на мішені, спрямовані на структури центральної нервової системи, а не лише застосовувати протизапальні й анальгетичні препарати [5]. Наявність нейропатичного компонента болю може частково пояснити недостатню ефективність знеболювальних і протизапальних препаратів при хронічній суглобовій патології.
Висновки
1. Результати проведених досліджень свідчать про значну частку пацієнтів з ОА та РА, в яких відзначають нейропатичний характер больового синдрому одночасно із ноцицептивним болем.
2. У 48,2% пацієнтів з ОА встановлено нейропатичний компонент больового синдрому, у 44,3% — із РА при тестуванні за опитувальником DN4; за опитувальником LANSS — у 56,25% пацієнтів із ОА та у 48,86% — із РА.
3. Найчастіше при характеристиці больового синдрому серед скарг, що свідчать про нейропатичний біль, пацієнти наголошували на відчутті печії в больовій ділянці, поколювання, відчуття «повзання мурашок», біль за типом «удар током».
4. Нейропатичний компонент частіше виявлявся у жінок із високою активністю РА, високими показниками болю за ВАШ і альгофункціональним індексом Лекена, а також корелював із високим рівнем тривоги.
5. Хронічний біль при ревматичних хворобах має змішаний характер, в його патогенезі у значної частини хворих бере участь нервова система. Зважаючи на значну частку пацієнтів із нейропатичним болем у структурі хронічного больового синдрому, необхідно проводити тестування чи опитування пацієнта щодо виявлення нейропатичного компонента больового синдрому.
Список використаної літератури
1. Данилов А.Б., Давыдов О.С. (2007) Нейропатическая боль, Боргес, Москва, 192 с.
2. Поворознюк В.В., Шинкаренко Т.Є., Приймич У.І. (2014) Нейропатичний компонент болю при захворюваннях кістково-м’язової системи: огляд літератури та результати власних досліджень. Ч. 1. Боль. Суставы. Позвоночник, 4(16): 5–13.
3. Саковец Т.Г. (2014) Особенности нейропатической боли при поражении суставов. Практ. медицина, 4(80): 103–106.
4. Семенів І.П., Головач І.Ю., Чіпко Т.М. та ін. (2012) Частота діагностики нейропатичного компонента больового синдрому у пацієнтів з остеоартрозом колінних суглобів. Укр. ревматол. журн., 1(47): 68–71.
5. Туровская Е.Ф., Филатова Е.Г., Алексеева Л.И. (2013) Дисфункциональные механизмы хронического болевого синдрома у пациентов с остеоартрозом. Лечение заболеваний нервной системы, 1(11): 21–28.
6. Филатова Е.С., Туровская Е.Ф., Алексеева Л.И. и др. (2014) Анализ патогенетических механизмов хронической суставной боли у больных ревматоидным артритом и остеоартрозом коленных суставов. Науч.-практ. ревматол., 6(52): 631–635.
7. Dray A., Read S.J. (2007) Arthritis and pain. Future targets to control osteoarthritis pain. Arthritis Res. Ther., 9(3): 212.
8. Gwilym S.E., Keltner J.R., Warnaby C.E. et al. (2009) Psychophysical and functional imaging evidence supporting the presence of central sensitization in a cohort of osteoarthritis patients. Arthritis Rheum., 61(9): 1226–1234.
9. Lequesne M.G. (1997) The algofunctional indices for hip and knee osteoarthritis. J. Rheumatol., 24(4): 779–781.
10. Rowbotham M., Kidd B.I., Porreca F. (2005) Role of central sensitization in chronic pain: Ostesarthritis and rheumadoid arthritis compared to neuropathic pain. 11 Wold Congress on pain. Аbstract book. Sydney; N.S.W.: 231–250.
11. Sofat N., Ejindu V., Kiely P. (2011) What makes osteoarthritis painful? The evidence for local and central pain processing. Rheumatology (Oxford), 50(12): 2157–2165.
12. Zigmond A.S., Snaith R.P. (1983) The Hospital Anxiety and Depression scale. Acta Psychiatr. Scand., 67: 361–370.
ОЦЕНКА НЕЙРОПАТИЧЕСКОЙ БОЛИ У ПАЦИЕНТОВ С ХРОНИЧЕСКИМ СУСТАВНЫМ СИНДРОМОМ
Резюме. Хронические поражения суставов — широко распространены в популяции — наиболее частая причина инвалидизации, однако до сих пор отсутствует ясное понимание природы суставной боли. Механизмы хронической боли при остеоартрите и ревматоидном артрите до конца не изучены. У 112 пациентов с остеоартрозом и 88 пациентов с ревматоидным артритом проведено тестирование с целью выявления нейропатического компонента болевого синдрома. Проведенные исследования позволили установить значительную долю пациентов, у которых определяется нейропатический характер болевого синдрома в сочетании с ноцицептивной болью. Так, нейропатическую боль выявлено у 48,2% пациентов с остеоартритом при тестировании по опроснику DN4 и у 56,25% — при использовании опросника LANSS. Нейропатический характер боли установлен у 44,3% пациентов с ревматоидным артритом по опроснику DN4 и у 48,86% пациентов — при тестировании по LANSS. Чаще всего при характеристике болевого синдрома среди жалоб, свидетельствующих о нейропатическом компоненте, пациенты акцентировали внимание на ощущении жжения в болевом участке, покалывании, «ползании мурашек», на боли по типу «удара током». При хронической суставной патологии нейропатический компонент болевого синдрома был ассоциирован с болевой гипералгезией, большей интенсивностью боли, воспалением, более выраженными нарушениями функции суставов, тревогой.
хроническая суставная патология, остеоартрит, ревматоидный артрит, боль, нейропатическая боль.
Адреса для листування:
Головач Ірина Юріївна
03680, Київ, вул. Заболотного, 21,
3-й корпус
Клінічна лікарня «Феофанія» ДУС
E-mail: golovachirina@yandex.ru

Leave a comment