Випадок діагностики ендоваскулярного синдрому обкрадання підключично-каротидних і вертебральних судин у пацієнтки з неспецифічним аортоартеріїтом
Резюме. Описано випадок із клінічно прихованими ознаками хвороби, який демонструє діагностику неспецифічного аортоартеріїту (НАА) лише в період розвитку ендоваскулярного синдрому обкрадання підключично-вертебральних та підключично-каротидних ділянок, що виявилося можливим лише за умов підтвердження даних комп’ютерної томографічної ангіографії. Труднощі діагностики в описаному випадку пов’язані з тим, що у хворої при зверненні констатовано неспецифічні симптоми, які жодним чином не свідчили про наявність НАА. Глибокі незворотні морфологічні зміни в судинах роблять перебіг НАА несхильним до регресії навіть за умов застосування сучасних лікувальних технологій.
Неспецифічний аортоартеріїт (НАА) — доволі рідкісне системне захворювання великих судин, що супроводжується гранулематозним запаленням аорти та її великих гілок [1]. Різноманіття клінічних проявів цієї патології зумовлено характерним порушення кровообігу в різних басейнах. Частота виявлення зазначеної хвороби коливається в широких межах, але найбільш поширена — в Японії, Мексиці, Індії, Китаї, Кореї, країнах Південної Америки та Африки. Набагато рідше вона відзначається в Західній Європі та США. На початку 70-х років ХХ ст. в Японії створено реєстр пацієнтів із так званою хворобою НАА [1, 2, 3]. До 1975 р. зареєстровано 2148 пацієнтів, а до 1984 р. — 2606 хворих [9]. За даними інших авторів, до 1990 р. у Китаї описано 1200 випадків захворюваності на НАА. Захворюваність: 2,6 випадків на 1 млн населення щорічно, але може підвищуватися до 1 на 3000 випадків, як повідомлялося в серіях аутопсій з Японії [1, 3]. На території України щорічна захворюваність на НАА коливається від 0,12 до 0,63 випадка на 100 тис. населення [1]. Найбільш схильні до НАА жінки молодого і середнього віку (молодше 50 років). У світовій літературі існує понад 10 найменувань цього симптомокомплексу. Серед них найвідомішими є: НАА, синдром дуги аорти, синдром відсутності пульсу, брахіоцефальний артеріїт, синдром Данарая, панаортит, панаортоартеріїт, синдром облітерації супрааортальних стовбурів, атипова (інвертована) коарктація аорти, синдром Марторела — Фабре, синдром середньої ділянки аорти, оклюзійна тромбоартеріопатія, множинний облітеруючий поліаортоартеріїт тощо [2]. Однак останнім часом у Європейській та вітчизняній літературі вкоренився термін «неспецифічний аортоартеріїт», тоді як в американській і японській медичній практиці збережена термінологія, що застосовувалася раніше. Незважаючи на успіхи медичної науки, досі залишаються складності щодо своєчасної діагностики цієї хвороби, особливо на ранньому етапі. Низька поширеність хвороби робить неефективними спроби забезпечити стандартизований підхід до діагностики та лікування НАА. Ангіографія була золотим стандартом для діагностики, але продовжуються зусилля, щоб замінити цей засіб іншими методами візуалізації, такими як ультразвукове дослідження, магнітно-резонансна томографія (МРТ), ангіографія та позитронно-емісійна томографія (ПЕТ).
Оцінка активності НАА — складне завдання [2, 6, 7]. Більшість системних проявів не є специфічними для васкулітів, а судинні особливості розвиваються повільно [2, 3, 5]. Судинні прояви не корелюють з активною реактивною стадією у майже половини пацієнтів із НАА. На відміну від інших васкулітів, які уражають дрібні та середні судини, гістологічні методи рідко використовують для діагностики та оцінки активності пацієнтів із НАА. Завдяки методам візуалізації можна виявити активне захворювання, якщо проводити їх при первинному огляді; однак у зв’язку з їх вартістю, технічними труднощами виконання та побічними ефектами контрастних речовин, їх важче використовувати при повсякденному спостереженні. МР-ангіографія і ПЕТ — досить перспективні методи у діагностиці хвороби, але ненадійні для спостереження, оскільки майже у половини пацієнтів у клінічній ремісії відзначають поглинання контрастних речовин у наведених (табл. 1) зображеннях [1, 4].
Таблиця 1
Променеві методи, які використовують для діагностики та визначення активності НАА
| Дослідження | Недоліки | Перевага |
| Ультрасонографія | – Залежність від оцінки дослідника;- недостатньо інформації про грудний відділ аорти | – Неінвазивне;- доступне;
– відсутність променевого навантаження; – можливість розрізнення запальних змін від атеросклеротичних; – можливість оцінення дрібних артерій |
| Ангіографія | – Інвазивний;- значне променеве навантаження;
– використання контрасту; – загроза ішемії; – низька чутливість |
– Золотий стандарт;- багаторічний досвід використання;
– можливість оцінення дрібних артерій |
| МРТ | – Високовартісне;- обмежена доступність;
– використання контрасту; – неможливість оцінення дрібних артерій; – неможливість розрізнення запальних змін від атеросклеротичних |
– Виявлення ранніх змін;- висока чутливість |
| Спіральна комп’ютерна томографія (КТ) |
– Високовартісне;- негативний вплив контрасту;
– неможливість оцінення дрібних артерій |
– Виявлення ранніх змін;- можливість розрізнення запальних змін від атеросклеротичних |
| ПЕТ | – Високовартісне;- обмежена доступність;
– негативний вплив контрасту; – надмірна чутливість |
– Виявлення ранніх змін;- кореляція з активністю хвороби |
Таблиця 2
Лабораторні та клінічні параметри в оцінці активності НАА
| Клінічні та лабораторні параметри | Недоліки | Перевага |
| Клінічні ознаки | Наявність неспецифічних симптомів: слабкість, пітливість вночі. Пізня поява незворотних специфічних симптомів | Симптоми, характерні для НАА: послаблення пульсації на судинах, судинні шуми |
| Шкали активності | В оцінці активності НАА потребує підтвердження | Комплексність: клінічні ознаки ± лабораторні показники та дослідження зображень |
| Швидкість осідання еритроцитів (ШОЕ) | Залежить від віку, статі, складу крові, білків у плазмі крові. Повільне зростання у відповідь на запалення | Доступне дослідження |
| Концентрація С-реактивного протеїну (СРП) | Не залежить від віку, статі, складу крові, білків у плазмі крові. Неоднозначна кореляція із судинними змінами | Доступне дослідження. Швидке зростання у відповідь на запалення |
| Інтерлейкін (ІЛ)-6, -8, -12, -18 | В оцінці активності НАА потребує підтвердження | Концентрація корелює з показниками запалення |
| Антиендотеліальні антитіла | В оцінці активності НАА потребує підтвердження | Титр корелює з показниками запалення |
Лабораторні та клінічні параметри в оцінці активності НАА мають певні недоліки та переваги (табл. 2) [1, 2, 5].
На сьогодні в оцінці активності НАА і його прогресування порівняно зі світовою оцінкою лікарів (PGA) і критеріями активності захворювань Керра з використанням лише клінічних даних (без необхідності методів візуалізації) застосовують новий так званий індекс DEI-Tak (табл. 3). DEI-Tak індекс був опублікований з дозволу Індійської ревматологічної асоціації васкулітів (дослідна група — IRAVAS). Тому вчені рекомендують досліджувати ефективність DEI-Tak для оцінки поточної активності НАА та його прогресування порівняно зі світовою оцінкою лікарів (PGA) і критеріями активності захворювань, визначених Керром [2].
Таблиця 3
Оцінка індексу DEI-Тak з огляду на випадок НАА, який спостерігали
| Синдром | Симптоми | Наявність |
| Системного ураження | Нездужання/втрата маси тіла >2 кг, біль у м’язах/артралгія/артрит, головний біль, лихоманка | + |
| Ураження покривів шкіри | Гангрена, інші васкуліти шкіри | – |
| Ураження слизової оболонки | Сухість, виразки, подразнення | – |
| Ураження очей | Втомлюваність очей, кон’юнктивіт, увеїт, диплопія, поступове зниження гостроти зору, утворення аневризм, формування анастомозів, гіпертензивна, ретинопатія | – |
| Ураження ЛОР-органів | Гранулематозне ураження слизової оболонки, виразки, ерозії | – |
| Ураження легеневої системи | Персистуючий кашель, задишка/хрипи, порушення дихання, кровохаркання/кровотеча | – |
| Ураження серцево-судинної системи | Шуми (в сонних артеріях, вертебральні, підключичні, ренальні, абдомінальні, в паху) | + |
| Асиметричність пульсу та артеріального тиску (АТ) | + | |
| Відсутність пульсації; порушення кровообігу | + | |
| Каротидинія, аортальна недостатність | + | |
| Біль/шум, тертя перикарда, ішемічний серцевий біль, застійна серцева недостатність | – | |
| Перикардит, кардіоміопатія, інфаркт міокарда/стенокардія | – | |
| Ураження судинного ендотелію | + | |
| Абдомінальний синдром | Гострий абдомінальний біль, перфорація кишечнику/інфаркт, геморагічна діарея | – |
| Ураження нирок | Гіпертензія: діастолічна >90 мм рт. ст., систолічна >140 мм рт. ст.; протеїнурія (>1+/0,2 г/добу), гематурія (>1+/10 еритроцити/мл), креатинін (125–249 мкмоль/л), креатинін (250–499 мкмоль/л), креатинін (>500 мкмоль/л), підвищення креатиніну >30% або >25% зниження кліренсу креатиніну | + |
| Ураження нервової системи | Органічні розлади/деменція, судоми (негіпертонічні), інсульт, втрата свідомості, ураження спинного мозку | – |
| Ураження органів статевої системи | Статеве безсилля, викидні | – |
| ШОЕ | >20 мм/год | + |
| СРП | >5 мг/л | + |
Згідно з досвідом, запозиченим із джерел літератури, зарубіжні вчені пропонують у клінічній практиці спочатку заповнювати форми згідно з оцінкою DEI-Tak для визначення основної лінії ураження, незалежно від тривалості симптомів. У подальшому використовують той же індекс з інтервалом не менше 6 міс за рахунок включення нових симптомів або погіршення стану протягом останніх 6 міс, щоб відобразити поточну активність. На додаток до DEI-Tak, який включає тільки клінічні результати і фізичне обстеження, простежуються показники гострої фази, прогресування за методами візуалізації (за його наявності).
Перша частина докладного запитальника у визначенні DEI-Tak присвячена історії хвороби щодо ураження внутрішніх органів при НАА. Інші параметри, такі як гіпертонія і показники функції нирок (креатинін у сироватці крові та білок у сечі), також оцінюються. Перевага цієї складової запитальника в тому, що жодна оцінка органа не може бути пропущеною. Велика кількість запитань підвищує чутливість індексу ціною втрати специфічності й часу. Одним із недоліків порівняно з Бірмінгемською шкалою оцінки активності васкуліту (BVAS) щодо васкуліту дрібних та середніх судин є невиважена оцінка симптомів. Наприклад, важливість наявності артралгії подібна до раптової втрати зору.
Друга частина DEI-Tak включає детальну оцінку стану серцево-судинної системи. Історія хвороби, що включає кульгавість, результати фізикального обстеження, такі як дефіцит пульсу та шум, входять до складу цієї частини індексу. Хоча обидва нових симптоми і погіршення стану включені в індекс, практично неможливо реалізувати оцінку виникнення шуму протягом 6-місячної перерви, результати фізикального обстеження в DEI-Tak корисні за наявності звуження чи оклюзії нової судини, яка до того була не уражена. Методи візуалізації використовують для виявлення звуженої судини.
DEI-Tak оцінює тяжкість хвороби і розширює в основному діапазон клінічних ознак. Одним з основних недоліків є невизначеність термінів фізичних результатів обстеження. Хоча анкета належить до «появи нових симптомів або погіршення стану протягом останніх 6 міс», неможливо визначити терміни дефіциту пульсу, якщо стан здоров’я пацієнта оцінюють вперше, і досить складно у подальшому у зв’язку з обмеженою кількістю симптомів. У цьому контексті DEI-Tak при першому візиті, особливо у разі тривалої хвороби, служить «індексом збитку», показуючи ступінь минулих і нинішніх уражень судин, що зазвичай незворотні.
Крім цього, стан здоров’я пацієнта також класифікується за активністю НАА відповідно до змінених критеріїв Керра (табл. 4) [2], в яких «активне захворювання» визначається, якщо два з наступних критерії позитивні: системні прояви за відсутності інших причин; підвищення ШОЕ; особливості судинної ішемії чи запалення (кульгавість, порушення нервової провідності, судинний біль, асиметрія АТ); типові ангіографічні ознаки. Вихідна оцінка, а потім наступна відстежують різниці відповідно до DEI-Tak. Згідно з висновками дослідної групи (OMERACT), можливість кількісно оцінювати активність захворювання, розрізняти короткі та тривалі періоди, високу і низьку активність хвороби та період ремісії притаманна окремим критеріям [2, 3]. У цьому контексті оцінка хвороби НАА може залежати від клінічної оцінки загальних симптомів, судинних ознак, відповіді гострої фази та візуалізації судин, відображених у найбільш широко використовуваних критеріях Керра.
Таблиця 4
Критерії активності НАА Керра з огляду на випадок НАА, який спостерігали
| За наявності нової чи погіршення ≥2 із таких ознак |
Наявність критерію у пацієнтки |
|---|---|
| Системні прояви: лихоманка і біль у суглобах, які не можуть бути пояснені з інших причин | + |
| Підвищена ШОЕ >20 мм/год | + |
| Кульгавість, шум або судинний біль | + |
| Нові типові ангіографічні характеристики | + |
Згідно з опублікованими результатами наукового дослідження (2010), автори серед 145 хворих порівнювали шкалу DEI-Tak, критерії активності хвороби Керра та оцінку активності процесу (лікарем) за PGA. Встановлено 94% узгодженості між критеріями Керра та DEI-Tak. Проте DEI-Tak корелював із PGA лише у 68%, що пов’язано з результатами лабораторних досліджень і зображень, які використовують в оцінці саме PGA [2].
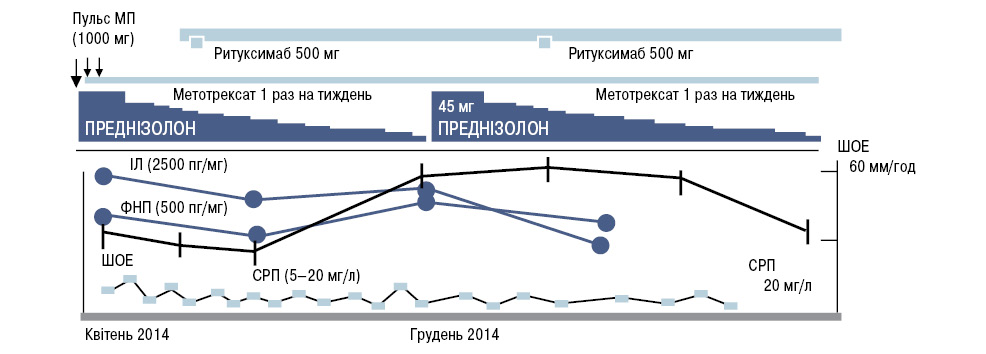
Наводимо власне спостереження, провідними клінічними проявами якого були головний біль, субфебрилітет. Хвора Д., 42 роки, з 2013 р. стала відзначати частий головний біль, зростаючу загальну слабкість, швидку втомлюваність, нетривалий біль у м’язах, періодичне оніміння в лівій верхній кінцівці. Поступово біль у м’язах зник. До наведених проявів хвороби майже через 6 міс приєднався тривалий субфебрилітет (епізоди фебрилітету), підвищене нічне потовиділення, задишка при підйомі на 3-й поверх. Із анамнезу життя відомо, що пацієнтка вважала себе абсолютно здоровою, майже не хворіла на гострі респіраторні вірусні інфекції. Спадковість не обтяжена. Харчової та медикаментозної алергії не відзначала. За 5 міс до звернення за допомогою спостерігала нетривалий епізод артралгії, який усунувся самостійно. При першому зверненні на консультацію (березень 2014 р.) до фахівців кафедри терапії, кардіології та сімейної медицини ФПО ДЗ «Дніпропетровська медична академія МОЗ України» пацієнтка скаржилася на частий головний біль, субфебрилітет, загальну слабкість, втомлюваність. На той момент перед нами постало завдання — провести обстеження, керуючись фактом невстановленого діагнозу (діагностичний пошук спрямовано на виключення системних хвороб сполучної тканини, паранеопластичного синдрому, сепсису). У період обстеження (2 тиж) у пацієнтки після надмірного фізичного навантаження вперше виникло запаморочення, що стало приводом до госпіталізації пацієнтки в неврологічне відділення, з подальшим направленням у відділення нейро- та серцево-судинної хірургії. На цей час зберігався субфебрилітет з епізодами фебрилітету. Моніторинг клінічного перебігу демонстрував стабільний синдром системної запальної відповіді активної фази, що супроводжувався прогресивним погіршенням стану хворої: при об’єктивному обстеженні констатовано лімфаденопатію в підщелепній та пахвинних ділянках з обох боків, ослаблення пульсу на правій та лівій плечових артеріях, утруднення виміру АТ на верхніх кінцівках. До цього часу приєдналися біль у верхньому відділі шиї, болючість при пальпації шиї до середини від груднино-ключично-соскоподібного м’яза, по ходу сонної артерії, вперше відзначено ослаблення пульсу на лівій променевій артерії. Аускультативно вислуховувався шум на сонних артеріях. Для визначення ступеня прогресування артеріальної гіпертензії (АГ) в нашому випадку, коли вимір АТ на верхніх кінцівках був неможливим, розраховували рівень АТ, виходячи з даних, отриманих при вимірюванні систолічного артеріального тиску (САТ) на нижніх кінцівках (регресивне співвідношення).
![]()
Градієнт САТ між верхніми та нижніми кінцівками визначали з обох сторін. Відзначено підвищення САТ >200 мм рт. ст. Результати інструментального обстеження пацієнтки наведено в табл. 5.
Таблиця 5
Результати інструментального обстеження пацієнтки
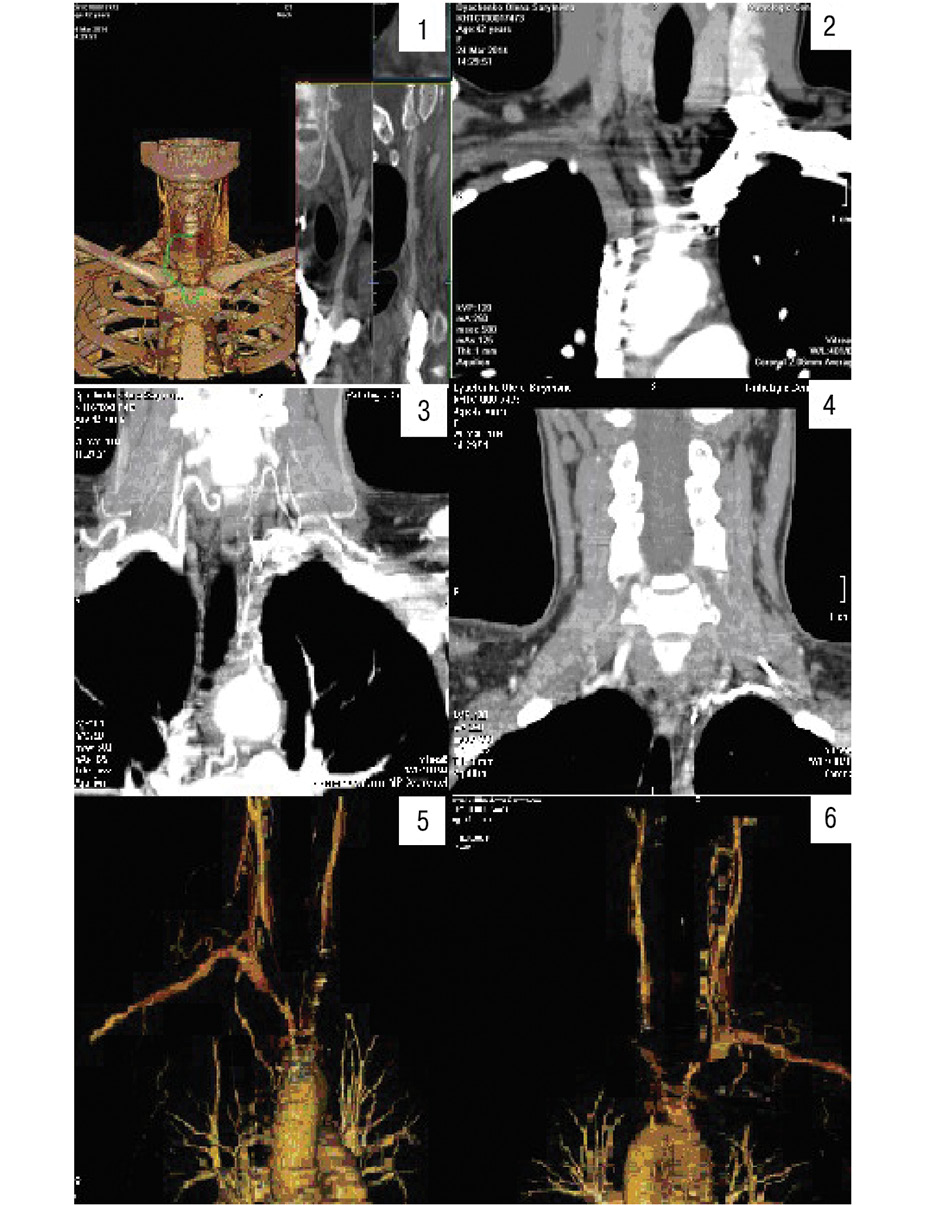
| Мультизрізова КТ — ангіографія (24.03.2014) (Радіологічний центр),р.н. 2792/КНIСТ00017473 (рис. 2) |
При КТ — ангіографії судин шиї дуги аорти — контрастовано задовільний просвіт висхідного — 29 мм та низхідного відділу — 25 мм, стінка ущільнена, товщиною до 3,5 мм. Візуалізується брахіоцефальний стовбур, просвіт до 6 мм у діаметрі, ділиться на праву підключичну артерію, праву загальну сонну артерію, звужену в початкових відділах до 1,5 мм впродовж до 25 мм (76–80%). Права загальна сонна артерія — просвіт до 6 мм, розширена в ділянці біфуркації до 9 мм, просвіт зовнішньої сонної артерії — 3,5 мм, внутрішньої сонної артерії — 4,2 мм, стінки нерівномірно стовщені. Також від брахіоцефального стовбура відходить гирло лівої загальної сонної артерії, не заповнене контрастною речовиною в початкових відділах, контрастується з рівня СVII хребця, просвіт до 6 мм, на рівні біфуркації розширення просвіту до 8 мм, просвіт зовнішньої сонної артерії — 4 мм, внутрішньої сонної артерії — 4 мм. Біфуркація загальних сонних артерій на рівні СIV–СV. Права підключична артерія в місці відходження правої артерії хребта аневризматично розширена від 9,5 до 17 мм. На 15 мм позаду від брахіоцефального стовбура візуалізується гирло лівої підключичної артерії до 6 мм у діаметрі, контрастоване лише в початкових відділах, стінка її нерівномірно стовщена. Артерії асиметричні, D більше S справа до 5 мм в діаметрі.Визначається розвинена колатеральна мережа хребта.Щитоподібна залоза не збільшена.Візуалізуються підщелепні лімфатичні вузли з обох боків розмірами до 7х13 мм, лімфовузли яремної ділянки розміром 6х10 мм.
Кісткових деструктивних змін на рівні дослідження не виявлено |
| Висновок | КТ — ознаки оклюзії лівої загальної сонної артерії та лівої підключичної артерії, стеноз правої загальної сонної артерії (75–80%), аномального відхождення лівої загальної сонної артерії, аневризматичне розширення правої підключичної артерії в місці відходження правої артерії хребта, нерівномірне стовщення стінок аорти та артерій |
| Мультиспіральна КТ | Зміни внутрішнього D загальної сонної артерії/артерії хребта. Ремоделювання судин за рахунок зміни внутрішнього діаметра артерій та за рахунок стовщення стінки судин |
| Ультразвукова допплерографія щитоподібної залози, органів черевної порожнини, ехокардіограма (06.03.2014) |
Без особливостей |
| Осцилографія | Осциляції з відхиленнями як на лівому, так і правому передпліччі та гомілках |
У крові відзначали позитивну реакцію на CРП (6,9 г/л), гіпергаммаглобулінемію, гіперфібриногенемію (6,24 г/л), з виникненням розчинних фібрин-мономірних комплексів (РФМК)– 12 — 21⋅10 г/л. У хворої відзначено зростання цитокінів: фактора некрозу пухлини (ФНП)-α — 500,4 пг/мл (рис. 1), ІЛ-1β — 175,9 пг/мл; ІЛ-6 — 2500,0 пг/мл; ІЛ-4 — 88,8 пг/мл; ІЛ-10 — 47,2 пг/мл. ANA — 1:100, ANCA — негативний (скринінг); лактоферин (IgG) — 0,2; нейтрофільна еластаза — 0,1; катепсин G (IgG) — 0,1; бактерецидний білок (IgG) — 0,1; мієлопероксидаза (МРО) — 0,1; PR3 — ANCA — <0,1. Загальний холестерин — 5,52 ммоль/л, тригліцериди — 1,36 ммоль/л, ліпопротеїди високої щільності — 1,81 ммоль/л, ліпопротеїди низької щільності — 3,24 ммоль/л, ліпопротеїди дуже низької щільності — 0,47 ммоль/л, коефіцієнт атерогенності — 2,05 од., міжнародне нормалізоване відношення — 1,02.
У пацієнтки Д. рівні ШОЕ і СРП нами вважалися основними показниками активності захворювання (див. рис. 1). Оскільки ІЛ-6 відіграє важливу роль у патогенезі НАА, перший може бути використаний як маркер оцінки активності процесу. Також помічено значне підвищення ФНП (див. рис. 1) [4, 6].
Враховуючи невідповідність активності процесу вираженості ремоделювання судин, нами проведено оцінку НАА за вищенаведеними критеріями. Хоча DEI-Tak спрямований на оцінку НАA без візуалізації, вважаємо, що розширення в будь-якому зображенні модальності (МР-ангіографія чи ультразвукова допплерографія) дозволяє поліпшити узгодженість DEI-Tak. Зіставлення індексу DEI-Тak і критеріїв Керра у пацієнтки з НАА розширює наші можливості щодо моніторингу перебігу хвороби (табл. 6).
Співвідношення між критеріями Керра і DEI-Tak виявилися достатніми, а використання критеріїв Керра замість DEI-Tak збільшує відповідність з PGA, що може бути пояснено впливом методів візуалізації чи показників гострої фази. Модифікація DEI-Tak з оцінкою показників гострої фази і прогресування процесу в поєднанні з методами візуалізації впливає на необхідність прийняття рішення щодо розширення терапевтичних заходів. Визначення рівнів цитокінів у поєднанні з критеріями Керра і DEI-Tak сприяє більш ефективному визначенню активності НАА [8, 9]. А саме моніторинг індексу DEI-Tak та критеріїв Керра на кожному візиті пацієнтки посилить визначеність лікаря щодо ефективності терапевтичних заходів.
Наявність у пацієнтки лихоманки, головного болю, втрата маси тіла, а також міалгiя, артралгія свідчили про гостру фазу запального процесу. Такі прояви, як біль у судинах, каротидинiя, порушена чутливість у хворої Д., свідчать про фазу запалення. Тоді як судинний фіброз із формуванням оклюзій та аневризм (встановлений за даними КТ) був свідченням формування хронічної фази. Порушення току крові у сонній та підключичній артерії, відсутність пульсу, гіпертензія (вимір на нижніх кінцівках) свідчили про пізній оклюзійний період [9]. За даними мультиспіральної КТ визначено поширені зміни внутрішнього діаметра артерій, стовщення судинної стінки загальної сонної артерії/артерії хребта та нові престенотичні ділянки, що передбачає поширеність.
Таблиця 6
Зіставлення індексу DEI-Тak і критеріїв Керра у пацієнтки з НАА
| Синдром | Індекс DEI-Тak | Критерії Керра |
|---|---|---|
| Системного ураження | + (Головний біль, лихоманка, біль у м’язах/артралгія) | + |
| Ураження покривів шкіри | – | |
| Ураження слизової оболонки | – | |
| Ураження очей | + (Втомлюваність очей, поступове зниження гостроти зору, гіпертензивна ретинопатія) | |
| Ураження ЛОР-органів | – | |
| Ураження легеневої системи | – | |
| Ураження серцево-судинної системи | + (Шуми в сонних артеріях, вертебральні, підключичні) | + |
| + (Асиметричність пульсу та АТ) | ||
| + (Відсутність пульсації) | ||
| + (Каротидинія) | ||
| + (Ішемічний серцевий біль) | ||
| – (Перикардит, кардіоміопатія, інфаркт міокарда/стенокардія) | ||
| + (Ураження судинного ендотелію) | ||
| Абдомінальний синдром |
– | |
| Ураження системи нирок |
+ (Гіпертензія: діастолічна >90 мм рт. ст., систолічна >140 мм рт. ст.) | |
| Ураження нервової системи | – | |
| Органів статевої системи |
– | |
| ШОЕ | + (>20 мм/год) | >20 мм/год |
| СРП | + (>5 мг/л) | |
| Нові типові ангіографічні характеристики | + |
Відсутність у переліку.
Враховуючи наявність у пацієнтки комбінацій клінічних та лабораторних ознак запального процесу з аномальними симптомами, а також визначеність переважного ураження аорти та її гілок, нами встановлено клінічний діагноз: НАА, підгострий перебіг, активність ІІІ ступеня. Ураження аорти (ІІ тип), сонних (оклюзія лівої загальної сонної артерії (75–80%), підключичних (оклюзія), аневризматичне розширення правої підключичної артерії в місці відходження правої артерії хребта. ANCA — негативний.
Під впливом базисної терапії (метилпреднізолон, метотрексат, ритуксимаб), суттєво гальмувалася гіперпродукція цитокінів (вміст ФНП-α знизився на 16%, ІЛ-6 — на 29%) (див. рис. 1).
Враховуючи розвиток ремоделювання судин, нами проаналізовано перш за все виникнення синдрому підключичного обкрадання. Серед підключичних синдромів обкрадання Subclavian Steal Syndromes НAA у пацієнтки Д. визначені підключично-вертебральні: загальна слабкість, слабкість у верхніх кінцівках, парестезія чи оніміння, шум у вухах, зниження пам’яті. Таких ознак, притаманних останньому, як ністагм, параліч вертикального погляду, дискон’югація погляду, офтальмоплегія, косоокість, двобічна слабкість у кінцівках, перехресна слабкість, перехресна втрата чутливості, параліч однобічного погляду (VI та VII), амнезiя, бiлатеральна гемiанопсiя, нами не виявлено. Очікувані підключично-каротидні симптоми обкрадання (порушення передньої циркуляції, геміпарез, афазія) та підключично-коронарні симптоми обкрадання (стенокардія, дискон’югація погляду, інфаркт міокарда, аритмія) потребують ретельного моніторингу.
З урахуванням розвитку ремоделювання судин нами проаналізовано перш за все виникнення синдрому підключичного обкрадання. Серед підключичних синдромів обкрадання (Subclavian Steal Syndromes) НAA у пацієнтки Д. визначені підключично-вертебральні: загальна слабкість, слабкість у верхніх кінцівках, парестезія чи оніміння, шум у вухах, зниження пам’яті. Таких ознак, притаманних останньому, як ністагм, параліч вертикального погляду, дискон’югація погляду, офтальмоплегія, косоокість, двобічна слабкість у кінцівках, перехресна слабкість, перехресна втрата чутливості, параліч однобічного погляду (VI та VII), амнезiя, бiлатеральна гемiанопсiя, нами не виявлено. Очікувані підключично-каротидні симптоми обкрадання (порушення передньої циркуляції, геміпарез, афазія) та підключично-коронарні симптоми обкрадання (стенокардія, дискон’югація погляду, інфаркт міокарда, аритмія) потребують ретельного моніторингу.
Ендоваскулярні варіанти синдрому обкрадання підключичної артерії (стенози, концентричне ураження, ураження судин (дистальних), некальцинуюче ураження, неульцерогенні пошкодження) зазвичай не мають негативних наслідків. Тоді як оклюзія, аневризмування, ушкодження поряд з артерією хребта є несприятливими ознаками. Прогностично очікуваними несприятливими ознаками в цьому випадку можуть бути: ексцентричні ураження, ураження проксимальних судин, кальцифікація, ульцерація, симптоматичні ушкодження, розвиток яких з часом залежить від ефективності лікування (імуносупресантними агентами, глюкокортикоїдами, низькими дозами метотрексату, циклофосфаміду, комбінацій глюкокортикоїди + циклофосфамід + метотрексат, комбінацій азатіоприн + глюкокортикоїди, мофетилу мікофенолату).
Враховуючи, що оперативні втручання на магістральних судинах — найбільш ефективні протягом перших 5 років хвороби, після купірування клініко-лабораторної активності НАА, нами разом із хірургами обговорено можливі варіанти реваскуляризації, такі як каротидний обхідний канал, обхідний канал верхньої кінцівки, або менш перспективні ендоваскулярні. Існують методики щодо аберантної правої підключичної артерії за відсутності аневризми і такої з аневризмою. Останні зводяться до виведення правої підключичної артерії ліворуч від плечової артерії, транспозиція правої плечової та правої каротидної артерій. Етапи оперативного втручання передбачають створення обхідного каналу правої каротидної та плечової артерій, лівобічну торакотомію. На думку судинних хірургів, трансплантація стента неможлива у зв’язку з поширеним стовщенням ендотелію. Подальша тактика (білатеральна реваскуляризація підключичної та каротидної артерій) залежатиме від активності НАА.
Таким чином, описаний випадок із клінічно прихованими ознаками хвороби демонструє діагностику НАА лише в період розвитку ендоваскулярного синдрому обкрадання підключично-вертебральних та підключично-каротидних ділянок, що виявилося можливим лише за умов ангіографічного підтвердження. Труднощі діагностики в описаному випадку пов’язані з тим, що у хворої Д. при зверненні констатовано неспецифічні симптоми, які жодним чином не свідчили про наявність НАА. Основним завданням у цьому разі є зниження активності НАА з подальшим хірургічним втручанням. Глибокі незворотні морфологічні зміни в судинах роблять перебіг НАА несприятливим та несхильним до регресії, навіть за умов застосування сучасних лікувальних технологій.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Коваленко В.М., Шуба Н.М. (ред.) (2013) Національний підручник з ревматології. МОРІОН, Київ, 671 с.
2. Aydin S.Z., Yilmaz N., Akar S. et al. (2010) Assessment of disease activity and progression in Takayasu’s arteritis with Disease Extent Index-Takayasu. Rheumatology (Oxford), 49(10): 1889–1893.
3. Direskeneli H., Aydın S.Z., Merkel P.A. (2011) Assessment of disease activity and progression in Takayasu’s arteritis. Clin. Exp. Rheumatol., 29(64): 86–91.
4. Jennette J.C., Falk R.J., Bacon P.A. et al.(2013) 2012 revised international Chapel Hill consensus conference nomenclature of vasculitides. Arthritis Rheum., 65(1): 1–11.
5. Keser G., Direskeneli H., Aksu K. (2014) Management of Takayasu arteritis: a systematic review. Rheumatology (Oxford), 53(5): 793–801.
6. Salvarani C., Cantini F., Boiardi L. et al. (2003) Laboratory investigations useful in giant cell arteritis and Takayasu’s arteritis. Clin. Exp. Rheumatol., 21(32): 23–28.
7. Tezuka D., Haraguchi G., Ishihara T. et al. (2012) Role of FDG PET-CT in Takayasu arteritis: sensitive detection of recurrences. JACC Cardiovasc. Imaging, 5(4): 422–429.
8. Webb M., Chambers A., AL-Nahhas A. et al. (2004) The role of 18F-FDG PET in characterising disease activity in Takayasu arteritis. Eur. J. Nucl. Med. Mol. Imaging, 31(5): 627–634.
9. Jennette J.C., Falk R.J., Bacon P.A. et al.(2013) 2012 revised international Chapel Hill consensus conference nomenclature of vasculitides. Arthritis Rheum., 65(1): 1–11.
CЛУЧАЙ ДИАГНОСТИКИ ЭНДОВАСКУЛЯРНОГО СИНДРОМА ОБКРАДЫВАНИЯ ПОДКЛЮЧИЧНО-КАРОТИДНЫХ И ВЕРТЕБРАЛЬНЫХ СОСУДОВ У ПАЦИЕНТКИ С НЕСПЕЦИФИЧЕСКИМ АОРТОАРТЕРИИТОМ
Резюме. Описан случай с клинически скрытыми признаками болезни, который продемонстрировал диагностику неспецифического аортоартериита (НАА) лишь в период развития эндоваскулярного синдрома обкрадывания подключично-вертебральных и подключично-каротидных участков при подтверджении данных компьютерной томографической ангиографии. Трудности диагностики в описанном случае обусловлены тем, что у пациентки при обращении констатированы неспецифические симптомы, которые никоим образом не свидетельствовали о наличии НАА. Глубокие необратимые морфологические изменения в сосудах делают течение НАА неблагоприятным и несклонным к регрессии даже при условии применения современных лечебных технологий.
aoртоартериит, эндоваскулярный синдром.
Адреса для листування:
Kузьмiнa Анна Петрівна
500084, Кривий Ріг, пл. 30-річчя Перемоги, 2
КЗ «Міська лікарня № 2»,
кафедра терапії, кардіології і сімейної медицини,
ФПО ДЗ «Дніпропетровська медична академія
МОЗ України»
E-mail: revmatologymed@rambler.ru

Leave a comment